Introducción: Los niveles en sangre de 25-hidroxi-vitamina D (25-OH-vitD) se relacionan con múltiples patologías. Acordes al riesgo cardiovascular, se han definido los valores considerados «normales» y con ese dintel los pacientes con enfermedad renal crónica tienen muy frecuentemente déficit de dicha vitamina. Su reposición en hemodiálisis (HD), con dosis todavía no claramente establecidas, comienza a ser una constante en la práctica habitual. Objetivo: Valorar si la técnica de diálisis influye en la concentración basal de 25-OH-vitD y en la respuesta a su suplementación. Métodos: Estudio observacional prospectivo de dos cohortes de pacientes tratados y no tratados con calcifediol. Se determinaron Ca, P, hormona paratiroidea (PTH) y 25-OH-vitD en 59 pacientes prevalentes en HD (35 eran varones; edad media: 65,2 [15,7] años) en noviembre de 2010. De ellos, 36 pacientes (con 25-OH-vitD < 10 ng/ml) se trataron con calcifediol semanal (Hidroferol®, 1 ampolla: 266 µg) administrado pos-HD por una enfermera a partir de enero de 2011. Recibieron 6 dosis y se determinaron de nuevo los niveles en marzo. Se comparó la respuesta en función de la técnica de HD. Los 22 restantes no fueron tratados y se consideran como un grupo control. Resultados: Medias basales (n = 59): 25-OH-vitD: 9,8 (7,0) ng/ml; Ca: 9,3 (0,5) mg/dl; P: 4,5 (1,4) mg/dl, y PTH intacta: 299 (224) pg/ml. No existían diferencias por edad, sexo, ni técnica (HD vs. hemodiafiltración en línea [HDF-OL]). Tratados (n = 36): Los niveles de 25-OH-vitD pasaron de 6,2 (3,4) a 51 (22,9) ng/ml, p < 0,0001, sin cambios significativos en el Ca. La fosfatemia se incrementó como media en 0,6 (1,4) mg/dl, de 4,4 a 5 mg/dl, (p = 0,015). La PTH disminuyó como media en 85 (208) pg/ml, p = 0,023. En estos pacientes la indicación de captores del P se incrementó en una dosis media equivalente de 0,47 (0,82), p < 0,001. Los 13 pacientes en tratamiento con HDF-OL alcanzaron unos niveles de 25-OH-vitD significativamente mayores que los 23 tratados con HD: 63 (21) vs. 43 (21) ng/ml, p = 0,011. El tratamiento doble con vitamina D nativa y activa se asoció de forma significativa al aumento de los niveles de P, p = 0,043. No tratados (n = 23): Los niveles de 25-OH-vitD bajaron de 15,3 (7,5) en noviembre a 11,1 (6,8) ng/ml en marzo, p < 0,01, sin cambios significativos en el P ni la PTH y sin que encontráramos diferencias según la edad. La disminución se produjo en los pacientes en HD, n = 15, y no en los que estaban en HDF-OL, n = 8. Comentario: Los niveles séricos basales de 25-OH-vitD en pacientes en HD son bajos o muy bajos. La respuesta al tratamiento con calcifediol es buena, más marcada en los pacientes en HDF-OL; mientras, en los pacientes no tratados los niveles bajan probablemente en relación con el período invernal. Algunos pacientes incrementan la fosfatemia a pesar de aumentar la cantidad de captores de P, fundamentalmente aquellos que estaban en tratamiento con vitamina D activa.
Introduction: 25-hydroxy vitamin D (25-OH-vit D) levels in the blood are associated with multiple pathologies. "Normal" values have been defined based on cardiovascular risk, and under this framework, patients with chronic kidney disease often have a deficit. 25-OH-vit D replacement in patients on haemodialysis (HD), in which dosage has not yet been clearly established, is becoming a constant in our daily practice. Objective: To assess whether dialysis technique influences the baseline concentration of 25-OH-vitamin D and the response to supplements. Method: Prospective observational study of two cohorts of patients, those patients treated with calcifediol and those untreated (controls). Blood levels of Ca, P, PTH, and 25-OH-vit D were measured in 59 prevalent patients on HD (35 male; mean age: 65.2 (15.7) years) in November 2010. Thirty-six patients with 25-OH-vit D<10ng/ml were treated with weekly calcifediol (Hidroferol®, 1 ampoule: 266µg) since January 2011, which was administered after HD by a nurse. They received 6 doses, and blood levels were measured again in March 2011. We compared the response based on the technique of HD (online haemodiafiltration [OL-HDF] vs HD). Results: Mean baseline values (n=59): 25-OH-vit D: 9.8 (7.0)ng/ml, Ca: 9.3 (0.5)mg/dl, P: 4.5 (1.4)mg/dl, and iPTH: 299 (224)pg/ml. There were no differences by age, sex, or dialysis technique (HD vs OL-HDF). Treated patients (n=36): 25-OH-vit D levels rose from 6.2 (3.4)ng/ml to 51 (22.9)ng/ml (P<.0001), without significant changes in Ca. Serum phosphate increased an average of 0.6 (1.4)mg/dl, from 4.4mg/dl to 5mg/dl, (P=.015). PTH decreased an average of 85 (208)pg/ml (P=.023). In these patients, the indication for phosphate binders increased by an average dose equivalent of 0.47 (0.82)mg/dl (P<.001). The 13 patients under treatment with OL-HDF reached 25-OH-vit D levels significantly higher than the 23 treated on HD: 63 (21)ng/ml vs 43 (21)ng/ml (P=.011). Dual treatment with native and active Vit D was associated with significantly increased levels of P (P=.043). Untreated patients (n=23): 25-OH-vit D levels decreased from 15.3 (7.5)ng/ml in November to 11.1 (6.8)ng/ml in March (P<.01), without significant changes in P or PTH and without differences according to age. 25-OH-vit D levels declined in patients on HD (15) but not in patients on OL-HDF. Conclusion: The patients on haemodialysis have low or very low baseline values for 25-OH-vit D. The response to treatment with calcifediol is good, with the most marked improvement occurring in patients on OL-HDF. Furthermore, 25-OH-vit D levels decreased in untreated patients, which was probably correlated with the lower sun exposure in winter. Some patients experienced an increase in phosphataemia despite increasing the dosage of phosphate binders, mainly in those receiving treatment with active vitamin D.
INTRODUCCIÓN
El déficit de vitamina D afecta a numerosas funciones biológicas del organismo, más allá de las acciones clásicas descritas, y todas ellas se relacionan con la morbimortalidad cardiovascular en los pacientes con enfermedad renal crónica (ERC)1-3. El déficit de vitamina D se ha asociado con albuminuria, hipertensión, resistencia a la insulina, diabetes y dislipemia, mientras que los suplementos de vitamina D (ergocalciferol o colecalciferol) reducen la mortalidad en personas de la tercera edad institucionalizadas. Se cree que la vitamina D podría tener efectos beneficiosos gracias a su actividad antiinflamatoria y antiproliferativa, así como por su acción reguladora en la disfunción endotelial.
Estas acciones han levantado un gran interés en la utilización de diferentes tipos de vitamina D, fundamentalmente 25-hidroxi-vitamina D (25-OH-vitD), aunque existe una gran confusión por la falta de definición de normalidad, de criterios de uso, forma de dosificación o efectos secundarios. Hay que recordar que, a pesar de que se considera que la concentración sérica de 25-OH-vitD es la determinación analítica que mejor valora los depósitos de vitamina D en el organismo, no hay consenso sobre los rangos normales. De hecho, habitualmente los rangos de referencia se basan en estudios poblacionales, por lo que la normalidad puede variar según la ingesta de vitamina D del área o la exposición solar según la latitud. Otra alternativa de definición de normalidad es utilizar niveles de vitamina D basados en concentraciones por debajo de las cuales aparecen efectos adversos del metabolismo calcio-fósforo. Por ejemplo, en el siglo pasado, se supo que se desarrollaba osteomalacia-raquitismo con concentraciones inferiores a 10 ng/ml4. Si pasamos a fijarnos en las últimas guías de la SEN5: «la deficiencia o insuficiencia de vitamina D se debería reponer siguiendo las estrategias recomendadas en la población general» y, según se define en estas mismas guías, en la población general existe «insuficiencia» de vitamina si los valores séricos de calcidiol son menores de 30 ng/ml y «deficiencia» si los valores séricos están por debajo de 15 ng/ml. Se considera que no existe ningún estudio, en población general, que demuestre que valores superiores a 40 ng/ml tengan algún beneficio1. Así, podría concluirse que, aunque no se define explícitamente, los valores deseados estarían entre 30-50 ng/ml.
A pesar de estas limitaciones de la definición de normalidad, los parámetros que manejamos encuentran que más de un 70% de la población general tiene déficit de 25-OH-vitD4, cifra que es mayor en la población con ERC6-8.
Utilizando, por tanto, esos rangos y como consecuencia de los efectos beneficiosos que puede tener, el tratamiento con vitamina D nativa, habitualmente calcifediol, ha comenzado a ser una práctica habitual en los todos pacientes con ERC. Todos los nefrólogos tenemos experiencia de tratar con dosis altas y bajas de vitamina D activa, fundamentalmente con calcitriol, en un intento por controlar el hiperparatiroidismo secundario. La experiencia no ha sido buena globalmente, por la alta frecuencia de episodios de hipercalcemia e hiperfosfatemia y su relación con las calcificaciones vasculares, ya que todas ellas se asocian a mayor mortalidad en población con ERC. Los resultados de metaanálisis sobre la relación entre el tratamiento con vitamina D y los eventos cardiovasculares9-11 son negativos y en algún caso dudosos, lo cual se debe en gran medida a la baja calidad de los trabajos. Los datos que hay disponibles concluyen que la suplementación con calcifediol mejora los niveles de 25-OH-vitD y de 1-25-OH-vitD al tiempo que reduce los niveles de hormona paratiroidea (PTH) sin incrementar de una forma significativa el riesgo de hipercalcemia e hiperfosfatemia. Sin embargo, no logra mejorar el pronóstico cardiovascular o esquelético9.
En el momento actual, los nefrólogos estamos comenzando a tratar con calcifediol a los pacientes en hemodiálisis (HD) de una forma totalmente empírica, viendo cuáles son las dosis necesarias, los efectos secundarios que podemos encontrar y cuál puede ser el efecto en el tratamiento de la propia técnica de diálisis, ya que se ha comunicado en un trabajo que pueden existir diferencias con la hemodiafiltración on-line (HDF-OL) post (HDF-OL-post)12.
Con estos antecedentes decidimos tratar con calcifediol sólo a los pacientes en HD con un déficit severo de 25-OH-vitD, inferior a 10 ng/ml.
OBJETIVOS
1. Valorar la respuesta a una pauta de tratamiento con calcifediol en pacientes en HD con déficit severo de 25-OH-vitD, respecto a niveles sanguíneos de 25-OH-vitD, PTH, Ca total (CaT) y P.
2. Valorar si la técnica de diálisis influye en la concentración basal de 25-OH-vitD y en la respuesta a su suplementación.
3. Valorar los niveles de 25-OH-vitD alcanzados con otra pauta de tratamiento con calcifediol.
MÉTODOS
Diseño: Se trata de un estudio prospectivo observacional en dos cohortes de pacientes. Se comparan los resultados/variables en tres puntos de corte de la evolución de los mismos pacientes.
Todos los pacientes prevalentes de la Unidad de Hemodiálisis se consideraron aptos para la determinación basal de 25-OH-vitD.
De los 65 pacientes reclutados, se excluye a 6 porque no se tuvo un seguimiento completo de ellos desde noviembre de 2010 a marzo de 2011 o porque presentaron un proceso intercurrente que les impedía completar el tratamiento. De los 59 incluidos, se consideró que 36 debían tratarse con calcifediol por tener un déficit severo de 25-OH-vitD (< 10 ng/ml). Los 23 pacientes restantes no se trataron y constituyen la segunda cohorte, que se utiliza como grupo control. En una segunda fase, a partir de marzo y hasta junio de 2011, los 59 pacientes son tratados con otra pauta de calcifediol.
Características de los pacientes: 35 hombres y 24 mujeres; edad media: 65,2 (15,7) años. Eran diabéticos 15 pacientes; el índice de masa corporal medio era 26,8 (5,3) (rango 17,8-43,4) kg/m2. Todos los pacientes estudiados eran caucasianos. Los 59 pacientes al comienzo del estudio llevaban 5,5 (6,3) años de media en tratamiento sustitutivo de la función renal.
Características de la hemodiálisis: Todos los pacientes se dializan con dializadores de alta permeabilidad y membranas sintéticas. Se dializan 4 o más horas por sesión, salvo los que tienen una función renal residual superior a 5 ml/min de aclaramiento de creatinina. Veintiún pacientes se dializaban en HDF-OL posdilucional con más de 20 litros de infusión por sesión. El eKt/V de la sesiones de diálisis era 1,85 (0,46) (rango 0,97-2,98). Todas las máquinas de hemodiálisis cuentan con líquido de diálisis (LD) ultrapuro. La concentración de calcio en el LD es en general de 1,5 mmol/l.
Tratamientos concomitantes del metabolismo mineral: En la Unidad de Hemodiálisis se intenta mantener los parámetros del metabolismo óseo-mineral según las recomendaciones de la Guía de metabolismo óseo-mineral de la SEN5. Los pacientes recibían tratamiento con captores del P para lograr mantener niveles de P sérico por debajo de 5 mg/dl. Se ha utilizado tratamiento con cinacalcet para controlar el hiperparatiroidismo secundario con difícil control de Ca y P.
Basal: Se determinaron Ca, P, PTH intacta (iPTH) y 25-OH-vitD en 59 pacientes prevalentes en HD en noviembre de 2010.
Pacientes tratados: 36 pacientes, con déficit severo de 25-OH-vitD, se trataron con calcifediol semanal (Hidroferol®, 1 ampolla: 266 µg) administrado pos-HD por una enfermera a partir de enero de 2011. Recibieron 6 dosis y se determinaron de nuevo los niveles en marzo. Se comparó la respuesta en función de la técnica de HD: HD vs. HDF-OL.
Pacientes no tratados: A los 23 pacientes no tratados se les consideró como grupo control.
Seguimiento del tratamiento posterior: Se realizó un nuevo control clínico y analítico en junio de 2011, momento en que los 59 pacientes seguían un nuevo protocolo de tratamiento con calcifediol. Se analizan los resultados de los 54 pacientes que tienen controles completos en noviembre de 2010 y marzo y junio de 2011.
A partir de marzo de 2011 se aplicó a todos los pacientes el protocolo de tratamiento que se describe a continuación.
Protocolo de suplementación 25-OH-VitD en diálisis:
Objetivo: Mantener a todos los pacientes en HD con concentraciones plasmáticas de entre 20 y 50 ng/ml.
Controles: Determinación de 25-OH-VitD:
- En todos los pacientes cuando inician tratamiento con HD.
- De rutina con las revisiones trimestrales.
Pauta de correción (todas con Hidroferol®, 266 μg), valoración cada 3 meses.
- Si niveles < 10 ng/ml: 1 ampolla/quincenal (6 dosis en 3 meses).
- Si niveles = 10-30 ng/ml: 1 ampolla/mes (3 dosis en 3 meses).
- Si niveles = 30-50 ng/ml: 1 ampolla/6 semanas (2 dosis en 3 meses).
- Si niveles superiores a 50 ng/ml: suspender aporte y control en la siguiente revisión trimestral.
Llamadas de atención
1. En todos los pacientes con tratamiento con Hidroferol® se vigilará el Ca y el P mensualmente.
2. Si el paciente presenta hipercalcemia (Ca > 9,5 mg/dl) o hiperfosfatemia (P > 6 mg/dl), está indicada la suspensión temporal de Hidroferol®.
3. Lo anterior será más marcado para aquellos pacientes en tratamiento con vitamina D activa (calcitriol o paricalcitol).
4. En la actualidad, es dudosa la utilidad del tratamiento concomitante con calcitriol.
5. En la interpretación de los resultados, se tendrá en cuenta la estacionalidad.
Metodología analítica
La 25-OH-vitD se midió mediante radioinmunoanálisis quimioluminescente (Dia-Sorin LIAISON®), valores de referencia 8,6-54,8 ng/ml. La variación intraensayo e interensayo fue del 5 y el 8%, respectivamente.
Se determinó iPTH con técnica de quimioluminometría (Advia Centaur PTH, Bayer); los valores de referencia son 10-65 pg/ml.
Consentimiento informado
Se obtuvo el consentimiento informado para el análisis de los datos de cada paciente que están registrados en el programa informático Therapy Manager Extended® CE (TME). TME es un sistema de información renal especializado en la gestión clínica integral de la ERC y sus patologías relacionadas.
Estadística
Se determinó la normalidad de las variables mediante la prueba de Kolgomorov-Smirnov. Estas variables se expresan como la media y la desviación típica entre paréntesis. Cuando conviene, se menciona el rango. Las variables no gaussianas se expresan como la mediana y percentiles 25-75.
La comparación de las muestras independientes se ha realizado con la t de Student o con el test de la U de Mann-Whitney. Como análisis para determinaciones continuas o repetidas, se realizó la prueba de Friedman. Las variables categóricas se compararon mediante la prueba de χ2. Se consideró como significativos los valores con una p < 0,05.
La base de datos se registró en el programa estadístico SPSS versión 15 (SPSS Inc., Chicago, IL) en español de acuerdo con la metodología aprobada para la protección de los datos.
RESULTADOS
En los 59 pacientes considerados para el estudio en la primera fase de tratamiento, entre noviembre de 2010 y marzo de 2011, los resultados fueron:
Basal (media y desviación típica) (n = 59)
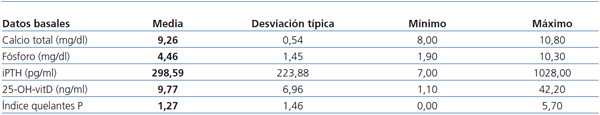
Los niveles sanguíneos basales fueron: 25-OH-vitD: 9,8 (7,0) ng/ml; Ca: 9,3 (0,5) mg/dl; P: 4,5 (1,4) mg/dl, e iPTH: 299 (224) pg/ml.
Aunque los niveles de 25-OH-vitD tendían a ser menores con la edad, la relación no alcanzaba a ser significativa, p = 0,07. No existían diferencias en los niveles de 25-OH-vitD respecto al sexo ni la técnica (HD vs. HDF-OL).
De los 59 pacientes, 13 estaban en tratamiento con cinacalcet y 18 con vitamina D activa: 11 con calcitriol y 7 con paricalcitol.
De los 59 pacientes, 39 recibían distintos quelantes (captores) del P, en ocasiones asociados (carbonato cálcico, acetato cálcico, hidróxido de aluminio, sevelamer, carbonato de lantano y de magnesio). La dosis equivalente en su poder captor de P respecto a 1 g de carbonato cálcico13 fue 1,23 (1,46) como media en los 59 pacientes (tabla 1).
Tratados (n = 36)
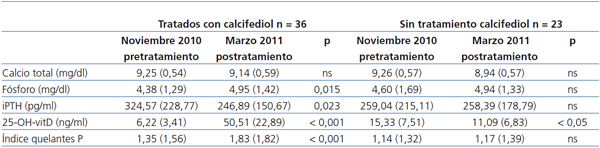
Los niveles de 25-OH-vitD pasaron de 6,2 (3,4) a 51 (22,9) ng/ml, p < 0,0001, sin cambios significativos en el Ca. La fosfatemia se incrementó como media en 0,6 (1,4) mg/dl, de 4,4 a 5 mg/dl, (p = 0,015). La PTH disminuyó en 85 (208) pg/ml como media (p = 0,023) (tabla 2).
En estos pacientes, la indicación de captores del P se incrementó en una dosis media equivalente de 0,47 (0,82) p < 0,00113.
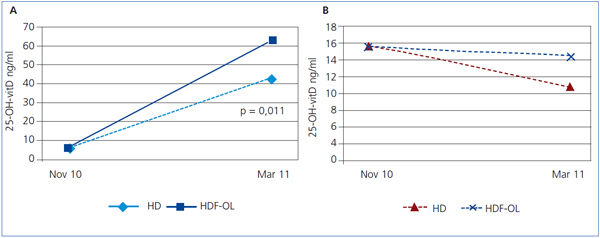
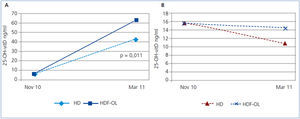
Los 13 pacientes en tratamiento con HDF-OL alcanzaron unos niveles de 25-OH-vitD significativamente mayores que los 23 tratados con HD: 63 (21) vs. 43 (21) ng/ml, p = 0,011. En los pacientes en HDF-OL, el aumento de los niveles de 25-OH-vitD fue de 33,9 (7,4 ng/ml), mientras que en los de HD fue de 19,7 (26,7) ng/ml (figura 1 A y figura 1 B). El tiempo previo en diálisis no era significativamente diferente en los pacientes en HD, 5,2 años, respecto a los de HDF-OL, 6 años. Los pacientes en HD eran mayores respecto a los de HDF-OL, una media 6 años, p = 0,103.
Entre los 36 pacientes tratados, en noviembre 9 recibían cinacalcet, que pasaron a ser 11 en marzo. Once pacientes recibían tratamiento con vitamina D activa tanto en noviembre como en marzo.
El tratamiento doble con vitamina D nativa y activa se asoció de forma significativa al aumento de los niveles de P en marzo, pero no en junio, p = 0,043.
No tratados (n = 23)
Los niveles de 25-OH-vitD bajaron de 15,3 (7,5) en noviembre a 11,1 (6,8) ng/ml en marzo, p < 0,01, sin cambios significativos en el P ni la PTH y sin que encontráramos diferencias según la edad. En los 15 pacientes en HD, los niveles de 25-OH-vitD disminuyeron de 15,4 (9,1) ng/ml a 9,7 (7,3) ng/ml, p = 0,001. En los 8 pacientes en HDF-OL la disminución fue menor, 15,2 (3,2) a 13,7 (5,2) ng/ml, y no significativa, p = 0,529.
En marzo, entre tratados y no tratados existieron diferencias en la 25-OH-vitD, pero no en el Ca, el P o la PTH (figura 1 A y B).
Evolución posterior con el nuevo protocolo (n = 54)
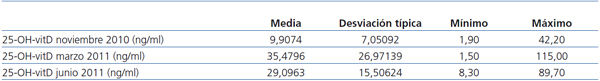
Desde noviembre de 2010 hasta junio de 2011 fueron seguidos 54 pacientes. En la tabla 3 se recogen los resultados. Con el cambio de la pauta de tratamiento, destaca una disminución del nivel medio en junio respecto a marzo, pero sigue habiendo pacientes con niveles altos y bajos.
DISCUSIÓN
Los niveles basales de 25-OH-vitD estaban en unos niveles considerados bajos y muy bajos, como sucede en la mayoría de los pacientes con ERC e incluso en la población general. Sólo un paciente tenía más de 30 ng/ml. ¿Qué factores contribuyen al balance y a los niveles de 25-OH-vitD? Está claramente establecido el papel de la ingesta y de los suplementos de provitaminas D, así como la exposición solar14. Los cofactores que influyen en los anteriores, como la obesidad y el color de la piel, también condicionan los niveles de 25-OH-vitD. Variantes en los genes cercanos a los involucrados en la síntesis del colesterol (DHCR7), hidroxilación (CYP2R1, CYP24A1) y transporte de la vitamina D influyen en su estatus15. Algunas variantes de esos locus identifican a individuos con un alto riesgo de déficit de la vitamina D. La causa por la que los pacientes con ERC tienen niveles bajos se relaciona con los efectos derivados de la retención de P, con aumento del FGF23 y de la PTH. Probablemente, algunos de estos mecanismos se relacionan no sólo con una menor síntesis de 1-25-OH-vitD, sino con un aumento de la metabolización tanto de 25-OH-vitD como de 1-25-OH-vitD a través de la 24 hidroxilasa.
Aunque respecto a lo normal los valores de 25-OH-vitD son bajos, no está claro cuáles deben ser los niveles objetivo en los pacientes con ERC en HD y probablemente no sean extrapolables valores de referencia de otras poblaciones. Ni siquiera en la población general están claras las relaciones entre los niveles de 25-OH-vitD y la aparición de distintas patologías. En la población europea, los niveles de 25-OH-vitD son mayores en los países nórdicos que en los mediterráneos16. Sin embargo, en los últimos hay una mayor exposición solar y globalmente una incidencia menor de eventos cardiovasculares y riesgo cardiovascular. Para precisar los niveles séricos objetivo de 25-OH-vitD, hacen falta nuevos estudios en la población con ERC y en diálisis que determinen con qué rangos se asocian los supuestos beneficios y se evita la aparición de complicaciones.
En la población general, sigue existiendo un dilema entre si tratar o no tratar sistemáticamente con vitamina D y si es útil o no medir los niveles de 25-OH-VitD17. Está claro que existe la intoxicación por vitamina D, con consecuencias que van desde los cólicos nefríticos y las calcificaciones vasculares hasta la insuficiencia renal por nefrocalcinosis. Estas situaciones se dan en general con tratamientos intensivos y con niveles de 25-OH-VitD por encima de 200 µg/l.
Con el tratamiento con calcifediol, aumentan significativamente los niveles en sangre de 25-OH-vitD en los pacientes en HD. Al mismo tiempo, en el grupo no tratado los niveles disminuyen probablemente en relación con la época invernal. Es necesario buscar una dosis y una pauta de administración que logren mantener los niveles dentro del rango deseado. En junio de 2011, a pesar de espaciar las dosis, se sigue observando pacientes con niveles de 25-OH-vitD fuera del rango deseado; probablemente sea necesaria la individualización y tener en cuenta la estación del año.
Se ha demostrado que la mayor disponibilidad de 25-OH-vitD implica un aumento en los niveles de 1-25-OH-vitD. Este aumento conlleva una supresión de la PTH y una mayor absorción intestinal de Ca y P, que en nuestro caso se traduce en un aumento significativo de la fosfatemia a pesar del aumento de los captores del P empleados. En este estudio, la hiperfosfatemia es más frecuente cuando se asocia el calcifediol con el tratamiento con vitaminas D activas, calcitriol o paricalcitol. Esto nos alerta sobre la necesidad de controlar la fosfatemia cuando empleemos este tratamiento, sobre todo si lo asociamos a metabolitos activos de vitamina D. Probablemente se pueda reducir la necesidad de tratar con calcitriol a estos pacientes. Los supuestos beneficios de aumentar/normalizar los niveles de 25-OH-vitD se podrían ver contrarrestados por un aumento de la fosfatemia o el riesgo de calcificaciones vasculares. El paciente con ERC no puede eliminar un aumento del aporte de Ca ni de P como lo haría una persona sin insuficiencia renal. Este tema condiciona el tratamiento no selectivo con vitamina D en los pacientes con ERC. Por otro lado, hay que tener en cuenta el impacto económico del tratamiento con vitamina D en pacientes con ERC, mucho mayor con las vitaminas D activas que con las nativas18. Esto nos debe estimular a compararlas en el ámbito de estos pacientes.
En nuestra experiencia, los niveles basales no eran diferentes entre los pacientes en HD y en HDF-OL, como sí se ha objetivado en otro estudio12. En nuestro caso, la población en HDF-OL no era comparable con la de HD; entre otras diferencias, aquéllos eran más jóvenes. Pero lo que sí hemos objetivado es una mejor respuesta al tratamiento en los pacientes en HDF-OL. La explicación no puede depender de la exposición solar, la raza, la obesidad o la dieta. Una posible hipótesis sería que la HDF-OL eliminaría moléculas implicadas en el estimulo de la 24 hidroxilasa (CYP24A1)19. También hemos objetivado una menor disminución de los niveles de vitamina D durante el invierno en los pacientes en HDF-OL no tratados respecto a los de HD.
Como conclusión, que los pacientes tratados con HDF-OL tengan mejor respuesta al tratamiento con calcidiol y que la concentración varíe según la estación obliga a una dosificación personalizada que todavía está por definir.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Valores analíticos y captores del fósforo basales en los 59 pacientes en noviembre de 2010
Tabla 2. Niveles séricos en noviembre de 2010 (pretratamiento) y en marzo de 2011, después del tratamiento con 25-OH-vitD en 36 pacientes o en 23 pacientes controles sin tratamiento
Tabla 3. Evolución de los niveles de 25-OH-vitD en las mediciones en noviembre, marzo y junio. Aumento de los niveles en función de dos pautas de tratamiento
Figura 1. Respuesta al calcifediol según la técnica de diálisis