La muerte con injerto funcionante (MCIF) es la causa más frecuente de pérdida del trasplante renal (TR).
ObjetivoAnalizar la evolución de las etiologías de MCIF y la frecuencia de los tipos de neoplasia causantes.
MétodosEstudio retrospectivo de los TR en Andalucía desde 1984 hasta 2018. Analizamos la evolución de las MCIF según etapas (1984-1995; 1996-2007; 2008-2018) y según período post-TR (muerte precoz: primer año post-TR; muerte tardía: tras el primer año post-TR).
ResultadosSe realizaron 9.905 TR; se produjeron 1.861 MCIF. Las causas más frecuentes fueron enfermedad cardiovascular (25,1%), infecciones (21,5%) y neoplasias (19,9%).
En las muertes precoces no observamos cambios en el tiempo; las infecciones siempre fueron la causa principal. En las tardías, desciende la muerte cardiovascular (1984-1995: 35,2%; 1996-2007: 22,6%; 2008-2018: 23,9%) y aumentan las muertes por infecciones (1984-1995: 12,5%; 1996-2007: 18,3%; 2008-2018: 19,9%) y, sobre todo, por cáncer (1984-1995: 21,8%; 1996-2007: 29%; 2008-2018: 26,8%) (p<0,001). En el análisis multivariante para muerte tardía cardiovascular, edad del receptor, retrasplante, diabetes y primera etapa fueron factores de riesgo, mientras que el riesgo de muerte tardía por cáncer e infecciones se asoció con las etapas recientes.
La neoplasia más frecuente en el primer año post-TR fue la enfermedad linfoproliferativa post-TR y tras el primer año el cáncer de pulmón, sin diferencias entre etapas.
ConclusionesA pesar de la mayor comorbilidad del receptor, las muertes cardiovasculares han descendido. Las neoplasias son la principal causa de muerte tardía en los últimos años. El cáncer de pulmón es la neoplasia más frecuente causante de MCIF en TR.
Death with a functioning graft (DWFG) is the most frequent cause of loss of kidney transplantation (KT).
ObjectiveTo analyze the evolution of the causes of DWFG and the frequency of the types of cancer causing DWFG.
MethodsRetrospective study of KT in Andalusia from 1984 to 2018. We analyzed the evolution according to eras (1984-1995; 1996-2007; 2008-2018) and according to post-transplant period (early death: first year post-KT; late death: after first year post-KT).
ResultsA total of 9,905 KT were performed, registering 1,861 DWFG. The most frequent causes were cardiovascular disease (25.1%), infections (21.5%) and cancer (19.9%).
In early death we did not observe changes, and infections were always the main cause. In late death, cardiovascular death decreased (1984-1995: 35.2%, 1996-2007: 22.6%, 2008-2018: 23.9%), but infections (1984-1995: 12.5%, 1996-2007: 18.3%, 2008-2018: 19.9%) and, above all, cancer-related deaths increased (1984-1995: 21.8%, 11996-2007: 29%, 2008-2018: 26.8%) (P<0.001). In the multivariable analysis for late death due to cardiovascular disease, recipient age, retransplantation, diabetes, and the first period were risk factors, while the risk of late death due to cancer and infections was associated with recent eras.
In the first year after transplantation, the most frequent neoplasia causing DWFG was post-transplant lymphoproliferative disease, and after the first year, it was lung cancer, without differences when it was analyzed by eras.
ConclusionsDespite the greater comorbidity of the recipients, cardiovascular deaths have decreased. Cancer has been the main cause of late death in recent years. Lung cancer is the most frequent malignancy that causes DWFG in our transplant patients.
La supervivencia del trasplante renal (TR) ha mejorado significativamente durante los últimos años. La introducción de nuevos esquemas de inmunosupresión, más potentes y seguros, ha reducido la incidencia de rechazo agudo1,2. En la década de los 70 y principios de los 80, la tasa de rechazo era aproximadamente del 50% durante el primer año. Desde la introducción de la ciclosporina, esta se redujo hasta un 15%, con mejora de los resultados a corto plazo. En la actualidad la incidencia de rechazo agudo en el primer año se encuentra entre el 8 y el 10% y la supervivencia del injerto en el primer año se sitúa por encima del 90% en la mayoría de las series1,3,4.
A largo plazo también hemos asistido a una mejora notable en los resultados motivada, en gran parte, por los continuos avances en las técnicas quirúrgicas, en la inmunosupresión y en el tratamiento de las distintas complicaciones post-TR1,5. También han tenido un papel fundamental las aportaciones en el campo de la inmunología y el mayor conocimiento y caracterización de las lesiones histológicas. Los avances en el diagnóstico histológico han supuesto el desarrollo de nuevas clasificaciones del rechazo, han permitido conocer la afectación renal por infecciones virales, como el virus BK, y ampliar el estudio de la recidiva de la enfermedad renal primaria en el injerto renal1,6.
Este cambio de escenario en el TR ha condicionado también que las causas de pérdida del injerto a largo plazo se hayan visto modificadas en las últimas décadas. Hasta finales de los 90 seguía siendo el rechazo crónico la principal causa de pérdida del injerto después del primer año de trasplante, al que se le atribuían más del 50% de las pérdidas2,3. A principios del milenio empezaron a aparecer trabajos que situaban la muerte con injerto funcionante (MCIF) como la causa más frecuente de pérdida del injerto a largo plazo. Varios factores han podido condicionar esta transición: una menor tasa de pérdida del injerto, motivada por los nuevos inmunosupresores, a la que se añade la mayor edad de los pacientes que acceden al TR y la presencia de un mayor número de comorbilidades. Es importante, por tanto, conocer las causas de muerte en nuestros trasplantados, puesto que, si reducimos la tasa de muerte entre los receptores con un injerto funcionante, mejorará la supervivencia a largo plazo del injerto renal7,8.
En general, la principal causa de MCIF en los pacientes con enfermedad renal crónica (ERC) ha sido la enfermedad cardiovascular2,7,9. Estos pacientes tienen un alto riesgo cardiovascular que puede deberse a factores previos al TR que, a veces, también condicionan la evolución a ERC terminal, como la obesidad, la hipertensión, la hiperlipidemia, la diabetes mellitus (DM) o el tabaquismo, así como a otros factores posteriores al TR, como el tratamiento inmunosupresor7. Por todo ello, está ampliamente establecido el estudio de detección de enfermedad cardiovascular previo al TR y tratar enérgicamente aquellos factores de riesgo cardiovascular modificables con el fin de reducir la morbimortalidad perioperatoria y tras el TR7,9.
Sin embargo, las causas de MCIF también parecen haberse modificado en los últimos años. En el año 2009, en un análisis preliminar en pacientes TR en Andalucía, observamos una tendencia a disminuir las muertes de origen cardiovascular con un incremento de la mortalidad asociada al cáncer10. Otros grandes registros de enfermos renales han ido comunicando también tendencias parecidas8,11-14. El Registro Andaluz de Trasplante Renal cuenta ya con más de 10.000 TR realizados y seguidos durante más de 35 años15. En los últimos años las características de los pacientes trasplantados han variado de forma significativa, con aumento de la edad y de las comorbilidades. Por todo ello, el objetivo principal de este trabajo es actualizar y analizar la evolución de las causas de MCIF en nuestro país, a lo largo de este extenso período, a partir de los datos de este registro. Como objetivo secundario, describimos la frecuencia de los distintos tipos de neoplasia causantes de MCIF en el paciente TR.
Material y métodosEn Andalucía desde 1984 se recogen en un registro informatizado los datos de todos los pacientes que han recibido hemodiálisis, diálisis peritoneal o TR. Las variables del paciente incluyen la edad, sexo, causa de la ERC, serología de hepatitis viral, tipo y duración del tratamiento renal sustitutivo (TRS) previo, origen del órgano (donante fallecido o vivo), trasplante combinado de órganos sólidos, tiempo de supervivencia y causas del fracaso del injerto y de la muerte del paciente, según los códigos de la Asociación Europea de Diálisis y Trasplante.
Realizamos un estudio de cohortes retrospectivo incluyendo a todos los pacientes TR en Andalucía en el período comprendido entre el 1 de enero de 1984 y el 31 de diciembre de 2018. Se excluyó a los receptores pediátricos y a los receptores de TR combinado con otros órganos.
Se analizaron las causas de MCIF y su evolución en el tiempo según la etapa en la que se realizó el TR: 1.ª etapa, 1984-1995; 2.ª etapa, 1996-2007 y 3.ª etapa, 2008-2018. Para igualar el seguimiento en las distintas etapas, se excluyeron las MCIF posteriores a los 10 años post-TR, ya que es el tiempo máximo de seguimiento de la tercera etapa. Asimismo, se analizaron las MCIF según el período post-TR en el que ocurrieron: se definió muerte precoz como la ocurrida en el primer año post-TR y muerte tardía la producida tras el primer año post-TR. En el caso de las MCIF por cáncer analizamos también el tipo de neoplasia y su distribución en relación con el tiempo desde el TR.
Los códigos de la Asociación Europea de Diálisis y Trasplante de causa de muerte fueron agrupados en 5 categorías: muerte cardiovascular, infecciones, neoplasias, otras y desconocidas. Se analizaron variables demográficas, etiología de la ERC, serología de hepatitis, DM como enfermedad renal de base, tiempo y tipo de TRS, tipo de donante, retrasplante y tipo de neoplasia. Los datos se obtuvieron del Registro Andaluz de Trasplante Renal y de los registros clínicos de los hospitales que hacen TR en Andalucía (Hospitales Virgen de Rocío, Reina Sofía, Regional de Málaga, Virgen de las Nieves y Puerta del Mar).
Análisis estadísticoLas variables categóricas se expresaron mediante distribución de frecuencias y porcentajes y las continuas mediante la media y la desviación estándar o con la mediana y el rango intercuartílico. Se utilizó el test de Kolgomorov-Smirnov para evaluar la normalidad de los datos analizados. Para la comparación de variables cualitativas se empleó el test de la χ2 y las variables continuas se compararon mediante la t de Student, U de Mann-Whitney, test de ANOVA o Kruskal-Wallis, según correspondiera. Para comparaciones múltiples en variables continuas se empleó el test de Bonferroni.
El análisis univariante y multivariante se hizo mediante regresión de Cox para identificar factores de riesgo relacionados con mortalidad cardiovascular, por neoplasias y por infecciones en las MCIF ocurridas tras el primer año del TR. En el análisis multivariante se incluyeron aquellas variables previas al TR con impacto conocido en la supervivencia del paciente, así como las etapas en las que se realizó el TR. Se consideró significativo un valor de p<0,05. Para el análisis estadístico se utilizó SPSS para Mac versión 25.0.
ResultadosCaracterísticas de todos los receptores fallecidos con injerto funcionante y sus causas de muerteEn el período del estudio recibieron un trasplante en Andalucía 10.902 pacientes, con una mediana de seguimiento hasta fallecimiento o pérdida del injerto de 6,2 años (rango intercuartil: 2,1-12,2 años). Excluidos los receptores pediátricos (n=518) y los receptores de TR combinado con otros órganos (n=479), finalmente 9.905 TR cumplieron los criterios de inclusión.
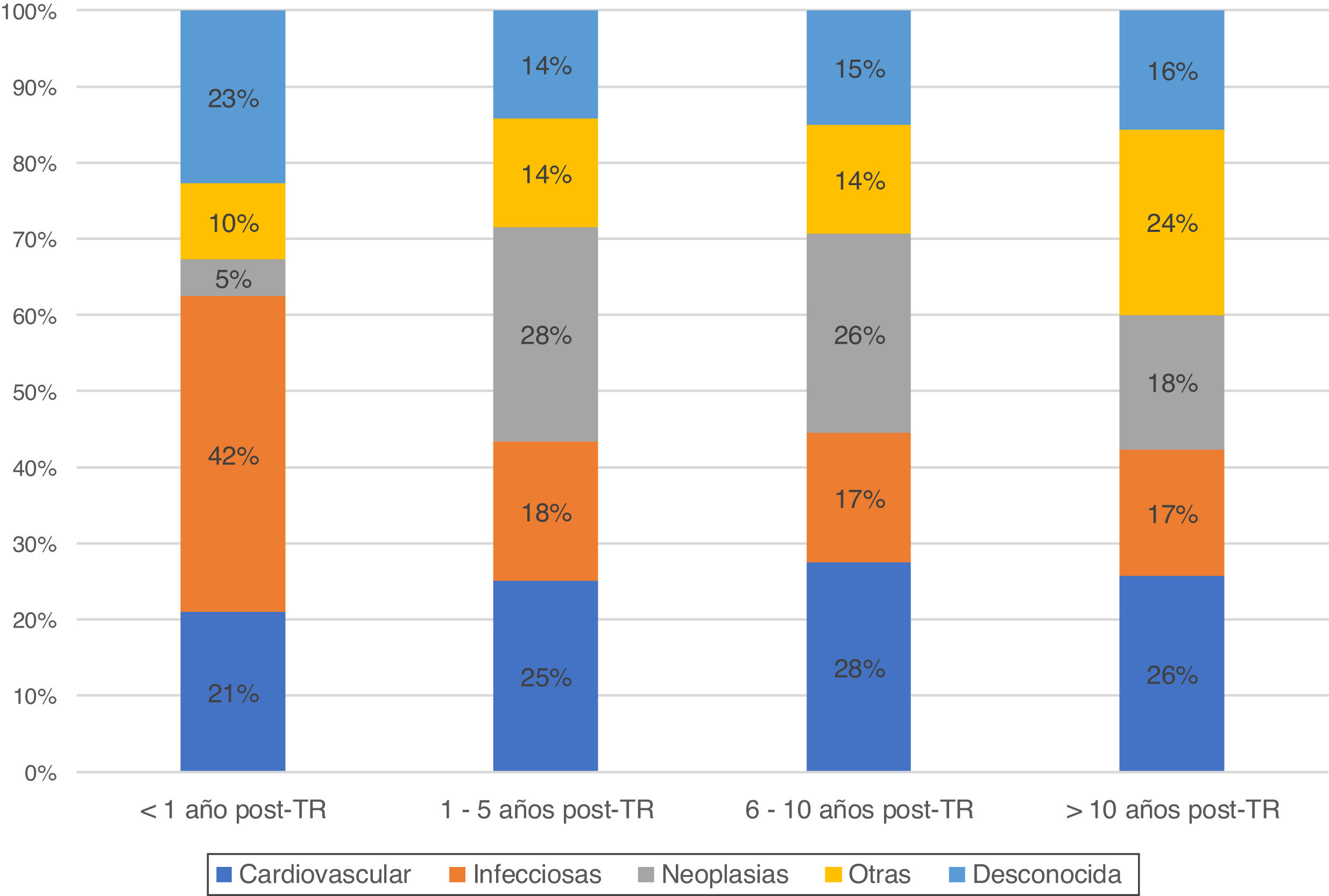
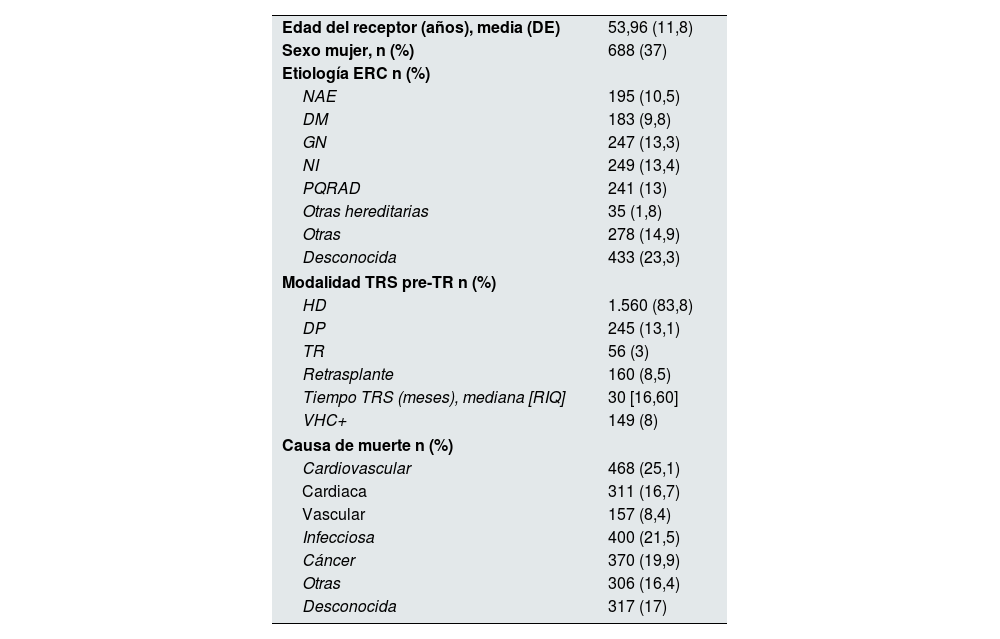
En este tiempo se registraron 1.861 pacientes fallecidos con injerto funcionante. La mediana de tiempo desde el trasplante hasta el fallecimiento con injerto funcionante fue de 6,8 años (2,3-12,5 años). De ellos, el 37% fueron mujeres, con una edad media de 54 años. Las características de los receptores fallecidos se muestran en la tabla 1. La causa más frecuente de MCIF fue la muerte cardiovascular (25,1%), seguida de las infecciones (21,5%) y neoplasias (19,9%). Según el tiempo desde el trasplante, las infecciones fueron la causa más habitual en los primeros meses, con una muy escasa incidencia del cáncer. Posteriormente, los eventos cardiovasculares y las neoplasias se mantuvieron como causas principales de MCIF (fig. 1).
Características clínicas de los pacientes fallecidos con injerto funcionante
| Edad del receptor (años), media (DE) | 53,96 (11,8) |
| Sexo mujer, n (%) | 688 (37) |
| Etiología ERC n (%) | |
| NAE | 195 (10,5) |
| DM | 183 (9,8) |
| GN | 247 (13,3) |
| NI | 249 (13,4) |
| PQRAD | 241 (13) |
| Otras hereditarias | 35 (1,8) |
| Otras | 278 (14,9) |
| Desconocida | 433 (23,3) |
| Modalidad TRS pre-TR n (%) | |
| HD | 1.560 (83,8) |
| DP | 245 (13,1) |
| TR | 56 (3) |
| Retrasplante | 160 (8,5) |
| Tiempo TRS (meses), mediana [RIQ] | 30 [16,60] |
| VHC+ | 149 (8) |
| Causa de muerte n (%) | |
| Cardiovascular | 468 (25,1) |
| Cardiaca | 311 (16,7) |
| Vascular | 157 (8,4) |
| Infecciosa | 400 (21,5) |
| Cáncer | 370 (19,9) |
| Otras | 306 (16,4) |
| Desconocida | 317 (17) |
DE: desviación estándar; DM: diabetes mellitus; DP: diálisis peritoneal; ERC: enfermedad renal crónica; GN: glomerulonefritis; HD: hemodiálisis; NAE: nefroangioesclerosis; NI: nefritis intersticial; PQRAD: poliquistosis renal autosómica dominante; RIQ: rango intercuartílico; TR: trasplante renal; TRS: tratamiento renal sustitutivo; VHC: virus de la hepatitis C.
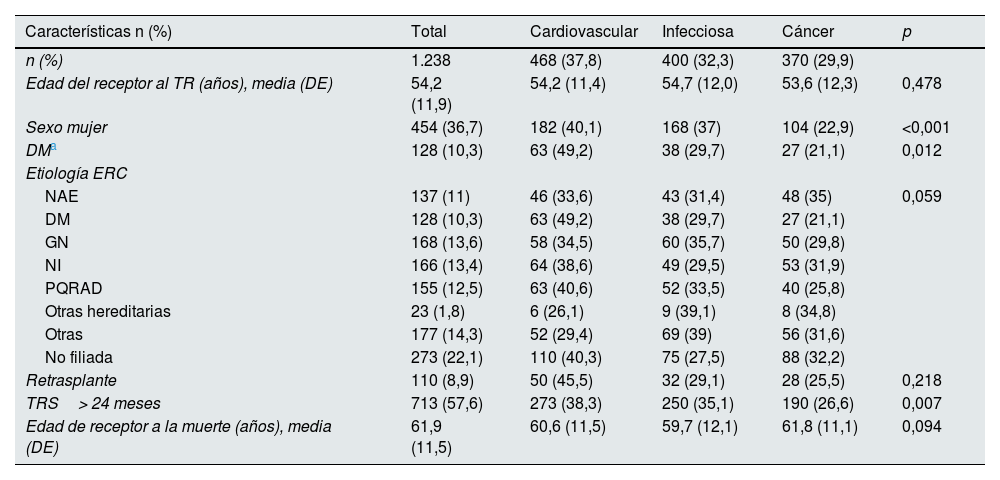
Se compararon las características de los receptores fallecidos por alguna de estas 3 causas principales de muerte (n=1.238) (tabla 2). La enfermedad cardiovascular fue la primera causa de muerte en ambos sexos (p<0,001) y en los pacientes diabéticos (p=0,012), así como en aquellos con tiempo prolongado en TRS (p=0,007).
Características clínicas y demográficas de los pacientes fallecidos con injerto funcionante según las 3causas principales de muerte
| Características n (%) | Total | Cardiovascular | Infecciosa | Cáncer | p |
|---|---|---|---|---|---|
| n (%) | 1.238 | 468 (37,8) | 400 (32,3) | 370 (29,9) | |
| Edad del receptor al TR (años), media (DE) | 54,2 (11,9) | 54,2 (11,4) | 54,7 (12,0) | 53,6 (12,3) | 0,478 |
| Sexo mujer | 454 (36,7) | 182 (40,1) | 168 (37) | 104 (22,9) | <0,001 |
| DMa | 128 (10,3) | 63 (49,2) | 38 (29,7) | 27 (21,1) | 0,012 |
| Etiología ERC | |||||
| NAE | 137 (11) | 46 (33,6) | 43 (31,4) | 48 (35) | 0,059 |
| DM | 128 (10,3) | 63 (49,2) | 38 (29,7) | 27 (21,1) | |
| GN | 168 (13,6) | 58 (34,5) | 60 (35,7) | 50 (29,8) | |
| NI | 166 (13,4) | 64 (38,6) | 49 (29,5) | 53 (31,9) | |
| PQRAD | 155 (12,5) | 63 (40,6) | 52 (33,5) | 40 (25,8) | |
| Otras hereditarias | 23 (1,8) | 6 (26,1) | 9 (39,1) | 8 (34,8) | |
| Otras | 177 (14,3) | 52 (29,4) | 69 (39) | 56 (31,6) | |
| No filiada | 273 (22,1) | 110 (40,3) | 75 (27,5) | 88 (32,2) | |
| Retrasplante | 110 (8,9) | 50 (45,5) | 32 (29,1) | 28 (25,5) | 0,218 |
| TRS> 24 meses | 713 (57,6) | 273 (38,3) | 250 (35,1) | 190 (26,6) | 0,007 |
| Edad de receptor a la muerte (años), media (DE) | 61,9 (11,5) | 60,6 (11,5) | 59,7 (12,1) | 61,8 (11,1) | 0,094 |
DE: desviación estándar; DM: diabetes mellitus; ERC: enfermedad renal crónica; GN: glomerulonefritis; NAE: nefroangioesclerosis; NI: nefritis intersticial; PQRAD: poliquistosis renal autosómica dominante; TR: trasplante renal; TRS: tratamiento renal sustitutivo.
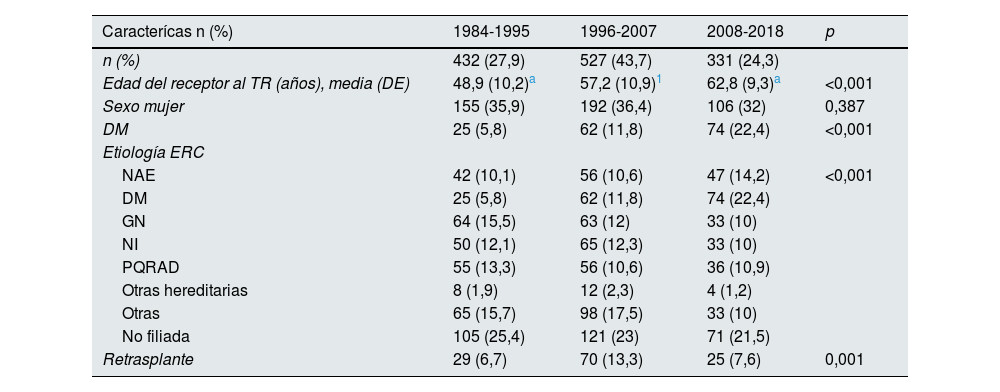
Para el análisis a través del tiempo solo se incluyeron las MCIF ocurridas durante los primeros 10 años tras el TR, como se ha explicado (n=1.290). En la tabla 3 se muestran las características de los pacientes con MCIF según la etapa en la que se realizó el TR (1.ª etapa: 1984-1995, 2.ª etapa: 1996-2007 y 3.ª etapa: 2008-2018). Se aprecia un incremento progresivo en la edad del receptor, que ha pasado de una media de 49 años en la primera etapa a casi 63 en la última, lo que supone un aumento de 14 años en la edad de acceso al TR (p<0,001). El porcentaje de pacientes con DM también aumentó de forma significativa y representaron el 22,4% del total de los pacientes fallecidos con injerto funcionante en la última etapa (p<0,001). Igualmente, la tasa de retrasplantados es mayor en las etapas recientes (13,3 y 7,6% en la segunda y tercera etapas, vs. 6,7% en la etapa inicial; p=0,001).
Características clínicas y demográficas de los pacientes fallecidos con injerto funcionante en las distintas etapas de estudio
| Caracterícas n (%) | 1984-1995 | 1996-2007 | 2008-2018 | p |
|---|---|---|---|---|
| n (%) | 432 (27,9) | 527 (43,7) | 331 (24,3) | |
| Edad del receptor al TR (años), media (DE) | 48,9 (10,2)a | 57,2 (10,9)1 | 62,8 (9,3)a | <0,001 |
| Sexo mujer | 155 (35,9) | 192 (36,4) | 106 (32) | 0,387 |
| DM | 25 (5,8) | 62 (11,8) | 74 (22,4) | <0,001 |
| Etiología ERC | ||||
| NAE | 42 (10,1) | 56 (10,6) | 47 (14,2) | <0,001 |
| DM | 25 (5,8) | 62 (11,8) | 74 (22,4) | |
| GN | 64 (15,5) | 63 (12) | 33 (10) | |
| NI | 50 (12,1) | 65 (12,3) | 33 (10) | |
| PQRAD | 55 (13,3) | 56 (10,6) | 36 (10,9) | |
| Otras hereditarias | 8 (1,9) | 12 (2,3) | 4 (1,2) | |
| Otras | 65 (15,7) | 98 (17,5) | 33 (10) | |
| No filiada | 105 (25,4) | 121 (23) | 71 (21,5) | |
| Retrasplante | 29 (6,7) | 70 (13,3) | 25 (7,6) | 0,001 |
DE: desviación estándar; DM: diabetes mellitus; ERC: enfermedad renal crónica; GN: glomerulonefritis; NAE: nefroangioesclerosis; NI: nefritis intersticial; PQRAD: poliquistosis renal autosómica dominante; TR: trasplante renal.
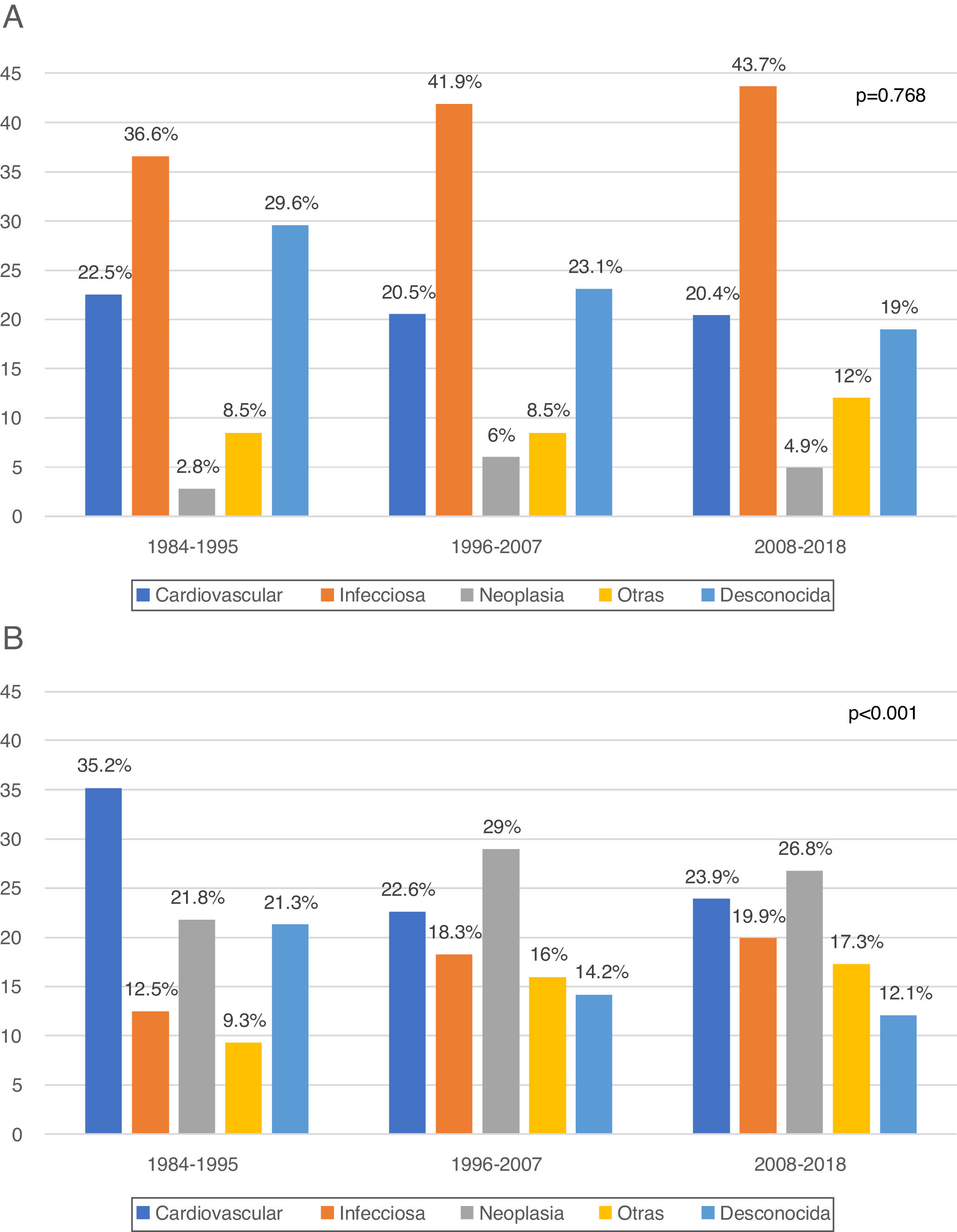
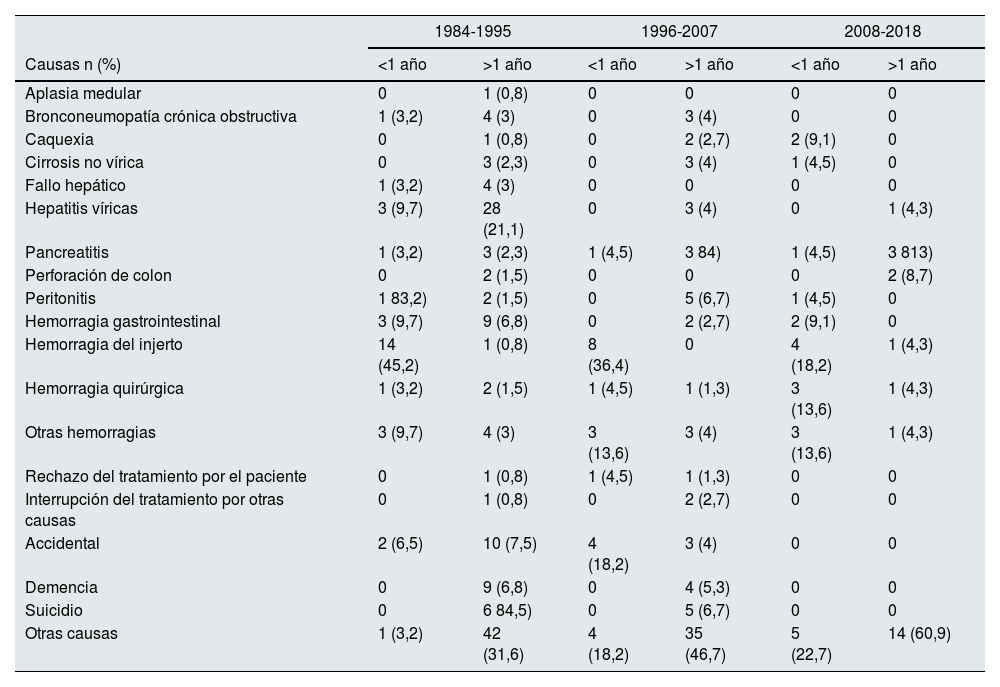
En el primer año post-TR (muerte precoz) se registraron 330 MCIF. Al analizar su evolución en el tiempo no observamos cambios en el patrón de muerte entre las distintas etapas: siempre las infecciones fueron la causa más frecuente (1984-1995: 36,6%; 1996-2007: 41,9%; 2008-2018: 43,7%; p=0,768) (fig. 2a). La variable «otras causas» incluye un número importante de etiologías. Se observó la mayor diferencia en las MCIF precoces en la disminución de muertes asociadas a hemorragia del injerto (tabla 4).
Evolución de las «otras» causas de muerte precoces y tardías en los diferentes períodos
| 1984-1995 | 1996-2007 | 2008-2018 | ||||
|---|---|---|---|---|---|---|
| Causas n (%) | <1 año | >1 año | <1 año | >1 año | <1 año | >1 año |
| Aplasia medular | 0 | 1 (0,8) | 0 | 0 | 0 | 0 |
| Bronconeumopatía crónica obstructiva | 1 (3,2) | 4 (3) | 0 | 3 (4) | 0 | 0 |
| Caquexia | 0 | 1 (0,8) | 0 | 2 (2,7) | 2 (9,1) | 0 |
| Cirrosis no vírica | 0 | 3 (2,3) | 0 | 3 (4) | 1 (4,5) | 0 |
| Fallo hepático | 1 (3,2) | 4 (3) | 0 | 0 | 0 | 0 |
| Hepatitis víricas | 3 (9,7) | 28 (21,1) | 0 | 3 (4) | 0 | 1 (4,3) |
| Pancreatitis | 1 (3,2) | 3 (2,3) | 1 (4,5) | 3 84) | 1 (4,5) | 3 813) |
| Perforación de colon | 0 | 2 (1,5) | 0 | 0 | 0 | 2 (8,7) |
| Peritonitis | 1 83,2) | 2 (1,5) | 0 | 5 (6,7) | 1 (4,5) | 0 |
| Hemorragia gastrointestinal | 3 (9,7) | 9 (6,8) | 0 | 2 (2,7) | 2 (9,1) | 0 |
| Hemorragia del injerto | 14 (45,2) | 1 (0,8) | 8 (36,4) | 0 | 4 (18,2) | 1 (4,3) |
| Hemorragia quirúrgica | 1 (3,2) | 2 (1,5) | 1 (4,5) | 1 (1,3) | 3 (13,6) | 1 (4,3) |
| Otras hemorragias | 3 (9,7) | 4 (3) | 3 (13,6) | 3 (4) | 3 (13,6) | 1 (4,3) |
| Rechazo del tratamiento por el paciente | 0 | 1 (0,8) | 1 (4,5) | 1 (1,3) | 0 | 0 |
| Interrupción del tratamiento por otras causas | 0 | 1 (0,8) | 0 | 2 (2,7) | 0 | 0 |
| Accidental | 2 (6,5) | 10 (7,5) | 4 (18,2) | 3 (4) | 0 | 0 |
| Demencia | 0 | 9 (6,8) | 0 | 4 (5,3) | 0 | 0 |
| Suicidio | 0 | 6 84,5) | 0 | 5 (6,7) | 0 | 0 |
| Otras causas | 1 (3,2) | 42 (31,6) | 4 (18,2) | 35 (46,7) | 5 (22,7) | 14 (60,9) |
Comparación para el global de etiologías incluidas en «otras»: p=0.046 (muerte precoz); p=0.019 (muerte tardía).
A partir del primer año post-TR (muerte tardía) se produjeron 960 MCIF. Se aprecia una reducción en las muertes de origen cardiovascular (1984-1995: 35,2%; 1996-2007: 22,6% y 2008-2018: 23,9%) y un incremento significativo de las muertes por cáncer (1984-1995: 21,8%; 1996-2007: 29% y 2008-2018: 26,8%; p<0,001), que ha sido la causa más frecuente de muerte tardía en las etapas más recientes (fig. 2b). Aunque el número de muertes asociadas a hepatitis víricas es escaso, se observa un claro descenso en el tiempo (tabla 4).
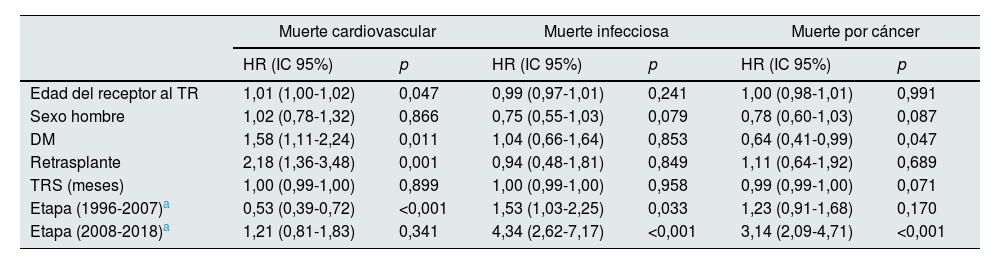
En el análisis multivariante para muerte tardía de origen cardiovascular la edad del receptor, la condición de retrasplante y la DM fueron factores independientes de riesgo, en tanto que solo la 2.ª etapa (1996-2007) se comportó como protector. Para la muerte tardía por neoplasia, la DM se asoció a menor riesgo, mientras que durante la etapa más reciente (2008-2018) se vio incrementado el riesgo de muerte por cáncer. En el caso de las infecciones, el riesgo aumentó en las últimas etapas (tabla 5). Tras excluir a los pacientes diabéticos en el análisis multivariante, los resultados para las 3 causas de muerte son similares en relación con las demás variables (datos no mostrados).
Análisis multivariante de regresión de Cox de riesgo de muerte tardía por enfermedad cardiovascular, infecciosa y por neoplasia
| Muerte cardiovascular | Muerte infecciosa | Muerte por cáncer | ||||
|---|---|---|---|---|---|---|
| HR (IC 95%) | p | HR (IC 95%) | p | HR (IC 95%) | p | |
| Edad del receptor al TR | 1,01 (1,00-1,02) | 0,047 | 0,99 (0,97-1,01) | 0,241 | 1,00 (0,98-1,01) | 0,991 |
| Sexo hombre | 1,02 (0,78-1,32) | 0,866 | 0,75 (0,55-1,03) | 0,079 | 0,78 (0,60-1,03) | 0,087 |
| DM | 1,58 (1,11-2,24) | 0,011 | 1,04 (0,66-1,64) | 0,853 | 0,64 (0,41-0,99) | 0,047 |
| Retrasplante | 2,18 (1,36-3,48) | 0,001 | 0,94 (0,48-1,81) | 0,849 | 1,11 (0,64-1,92) | 0,689 |
| TRS (meses) | 1,00 (0,99-1,00) | 0,899 | 1,00 (0,99-1,00) | 0,958 | 0,99 (0,99-1,00) | 0,071 |
| Etapa (1996-2007)a | 0,53 (0,39-0,72) | <0,001 | 1,53 (1,03-2,25) | 0,033 | 1,23 (0,91-1,68) | 0,170 |
| Etapa (2008-2018)a | 1,21 (0,81-1,83) | 0,341 | 4,34 (2,62-7,17) | <0,001 | 3,14 (2,09-4,71) | <0,001 |
DM: diabetes mellitus como causa de enfermedad renal crónica; HR: hazard ratio; IC: intervalo de confianza; TR: trasplante renal; TRS: tratamiento renal sustitutivo.
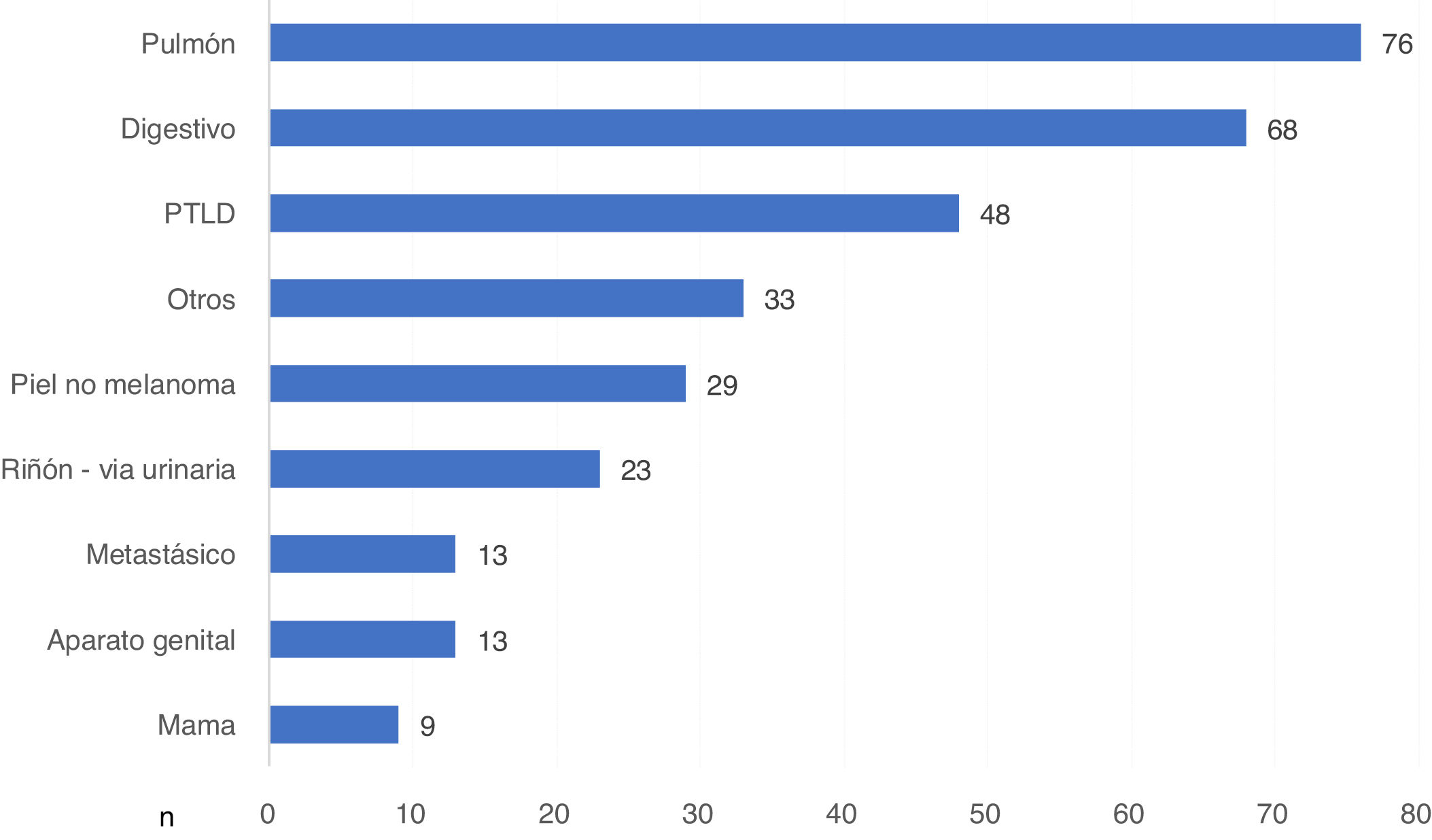
Se produjeron 370 MCIF secundarias a enfermedad por cáncer. Dispusimos del tipo de cáncer en 312 casos, lo que supone el 84,3% de los reportados. Globalmente fue el cáncer de pulmón la neoplasia que más muertes causó, con 76 pacientes fallecidos, seguido del cáncer de origen digestivo y de la enfermedad linfoproliferativa post-TR (PTLD) (fig. 3).
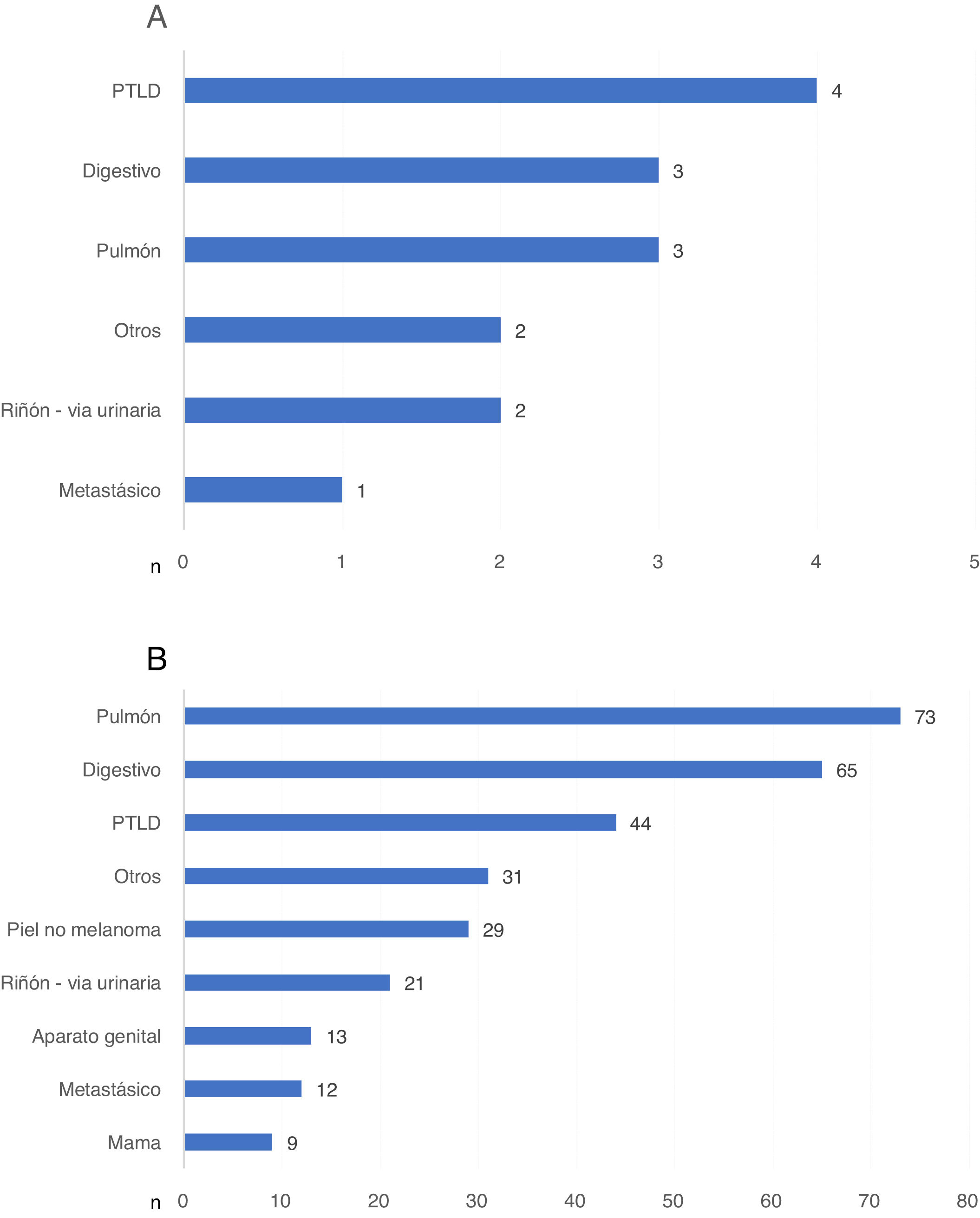
Aquellas MCIF relacionadas con el cáncer que se produjeron en el primer año del TR fueron debidas, en primer lugar, a la PTLD (fig. 4a). A partir del primer año tras el TR, el cáncer de pulmón fue la neoplasia que con más frecuencia causó la MCIF (fig. 4b). No encontramos diferencias en la distribución de los tipos de tumores en las distintas etapas (datos no mostrados).
a) Tipos de neoplasia causante de muerte con injerto funcionante en el primer año postrasplante, expresados en número de pacientes. b) Tipos de neoplasia causante de muerte con injerto funcionante tras el primer año postrasplante, expresados en número de pacientes.
PTLD: enfermedad linfoproliferativa postrasplante.
Presentamos el análisis de una de las más extensas series de pacientes fallecidos con injerto funcionante. Nuestro trabajo confirma, en una amplia serie con prolongado seguimiento, el significativo descenso en las últimas décadas de las muertes de origen cardiovascular, así como el incremento de las muertes atribuidas a cáncer en el paciente TR, las cuales constituyen, en la actualidad, la principal causa de MCIF a partir del primer año post-TR en nuestra experiencia. Asimismo, observamos que, dentro de los fallecimientos por neoplasia, el cáncer de pulmón es el que condiciona peor evolución y es el principal causante de muerte por enfermedad tumoral.
Las mayores diferencias en las causas de MCIF las hemos observado entre la primera etapa analizada y las siguientes. Sin embargo, en las etapas más recientes las diferencias son menores, al igual que se ha observado en otras áreas geográficas13. En nuestro caso, por ejemplo, la diferencia en la edad de los fallecidos es mucho mayor entre el primer período y el segundo que entre este y el siguiente. Es posible que las menores diferencias demográficas y pautas de tratamiento inmunosupresor similares (uso más racional de los esteroides, empleo de tacrolimus y micofenolato) puedan explicar, al menos en parte, los resultados parecidos observados en las 2últimas etapas evaluadas.
Tradicionalmente, la principal causa de muerte en el paciente trasplantado ha sido la enfermedad cardiovascular2,7,9. Todos los pacientes con ERC tienen un elevado riesgo cardiovascular y, aunque tras el TR el riesgo es menor que en los pacientes en diálisis, este sigue siendo muy elevado. Se estima que tras el TR los pacientes tienen una tasa anual de eventos cardiovasculares aproximadamente de un 3,5-5%11,16-18. Tras dicho TR, estos factores de riesgo cardiovascular tienen una alta prevalencia. Prueba de ello es que entre un 60 y un 80% de los receptores de TR presentan hipertensión arterial, hasta el 30% presentan alteración en la tolerancia a la glucosa, un 60% tienen dislipidemia y alrededor del 20% está con sobrepeso9,19,20. Si bien muchos de estos factores están ya presentes cuando el paciente se encuentra en lista de espera, también se añaden algunos relacionados con el TR, como la disfunción crónica del injerto. Asimismo, el tratamiento inmunosupresor puede favorecer el desarrollo de factores de riesgo cardiovascular o potenciar los ya existentes antes del TR9,18. Todo ello se ha relacionado con una mayor mortalidad y una peor supervivencia del injerto a largo plazo19.
En nuestro caso, tanto la edad del receptor como la DM se relacionaron con un mayor riesgo de muerte cardiovascular. Aunque resulta lógico mencionar que la edad se asocia con mayor mortalidad en todos los ámbitos, ciertamente se considera el principal factor de riesgo para complicaciones y muerte cardiovascular21,22. Durante el envejecimiento se producen una serie de cambios, entre los que se encuentran un aumento de la rigidez del árbol arterial (lo que condiciona la hipertrofia del ventrículo izquierdo) y la desregulación de genes implicados en el estrés oxidativo, la señalización de la insulina y la inflamación21-23. Todo ello dispone a un mayor riesgo de isquemia e insuficiencia cardíaca, lo que podría justificar el hecho de que más del 30% de las muertes en personas mayores de 65 años sean debidas a enfermedad cardiovascular23. En un estudio español se analizó la mortalidad por infarto agudo de miocardio estratificada por edad y se objetivó un aumento progresivo con la edad, que pasó del 19% en el grupo de menos de 65 años a un 84% en el grupo de más de 85 años24.
La DM es también un conocido factor de riesgo cardiovascular. El riesgo de mortalidad de los pacientes diabéticos es el mismo que el de un paciente tras un infarto de miocardio25. Estos datos han llevado a que en la actualidad la DM se considere uno de los principales factores de riesgo cardiovascular, que se comporta de la misma forma en el TR26. Se estima que el riesgo de muerte cardiovascular es 10 veces mayor que en los pacientes no diabéticos, incluidos aquellos que desarrollan DM post-TR27,28. En nuestra experiencia, además de ser un factor de riesgo para muerte cardiovascular en el análisis multivariante, se comportó como protector respecto a la muerte por cáncer, lo que muy probablemente refleja el riesgo competitivo entre ambas, como ha sido ya reportado por otros29,30.
A raíz de lo expuesto, las guías de práctica clínica recomiendan tratar enérgicamente los factores de riesgo cardiovascular en el paciente TR17,31. Asimismo, es práctica habitual el estudio exhaustivo y el tratamiento de la enfermedad cardiovascular en los pacientes que acceden al TR2,7,9. En consecuencia, es probable que la generalización de todas estas recomendaciones pueda explicar, al menos en parte, el descenso de los fallecimientos producidos por enfermedad cardiovascular en el TR en los últimos años reflejado en los datos aportados por distintos registros, como es nuestro caso8,11-13.
Nosotros observamos esta tendencia en las MCIF ocurridas a partir del primer año post-TR. El hecho de que los pacientes que fueron trasplantados entre 1996 y 2007 presentaran menor mortalidad cardiovascular puede reflejar la influencia de las estrategias de prevención primaria, pero es posible que hayan influido también cambios en otros factores específicos del trasplante, como la introducción de esquemas de inmunosupresión más seguros y con menos efectos secundarios. La ciclosporina ha sido ampliamente sustituida por el tacrolimus, que tiene menos potencial de producir hipertensión o dislipidemia32. Por otra parte, la tendencia a la minimización de esteroides reduce la probabilidad de DM, entre otros efectos beneficiosos12,25. Así, a pesar del aumento progresivo de la edad y de la comorbilidad de los pacientes que se incluyen en lista de espera, como confirman los datos que presentamos, la tasa más baja de fallecimientos de causa cardiovascular se ha mantenido también en los últimos años, lo que parece reflejar una positiva estabilización de esta tendencia.
De forma paralela a lo observado en relación con la muerte cardiovascular, las neoplasias parecen haber ido ganando protagonismo como causa de MCIF a largo plazo11-14. Se estima que los pacientes receptores de trasplante de órgano sólido tienen un riesgo de desarrollar cáncer entre 2 y 4 veces mayor que la población general, ajustado por edad y sexo, y este riesgo parece incrementarse cuanto mayor es el tiempo desde el TR33. Por otra parte, además de los factores de riesgo clásicos, como la edad, el sexo, la raza o la exposición a tóxicos, se encuentran también aquellos propios del trasplante, como la inmunosupresión, el tiempo en diálisis y la influencia de ciertos virus oncogénicos29,34-36. Para algunos autores este cambio de tendencia puede ser debido más a un descenso de la enfermedad cardiovascular que al incremento de los tumores12. Sin embargo, está claramente establecida la peor evolución del cáncer en el trasplantado, así como su relación con las pautas inmunosupresoras, cada vez más potentes en los últimos años por la complejidad creciente de los receptores, lo que podría contribuir de forma directa a la relevancia actual de las neoplasias como causa de muerte en esta población29,34-36.
El papel de la edad como factor de riesgo para el desarrollo de cáncer está bien definido en la población general37. Sin embargo, la relación entre edad y cáncer como causa de muerte es controvertida en el TR. El riesgo absoluto de desarrollar cáncer es superior en pacientes trasplantados mayores. Sin embargo, el riesgo relativo es mucho mayor en trasplantados jóvenes, debido a la rareza del cáncer en la población general en edades más tempranas29. A pesar de que algunos trabajos apuntan a la edad como factor de riesgo para la muerte por neoplasia en los trasplantados, en nuestro registro el análisis multivariante no demostró esta asociación38. Otros autores también discuten el efecto directo de la edad sobre el aumento de muertes por cáncer tras un TR y lo consideran más probablemente relacionado con riesgo competitivo con otras causas de muerte, incluida la cardiovascular29,30, como en la DM.
De forma análoga a lo que observamos en trasplantados, en la población general estamos asistiendo también desde hace unos años a un cambio en las causas de fallecimiento. En Estados Unidos las muertes debidas a enfermedades cardíacas casi duplicaban a las originadas por cáncer en los años 80, en tanto que en los últimos años tienden a igualarse39. En nuestro país, según el informe anual del Ministerio de Sanidad, los tumores malignos ocasionaron más del 25% del total de muertes documentadas, por encima de las muertes de origen cardíaco y vascular40. Por tanto, además de los factores específicos del trasplante, factores generales (hábitos más cardiosaludables, descenso del tabaquismo, exposición a tóxicos, mayor capacidad de diagnóstico de los tumores…) podrían también estar influyendo en la tendencia sobre las causas de muerte observada en nuestros trasplantados.
Por otra parte, nuestro trabajo ofrece información sobre el tipo de cáncer en aquellos pacientes fallecidos por neoplasia. En nuestra experiencia, la PTLD es la enfermedad neoplásica que con más frecuencia produce muerte en el período precoz post-TR. Aunque el cáncer es una causa poco habitual de muerte en el post-TR reciente, la PTLD tiene una distribución bimodal: es característico que muestre un pico de mayor incidencia en el primer año, que se asocia a alta mortalidad, lo que apoya nuestros datos y puede explicar el que sea la causa más habitual de muerte por cáncer en esta etapa inicial41.
Sin embargo, tanto globalmente como a largo plazo, el cáncer de pulmón es la neoplasia que con más frecuencia condicionó la muerte en nuestros pacientes. De nuevo, estos hallazgos no son específicos de la población trasplantada. En el último informe sobre las cifras del cáncer en España de 2020 publicado por la Sociedad Española de Oncología Médica, el cáncer de pulmón es el tumor que causó el mayor número de muertes en nuestro país, al igual que en el resto del mundo42,43. Una posible explicación de ello es que su curso suele ser silente y su diagnóstico se da en estadios avanzados44. Además, aunque el riesgo de cáncer de pulmón se encuentra solo un poco aumentado en los pacientes TR frente a la población general, su mortalidad es significativamente superior45-47. Desgraciadamente no disponemos de datos sobre la incidencia de tabaquismo en nuestra población para analizar su relación con el desarrollo de esta neoplasia. Algunos grupos aconsejan un cribado anual mediante TC de tórax de baja radiación en los pacientes TR con mayor riesgo de desarrollar cáncer de pulmón (antecedentes de tabaquismo o fumadores activos), aunque queda por establecer si esta práctica puede extenderse y mejorar el pronóstico de este cáncer en nuestros pacientes29.
Al margen de las 2principales causas de MCIF tardías, cardiovascular y cáncer, ya discutidas, hemos observado otros cambios a lo largo de estos años. La creciente experiencia de los equipos quirúrgicos y los avances en el conocimiento y tratamiento de las hepatitis víricas se ven reflejados, con mucha probabilidad, en un descenso de las MCIF asociadas a estas causas.
En relación con la muerte de etiología infecciosa, es posible que el riesgo de muerte tardía por infección aumente por múltiples factores descritos en la literatura, como el incremento de la potencia inmunosupresora de las actuales terapias, de la edad de los receptores y de la incidencia de las infecciones por gérmenes multirresistentes, entre otros48.
Nuestro trabajo presenta limitaciones. En primer lugar, se trata de un análisis retrospectivo con todas las limitaciones inherentes a este diseño. Por otro lado, disponemos de un número limitado de variables para poder explicar los cambios en el tiempo que observamos, sin datos sobre algunos factores muy relacionados con la mortalidad, como el hábito tabáquico, la hipertensión arterial, la cardiopatía isquémica, la vasculopatía periférica o la dislipidemia. Tampoco disponemos de datos sobre el tipo de inmunosupresión. No obstante, para minimizar esta limitación, las etapas fueron establecidas por su relación temporal con los cambios de inmunosupresión: desde la era pretacrolimus (primera etapa), al uso extendido de tacrolimus y micofenolato (segunda etapa) y, finalmente, al empleo muy habitual de las terapias de inducción (tercera etapa). Asimismo, el análisis se ha ajustado por tiempo post-TR para eliminar, en lo posible, el sesgo que el factor tiempo tiene sobre las causas de muerte, estableciendo el seguimiento a 10 años post-TR en todas las etapas. Por último, no podemos conocer la influencia que la pandemia por COVID ha podido tener en las causas de fallecimiento de nuestros pacientes. Creemos que esto debe ser objeto de un análisis específico y, por eso, no hemos extendido más en el tiempo el estudio que ahora presentamos.
ConclusionesComo conclusión, podemos afirmar que la evolución de las causas de muerte en el paciente TR sigue un patrón parecido al de la población general. Las muertes de origen cardiovascular han descendido de forma significativa y esto se mantiene en los últimos años a pesar de la mayor edad y comorbilidad de los receptores. Por el contrario, las neoplasias son ya la principal causa de muerte tardía en los últimos años. La PTLD es la neoplasia más frecuente causante de muerte en el primer año y, después, el cáncer de pulmón. Globalmente, el cáncer de pulmón, como en la población general, es la neoplasia de peor pronóstico, lo que deberíamos tener en cuenta a la hora de establecer planes y protocolos de seguimiento en nuestros pacientes trasplantados.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.