Sr. Director:
Se ha descrito una incidencia de calcifilaxis del 1% por año y una prevalencia del 4% en pacientes en diálisis1, pero raramente aparece en trasplantados renales o con enfermedad renal crónica estadios III y IV2.
La distribución proximal de las lesiones y la presencia de ulceración están asociados a un muy pobre pronóstico, principalmente por la infección de éstas y consecuente muerte del paciente3. En los casos descritos de calcifilaxis en trasplantados renales, su evolución puede ser aún peor4,5, discutiéndose el posible papel de los corticoides como precipitantes de esta enfermedad. No obstante, la patogenia es poco conocida, pero existen factores de riesgo que posiblemente tengan una contribución relativa diferente entre la afectación proximal o distal. Por ello, el tratamiento no está establecido, llegando a ser multidisciplinario y, en ocasiones, empírico. Aun así, debe enfatizarse en la normalización del producto fosfocálcico y de los niveles de PTHi si se hallan elevados, al ser posibles precipitantes6.
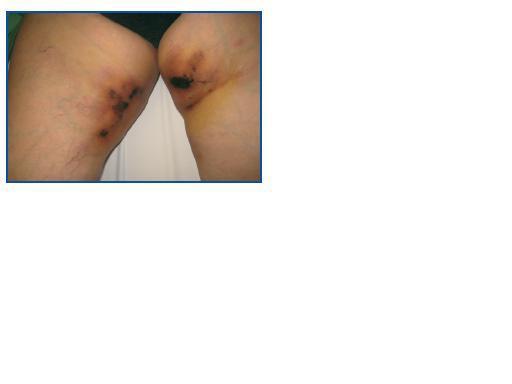
Presentamos el caso de una mujer de 66 años trasplantada hepática desde hacía 11 años por hepatopatía crónica enólica y, por segunda vez, de trasplante renal tres años antes del ingreso actual, debido a glomerulonefritis mesangial por IgA, en la cual aparecieron lesiones induradas y con necrosis dérmica central, muy dolorosas y simétricas, en la cara interna de ambos muslos, muy sugestivas de calcifilaxis (figura 1). Se realizó un punch cutáneo que confirmó el diagnóstico. No obstante, la gammagrafía ósea no evidenció captación extraesquelética. Su tratamiento habitual consistía en furosemida, bisoprolol, prednisona, tacrolimus, micofenolato de mofetil, omeprazol, acenocumarol al existir una fibrilación auricular crónica y darbopoyetina sc. Analíticamente, destacaba una PCR de 51 mg/l, Hb de 10 g/dl, creatinina de 2,9 mg/dl debido a nefropatía crónica del injerto con una proteinuria de 2,6 g/d, patrón de colestasis con GGT de 230 U/l y fosfatasa alcalina de 177 U/l, calcio corregido de 8,6 mg/dl, fósforo de 6,6 mg/dl y PTHi inicial de 653 pg/ml. Se inició cinacalcet 30 Ìg/d e hidróxido de aluminio como quelante del fósforo, lográndose la normalización y la estabilización de los productos fosfocálcicos y de los valores de PTHi en 150 pg/ml. A pesar de ello, se desarrollaron amplias úlceras, aplicándose diariamente curas locales con gasas húmedas y pomada enzimática (Iruxol Mono®), y administrándose oralmente derivados opioides para controlar el dolor, además de tiosulfato sódico ev. a dosis de 50 g ev. tres veces por semana. La evolución clínica no fue satisfactoria, siendo necesario el inicio de hemodiálisis a los 38 días del diagnóstico a través de catéter yugular derecho debido a un empeoramiento de la función renal; asimismo, también fue preciso mantenerse correctos los niveles plasmáticos de tacrolimus y no objetivarse cuadro séptico acompañante. Pocas horas después, presentó un paro cardiorrespiratorio no recuperable. No se realizó necropsia.
A pesar del fatal desenlace de nuestra paciente, queremos destacar el posible beneficio terapéutico del cinacalcet en el tratamiento de la calcifilaxis proximal con hiperparatiroidismo secundario7. No obstante, falta demostrar su utilidad en los pacientes trasplantados con calcifilaxis, aunque ya se ha descrito su efectividad en el control del hiperparatiroidismo8. Tampoco hemos encontrado la descripción de otros pacientes trasplantados renales a los cuales se les haya administrado tiosulfato sódico, aunque sí se ha ido demostrando su efectividad en varias publicaciones en enfermos sometidos a diálisis. Se ha observado que este fármaco tiene una alta solubilidad en forma de tiosulfato cálcico, inhibiendo la precipitación de calcio y disolviendo los depósitos de éste en los tumores cálcicos y en la calcifilaxis9.
Esperamos que la descripción de otros casos de calcifilaxis en trasplantados renales pueda ayudarnos en el conocimiento del uso de tratamientos como el cinacalcet, tiosulfato sódico y bifosfonatos, entre otros. Aunque en este caso no resultó de ayuda, parece ser que la gammagrafía ósea tiene una alta sensibilidad en el diagnóstico de esta enfermedad, demostrándose la anormal captación isotópica a nivel subcutáneo en el 97% de los casos10.
Figura 1.