Introducción: La hiperfosfatemia se ha relacionado con la velocidad de progresión de la enfermedad renal crónica (ERC), aunque todavía existen dudas sobre algunos aspectos de esta asociación. Objetivos: Establecer los determinantes de los niveles de fósforo sérico (P) en la ERC avanzada, con especial interés en aquellos con potencial influencia sobre la progresión de la ERC, y analizar la relación entre los niveles promediados de P sérico con las variaciones del filtrado glomerular (FG) durante el tiempo de seguimiento. Pacientes y métodos: Estudio prospectivo de observación que incluyó a 184 pacientes con ERC avanzada. La tasa de variación del filtrado glomerular (TFG) fue calculada como la pendiente de la recta resultante de la regresión lineal entre el FG y el tiempo de seguimiento, y expresada como ml/min/mes. La mediana de seguimiento fue de 303 días. La asociación entre la TFG y las covariables de estudio se analizó mediante regresión lineal múltiple. Resultados: Los mejores determinantes de los niveles de P sérico fueron, además del FG (beta = 0,477), el sexo femenino (beta = 0,106), el calcio sérico (beta = —0,274), la albúmina sérica (beta = —0,112), el bicarbonato sérico (beta = —0,182), la tasa de catabolismo proteico (beta = 0,144) y el tratamiento diurético (beta = 0,180). La TFG media ± desviación estándar (DE) fue —0,198 ± 0,376 ml/min/mes. Los mejores determinantes de la TFG fueron: proteinuria (beta = —0,462), P sérico (beta = —0,440) y FG basal (beta = —0,404). Los valores absolutos de excreción urinaria de P no se asociaron con el deterioro de la función renal, aunque sí lo hizo la excreción urinaria de P ponderada al FG. Conclusión: Los niveles de fósforo sérico se correlacionan fuertemente con la velocidad de progresión de la ERC.
Introduction: High serum phosphorus (P) has been shown to be associated with a more rapid decline of renal function in patients with chronic kidney disease (CKD). Objective: The aim of this study was to determine whether time-averaged serum P levels are associated with the progression of renal failure adjusted for other potential confounders. Patients and methods: A prospective observational study of 184 patients with pre-dialysis CKD, stages 3, 4 and 5 (mean GFR=15.2±5.6ml/min/1.73m2). The rate of decline in renal function was calculated as the slope of GFR. Median follow-up time was 303 days. Biochemical parameters were analysed as time-averaged concentrations. Multivariate linear regression analysis was used to assess the best determinants of serum P levels, and the relationship between the rate of decline of renal function and the study covariates. Results: The best determinants of serum P levels were: GFR (beta = 0.477), female sex (beta = 0.106), serum calcium (beta = —0.274), serum albumin (beta = —0.112), serum bicarbonate (beta = —0.182), protein catabolic rate (beta = 0.144), and use of diuretics (beta = 0.180). The mean ± standard deviation (SD) slope of GFR was —0.198±0.376ml/min/month. The best determinants of the slope of GFR were: proteinuria (beta = —0.462), serum P (beta = —0.440), and basal GFR (beta = —0.404). Total urinary P excretion was not significantly associated with the rate of decline of renal function. Conclusion: High serum P levels are strongly and independently associated with a more rapid decline of renal function in patients with advanced CKD.
INTRODUCCIÓN
Una deficiente excreción urinaria de fósforo es uno de los elementos patogénicos clave en el desarrollo de las alteraciones del metabolismo óseo-mineral asociadas a la enfermedad renal crónica (ERC). Aunque esta alteración se produce desde estadios iniciales de la ERC, los mecanismos compensadores son capaces de mantener los niveles de fósforo sérico dentro de la normalidad hasta que el deterioro de la función renal es muy avanzado1-3.
Además de la función renal y la carga de fósforo (principalmente dietética), existen otros factores que predisponen a la hiperfosfatemia, y que podrían explicar la notable diferencia en los niveles de fósforo sérico entre pacientes, incluso con estadios menos avanzados de ERC3.
En pacientes con ERC, la hiperfosfatemia se ha relacionado con la morbilidad cardiovascular y con la mortalidad, así como con la velocidad de progresión del deterioro de la función renal3-7. Sin embargo, aún existen dudas sobre algunos aspectos de esta asociación: la relación del fósforo sérico con otros factores potencialmente implicados en la progresión de la ERC, la influencia de la carga de fósforo sobre la progresión de la ERC independiente de los niveles de fósforo sérico, los mecanismos patogénicos por los que el fósforo acelera el deterioro de la función renal, y si su control puede retardar la progresión de la ERC o mejorar el pronóstico vital.
Los objetivos del presente estudio fueron los siguientes: establecer los determinantes de los niveles de fósforo en pacientes con ERC avanzada, con especial interés en aquellos con potencial influencia sobre la progresión de la ERC, y analizar la relación entre los niveles promediados de fósforo sérico durante el tiempo de seguimiento con los cambios del filtrado glomerular (FG), tanto de forma univariable como ajustada al resto de covariables de interés.
PACIENTES Y MÉTODOS
Pacientes
El número total de pacientes incluidos en este estudio fue de 184 (edad media 69 ± 12 años, 93 mujeres y 91 hombres) seleccionados durante el período comprendido entre el uno de septiembre de 2009 y el uno de noviembre de 2010 en la Consulta Externa de Enfermedad Renal Crónica Avanzada del Hospital Infanta Cristina, Badajoz.
Los criterios de inclusión fueron: edad mayor de 18 años, presentar una insuficiencia renal crónica con FG estimado (FGe) inferior a 40 ml/min/1,73 m2 no en diálisis, y no secundaria a fracaso de un trasplante renal, y ausencia de procesos agudos intercurrentes (incluyendo enfermedades sistémicas en actividad) o alteraciones importantes del estado nutricional. No se excluyeron del estudio cinco pacientes que presentaban alteraciones del fósforo conocidas previamente (un paciente con síndrome de Fanconi, dos con litiasis y pérdida renal de fósforo, y otros dos con poliquistosis e hiperfosfaturia). Tampoco se excluyeron los pacientes que ya estaban en tratamiento quelante de fósforo o vitamina D.
Sí se excluyeron aquellos en los que no se pudo realizar un seguimiento de, al menos, tres meses y tres mediciones consecutivas de la función renal, los tratados con corticoides, y los que presentaban paraproteinemias.
Además de los datos demográficos, también se incluyeron como variables del estudio tener diabetes mellitus, el índice de masa corporal, las presiones arteriales sistólica y diastólica (medición en consulta) y el consumo de tabaco.
Los quelantes de fósforo que se utilizaron en estos pacientes fueron en su mayoría sales de calcio o de aluminio. Algún paciente fue tratado con carbonato de lantano, y ninguno con clorhidrato de sevelamero. Las dosis prescritas no superaron en ningún caso los 600 mg/día de calcio elemental.
El calcitriol oral fue la forma farmacológica más utilizada en aquellos tratados con vitamina D (92%), con dosis no superiores a los 0,25 µg/día, y dosis habitual de 0,25 µg cada 48 horas. En caso de hiperfosfatemia no controlada esta medicación fue suspendida.
Análisis de laboratorio y cálculo de los parámetros de estudio
Las determinaciones bioquímicas se realizaron con un autoanalizador (Advia Chemistry, Siemens Healthcare Diagnostics). También se midió el bicarbonato en sangre venosa (analizador de gases ABL 800 FLEX, Radiometer Ibérica). Las concentraciones plasmáticas de hormona paratiroidea (PTH) se determinaron mediante IRMA (N-tact PTH DiaSorin).
En orina recogida durante las 24 horas antes de la extracción de sangre se analizaron los siguientes parámetros bioquímicos: urea, creatinina, proteinuria, fósforo y calcio.
El FG fue estimado mediante la fórmula MDRD-48.
La tasa de catabolismo proteico (TCP) se calculó mediante la excreción del nitrógeno ureico con las fórmulas combinadas de Cottini, et al. y Maroni, et al., según la descripción de Bergström, et al.9.
Las excreciones diarias de fósforo y calcio se calcularon en las muestras de orina de 24 horas, y se mostraron como excreción total y normalizada al FG (mg de fósforo excretado cada 24 horas por cada ml/min/1,73 m2 de FG). Con este último parámetro se pretende valorar la carga de fósforo estimada indirectamente mediante la excreción urinaria y ponderada al grado de insuficiencia renal.
El índice de excreción urinaria de calcio (calcio en orina x creatinina en plasma/creatinina en orina) fue calculado para estimar la excreción de calcio ponderada al grado de insuficiencia renal.
Para estudiar el manejo tubular de fósforo se calculó la fracción de excreción de fósforo (FEP) mediante la fórmula: (fósforo orina x creatinina sérica)/(fósforo sérico x creatinina orina) x 100, y el resultado fue expresado como porcentaje (%).
Diseño del estudio y análisis estadístico
Este estudio es prospectivo, observacional y realizado en un único centro.
La tasa de modificación del FG fue la variable evolutiva principal, y se estimó en cada paciente como la pendiente de la recta resultante de la regresión lineal entre el FG y el tiempo de seguimiento (meses). Este parámetro se expresó como ml/min/mes, y el resultado negativo significó pérdida de función renal.
La mediana de seguimiento fue de 303 días, con unos rangos intercuartílicos de 218 y 391 días.
Antes de analizar la relación entre la tasa de progresión de la ERC y el fósforo sérico, se intentaron identificar variables de interés común en esta relación mediante un análisis transversal, estableciendo los mejores determinantes de los niveles de fósforo sérico.
Todas las variables continuas de los parámetros bioquímicos fueron presentadas y analizadas como valores promediados durante el tiempo de seguimiento.
Para analizar las variables que mejor se asociaban con la tasa de progresión de la ERC se utilizaron modelos de regresión lineal univariable y multivariable, con elección de covariables de forma automática mediante el proceso de eliminación progresiva condicional (hacia atrás).
Para la comparación de dos variables continuas independientes se utilizaron el test de la t de Student para muestras no apareadas, o el test no paramétrico de Mann-Whitney según las características de distribución de las variables. Para la comparación de variables discretas se utilizó el test de la chi-cuadrado.
Los datos de este estudio se presentan como media y desviación estándar (± DE), o como mediana y rangos intercuartílicos o valor mínimo-máximo. Una p <0,05 fue considerada como estadísticamente significativa. El análisis estadístico y los gráficos se realizaron con el programa SPSS versión 15.0 (SPSS, Chicago, EE.UU.).
RESULTADOS
Las características clínicas y analíticas del grupo de estudio se muestran en la tabla 1. El FG medio fue de 15,2 ± 5,6 ml/min/1,73 m2, y el número de pacientes en estadios 3-4 y 5 fue de 86 y de 98, respectivamente.
El número de pacientes que presentó unos niveles promedio de fósforo elevados (>4,5 mg/dl) fue de 77 (42%).
Determinantes de hiperfosfatemia
En comparación con los pacientes que mantuvieron un buen control del fósforo sérico (tabla 1), los que presentaron hiperfosfatemia eran más jovenes, con un mayor predominio de mujeres, y con un FG basal más bajo. No había diferencias en el porcentaje de diabéticos, pero los que presentaron hiperfosfatemia tenían una proteinuria más elevada y unas concentraciones de albúmina plasmática más reducidas. Los niveles de calcio sérico también eran más bajos, la PTH más elevada, y el bicarbonato sérico más reducido en los pacientes con hiperfosfatemia. No se observaron diferencias ni en la tasa de catabolismo proteico, ni en la excreción total de fósforo urinario, aunque el índice de excreción urinaria de calcio fue significativamente más elevado en los pacientes con hiperfosfatemia, en probable relación con la toma más frecuente de quelantes cálcicos, vitamina D y diuréticos de asa.
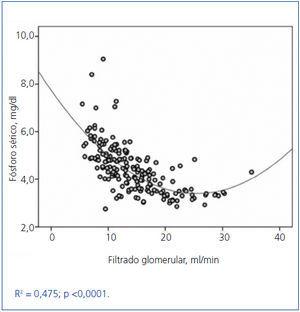
Se observó una importante correlación entre el fósforo sérico y el FG, ambos promediados en el tiempo de seguimiento (figura 1). Como se muestra en la figura, el mejor ajuste de esta correlación fue mediante una curva de tal forma que la hiperfosfatemia comenzaba a ser más frecuente con FG por debajo de 15 ml/min.
En la figura 2 se muestra la correlación entre la fracción de excreción de fósforo (FEP) y la excreción urinaria de fósforo ponderada al FG. La figura ilustra cuáles son los límites del mecanismo de compensación renal para mantener la fósfatemia dentro de la normalidad. Según aumenta la carga de fósforo por cada unidad de FG se eleva la FEP, pero con un límite medio de aproximadamente el 50%, salvo en algunos pacientes con trastornos tubulares, los cuales son capaces de superar el 70% de FEP.
Los pacientes con hiperfosfatemia fueron tratados más frecuentemente con diuréticos, quelantes del fósforo y vitamina D. Los 107 pacientes tratados con diuréticos tenían una concentración promedio de fósforo sérico significativamente más elevada que los no tratados (4,67 ± 1,11 frente a 4,10 ± 0,75 mg/dl; p <0,0001).
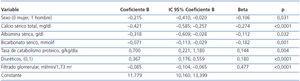
Por regresión lineal múltiple, los mejores determinantes de los niveles de fósforo sérico se exponen en la tabla 2. Además del FG (determinante más influyente), el sexo femenino, el calcio sérico, la albúmina plasmática, el bicarbonato sérico, la tasa de catabolismo proteico y el tratamiento diurético formaron parte de la mejor ecuación predictiva.
Determinantes de la progresión de la enfermedad renal crónica
La tasa de variación del FG fue de −0,198 ± 0,376 ml/min/mes. Hubo diferencias en este descenso de función renal según el estadio de la ERC, que fue más acelerado en pacientes en estadio 5 (−0,234 ± 0,367 ml/min/mes) que en los que se encontraban en estadio 3-4 (−0,158 ± 0,384 ml/min/mes), aunque esta diferencia no fue estadísticamente significativa.
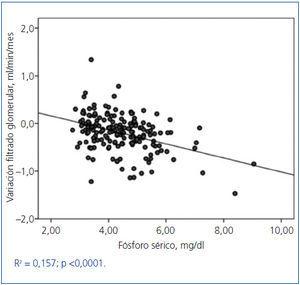
Se observó una correlación lineal entre la tasa de variación del FG y el fósforo sérico promediado (figura 3), y también, aunque con una menor significación, con el fósforo sérico basal (R2 = 0,03; p = 0,02). La proteinuria transformada en logaritmo también se correlacionó fuertemente con la tasa de variación del FG (R2 = 0,242; p <0,0001).
En el análisis de regresión lineal múltiple (tabla 3), los principales determinantes de la tasa de variación de la función renal fueron el fósforo sérico, la proteinuria (en logaritmo) y la función renal basal, esta última de forma negativa, es decir, a mayor FG basal más rápida caída de la función renal.
Este modelo predice un descenso de la tasa de FG un 46% más rápido por cada mg/dl de fósforo sérico por encima del nivel de referencia normal de 4,5 mg/dl.
No entraron a formar parte de esta ecuación variables relacionadas con los niveles de fósforo sérico como la excreción urinaria de fósforo tanto en valores absolutos como normalizados a peso corporal total, albúmina plasmática, sexo femenino, diuréticos, tasa de catabolismo proteico o bicarbonato sérico.
Cuando en este modelo se introdujo como variable sustituta del fósforo sérico la excreción urinaria de fósforo ponderada al FG, ésta también se asoció negativamente con la tasa de variación de la función renal (coeficiente beta = −0,332; p = 0,002).
DISCUSIÓN
Los resultados de este estudio muestran que la hiperfosfatemia (fósforo sérico >4,5 mg/dl) es frecuente en los pacientes con ERC en estadios avanzados pre-diálisis. Además de la función renal (determinante más influyente), el sexo femenino, la albúmina sérica, el bicarbonato sérico y el uso de diuréticos también resultaron ser determinantes significativos de los niveles de fósforo sérico.
La velocidad de progresión de la ERC se correlacionó de manera importante con los niveles promediados de fósforo, tanto de forma univariable como en modelos ajustados a otras covariables de interés por su potencial participación en la progresión de la ERC.
El principal mecanismo compensador del déficit de excreción urinaria de fósforo inherente a la pérdida de función renal es el incremento de la fracción de excreción tubular10. La fracción de excreción de P depende de la expresión de las proteínas transportadoras tubulares NaPi-IIa y NaPi-IIc, que, a su vez, están reguladas por factores que intervienen de forma directa en el metabolismo mineral (PTH, vitamina D, calcio, fósforo y fosfatoninas)11-13. Sin embargo, procesos ajenos al metabolismo mineral, como las alteraciones del equilibrio ácido-base11-13, el estado de expansión o contracción del volumen circulante efectivo11,12, e incluso la participación de otras hormonas11,12 y fármacos14, también pueden influir en la expresión de estos transportadores de fósforo.
Aunque es controvertido si a lo largo de la evolución de la ERC se produce retención (balance positivo) de fósforo a pesar de niveles séricos dentro de la normalidad, la hiperfosfatemia es el signo más evidente de retención de fósforo, que se produce cuando se sobrepasan los límites de manejo y compensación renal ante una determinada carga de fósforo10. Como se muestra en la figura 2, la fracción de excreción de fósforo tiene un límite (alrededor del 50%), que se alcanza cuando la carga de fósforo (estimada indirectamente a través de la excreción urinaria) por cada unidad de filtrado glomerular supera los 35-40 mg/día por ml/min/1,73 m2. Sin embargo, en pacientes con tubulopatías que afectan selectivamente al transporte de fósforo, la fracción de excreción puede alcanzar el 70-80%, sin que se observe hiperfosfatemia a pesar de la carga de fósforo o la reducción de FG.
Las mujeres incluidas en este estudio tendieron a presentar niveles más elevados de fósforo sérico que los hombres. El sexo femenino ha sido señalado en algunos estudios como determinante de la hiperfosfatemia en la ERC6,7, pero no en todos4.
Los estrógenos desempeñan una notable influencia en el manejo del fósforo, al modificar la síntesis de PTH, vitamina D y FGF-2315,16, o incluso al reducir directamente la expresión de transportadores tubulares17, de tal forma que todos estos cambios favorecen la excreción renal de fósforo. Por otro lado, el hipogonadismo masculino se asocia con un aumento de los niveles de fósforo sérico y con una disminución de la fracción de excreción renal16,18.
Aunque en el presente estudio no se realizaron análisis de hormonas gonadales, es probable que la prevalencia de hipogonadismo fuera mayor en las mujeres, por ser la mayoría posmenopáusicas, que en los hombres.
En este estudio se observó una asociación inversa entre las concentraciones séricas de albúmina y de fósforo. Otros estudios también han observado esta asociación5,7, aunque los vínculos patogénicos entre estos dos parámetros son inciertos.
La concentración de albúmina plasmática refleja la presencia y la gravedad de distintos procesos que tienen un impacto negativo en la evolución de los pacientes con ERC (p. ej., desnutrición, inflamación, proteinuria, hipervolemia, etc.)19.
En este estudio no se observaron diferencias en el estado de nutrición, y la tasa media de catabolismo proteico fue igual en los que presentaban o no hiperfosfatemia. En cambio, los pacientes con hiperfosfatemia presentaban una proteinuria más elevada, y se observó una correlación significativa entre ambos parámetros (fósforo sérico y proteinuria).
Una hipótesis para explicar esta relación es el vínculo que puede existir entre un estado ávido de reabsorción de sodio en el túbulo proximal y los mecanismos de compensación de la excreción de fósforo. Se ha descrito una relación entre la expansión de volumen, niveles de péptido natriurético auricular y producción de dopamina intrarrenal con la disminución de la expresión de los transportadores tubulares NaPi-IIa y, por tanto, una mayor fosfaturia11,12. Por el contrario, una disminución del volumen circulante efectivo (p. ej., síndrome nefrótico) podría influir en la expresión de estos transportadores de NaPi, haciendo menos efectiva la excreción urinaria de fósforo12.
En conexión con esta misma hipótesis, los pacientes tratados con diuréticos mostraban una concentración media de fósforo sérico significativamente más elevada que los no tratados. Esta asociación se ha observado también en otros estudios20, y los diuréticos han sido empleados con éxito para elevar la fosfatemia en procesos patológicos caracterizados por pérdida renal de fósforo como es el raquistismo hipofosfatémico21.
La hiperfosfatemia se ha relacionado con un aumento de la presión arterial y circulación hiperdinámica22. También se ha observado que la sobrecarga de fósforo daña el podocito en animales de experimentación23. Estos dos mecanismos podrían explicar de forma alternativa una relación causal entre el fósforo y la magnitud de la proteinuria.
La asociación inversa entre las concentraciones de bicarbonato y fósforo sérico que se observó en este estudio es un hallazgo destacable, pero de difícil interpretación. Se ha descrito en estudios previos que la corrección de la acidosis metabólica en pacientes con ERC reduce de forma significativa los niveles de fósforo sérico, sin aumentar concomitantemente la fosfaturia o la excreción fecal de fósforo24.
Sin embargo, en modelos experimentales de acidosis metabólica en ratas, la expresión de los transportadores tubulares de fósforo Na-PiII disminuye, incrementando la fosfaturia, y favoreciendo así la excreción neutralizada de ácidos en la orina25.
De forma muy similar a como se llega a desarrollar hiperfosfatemia, el grado de acidosis en la ERC se relaciona con el grado de reducción del FG y la carga de ácidos, procedentes principalmente de la dieta. De este modo, acidosis e hiperfosfatemia podrían reflejar simplemente el efecto común de dietas inadecuadas al grado de insuficiencia renal. No obstante, los resultados de este estudio muestran que la asociación entre fósforo y bicarbonato séricos es independiente del FG y de la tasa de catabolismo proteico, y se sugiere una relación por otros mecanismos aún por esclarecer (¿movilización ósea o de depósitos extraóseos, o redistribución celular?).
Aunque la asociación entre los niveles de fósforo y la velocidad de progresión de la ERC ya ha sido descrita en otros estudios4-7, todavía existen dudas sobre los mecanismos patogénicos que vinculan estos procesos. Una forma simple de explicar este hallazgo podría ser la estrecha relación entre hiperfosforemia y estadios más avanzados de ERC, pudiendo ser atribuible la velocidad de deterioro de la función renal a la propia gravedad de la ERC más que a las concentraciones de fósforo sérico. Sin embargo, en este estudio se demuestra que la relación del fósforo sérico con la velocidad de deterioro de función renal es más intensa cuanto más alta es la función renal residual basal, lo que sugiere el papel independiente del fósforo o de los factores relacionados con las concentraciones de fósforo.
La magnitud de la proteinuria y el grado de acidosis metabólica, factores que se asocian con unas concentraciones de fósforo más elevadas, han sido implicados también como determinantes de la velocidad de progresión de la ERC26-29. Los resultados del presente estudio confirman el papel independiente del fósforo sérico en la progresión de la ERC, a pesar de la asociación con la proteinuria y el bicarbonato sérico.
Aunque el número de pacientes no fue muy elevado, este estudio tiene dos fortalezas reseñables como son que las variables incluidas no fueron el resultado de una sola muestra sino de los promedios de numerosas muestras durante el tiempo de seguimiento, y que la medición de la progresión de la ERC se realizó por métodos más precisos que el uso de variables cualitativas, como son la entrada en diálisis o la duplicación de la creatinina sérica basal.
Este estudio presenta también limitaciones. Aunque todos los pacientes fueron tratados con los mismos criterios, es probable que aquellos que no lograron un control adecuado de fósforo fueran los menos cumplidores de la dieta y del tratamiento, y de esta forma podrían tener otros factores influyentes en la progresión de la ERC no relacionados con el fósforo y no reconocidos en este estudio.
No se excluyeron a los pacientes ya tratados con quelantes, y aunque esta circunstancia fue tenida en cuenta en los análisis multivariable, la prevalencia de hiperfosfatemia en el grupo de estudio podría estar sometida a artefactos.
No se determinaron los niveles de FGF-23 o de otras fosfatoninas, ni tampoco de 25-hidroxi-colecalciferol.
La excreción urinaria de fósforo es una aproximación a la cantidad de fósforo que se ingiere y se absorbe, más la generada por el balance de remodelado óseo e intercambio extraóseo. Esta cantidad se toma en el presente estudio como carga de fósforo, pero en absoluto debe considerarse como el resultado de un riguroso balance metabólico.
En conclusión, la hiperfosfatemia es un hallazgo frecuente en estadios avanzados de ERC. Además de la función renal, otros factores como el sexo femenino, la acidosis, la hipoalbuminemia o el uso de diuréticos se asocian con concentraciones más elevadas de fósforo sérico.
En este estudio se demuestra que los niveles de fósforo sérico son determinantes independientes de la velocidad de progresión de la ERC y, por tanto, estos resultados apoyan la realización de ensayos clínicos para confirmar si un control adecuado del fósforo retarda la progresión de la ERC.
Tabla 2. Determinantes de los niveles de fósforo sérico por regresión lineal múltiple
Tabla 3. Determinantes progresión de la enfermedad renal crónica por regresión lineal múltiple
Figura 1. Asociación entre los niveles de fósforo sérico y el filtrado glomerular, ambos parámetros promediados en el tiempo de seguimiento.
Figura 2. Asociación entre la excreción urinaria de fósforo ponderada al filtrado glomerular y la fracción de excreción tubular de fósforo.
Figura 3. Asociación entre la tasa de variación del filtrado glomerular durante el periodo de seguimiento y el fósforo sérico promediado.
Tabla 1. Características clínicas y bioquímicas del grupo de estudio en conjunto y en cada subgrupo según niveles de fósforo sérico