La búsqueda de biomarcadores tempranos de enfermedad renal diabética (ERD) en pacientes con diabetes mellitus tipo 2 (DMT2), como los marcadores genéticos para identificar pacientes vulnerables de la enfermedad, incluso antes de la presencia de una disminución de la estimación de tasa de filtrado glomerular (TFGe) o presencia de microalbuminuria ha cobrado importancia en los últimos años.
El polimorfismo rs5186 (A1166C) presente en el gen receptor tipo 1 de la angiotensina II (AGTR1) ha sido asociado a distintos efectos del riesgo de daño renal que suelen estar presentes en pacientes con diabetes mellitus (DM). Se ha descrito que el rs5186 podría influir en la estabilidad de las proteínas que conforman al receptor de la angiotensina II tipo 1 (AT1) alterando su actividad, por lo que podría ser considerado como un factor de riesgo a enfermedad renal crónica (ERC) caracterizada por una disminución progresiva de la TFG. Sin embargo, la asociación del polimorfismo rs5186 del gen AGTR1 con ERD en pacientes con DMT2 ha sido controversial, no concluyente, incluso nula. Las controversias podrían ser por los estudios de asociación y estimación del riesgo del rs5186 previamente reportados incluyen distintos fenotipos clínicos considerados como inductores y potenciadores de ERC, además, los tamaños de las muestras analizadas en pacientes con DMT2 eran pequeñas y no tenían un control estricto en su inclusión, careciendo incluso de marcadores bioquímicos o estadificación KDOQI que han dificultado su análisis.
ObjetivoDeterminar la asociación del rs5186 del gen AGTR1 con la disminución de TFGe considerada como riesgo al desarrollo de ERD en pacientes con DMT2.
Material y métodosSe analizaron 297 pacientes con DMT2 no emparentados, divididos en 221 controles (KDOQI 1) y 76 casos (KDOQI 2). Se determinaron parámetros de presión arterial, antropometría y bioquímicos. El genotipado del rs5186 del gen AGTR1 se realizó por PCR en tiempo real con uso de sondas TaqMan. Se determinaron frecuencias alélicas, genotípicas y equilibrio de Hardy-Weinberg. El análisis del comportamiento de los datos se determinó con Shapiro-Wilk, la comparación de las variables por t de Student para variables continuas, y X2 para variables categóricas, se usó prueba ANOVA para comparación de medias de más de dos grupos. El efecto del rs5186 a disminución de TFGe se realizó por distintos modelos de herencia ajustados por variables de riesgo a ERD. Se consideró un valor de p < 0,05 como estadísticamente significativo. Se utilizó el software Statistical Package STATA v11.
ResultadosLos modelos dominante y sobredominante mostraron un riesgo a la disminución de la TFGe de 1,89 (1,05-3,39, p = 0,031) y 2,01 (1,08-3,73, p = 0,023) en pacientes con DMT2. El riesgo aumentó a 2,54 (1,10-5,89) en el modelo sobredominante en mujeres.
ConclusiónEn la práctica clínica, la mayoría de las nefropatías progresan lentamente hacia la pérdida definitiva de la función renal, cursando incluso asintomáticas. El presente estudio es el primero en reportar una contribución del rs5186 del gen AGTR1 con una disminución de la TFGe y podría ser considerado como un riesgo a ERD en pacientes con DMT2.
Early biomarkers search for Diabetic Kidney Disease (DKD) in patients with Type 2 Diabetes Mellitus (T2DM), as genetic markers to identify vulnerable carriers of the disease even before Glomerular Filtration Rate (GFR) decline or microalbuminuria development, has been relevant during the last few years.
The rs5186 (A116C) polymorphism of the Angiotensin II Receptor Type I gene (AGTR1), has been associated to multiple effects of renal injury risk, commonly detected in patients with Diabetes Mellitus (DM). It has been described that rs5186 could have an effect in stability proteins that assemble Angiotensin II Receptor Type I (AT1), modifying its action, which is why it should be considered as a risk factor for Chronic Kidney Disease (CKD), characterized by a GFR progressive reduction. Even though, the association between rs5186 AGTR1 gene polymorphism and DKD in patients with T2DM has been controversial, inconclusive, and even absent. This disputable issue might be as a result of association studies in which many and varied clinical phenotypes included are contemplated as CKD inductors and enhancers. Although, the sample sizes studied in patients with T2DM are undersized and did not have a strict inclusion criteria, lacking of biochemical markers or KDOQI classification, which have hindered its examination.
ObjectiveThe aim of our study was to establish an association between rs5186 AGTR1 gene polymorphism and GFR depletion, assessed as a risk factor to DKD development in patients with T2DM.
MethodsWe analyzed 297 not related patients with T2DM, divided into 221 controls (KDOQI 1) and 76 cases (KDOQI 2). Arterial pressure, anthropometric and biochemical parameters were measured. rs5186 of AGTR1 genotyping was performed by TaqMan assay real-time PCR method. Allele and genotype frequencies, and Hardy-Weinberg equilibrium were measured. Normality test for data distribution was analyzed by Shapiro-Wilk test, variable comparison by Student's t-test for continuous variables, and Chi-squared test for categorical variables; ANOVA test was used for mean comparison of more than two groups. Effect of rs5186 to DKD was estimated by multiple heritability adjustment models for risk variables of DKD. Statistical significance was indicated by p<0.05. Data was analyzed using Statistical Package STATA v11 software.
ResultsDominant and Over-dominant models showed a likelihood ratio to GFR depletion of 1.89 (1.05-3.39, p = 0.031) and 2.01 (1.08-3.73, p = 0.023) in patients with T2DM. Risk factor increased to 2.54 (1.10-5.89) in women in Over-dominant model.
ConclusiónIn clinical practice, most of nephropathies progress at a slow pace into a total breakdown of renal function, even asymptomatic. This is the first study, reporting that rs5186 polymorphism of AGTR1 gene contribution to GFR depletion, and this could be evaluated as a predisposing factor for DKD in patients with T2DM.
Se ha reportado que la prevalencia de enfermedad renal crónica (ERC) en población adulta a nivel mundial oscila entre 9 a 13%. En el año 2017, México reportó una prevalencia de ERC de 12,2%, con una tasa de mortalidad de 51,4% por cada 100 mil habitantes, siendo uno de los países con mayor prevalencia y tasas de mortalidad asociadas a ERC en el mundo1,2.
Se ha descrito que la causa etiológica más importante asociada a la ERC es la enfermedad renal diabética (ERD), principalmente la secundaria a diabetes mellitus tipo 2 (DMT2) descontrolada. Los cambios metabólicos y hemodinámicos originados por la hiperglucemia, el hiperinsulinismo y la acumulación de productos de glicación avanzada3 propios del descontrol crónico de la diabetes mellitus (DM), conllevan inicialmente a una disminución paulatina de la estimación de la tasa de filtrado glomerular (TFGe) y posteriormente a alteraciones estructurales y funcionales severas de la microvasculatura renal, condicionando un riesgo potencial a enfermedad renal crónica avanzada (ERCA)4.
En los últimos años se ha observado que el uso de fármacos tipo antagonistas de receptores de la angiotensina II (ARA-II) pueden retrasar y disminuir la frecuencia de ERCA5, sin embargo, no todos los pacientes con ERD han presentado buena respuesta a esta intervención, sugiriendo incluso que factores genéticos pudiesen estar involucrados como factores desencadenantes o potenciadores al riesgo, al desarrollo y progresión de la ERC.
El polimorfismo rs5186 (A1166C) presente en el gen receptor tipo 1 de la angiotensina II (AGTR1) ha sido asociado a distintos efectos del riesgo de daño renal que suelen estar presentes en pacientes con ERD y nefropatía diabética (ND)6. Distintos estudios han reportado que el rs5186 influye en la estabilidad y actividad de las proteínas que conforman al receptor de la angiotensina II tipo 1 (AT1)7, aún existen controversias en su participación y consideración como un factor de riesgo al daño renal en pacientes con ERD.
Los estudios de asociación del rs5186 del gen AGTR1 con disminución de la TFGe asociada a los fenotipos de ERD, ND o ERC en pacientes con DMT2 hasta la fecha son escasos, controversiales y poco concluyentes, se ha sugerido que la heterogeneidad de los resultados es debido a la edad de inicio, gravedad y progresión de los síntomas, así como al dimorfismo sexual, etnicidad, factores ambientales y aspectos epigenéticos8.
El objetivo del presente trabajo fue estimar el riesgo de la presencia del rs5186 del gen AGTR1 con la disminución de la TFGe considerada como un riesgo a ERD en una muestra de pacientes con DMT2 de la Ciudad de México. El tipo de abordaje del presente estudio resultaría de gran importancia, ya que podría orientarnos en un futuro en el manejo predictivo y personalizado de la ERD, incluso en estadios previo a la presencia de sus manifestaciones clínicas. Hasta ahora no existen estudios reportados de este tipo en población mexicana o mundial.
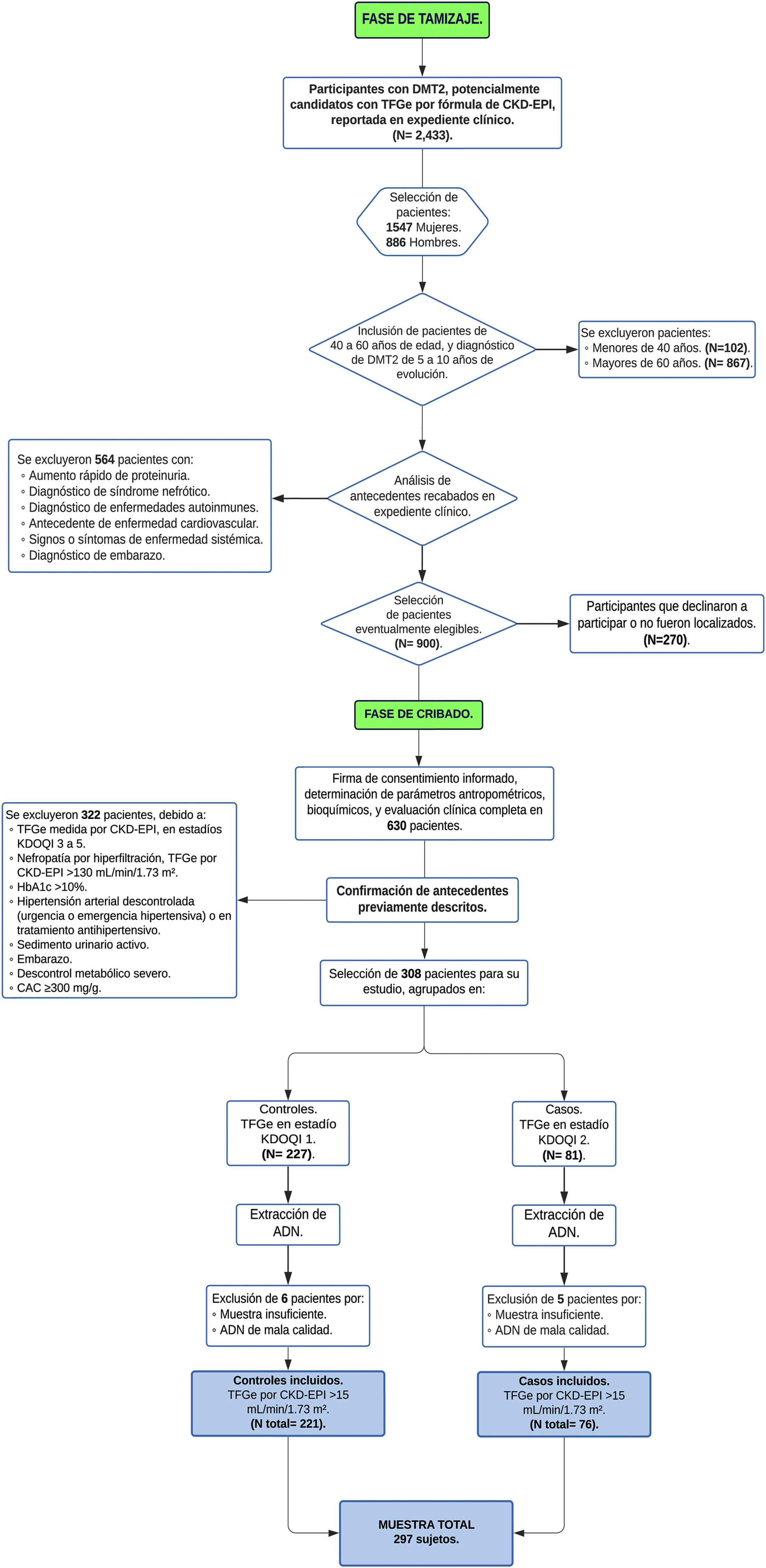
Material y métodosParticipantesEl estudio se realizó entre los años 2017 a 2019 en pacientes derechohabientes de la Unidad de Medicina Familiar número 31 (UMF 31) del Instituto Mexicano del Seguro Social (IMSS) de la Ciudad de México. Para la identificación de pacientes con los estadios KDOQI 1-2 inicialmente se realizó un tamizaje y posteriormente un cribado (fig. 1), Flowchart.
Tamizaje. El tamizaje se realizó en 2.443 pacientes adultos con diagnóstico de DMT2 que reportaron en los últimos tres meses la TFGe por la clasificación del Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) 2009 en expediente clínico, la que consideramos como una medición basal. Se incluyeron en esta fase del estudio pacientes que tenían una edad mayor a los 40 e inferior a los 60 años, así como, una edad mayor de 5 y menor a los 15 años de evolución de DMT2. Se excluyeron pacientes emparentados, y aquellos que en expediente reportaron otras condiciones patológicas asociadas a alteraciones de la TFGe o riesgo a ERCA, incluyendo los estadios KDOQI 3-5 considerados como daño moderado, severo y falla renal respectivamente de acuerdo con las guías KDOQI9, que reportaran desequilibrio electrolítico u otras alteraciones de origen tubular, evidencia de daño histológico o estructural por pruebas de imagen, pacientes con uso de terapia sustitutiva renal en diálisis peritoneal, hemodiálisis, trasplante renal, un rápido aumento de proteinuria, síndrome nefrótico, presencia de sedimento urinario activo, antecedentes de enfermedades autoinmunes o signos y síntomas de otra enfermedad sistémica, pacientes que reportaron hipertensión arterial (HTA) con tratamiento farmacológico o en franco descontrol, antecedentes de infarto agudo al miocardio y miocardiopatías. Los pacientes candidatos al cribado fueron contactados, excluyendo los que no deseaban participar.
Cribado. El cribado se realizó con previa firma de carta de consentimiento informado en 630 pacientes candidatos seleccionados del tamizaje. Se determinaron parámetros antropométricos, bioquímicos y la TFGe por la fórmula CKD-EPI 2009 para corroborar y seleccionar el estadio de la función renal evaluada tres meses antes y reportada en el expediente clínico. Finalmente, nuestro estudio incluyó un total de 297 pacientes no emparentados, los cuales fueron divididos en dos grupos, asignando a 76 pacientes como casos por la presencia de daño renal discreto o leve que presentaban una disminución de TFGe ≤ 90 y ≥ 60 mL/min/1,73 m2 (KDOQI 2) y 221 pacientes controles considerados como normo filtrantes (≥ 90 mL/min/1,73 m2, KDOQI 1) utilizando la fórmula CKD-EPI 2009.
Se incluyeron pacientes con coeficiente albúmina creatinina (CAC) normal o ligeramente elevada (< 30 mg/g) o moderadamente incrementada (≥ 30 y < 300 mg/g), se excluyeron pacientes con CAC gravemente elevada (≥ 300 mg/g)10. El estudio incluyó 37 pacientes con HTA sin descontrol severo y sin uso tratamiento farmacológico.
El presente estudio es derivado del protocolo bajo Titulo de Estudio de Polimorfismos asociados a Insuficiencia renal crónica en pacientes mexicanos con Diabetes tipo 2 con número de registro R-2016-785-022, autorizado por el Comité de Etica en Investigación de la Coordinación de Investigación en Salud del Centro Medico Nacional Siglo XXI (CONBIOÉTICA-09-CEI-009-20160601, respetando las guías y regulaciones de la Declaración de Helsinki11.
Mediciones antropométricas y bioquímicasEl peso y la estatura fueron determinados usando una báscula digital y estadímetro (Seca, Hamburgo, Alemania). El Índice de Masa Corporal (IMC) fue calculado por la fórmula peso (kg)/altura(m2) de acuerdo con puntos de corte descritos por la Organización Mundial de la Salud (OMS). La determinación de la circunferencia abdominal fue realizada por medio del uso de una cinta métrica no distensible (Seca, Umfangmessband 203 cm, Hamburgo, Alemania), la medición se realizó a nivel del punto equidistante entre los bordes inferiores de las costillas y la cresta ilíaca anterosuperior12. La presión arterial (PA) fue determinada por la medición de la presión arterial sistólica (PAS) y diastólica (PAD) con uso de esfigmomanómetro de mercurio (ALPK2, Tokio, Japón) de acuerdo con las guías descritas por el Octavo Comité Nacional Conjunto para la Prevención, Detección, Evaluación y Tratamiento de la Hipertensión Arterial (JNC 8)13.
A cada participante se le extrajo sangre por punción venosa con previo ayuno de 8 horas para determinar concentraciones séricas de glucosa, colesterol total (CT), colesterol de lipoproteína de baja densidad (C-LDL), colesterol de lipoproteína de alta densidad (C-HDL), triglicéridos, hemoglobina glucosilada (HbA1c%), urea, nitrógeno ureico en sangre (BUN), creatinina y albúmina urinaria (AU) esta última determinada de una muestra de orina al azar, con el equipo ILab 300 plus Clinical Chemistry System (Instrument Laboratory, Bedford, MA, EE. UU.).
La determinación de insulina sérica (μU/mL) se realizó por quimioluminiscencia (IMMULITE® 1000 Immunoassay System, Siemens Healthcare Diagnostics). La resistencia a la insulina (RI) fue calculada por la fórmula de Homeostatic Model Assessment (HOMA-IR), siendo determinada por la fórmula (glucosa en ayuno [mg/dL]) (insulina en ayuno [μU/mL]/405)14. El CAC se realizó por medio de la fórmula albúmina/creatinina recomendada por las guías KDIGO10. La estimación del riesgo cardiovascular (RCV) fue realizada por la ecuación Framingham SCORE15.
Extracción, cuantificación, pureza y genotipificación del ADNEl ácido desoxirribonucleico (ADN) se extrajo de la sangre periférica total con ayuda del equipo AutoGen Flex Star (AutoGen, MA, USA) con los reactivos de QiagenFlexi Gene DNA AGF3000 (QIAamp DNA Blood Midi/ Kit, Qiagen, Alemania) siguiendo las especificaciones recomendadas por el fabricante. La pureza del ADN fue determinada por espectrofotometría con relación de 260/280 nm (BioTek Instruments, Winooski, VT, USA) y su integridad por medio de electroforesis en gel de agarosa al 0,8% con SYBR Safe DNA Gel Stain (Thermo Scientific).
El genotipado se realizó empleando 20 ng/μL de ADN de cada muestra en una mezcla de reacción que contenía: Máxima Probe/ROX qPCR Master Mix (Thermo Scientific) y sonda Taqman específica para el polimorfismo rs5186 del gen AGTR1 (C_3187716_10, TGCAGCACTTCACTACCAAATGAGC[A/C]TTAGCTACTTTTCAGAATTGAAGGA Applied Biosystems CA, USA). La reacción de PCR se realizó en el equipo 7900HT Fast Real-Time PCR system (Applied Biosystems, CA, USA) y la discriminación alélica se realizó con el programa Allelic Discrimination del software SDS v2.4 (Applied Biosystems).
Cálculo de la muestra y poder estadísticoLa muestra total estimada fue de 324 pacientes, con un poder estadístico de al menos un 80% y un nivel de seguridad del 95%, calculada de acuerdo a la frecuencia alélica menor (MAF) C de 0,29 del rs5186 reportado para poblaciones con ancestría nativa americana y europea del proyecto ALFA (Latin American 2,https://www.ncbi.nlm.nih.gov/snp/rs5186?horizontal%20tab=true#seq_hash, Referencia consultada y actualizada el 26 de Julio del 2022)16, con un OR de riesgo de 1,63 reportado por Lin et al.17, y una proporción de 3:1 para controles y casos, respectivamente.
La muestra total analizada en nuestro estudio posterior al tamizaje y cribado fue de 297 pacientes, conforme a nuestros resultados se obtuvo un poder estadístico de 83,4% y un nivel de seguridad de 70%, tomando en cuenta la proporción de 3:1 para controles y casos, respectivamente.
Análisis estadísticoPosterior al análisis de la distribución de los datos por la prueba de Shapiro-Wilk, se realizó la comparación de las variables entre los grupos usando las pruebas t de Student (paramétrico) para variables continuas y la prueba de X2 para variables categóricas. La comparación del comportamiento de los parámetros antropométricos, bioquímicos y función renal de acuerdo con el genotipo se realizó por la prueba ANOVA para la comparación de medias de más de dos grupos. Las frecuencias alélicas, genotípicas y el equilibrio de Hardy-Weinberg (EWH) del rs5186 fueron calculadas y comparadas por medio de la prueba de X2 para la diferencia de proporciones. Se calculó por medio de un análisis de regresión logística el riesgo a ERD definido como la TFGe ≤ 90 y ≥ 60 mL/min/1,73 m2 (estadio KDOQI 2), con relación al efecto de estimación del riesgo de la presencia del rs5186 en diferentes genotipos determinados en cinco modelos de herencia: codominante, dominante, recesivo, sobredominante y aditivo, los cuales son expresados en Odds Ratio (OR) y coeficientes de regresión ajustados por edad, género, IMC, PAD, PAS y CAC consideradas como variables al riesgo de ERD.
Donde el modelo codominante describe que cada genotipo proporciona un riesgo de enfermedad diferente y no aditivo. El modelo dominante hace referencia a que una sola copia del alelo C del rs5186 del gen AGTR1 sería suficiente para modificar el riesgo y el ser portador de dos copias lo modifica en igual magnitud. El modelo recesivo estima la modificación del riesgo a ERD si únicamente están presentes CC, esto es que los heterocigotos (AC) y los homocigotos del alelo de mayor frecuencia (AA) tendrían el mismo riesgo, de tal forma que el genotipo CC se compara con AC + AA. El modelo sobredominante describe que los individuos homocigotos para el genotipo más frecuente (AA) y el genotipo variante (CC) del rs5186 del gen AGTR1 tendrán el mismo riesgo. Por último, el modelo aditivo refiere a que cada copia de C modifica el riesgo en una cantidad aditiva, por lo tanto, los homocigotos CC tienen el doble de riesgo que los heterocigotos AC. Para todas las pruebas se consideró un valor de p < 0,05 como estadísticamente significativo. Para el análisis estadístico se utilizó el software Statistical Package STATA v11 software (Stata Corporation, Texas).
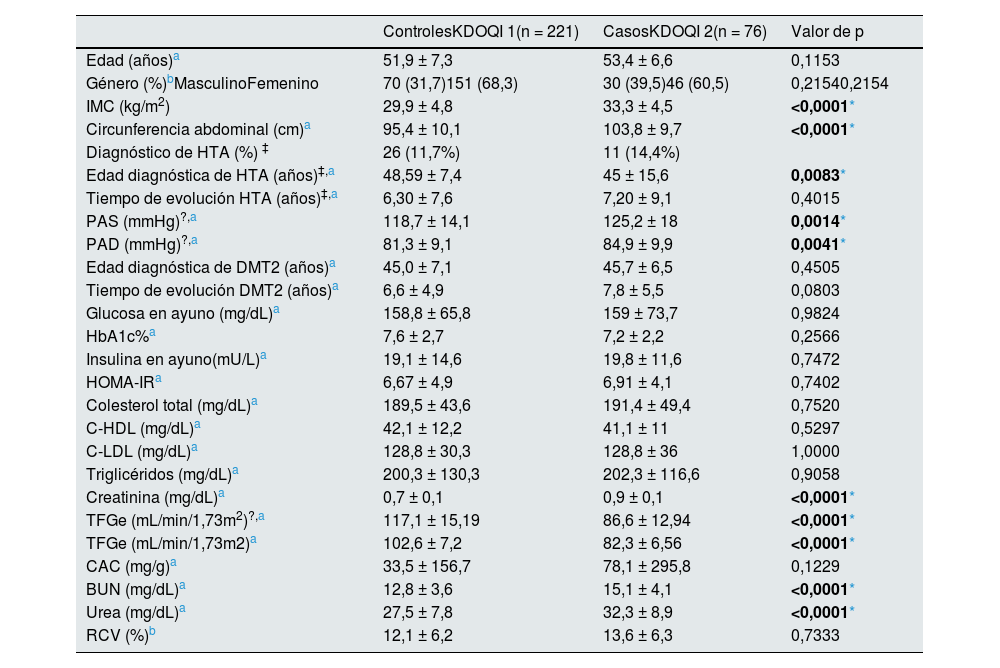
ResultadosCaracterísticas de la muestra del estudioLas características generales de la población analizada se presentan en la tabla 1. La selección de los grupos KDOQI 1 y 2 se realizó acorde a la confirmación de la TFGe como se describió en la metodología. No existen diferencias estadísticamente significativas al comparar entre los grupos la edad y el género, así como distintas variables asociadas al riesgo de la disminución de la TFGe o complicaciones renovasculares, como la edad diagnóstica de DMT2, el tiempo de evolución de HTA y DMT2, las concentraciones de glucosa e insulina en ayuno, HbA1c%, HOMA-IR, los parámetros lipídicos (CT, C-HDL y C-LDL), CAC y RCV.
Características clínicas, antropométricas y bioquímicas de la población en estudio
| ControlesKDOQI 1(n = 221) | CasosKDOQI 2(n = 76) | Valor de p | |
|---|---|---|---|
| Edad (años)a | 51,9 ± 7,3 | 53,4 ± 6,6 | 0,1153 |
| Género (%)bMasculinoFemenino | 70 (31,7)151 (68,3) | 30 (39,5)46 (60,5) | 0,21540,2154 |
| IMC (kg/m2) | 29,9 ± 4,8 | 33,3 ± 4,5 | <0,0001* |
| Circunferencia abdominal (cm)a | 95,4 ± 10,1 | 103,8 ± 9,7 | <0,0001* |
| Diagnóstico de HTA (%) ‡ | 26 (11,7%) | 11 (14,4%) | |
| Edad diagnóstica de HTA (años)‡,a | 48,59 ± 7,4 | 45 ± 15,6 | 0,0083* |
| Tiempo de evolución HTA (años)‡,a | 6,30 ± 7,6 | 7,20 ± 9,1 | 0,4015 |
| PAS (mmHg)?,a | 118,7 ± 14,1 | 125,2 ± 18 | 0,0014* |
| PAD (mmHg)?,a | 81,3 ± 9,1 | 84,9 ± 9,9 | 0,0041* |
| Edad diagnóstica de DMT2 (años)a | 45,0 ± 7,1 | 45,7 ± 6,5 | 0,4505 |
| Tiempo de evolución DMT2 (años)a | 6,6 ± 4,9 | 7,8 ± 5,5 | 0,0803 |
| Glucosa en ayuno (mg/dL)a | 158,8 ± 65,8 | 159 ± 73,7 | 0,9824 |
| HbA1c%a | 7,6 ± 2,7 | 7,2 ± 2,2 | 0,2566 |
| Insulina en ayuno(mU/L)a | 19,1 ± 14,6 | 19,8 ± 11,6 | 0,7472 |
| HOMA-IRa | 6,67 ± 4,9 | 6,91 ± 4,1 | 0,7402 |
| Colesterol total (mg/dL)a | 189,5 ± 43,6 | 191,4 ± 49,4 | 0,7520 |
| C-HDL (mg/dL)a | 42,1 ± 12,2 | 41,1 ± 11 | 0,5297 |
| C-LDL (mg/dL)a | 128,8 ± 30,3 | 128,8 ± 36 | 1,0000 |
| Triglicéridos (mg/dL)a | 200,3 ± 130,3 | 202,3 ± 116,6 | 0,9058 |
| Creatinina (mg/dL)a | 0,7 ± 0,1 | 0,9 ± 0,1 | <0,0001* |
| TFGe (mL/min/1,73m2)?,a | 117,1 ± 15,19 | 86,6 ± 12,94 | <0,0001* |
| TFGe (mL/min/1,73m2)a | 102,6 ± 7,2 | 82,3 ± 6,56 | <0,0001* |
| CAC (mg/g)a | 33,5 ± 156,7 | 78,1 ± 295,8 | 0,1229 |
| BUN (mg/dL)a | 12,8 ± 3,6 | 15,1 ± 4,1 | <0,0001* |
| Urea (mg/dL)a | 27,5 ± 7,8 | 32,3 ± 8,9 | <0,0001* |
| RCV (%)b | 12,1 ± 6,2 | 13,6 ± 6,3 | 0,7333 |
Los datos son presentados como media ± desviación estándar, frecuencias y porcentajes n (%).
IMC: índice de masa corporal; HTA: hipertensión arterial; PAS: presión arterial sistólica; PAD: presión arterial diastólica; DMT2: diabetes mellitus tipo 2; HbA1c%: hemoglobina glucosilada %; HOMA-IR: modelo homeostático para evaluar la resistencia a la insulina; C-HDL: colesterol de lipoproteínas de alta densidad; C-LDL: colesterol de lipoproteínas de baja densidad; TFGe: estimación de tasa de filtrado glomerular por fórmula CKD-EPI; CAC: coeficiente albúmina/creatinina; BUN: nitrógeno ureico en sangre; RCV: riesgo cardiovascular por Framingham SCORE.
‡ Pacientes con HTA sin tratamiento incluidos en el estudio
No existieron diferencias estadísticamente significativas (p ≤ 0,05) en los parámetros de IMC y circunferencia abdominal, observándose un mayor estado nutricional y de obesidad central en los pacientes con KDOQI 2, además, en este grupo los pacientes diagnosticados con HTA a pesar de tener una menor edad en su diagnóstico al compararlos con los controles (p = 0,0083) se observó que presentaban una mayor PAS y PAD que los pacientes con KDOQI 1.
El análisis de los marcadores de daño renal, creatinina, urea y BUN se encontraban aumentados en los pacientes con KDOQI 2, mientras que la TFGe mL/min/1,73 m2 por la ecuación de CKD-EPI 2009 fue mayor en el grupo control, todas las variables mostraron diferencias estadísticamente significativas (p < 0,0001). No se observaron diferencias significativas al comparar el CAC en ambos grupos (p < 0,1229).
A pesar de que no se observaron diferencias estadísticamente significativas en la estimación del RCV por Framingham SCORE, ambos grupos están por arriba del punto de corte de ≥ 10% considerado como de riesgo a enfermedad coronaria en pacientes con alteraciones cardiometabólicas.
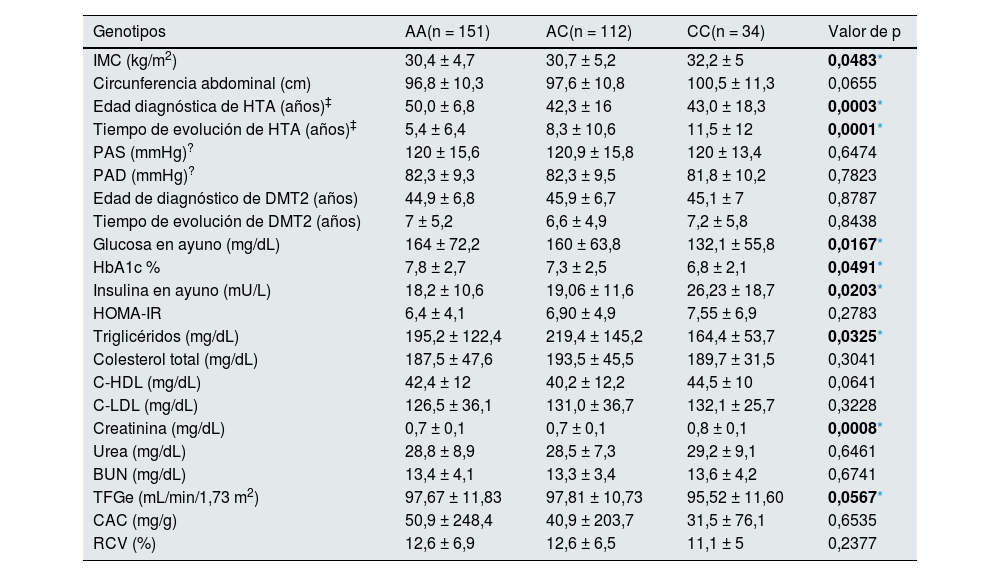
Comportamiento de las variables en estudio de acuerdo con el genotipoEl comportamiento de las variables en estudio de acuerdo con el genotipo se muestra en la tabla 2. Se observaron diferencias estadísticamente significativas con un aparente aumento en el genotipo CC de las determinaciones del IMC (p = 0,0483) y en las concentraciones de Creatinina (p = 0,0008) al compararlo con los genotipos AA y AC.
Análisis de comportamiento de los parámetros antropométricos y bioquímicos con la presencia de los genotipos del rs5186 del gen AGTR1
| Genotipos | AA(n = 151) | AC(n = 112) | CC(n = 34) | Valor de p |
|---|---|---|---|---|
| IMC (kg/m2) | 30,4 ± 4,7 | 30,7 ± 5,2 | 32,2 ± 5 | 0,0483* |
| Circunferencia abdominal (cm) | 96,8 ± 10,3 | 97,6 ± 10,8 | 100,5 ± 11,3 | 0,0655 |
| Edad diagnóstica de HTA (años)‡ | 50,0 ± 6,8 | 42,3 ± 16 | 43,0 ± 18,3 | 0,0003* |
| Tiempo de evolución de HTA (años)‡ | 5,4 ± 6,4 | 8,3 ± 10,6 | 11,5 ± 12 | 0,0001* |
| PAS (mmHg)? | 120 ± 15,6 | 120,9 ± 15,8 | 120 ± 13,4 | 0,6474 |
| PAD (mmHg)? | 82,3 ± 9,3 | 82,3 ± 9,5 | 81,8 ± 10,2 | 0,7823 |
| Edad de diagnóstico de DMT2 (años) | 44,9 ± 6,8 | 45,9 ± 6,7 | 45,1 ± 7 | 0,8787 |
| Tiempo de evolución de DMT2 (años) | 7 ± 5,2 | 6,6 ± 4,9 | 7,2 ± 5,8 | 0,8438 |
| Glucosa en ayuno (mg/dL) | 164 ± 72,2 | 160 ± 63,8 | 132,1 ± 55,8 | 0,0167* |
| HbA1c % | 7,8 ± 2,7 | 7,3 ± 2,5 | 6,8 ± 2,1 | 0,0491* |
| Insulina en ayuno (mU/L) | 18,2 ± 10,6 | 19,06 ± 11,6 | 26,23 ± 18,7 | 0,0203* |
| HOMA-IR | 6,4 ± 4,1 | 6,90 ± 4,9 | 7,55 ± 6,9 | 0,2783 |
| Triglicéridos (mg/dL) | 195,2 ± 122,4 | 219,4 ± 145,2 | 164,4 ± 53,7 | 0,0325* |
| Colesterol total (mg/dL) | 187,5 ± 47,6 | 193,5 ± 45,5 | 189,7 ± 31,5 | 0,3041 |
| C-HDL (mg/dL) | 42,4 ± 12 | 40,2 ± 12,2 | 44,5 ± 10 | 0,0641 |
| C-LDL (mg/dL) | 126,5 ± 36,1 | 131,0 ± 36,7 | 132,1 ± 25,7 | 0,3228 |
| Creatinina (mg/dL) | 0,7 ± 0,1 | 0,7 ± 0,1 | 0,8 ± 0,1 | 0,0008* |
| Urea (mg/dL) | 28,8 ± 8,9 | 28,5 ± 7,3 | 29,2 ± 9,1 | 0,6461 |
| BUN (mg/dL) | 13,4 ± 4,1 | 13,3 ± 3,4 | 13,6 ± 4,2 | 0,6741 |
| TFGe (mL/min/1,73 m2) | 97,67 ± 11,83 | 97,81 ± 10,73 | 95,52 ± 11,60 | 0,0567* |
| CAC (mg/g) | 50,9 ± 248,4 | 40,9 ± 203,7 | 31,5 ± 76,1 | 0,6535 |
| RCV (%) | 12,6 ± 6,9 | 12,6 ± 6,5 | 11,1 ± 5 | 0,2377 |
Los datos son presentados como media ± desviación estándar.
IMC: índice de masa corporal; HTA: hipertensión arterial; PAS: presión arterial sistólica; PAD: presión arterial diastólica; DMT2: diabetes mellitus tipo 2; HbA1c%: hemoglobina glucosilada %; HOMA-IR: modelo homeostático para evaluar la resistencia a la insulina; C-HDL: colesterol de lipoproteínas de alta densidad; C-LDL: colesterol de lipoproteínas de baja densidad; BUN: nitrógeno ureico en sangre; TFGe: estimación de tasa de filtrado glomerular por fórmula CKD-EPI; CAC: coeficiente albúmina/creatinina; RCV: riesgo cardiovascular por Framingham SCORE.
‡ Pacientes con HTA sin tratamiento incluidos en el estudio.
No se observaron diferencias en las mediciones de la PAS y PAD, sin embargo, los tres grupos presentaron una tendencia al aumento de las cifras tensionales. Se observó que los pacientes con diagnóstico de HTA que participaron en el estudio y portadores del genotipo CC mostraron una menor edad al diagnóstico (p = 0,0003) y un mayor tiempo de evolución (p = 0,0001) de la HTA al compararlos con los portadores del genotipo AA.
Tampoco se observaron diferencias significativas al comparar los genotipos en la edad diagnóstica y tiempo de evolución de DMT2, así como en el HOMA-IR. Sin embargo, se percibió un mayor incremento en las concentraciones de glucosa en ayuno y HbA1c% en los sujetos portadores del genotipo AA (p ≤ 0,05), si bien se observó la presencia de un hiperinsulinismo en ayuno (mU/L) en los tres genotipos, este fue mayor en los portadores de CC al compararlo con los portadores de AC y AA con diferencias estadísticamente significativas (p = 0,0203).
El análisis del perfil lipídico mostró que las concentraciones de triglicéridos fueron mayores en el genotipo AC (p = 0,0325), mientras que al comparar los genotipos no se observaron diferencias en las concentraciones de colesterol total, C-LDL y C-HDL.
El análisis de los marcadores de daño renal sólo mostró que las concentraciones de creatinina fueron mayores en los portadores de CC (p = 0,0008) al compararlo con los genotipos AA y AC, por lo que la TFGe también fue menor en ese grupo. El resto de los marcadores de daño renal BUN, urea, CAC y RCV por Framingham SCORE (%) no mostraron diferencias estadísticamente significativas.
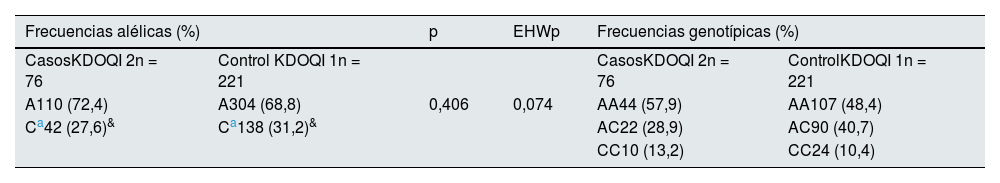
Asociación de la variante rs5186 del gen AGTR1 con riesgo a ERDEl análisis de frecuencias alélicas, genotípicas y el EHW de la muestra total del estudio se muestra en la tabla 3. Las frecuencias alélicas (%) fueron similares a la reportadas para poblaciones con ancestría nativa americana y europea del proyecto ALFA (Latin American 2, https://www.ncbi.nlm.nih.gov/snp/rs5186?horizontal%20tab=true#seq_hash, Referencia consultada y actualizada el 26 de Julio del 2022)16 sin mostrar diferencias estadísticamente significativas al comparar los grupos, además, cumplía con el EHW (p = 0,074).
Frecuencias alélicas, genotípicas y EHW del rs5186 (A1166C) del gen AGTR1 de la muestra total en estudio
| Frecuencias alélicas (%) | p | EHWp | Frecuencias genotípicas (%) | ||
|---|---|---|---|---|---|
| CasosKDOQI 2n = 76 | Control KDOQI 1n = 221 | CasosKDOQI 2n = 76 | ControlKDOQI 1n = 221 | ||
| A110 (72,4) | A304 (68,8) | 0,406 | 0,074 | AA44 (57,9) | AA107 (48,4) |
| Ca42 (27,6)& | Ca138 (31,2)& | AC22 (28,9) | AC90 (40,7) | ||
| CC10 (13,2) | CC24 (10,4) | ||||
Datos expresados en frecuencias y porcentajes.
n: (%); EHW: equilibrio de Hardy-Weinberg por X2.
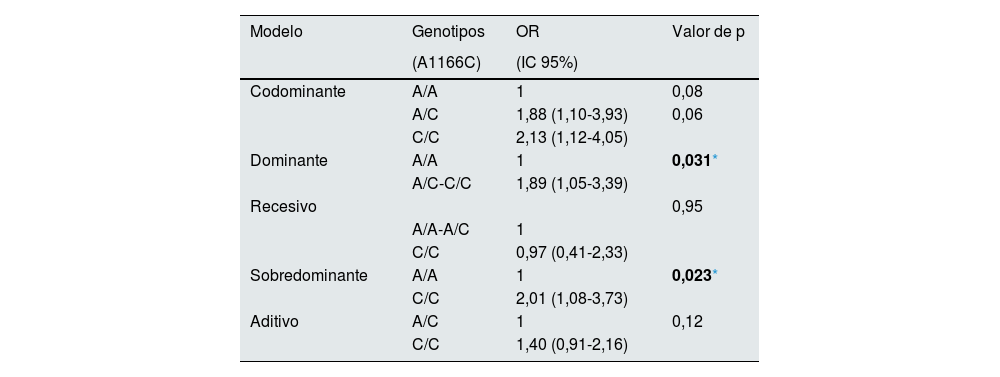
La asociación y estimación del efecto (OR) del rs5186 del gen AGTR1 con la disminución de TFGe se muestra en la tabla 4. El análisis con regresión logística de los modelos dominante y sobredominante corregidos por edad, género, IMC, PAD, PAS y CAC mostraron un riesgo de la presencia del rs5186 del gen AGTR1 con la disminución de la TFGe de 1,89 (IC 95% 1,05-3,39, p = 0,031) y de 2,01 (IC 95% 1,08-3.73, p = 0,023), respectivamente.
Asociación y estimación de riesgo del rs5186 del gen AGTR1 con disminución de la TFGe
| Modelo | Genotipos | OR | Valor de p |
|---|---|---|---|
| (A1166C) | (IC 95%) | ||
| Codominante | A/A | 1 | 0,08 |
| A/C | 1,88 (1,10-3,93) | 0,06 | |
| C/C | 2,13 (1,12-4,05) | ||
| Dominante | A/A | 1 | 0,031* |
| A/C-C/C | 1,89 (1,05-3,39) | ||
| Recesivo | 0,95 | ||
| A/A-A/C | 1 | ||
| C/C | 0,97 (0,41-2,33) | ||
| Sobredominante | A/A | 1 | 0,023* |
| C/C | 2,01 (1,08-3,73) | ||
| Aditivo | A/C | 1 | 0,12 |
| C/C | 1,40 (0,91-2,16) |
TFGe: estimación de tasa de filtrado glomerular; OR (Odds Ratio). Regresión logística corregida por edad, género; IMC: índice de masa corporal; PAS: presión arterial sistólica; PAD: presión arterial diastólica; CAC: coeficiente albúmina/creatinina.
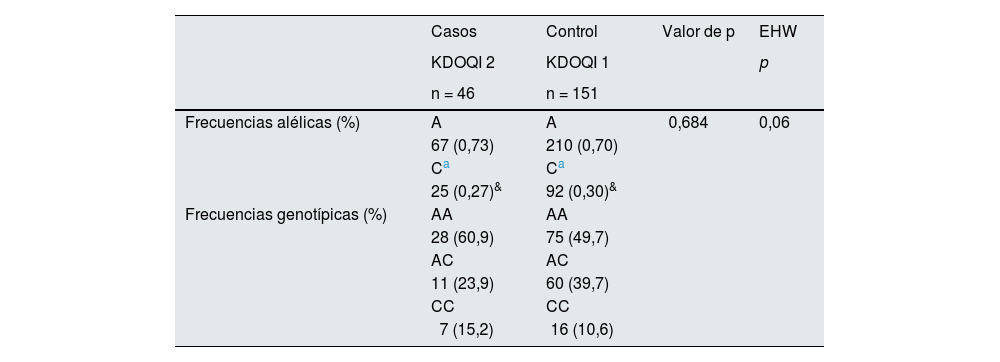
Por otra parte, el análisis de frecuencias alélicas, genotípicas, el EHW y la estimación de riesgo a la disminución de TFGe por la presencia del rs5186 del gen AGTR1 en mujeres (46 casos vs. 151 controles) se muestra en la tabla 5. Se observa que se conservó la similitud de las frecuencias alélicas (%) reportadas en las bases de datos de la NCBI y se encuentran en un EHW (p = 0,06). El riesgo de la variante rs5186 del gen AGTR1 con la disminución de TFGe se observó en el modelo sobredominante corregido por edad, género, IMC, PAD, PAS y CAC con un OR de 2,54 (IC 95% 1,10-5,89, p = 0,023).
Frecuencias alélicas, genotípicas y EHW del rs5186 (A1166C) del gen AGTR1 en mujeres
| Casos | Control | Valor de p | EHW | |
|---|---|---|---|---|
| KDOQI 2 | KDOQI 1 | p | ||
| n = 46 | n = 151 | |||
| Frecuencias alélicas (%) | A | A | 0,684 | 0,06 |
| 67 (0,73) | 210 (0,70) | |||
| Ca | Ca | |||
| 25 (0,27)& | 92 (0,30)& | |||
| Frecuencias genotípicas (%) | AA | AA | ||
| 28 (60,9) | 75 (49,7) | |||
| AC | AC | |||
| 11 (23,9) | 60 (39,7) | |||
| CC | CC | |||
| 7 (15,2) | 16 (10,6) |
| Asociación y estimación de riesgo del rs5186 del gen AGTR1 con disminución de TFGe en mujeres | |||
|---|---|---|---|
| Modelos | Genotipos | OR | Valor de p |
| (A1166C) | (IC 95%) | ||
| Codominante | A/A | 1 | 0,09 |
| A/C | 1,80 (1,08-3,86) | 0,075 | |
| C/C | 2,51 (1,06-5,96) | ||
| Dominante | A/A | 1 | 0,095 |
| A/C-C/C | 0,93 (0,31-2,81) | ||
| Recesivo | A/A-A/C | 1 | 0,49 |
| C/C | 0,68 (0,23-1,98) | ||
| Sobredominante | A/A | 1 | 0,023* |
| C/C | 2,54 (1,10-5,89) | ||
| Aditivo | A/C | 1 | 0,38 |
| C/C | 1,27 (0,74-2,16) | ||
TFGe: estimación de tasa de filtrado glomerular; OR (Odds Ratio). Regresión logística corregida por edad; IMC: índice de masa corporal; PAS: presión arterial sistólica; PAD: presión arterial diastólica; CAC: coeficiente albúmina/creatinina; EHW: equilibrio de Hardy-Weinberg por X2.
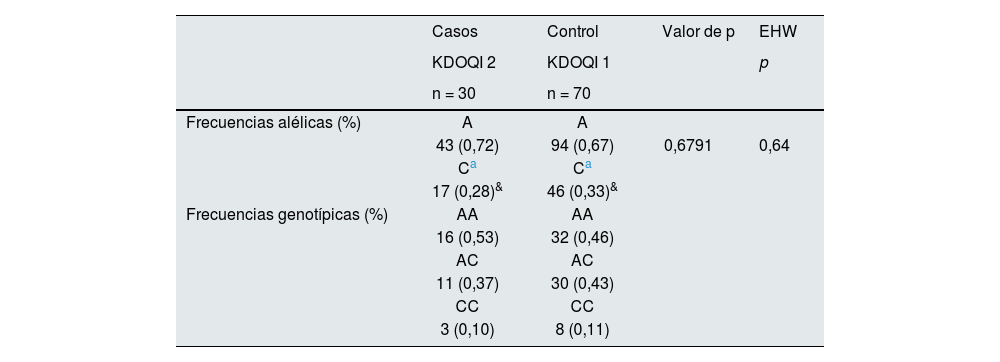
A pesar de mostrar frecuencias alélicas (%) sin diferencias estadísticamente significativas y similares reportadas en las bases de datos de la NCBI, además de EHW (p = 0,064), no se observó asociación de la variante rs5186 del gen AGTR1 con la disminución de TFGe en hombres (30 casos vs. 70 controles) en ninguno de los modelos de estimación de riesgo corregidos por edad, género, IMC, PAD, PAS y CAC (tabla 6).
Frecuencias alélicas, genotípicas y EHW del rs5186 (A1166C) del gen AGTR1 en hombres
| Casos | Control | Valor de p | EHW | |
|---|---|---|---|---|
| KDOQI 2 | KDOQI 1 | p | ||
| n = 30 | n = 70 | |||
| Frecuencias alélicas (%) | A | A | ||
| 43 (0,72) | 94 (0,67) | 0,6791 | 0,64 | |
| Ca | Ca | |||
| 17 (0,28)& | 46 (0,33)& | |||
| Frecuencias genotípicas (%) | AA | AA | ||
| 16 (0,53) | 32 (0,46) | |||
| AC | AC | |||
| 11 (0,37) | 30 (0,43) | |||
| CC | CC | |||
| 3 (0,10) | 8 (0,11) |
| Asociación y estimación de riesgo del del rs5186 del gen AGTR1 con disminución de TFGe en hombres. | ||||
|---|---|---|---|---|
| Modelos | Genotipos | OR | Valor de p | |
| (A1166C) | (95% IC) | |||
| Codominante | A/A | 1 | 0,88 | |
| A/C | 1,12 (1,44-3,12) | 0,78 | ||
| C/C | 1,39 (0,55-3,52) | |||
| Dominante | A/A | 1 | 0,5 | |
| A/C-C/C | 1,35 (0,56-3,22) | |||
| Recesivo | A/A-A/C | 1 | 0,96 | |
| C/C | 1,04 (0,25-4,34) | |||
| Sobredominante | A/A | 1 | 0,51 | |
| C/C | 1,35 (0,55-3,30) | |||
| Aditivo | A/C | 1 | 0,60 | |
| C/C | 1,20 (0,61-2,32) | |||
TFGe: estimación de tasa de filtrado glomerular; OR (Odds Ratio). Regresión logística corregida por edad; IMC: índice de masa corporal; PAS: presión arterial sistólica; PAD: presión arterial diastólica; CAC: coeficiente albúmina/creatinina; EHW: equilibrio de Hardy-Weinberg por X2.
El presente estudio es el primero que ha demostrado una asociación del rs5186 del gen AGTR1 con distintos modelos de estimación de riesgo con una disminución de la TFGe en pacientes DMT2, este desenlace es el principal signo predisponente de la progresión a ERD y a ERCA.
La originalidad de la investigación se demostró, tras la búsqueda de los antecedentes utilizando la estrategia PICO con los operadores booleanos: Diabetic Kidney Disease OR Chronic Kidney Disease OR Diabetic Nephropathy, AND AGTR1 OR rs5186 OR A1166C, buscado en la base de datos de PubMed entre los años 2010 al 2022 (fig. 2).
De acuerdo con esta búsqueda identificamos un total de seis trabajos reportados de la asociación del rs5186 del gen AGTR1 con ND y ERC; ninguno reportó algún análisis de asociación del polimorfismo con ERD en pacientes con DMT2. Previo al año 2010 se habían reportado más de seis metaanálisis y estudios sistematizados los cuales incluían distintos fenotipos y síndromes asociados al daño renal, generando a su vez discrepancias y nula asociación del rs5186 del gen AGTR1 con ERC secundaria a la progresión de la ERD en pacientes con DMT2.
Nuestro estudio es el primero en describir tras una caracterización fina de la muestra analizada basada en un tamizaje y cribado de los estadios 1 y 2 de KDOQI una asociación del rs5186 del gen AGTR1 con la disminución o declive de la TFGe considera como riesgo a ERD. El descartar en nuestro análisis los estadios 3-5 de KDOQI y otros factores desencadenes y potenciadores de ERC podría dar una mejor evidencia de nuestros hallazgos debido a que asumimos que los estadios avanzados de una TFGe estarían más expuestos a una franca ERCA.
Debemos considerar que la búsqueda de biomarcadores tempranos ha cobrado mayor importancia en los últimos años, debido a que marcadores tradicionales asociados a ERC como la albúmina urinaria en la ERD han sido controversiales para su aplicación clínica como un método diagnóstico o pronóstico de la enfermedad.
Si bien se ha descrito que la ERCA en pacientes con diagnóstico de DMT2 podría presentarse entre los 10 y 20 años después del diagnóstico de las alteraciones glucémicas, también se han identificado pacientes con reciente diagnóstico de DMT2 que suelen presentar distintos grados de daño renal asociados a la ERC, incluso de tipo incipiente la cual además de la disminución en la TFGe se acompaña de proteinuria que se correlaciona de manera positiva con el descontrol metabólico y es considerada a su vez como la primera evidencia clínica de ERD y ECV. Sin embargo, la controversia entre la presencia de microalbuminuria y su asociación con ERD en pacientes con DMT2 radica en que un porcentaje considerable de pacientes con diabetes tienen ERC sin albuminuria18. Por lo tanto, la presencia de una fase subclínica inicial de hiperfiltración que suele continuar a una pérdida leve o moderada de albúmina (CAC 30-300 mg/g) y posteriormente conlleva a la pérdida progresiva del filtrado glomerular podría no ser aplicable a la ERD secundaria a DMT2, porque a veces el diagnóstico de este tipo de diabetes suele ser a la par de una disminución ya establecida de la TFGe19. Además, la presencia de albuminuria en los pacientes con DMT2 suele ser reversible, puesto que puede ser modificada al controlar los factores desencadenantes o potenciadores asociados a ERD propios del fenotipo diabético, como la hiperglucemia, la PA elevada, la dislipidemia incluso con el uso de determinados fármacos como los inhibidores de la enzima convertidora de angiotensina (IECA) o los ARA II.
En nuestro estudio no observamos diferencias estadísticamente significativas en las variables consideradas como potenciadoras y desencadenantes de ERD como las concentraciones de glucosa en ayuno, HbA1c%, HOMA-IR, C-LDL y triglicéridos al comparar los grupos, sin embargo, estos se encuentran por arriba de los puntos de corte del optimo control metabólico en pacientes con DMT2 de acuerdo con distintas guías de práctica clínicas.
Si bien el franco descontrol metabólico observado en los grupos analizados podría estar condicionando una disminución de la TFGe incluso con características de ERD de tipo incipiente, la regresión logística ajustada por variables consideradas como causales o potenciadoras del daño renal mostró que la presencia del rs5186 del gen AGTR1 condiciona un riesgo a la disminución de la TFGe de OR entre 1,89 a 2,01 (tabla 4). A pesar de las controversias de asociación reportados en estudios previos, este desenlace esperado podría ser explicado desde el punto de vista biológico por el mecanismo de acción del AT1 al analizar la fisiopatología de la ERC. Además, debemos recordar que el fenotipo de DMT2 comúnmente suele estar acompañado de obesidad, dislipidemias, hiperinsulinismo y RI, entidades descritas como factores de susceptibilidad, de inicio, potenciadores o de progresión a la ERC, ya que promueven una mayor expresión y actividad del AT120,21.
Debemos reconocer que la alteración del sistema renina-angiotensina-aldosterona (SRAA), es considerada como la etiopatogenia más importante asociada a la disminución de la TFGe e implicada al desarrollo de la ERD en pacientes con DMT2, en donde la angiotensina II (AngII) es el principal péptido regulador, también identificada como el vasoconstrictor más potente del organismo y el principal efector del daño vascular y renal vinculado con la ERC. La acción de la AngII se ejerce mediante la activación del AT1, el cual está presente principalmente en corazón, pulmón, músculo, tejido adiposo, riñón y vasos sanguíneos, órganos vulnerables al daño de los productos de glicación avanzada en pacientes con DMT2 descontrolada.
Sabemos que la población analizada en nuestro estudio tiene una alta susceptibilidad genética al fenotipo de DMT222, y por consiguiente a sus complicaciones. Si bien algunos pacientes con DMT2 presentarán una buena respuesta al uso de fármacos de tipo IECA o ARA II para evitar o retardar la ERD, por otra parte, un porcentaje de ellos va a desarrollar la enfermedad incluso progresarán a ERCA. Hasta ahora no es posible predecir qué pacientes podrían desarrollar ERD, pero se coincide que la búsqueda y validación de biomarcadores genéticos que participan de manera directa en el SRAA podrían ser de utilidad clínica para identificar pacientes vulnerables de la ERD incluso antes de la presencia de una disminución de la TFGe o presencia de microalbuminuria con la intención de realizar una referencia oportuna al servicio de nefrología desde el primer nivel de atención. Consideramos que el gen AGTR1 podría ser un candidato como biomarcador genético, debido a que es responsable de la codificación de proteínas estructurales que conforman al AT16, además, distintos polimorfismos ubicados en este gen han sido asociados con alteraciones directas del SRAA que promueven el daño renal y a la ERC, como la vasoconstricción, la inflamación y el desequilibrio hidroelectrolítico23.
Se ha reportado que el polimorfismo rs5186 ubicado en la región 3’-UTR del gen AGTR1 puede influenciar en la estabilidad y traducción del ARNm de las proteínas que conforman al AT17, por lo tanto, su actividad alterada está asociada con fenotipos que afectan el sistema renovascular mediado por el SRAA, incluidas enfermedades cardiovasculares y autoinmunes24–26, sin embargo, su asociación con vasculopatías de origen diabético como la retinopatía, neuropatía, cardiopatías, ERD, ND, y ERCA en estudios de metaanálisis ha sido controversial incluso describiéndola como nula o no significativa. Las discrepancias mostradas en los metaanálisis de la asociación de distintas variantes genéticas del gen AGTR1 con ERD, ND o ERC podrían ser debidas por la etnicidad, la estratificación y tamaño muestral de las poblaciones analizadas27, la heterogeneidad muestral debido a la inclusión en la mayoría de los estudios de múltiples enfermedades vinculadas con la ERC, la distribución de las edades, variables que limitan el análisis de asociación del rs5186 con ERD o ND secundaria a DMT28,24,28.
En comparación con otros estudios nuestro objetivo fue analizar la asociación del rs5186 del gen AGTR1 con la disminución de TFGe que predispone a la ERD y ERCA en una muestra de pacientes con DMT2 de la Ciudad de México. Inferimos que la selección de los pacientes después del cribado para determinar los estadios KDIGO 1 y 2 de nuestro estudio pudo influir en el resultado de asociación entre el genotipo y el fenotipo.
Recientemente el metaanálisis de Braliou et al. reportó ninguna asociación putativa del rs5186 con ERCA independientemente de su etiología al utilizar distintos métodos de efecto aleatorio y multivariado29. En comparación con este estudio, nosotros no incluimos pacientes con trasplante renal o en terapia sustitutiva (diálisis o hemodiálisis) o pediátricos, además, nuestro grupo control fueron pacientes con DMT2 y una disminución de la TFGe considerada como discreta (≥ 90 mL/min/1,73 m2, KDOQI 1). Por otra parte, el metaanálisis consideró una muestra de poblaciones caucásicas, asiáticas y africanas, por lo tanto, se desconocía cuál podría ser la contribución al riesgo a ERD del rs5186 en poblaciones con DMT2 y con mayor ancestría nativa americana como la mexicana. Esto cobra importancia ya que se ha descrito que la etnicidad puede influir en la estadificación y comportamiento de la TFGe independientemente de su etiología4. La TFGe por la ecuación Modification of Diet in Renal Disease (MDRD) que ha sido la más utilizada en distintos estudios de asociación genética con ERC o ERCA incluso en estadios avanzados de terapia sustitutiva30, ha mostrado diferencias significativas con otras fórmulas de TFGe. Además, MDRD aún no está validada para población latinoamericana, mexicana o mexicoamericana31. Nuestro estudio utilizó la ecuación CKD-EPI para la TFGe, que de acuerdo con paneles de expertos es la fórmula más recomendada para población latina con ancestría nativa americana32. De acuerdo con estudios previos del análisis con paneles de ancestralidad en la población de la Ciudad de México, el porcentaje de mestizaje en nuestro análisis podría oscilar en 70% nativa americana y 30% europea33,34, por lo que justificamos el uso de CKD-EPI en el presente estudio.
Por otra parte, el estudio de Moradi et al. en 2015 no reportó asociación al riesgo directo del rs5186 con DMT2 y ND, sin embargo, concluyeron que los pacientes con DMT2 portadores del genotipo AC + CC presentaban macroalbuminuria cuando los niveles de HbA1c% eran mayores a 7,5%, y que los portadores del alelo C tenían cifras de PAS y concentraciones de creatinina sérica más altos al compararlos con los portadores del alelo A35. Sin embargo, no podríamos concluir que el rs5186 podría influenciar la presencia de micro o macroalbuminuria en pacientes con DMT2, debido a que los autores declararon tener limitaciones en el análisis por una insuficiente muestra en los tamaños de los grupos de estudio, principalmente en los controles. Por otra parte, nuestro estudio en comparación con Moradi et al.35 no incluyó sujetos sin diagnóstico de DM como un control, ni el diagnóstico de ERC por presencia de albuminuria, porque esta puede depender de distintas variables como el descontrol metabólico entre otras que ya hemos descrito. Además, la disminución de la TFGe y la presencia de micro o macroalbuminuria suele ser dependiente del tiempo de evolución y descontrol glucémico en pacientes con DMT2, la comparación de nuestros grupos analizados no mostraron diferencias estadísticamente significativas en edad del diagnóstico (p = 0,4505) y tiempo de evolución (p = 0,0803) de DMT2, sin embargo, sí presentaron hiperinsulinismo con RI estimada por HOMA-IR, la cual representó un descontrol glucémico franco en ayuno y en la HbA1c% en ambos grupos14,36. La DMT2 suele estar caracterizada por la presencia de hiperinsulinismo, hiperglucemia y RI, fenómenos que contribuyen a la HTA esencial aumentando el daño renal, debido a que se ve alterada la actividad del sistema nervioso simpático, la cual suele ser dependiente también de las concentraciones y actividad de la insulina. En nuestro estudio la presencia de RI estimada por HOMA-IR, podría estar influyendo en la elevación de la resistencia vascular renal y periférica, acelerando la presencia de disfunción endotelial y RCV en un futuro en ambos grupos37, además, observamos en ambos grupos que el RCV por Framingham Score estaba por arriba de 10%, el cual es considerado como de alto riesgo, independientemente que esta estimación suele ser muy subjetiva en pacientes con DMT238.
Nuestro estudio mostró que los pacientes portadores del alelo C presentaban una menor edad diagnóstica y mayor tiempo de evolución de HTA esencial (tabla 2). Distintos estudios han asociado de manera putativa a polimorfismos del gen AGTR1 con HTA esencial, sugiriendo que los individuos con los genotipos de riesgo tienen una mayor predisposición al desarrollo de esta entidad clínica39,40. Esta asociación del rs5186 con HTA podría tener una explicación biológica, ya que se ha descrito que algunas moléculas reguladoras como el microARN-155 puede suprimir la traducción de proteínas que conforman al AT1 al aparearse con el ARNm de AGTR1 siempre y cuando el alelo A esté presente, sin embargo, esta acción no se lleva a cabo cuando se encuentra el alelo de riesgo C del rs5186, ocasionando el aumento de la tensión arterial (TA)41 y contribuyendo al daño renal en los pacientes vulnerables por la presencia del alelo de riesgo. Además, se ha reportado que en la población mexicana con DMT2 existe una disminución de la expresión de microARN-155, la cual podría contribuir a un aumento de las cifras tensionales jugando un papel importante en la patogénesis de la ERD en pacientes con DMT2 acompañado del descontrol metabólico42. Quizá esta podría ser la explicación del por qué no todos los pacientes con DMT2 e HTA esencial tienen éxito en su control clínico, esto es, inferimos que la presencia del rs5186 promueve alteraciones en la actividad y expresión del AT1, de la homeostasis del SRAA y promover a su vez al daño renal independientemente de la intervención farmacológica.
Sin embargo, no podríamos concluir que la presencia de HTA esencial en los grupos analizados de nuestro estudio pueda ser una causa indirecta al riesgo o desarrollo ERD como se ha reportado en otros estudios43, debido a que no todos los pacientes incluidos en el estudio con presencia del alelo C tienen diagnóstico de HTA, además, la muestra de pacientes total con diagnóstico de HTA esencial fue de 37 y tenían como característica no tener un descontrol hipertensivo franco y no tenían prescrito algún tratamiento farmacológico antihipertensivo o nefroprotectores de tipo IECA o ARA II, por lo tanto, esta muestra pequeña no podría interferir en los resultados obtenidos.
Se ha descrito que en población mexicoamericana la presencia del rs5186 está asociada a un mayor IMC, el cual es reconocido como un factor subclínico y promotor al daño renal44. Es evidente en los grupos analizados la presencia de sobrepeso y obesidad determinado por el IMC, que está acompañado de la presencia de altas concentraciones de C-LDL y triglicéridos (tabla 1), que en conjunto podrían promover a aterosclerosis, alteraciones vasculares, RCV y al daño renal en un futuro45, al alterar de manera crónica la activación del SRAA secundario al aumento de la síntesis, absorción y almacenamiento de ácidos grasos y triglicéridos46.
Desconocemos si el descontrol lipídico en la muestra analizada podría estar influenciado también por la presencia de la variante rs5186, ya que se ha reportado que en la población mexicana los portadores del genotipo AC presentan un metabolismo lento de atorvastatina, mientras que los genotipos C/C o A/A+C/C tienen un metabolismo rápido47. Por lo que, la presencia de hipercolesterolemia, la cual ha sido asociada con glomeruloesclerosis, también podría ser considerada como un factor patogénico de la insuficiencia renal progresiva en pacientes portadores del rs5186, siendo un factor de riesgo aditivo a la ERD en pacientes con DMT2 independiente del uso de tratamiento farmacológico de hipercolesterolemia. En el presente estudio desconocemos la contribución del rs5186 como un efecto aditivo al desarrollo de ERD en pacientes DMT2 y dislipidemia, con o sin tratamiento, sin embargo, sí observamos que los genotipos con presencia del alelo de riesgo C presentaban más alteraciones lipídicas (tabla 2).
Según algunos estudios en México, es más probable que se desarrolle la ERC en mujeres que en hombres, con una prevalencia promedio de 14 y 12%, respectivamente. Sin embargo, el número de mujeres en diálisis es menor que el número de hombres.
Un hallazgo importante en nuestro estudio fue el reportar que la presencia del rs5186 en mujeres con DMT2 (tabla 5) podría ser un factor importante en el riesgo de ERD (OR 2,54, 1,10-5,89; p = 0,023, ajustado por edad, IMC, TA y CAC). Existe poca evidencia entre la asociación del rs5186 y daño renal en mujeres. El estudio de Cooper et al. reportó en 2009 que la presencia del genotipo de riesgo CC del rs5186 está asociada con un deterioro de la función renal en mujeres con preeclampsia48, incluso se ha sugerido que este polimorfismo puede ser un marcador de riesgo en mujeres para la presencia de HTA esencial y preeclampsia cuando existen los antecedentes familiares de HTA y un mayor IMC previo al embarazo49. Aunque los estudios sistemáticos y metaanálisis ponen en duda esta asociación50.
Nuestro estudio no mostró asociación del alelo de riesgo C del rs5186 con el riesgo a ERD en los varones, la cual en distintos estudios ha sido controversial. Lin et al. en el 2009 reportaron en una población de 733 varones adultos con DMT2 del Health Professionals’ Follow-Up Study (HPFS) una asociación del alelo C del rs5186 con una disminución de TFGe < 60 mL/min/1,73 m2 (1,63 [1,01, 2,65]) y cardiopatía coronaria (OR 1,57 [1,10, 2,24])17. Sin embargo, la interacción del genotipo-género en el riesgo de ERC en varones portadores del rs5186 parece variar de acuerdo con su etiología y etnicidad.
El estudio de Möllsten et al. en 2011 reportó en una muestra de 3,561 pacientes europeos con diabetes mellitus tipo 1 (DMT1) que el riesgo a ND en varones aumenta cuando son portadores del genotipo AA del rs5186 (OR = 1,27, IC 95%, 1,02-1,58, p = 0,03), ajustado por edad de diagnóstico y tiempo de evolución de la DM, HbA1c%, tabaquismo y etnia, pero en mujeres fue nula (OR = 0,89, 0,71-1,11, p = 0,30)6.
Por último, si bien se ha descrito que el alelo de riesgo del rs5186 a ERD y ERC podría ser C, la presencia del alelo ancestral A también juega un papel importante en pacientes con DMT2. El estudio sistemático y metaanálisis de Smyth et al. reportado en 2019, derivado de cuatro estudios cuantitativos con la intención de analizar el efecto de contribución del rs5186 al desarrollo de ND, concluyó que la presencia del alelo A en población de Asia del Sur representaba un factor de protección o de bajo riesgo al desarrollo de ND (p = 0,001; OR 0,71; IC 95% 0,58-0,87; I2 = 37%)51. Si bien nuestro análisis no reportó ninguna asociación de protección con el alelo A, sí pudiera tener una mejor validación poblacional que no se observa en otros estudios, al mostrar un EHW similar a la reportada en distintas bases de datos.
Podría ser razonable asumir que la presencia del rs5186 en la población analizada influye en la activación del SRAA y en la presencia del daño renal por distintos mecanismos fisiopatológicos, incluso alteraciones metabólicas prexistentes. De tal manera que nuestro análisis corregido por esas variables consideradas como factores de riesgo a ERD como edad, género, IMC, PAD, PAS y CAC cobra mayor importancia al observar la asociación de la variante genética rs5186 con la disminución de la TFGe en el modelo dominante y sobredominante en la población total (tabla 4). En la actualidad se siguen discutiendo si los factores ambientales podrían contribuir a la predisposición del riesgo a desarrollar ERD en pacientes con DMT2 portadores del rs5186, como una interacción gen-ambiente, por lo tanto, reconocemos que nuestro estudio podría tener las siguientes limitaciones:
- 1.
Nuestro estudio podría considerarse como piloto con muestra a conveniencia, debido a que la muestra calculada no fue alcanzada. Sin embargo, consideramos que la selección fina por medio del tamizaje y cribado representó una mejor estimación de riesgo a la disminución de la TFGe, incluso con OR de riesgo de 1,89 y 2,01 en los modelos dominante y sobredominante, respectivamente, en la población total y es mayor al reportado en otros estudios. El aumentar la N además podría dar un mayor poder estadístico y seguridad de los resultados obtenidos.
- 2.
Al ser un estudio de tipo transversal sólo demuestra una asociación, más no la causalidad o efecto.
- 3.
Desconocemos el efecto y respuesta al riesgo de ERD en pacientes con DMT2 considerados como vulnerables por ser portadores del rs5186 pero que usan ARA-II o IECA como monoterapia o terapia combinada de primera línea para el tratamiento de ERC como un uso nefro protector.
- 4.
Al no analizar el efecto y concentraciones de los medicamentos para el control de la glucosa o alteraciones metabólicas desconocemos si estos pudiesen haber generado cambios en los resultados obtenidos.
- 5.
No se cuantificó la ingesta de alimentos, actividad física o consumo de sal aditiva, lo cual podría influir en los resultados.
- 6.
Por último, no se cuenta con estudios de ultrasonografía o histológicos para asociarlos con algún daño estructural secundario a la ERD como la ND.
A pesar de las debilidades comentadas sugerimos que la presencia de la variante rs5186 podría ser un posible marcador de riesgo temprano al desarrollo de ERD y ERCA debido a su asociación con la disminución de TFGe en pacientes con DMT2. Nuestros resultados podrían incentivar a mayores estudios para justificar en un futuro al rs5186 como un posible biomarcador genético en el tamizaje, pronóstico o de referencia oportuna al servicio de Nefrología, porque los pacientes con DMT2 portadores del alelo de riesgo podrían ser considerados como vulnerables al desarrollo de ERD, ERCA e incluso falla renal. Esta información además podría ser útil para futuros estudios sistemáticos o de metaanálisis.
ConclusiónEn la práctica clínica, la mayoría de las nefropatías progresan lentamente hacia la pérdida definitiva de la función renal, incluso cursando asintomáticas. El presente estudio interinstitucional es el primero en reportar una contribución del rs5186 del gen AGTR1 con una disminución de la TFGe considerado como riesgo a ERD en pacientes con DMT2. En un futuro sería de suma importancia desarrollar estudios de prevención utilizando un tamizaje de tipo genético en pacientes vulnerables al desarrollo de ERD, el cual podría generar un mejor manejo clínico y disminuir el impacto económico de sus futuras complicaciones para las instituciones de salud pública.
FinanciaciónEl presente estudio es derivado del protocolo bajo Titulo de Estudio de Polimorfismos asociados a Insuficiencia renal crónica en pacientes mexicanos con Diabetes tipo 2 con número de registro R-2016-785-022, autorizado por el Comité de Ética en Investigación de la Coordinación de Investigación en Salud del Centro Medico Nacional Siglo XXI (CONBIOÉTICA-09-CEI-009-20160601. Declarando que la presente investigación no recibió beca o financiamiento provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNingún autor declara tener conflicto de intereses.
A todo el personal que apoyó en la Unidad de Investigación Médica en Bioquímica del Centro Médico Nacional Siglo XXI y la Unidad de Medicina Familiar número 31 del IMSS.