Sr. Director:
Los procesos autoinmunes con afectación renal son entidades clínicas heterogéneas sujetas a un diagnóstico diferencial complejo. La máxima expresión de los mismos es el lupus eritematoso sistémico (LES), cuyo pleomorfismo abarca desde las lesiones cutáneas o articulares hasta la propia nefritis lúpica (NL). Sus criterios diagnósticos fueron revisados en 1997 por el American College of Rheumathology (ACR), y permiten definir el cuadro con una sensibilidad y especificidad del 96%1. Sin embargo, su dificultad interpretativa surge siempre ante perfiles alejados de la estandarización clínica, donde además concurren el anacronismo en la manifestación de los síntomas y la inespecificidad de éstos.
En ese contexto presentamos el caso de un paciente de 40 años con antecedentes de tabaquismo, obesidad e hipertensión (HTA) (sin control farmacológico), que ingresó en Nefrología por un cuadro (de 3 semanas de evolución) de fiebre, diarrea/vómitos, pérdida de peso y disminución progresiva de la diuresis. Los valores analíticos pusieron de manifiesto entonces una disfunción renal severa (urea: 383 mg/dl; creatinina: 20,3 mg/dl), con hipoalbuminemia (2,3 g/dl) y anemia (hematocrito 20%; hemoglobina: 6,9 g/dl; volumen corpuscular medio: 88 fl). Mientras, los exámenes complementarios objetivaron microhematuria, coagulopatía (actividad protrombina 89%; haptoglobina: 298 mg/dl; reticulocitos: 1,5%; esquistocitosis escasa; COOMBS directo positivo), y también alteración ecográfica (riñones de tamaño normal, con hiperecogenicidad cortical). Ante estos resultados, y con la sospecha de un proceso glomerular vinculado a datos incompletos de anemia hemolítica, se llevó a cabo una hemodiálisis urgente con una transfusión sanguínea.
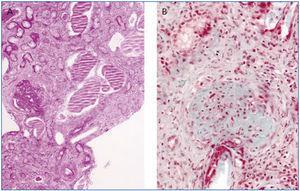
Otras determinaciones simultáneas fueron: copro y hemocultivos negativos; serología bacteriana y a parásitos negativa; serología viral −virus de hepatitis B, C y virus de la inmunodeficiencia humana−, con IgM e IgG positivos a citomegalovirus (CMV), Coxsackie, virus del herpes simple y virus varicela-zóster; y descenso de la fracción C3 (51 mg/dl). En cuanto a la biopsia renal, informó una glomeruloesclerosis generalizada en el 60% de la muestra, con semilunas fibrosas −que en algunos glomérulos tenían límites imprecisos con el intersticio−, atrofia tubular quística, fibrosis e infiltrado linfocitario intersticial. Asimismo, existían signos de arteriolopatía proliferativa en relación con la HTA (figura 1).
Con el diagnóstico de presunción de glomerulonefritis (GN) extracapilar rápidamente progresiva frente a LES, se administró tratamiento inmunosupresor coadyuvante a la diálisis (prednisona 1 mg/kg/día y azatioprina −AZA− 2 mg/kg/día) a la espera de las pruebas inmunológicas. Éstas concluyeron: ANA (+) a título 1/640; anti-DNAdc (+) 126 UI/ml; anti-Sm (+) 1,54 U/ml y c-ANCA (anticitoplasma de neutrófilos específicos para la proteinasa 3) (+) 52,8 U/ml. Los anticuerpos anticardiolipina y el anticoagulante lúpico fueron negativos. Y así, se catalogó definitivamente el cuadro como una NL de clase histológica VI de la Organización Mundial de la Salud, en un contexto sistémico (con 5 criterios del ACR: nefritis, serositis, alteración hematológica, ANA a título elevado, anti-DNA y anti-Sm). No obstante, a pesar del estudio positivo y la terapia propuesta, la función renal nunca se recuperó y la diuresis se mantuvo siempre con cifras inferiores a 500 cc/24 h.
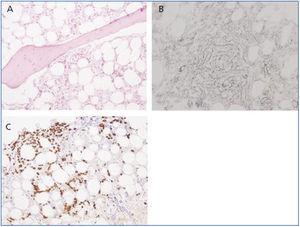
Ocho meses después del inicio (durante los cuales existió un deficitario control de la anemia a pesar del mantenimiento de la inmunosupresión), el enfermo sufrió distintas complicaciones, como un síndrome coronario agudo (SCA); un episodio de deposiciones diarreicas y fiebre alta sin respuesta a astringentes ni antibióticos, y, por último, una pancitopenia severa (2.320.000 hematíes/µl, 890 leucocitos/µl, 51.000 plaquetas/µl), con índice reticulocitario bajo (0,2%) y test de COOMBS directo e indirecto negativo. La alta sospecha de brote lúpico y/o mielotoxicidad hizo aconsejable entonces la intensificación de la terapia inmunomoduladora con bolus de metilprednisolona y la retirada de la AZA. De forma añadida, se decidió también el empleo de estimuladores de la serie granulocítica (filgrastim: 480 µg/sc/día). Sin embargo, no existió respuesta megacariocítica y la realización de la biopsia de médula ósea reveló una intensa hipoplasia con anomalías madurativas y proeritroblastos glicoforina negativos, posiblemente relacionados con el LES, aunque sin poder descartar la infección crónica simultánea por parvovirus B19 (figura 2). La nueva serología viral confirmó también la presencia de anticuerpos IgG frente a parvovirus, unidos a un recuento sanguíneo de 68.000 copias/ml de ADN de CMV. Entonces, se decidió el inicio de tratamiento con foscarnet (para evitar el efecto mielotóxico del ganciclovir) a razón de 50 mg/kg/día e inmunoglobulinas intravenosas (60 g/día). Su asociación no proporcionó ningún beneficio hematológico y se mostró claramente ineficaz para prevenir un nuevo episodio de diarrea sanguinolenta complicada con una hemorragia pulmonar, ante la cual ni siquiera la terapia combinada con diálisis diaria y plasmaféresis obtuvo resultados. Finalmente, el enfermo falleció en la Unidad de Cuidados Intensivos por un cuadro séptico secundario a una bacteriemia por Escherichia coli.
Como conclusión, el caso expuesto ejemplifica un LES atípico con una NL severa en la que fueron inexistentes los signos clásicos de la enfermedad, como las alteraciones cutáneas o las articulares, pero con predominio del síndrome constitucional (fiebre, anemia) y la insuficiencia renal grave. En él, el sustrato histológico dominante lo constituyeron la esclerosis glomerular generalizada/semilunas fibrosas/afectación intersticial (compatible con una GN extracapilar evolucionada) sin lesiones propias de las formas proliferativas de la NL2. Además, fue también singular la positividad de los anticuerpos c-ANCA (antiproteinasa 3), en lugar del tipo p-ANCA, más prevalente según la mayoría de los autores (hasta en el 15-30% de todos los casos de LES)3-5. Respecto a las complicaciones surgidas tras el diagnóstico, destacaron un SCA como expresión de inflamación y arteriosclerosis sistémica, y también la anemia hemolítica inicial evolucionada a una aplasia medular irreversible con etiología indeterminada (posiblemente secundaria a infección crónica por parvovirus B19)6,7. En ella no existió respuesta a la retirada de la AZA, ni tampoco al tratamiento intensivo con gammaglobulinas intravenosas, plasmaféresis o factores estimuladores. Este hecho, unido al cortejo sintomático provocado por el CMV (enteritis y hemorragia pulmonar), definieron el pronóstico final del cuadro, y obligaron a replantear la naturaleza de ambas infecciones como entidades oportunistas coexistentes y, de un modo no excluyente, como agentes inductores del brote lúpico7-10.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Biopsia renal. Glomeruloesclerosis severa y lesión tubular
Figura 2. Biopsia de médula ósea. Hipoplasia madurativa