Los pacientes con enfermedad renal crónica terminal muestran precozmente resistencia insulínica (RI), caracterizada por alteraciones en el metabolismo hidrocarbonado e hiperinsulinemia generalmente asociada a dislipemia y a un patrón pro inflamatorio. La enfermedad cardiovascular (CV) constituye la principal causa de mortalidad en los pacientes en diálisis. Existe una fuerte asociación entre RI, hiperinsulinismo y enfermedad CV. El objetivo del presente estudio fue evaluar el efecto de la diálisis peritoneal (DP) sobre la RI y sus efectos sobre la morbimortalidad CV subsiguiente en pacientes urémicos no diabéticos. Se incluyeron 69 pacientes no diabéticos en DP, 35 incidentes (≤ 3 meses en DP) y 34 prevalentes (> 3 meses en DP), con 2 mediciones de resistencia insulínica estimada mediante el índice de resistencia a la insulina (HOMAIR), separadas entre sí por 12 meses. El valor medio de HOMAIR en pacientes incidentes fue 1,8 ± 1,3 y 2,2 ± 2,1 en situación basal y a los 12 meses, respectivamente (no significativa [ns]). En pacientes prevalentes estos valores fueron 2,3 ± 1,3 y 2,5 ± 2,2 (ns). En nuestro estudio, las concentraciones medias de glucosa, insulina y RI medida por el HOMAIR y QUICKI (índice cuantitativo de control de la sensibilidad a la insulina) fueron similares en situación basal y al año de seguimiento, tanto en incidentes como en prevalentes. No objetivamos diferencias significativas en relación con la comorbilidad CV, cardiopatía isquémica, insuficiencia cardíaca o comorbilidad vascular cerebral o periférica, ni en función del índice HOMAIR, ni en el de los niveles de insulina. En conclusión, los pacientes no diabéticos en DP no presentan elevación significativa de los niveles de HOMAIR, ni se modifica con paso del tiempo en diálisis, lo que sugiere que la DP no es un factor de riesgo de RI. El hecho de que los índices de RI no se asocien a morbilidad o mortalidad CV parece sugerir el menor peso de este factor en el ámbito de la DP.
End-stage renal disease patients show early insulin resistance (IR), characterised by alterations in the carbohydrate metabolism and hyperinsulinaemia generally associated with dyslipidaemia and a proinflammatory condition. Cardiovascular disease (CVD) is the main cause of mortality in patients on dialysis. There is a strong association between IR, hyperinsulinism and CV disease. The objective of this study was to evaluate the effect of peritoneal dialysis (PD) on IR and its effects on the subsequent CVD morbidity and mortality in nondiabetic uraemic patients. It involved 69 nondiabetic patients on PD, 35 incident patients (≤ 3 months on PD) and 34 prevalent patients (> 3 months on PD), with 2 estimated insulin resistance measurements 12 months apart using the insulin resistance index (HOMAIR). The mean HOMAIR value in incident patients was 1.8 ± 1.3 and 2.2 ± 2.1 at baseline situation and at 12 months respectively (not significant [NS]). In prevalent patients these values were 2.3 ± 1.3 and 2.5 ± 2.2 (NS). In our study, the mean glucose, insulin and IR concentrations measured by the HOMAIR and QUICKI indexes (the latter being a quantitative control for insulin sensitivity control) were similar at baseline situation and the following year, in both incident and prevalent patients. We did not find any significant differences in relation to CVD comorbidity, ischaemic heart disease, heart failure or cerebrovascular or peripheral comorbidity neither in the HOMAIR index or insulin levels. To conclude, nondiabetic patients on PD do not display a significant increase in HOMAIR levels and this remains the case over time when on dialysis. This, in turn, suggests that PD is not an IR risk factor. The fact that the IR indexes are not associated with CVD morbidity or mortality seems to suggest that this is a less significant factor in the field of PD.
INTRODUCCIÓN
La enfermedad cardiovascular (CV) constituye la principal causa de mortalidad en los pacientes en diálisis1,2 . La asociación entre resistencia periférica a la insulina (RI), hiperinsulinismo y enfermedad CV se conoce por numerosos estudios transversales y prospectivos1-4. De hecho, el hiperinsulinismo se considera un buen marcador de RI en sujetos sin hiperglucemia significativa. Además, la RI se asocia a varios factores de riesgo de enfermedad CV como dislipemia2, hipertensión arterial5 e hipercoagulabilidad2.
Los pacientes con enfermedad renal crónica (ERC) terminal muestran precozmente RI, caracterizada por alteraciones en el metabolismo hidrocarbonado con hiperinsulinemia que, generalmente, se asocia a dislipemia y a un patrón pro inflamatorio con niveles séricos alterados de adipocitoquinas6. Numerosos estudios han demostrado que la RI se asocia posiblemente a un proceso inflamatorio sistémico silente y a un proceso microinflamatorio caracterizado por la activación de células periféricas como polimorfonucleares o monocitos7. La consecuencia final es una elevada prevalencia de ateroesclerosis con alta morbimortalidad de origen CV8.
Nuestra hipótesis de trabajo se basa en la posibilidad de que la glucosa de las soluciones de diálisis peritoneal (DP) pueda incrementar la RI, a través de un efecto mediado por adipocitoquinas, y contribuir a acelerar el proceso de ateroesclerosis del estado urémico. Por lo tanto, los objetivos del presente estudio fueron:
PACIENTES Y MÉTODOS
Pacientes
El diseño del estudio es prospectivo y observacional sobre una cohorte de pacientes incidentes y prevalentes tratados con DP. Se incluyeron 69 pacientes no diabéticos en DP, 35 incidentes (≤ 3 meses en DP) y 34 prevalentes (> 3 meses en DP), 58 % con diálisis peritoneal automatizada y 42 % con diálisis peritoneal continua ambulatoria, con 2 mediciones de resistencia insulínica estimada mediante el índice de resistencia a la insulina (HOMAIR), separadas entre sí 12 meses. El propósito de esta doble observación fue comprobar la reproducibilidad, potenciales cambios de situación derivados de la propia DP y la influencia de todo ello sobre la aparición de eventos CV y mortalidad.
Se excluyeron pacientes con neoplasia activa, infecciones agudas, enfermedad inflamatoria crónica no controlada o sintomática, o glucemia basal > 140 mg/dl.
Las causas de enfermedad renal fueron glomerulonefritis en 21 (30,4 %), nefroangioesclerosis o vascular en 8 (11,6 %), otras causas en 8 (11,6 %), enfermedad poliquística en 7 (10,1 %), enfermedad sistémica en 7 (10,1 %), causa no conocida en 7 (10,1 %), pielonefritis crónica en 5 (7,2 %), nefropatía intersticial en 5 (7,2 %) y hereditaria en 1 (1,4 %).
En el momento de la primera medición de RI se consideró el tiempo basal y el comienzo del seguimiento para el análisis de supervivencia.
La comorbilidad fue evaluada según el índice de Charlson modificado por Beddhu9.
PROCEDIMIENTOS DE LABORATORIO
Las determinaciones analíticas se realizaron basalmente y al año de evolución, tras 12 horas de ayuno y manteniendo su pauta habitual de DP. También se recogieron parámetros dialíticos, como Kt/V de urea semanal e índice de catabolismo proteico (nPNA).
La insulina se cuantificó por un método enzimoinmunométrico doble en el autoanalizador AIA 360 (Tosoh Bioscience). El coeficiente de variación intra e interensayo fue de 1,7 y 3,3 %, respectivamente. La sensibilidad del ensayo fue 1 µU/ml. El rango normal de insulina en nuestro laboratorio fue de 2 a 17 µU/ml
Con los datos de glucemia e insulinemia basales se calculó el índice HOMAIR, según la fórmula de Matthews et al.10: HOMAIR = glucosa (mmol/l) x insulina (µU/ml)/22,5. Además se calculó el índice cuantitativo de control de la sensibilidad a la insulina (QUICKI) de acuerdo con Hrebicek et al.11: QUICKI = 1/[log de insulina en ayunas (mU/l) – log de glucemia en ayunas (mg/dl)].
Definiciones
Enfermedad coronaria: antecedentes de angor, infarto de miocardio, evidencia coronariográfica, intervención percutánea o by-pass coronario.
Insuficiencia cardíaca congestiva: clasificación de la New York Heart Association (NYHA)12:
- Clase funcional I: actividad habitual sin síntomas. No hay limitación de la actividad física.
- Clase funcional II: el paciente tolera la actividad habitual, pero existe una ligera limitación de la actividad física, apareciendo disnea con esfuerzos intensos.
- Clase funcional III: la actividad física que el paciente puede realizar es inferior a la habitual, está notablemente limitado por la disnea.
- Clase funcional IV: el paciente tiene disnea al menor esfuerzo o en reposo, y es incapaz de realizar cualquier actividad física.
Enfermedad arterial periférica: pacientes con claudicación intermitente, by-pass arterial, amputación, gangrena o insuficiencia arterial aguda, aneurismas de aorta torácica o abdominal no reparados mayores de 5 cm.
Enfermedad vascular cerebral: pacientes con antecedentes de accidentes cerebrovasculares o accidentes isquémicos transitorios (con mediana o nula secuela).
Dislipidemia: presencia de uno o más de los siguientes criterios13: 1) colesterol LDL (colesterol ligado a lipoproteínas de densidad baja) ≥ 100 mg/dl; 2) colesterol no-HDL (colesterol no ligado a lipoproteínas de densidad alta) ≥ 130 mg/dl; 3) triglicéridos ≥ 150 mg/dl; 4) colesterol-HDL ≤ 40 mg/dl; y 5) uso de uno o más hipolipemiantes.
Hipertensión: la presión arterial (PA) fue medida con el monitor digital (HEM-907) con manguitos adaptados a la circunferencia del brazo después de que el sujeto reposara en posición supina durante al menos 5 minutos. El diagnóstico de hipertensión se realizaba cuando un sujeto presentaba uno o más de los siguientes criterios14: 1) PA sistólica ≥ 135 mmHg; 2) PA diastólica ≥ 85 mmHg; y 3) uso de uno o más antihipertensivos.
ANÁLISIS ESTADÍSTICO
Los valores se expresan como media (± desviación estándar) y porcentajes. Las proporciones se compararon con el test χ2 y las medias con la t de Student para variables de distribución normal y U de Mann-Whitney y Wilcoxon para las variables cuantitativas no paramétricas. El análisis de regresión lineal se realizó con los coeficientes de correlación de Pearson y Spearman. Para el análisis de supervivencia se empleó el método de Kaplan-Meier, y las curvas se compararon con el método log-rank. Un valor de p < 0,05 se consideró estadísticamente significativo.
RESULTADOS
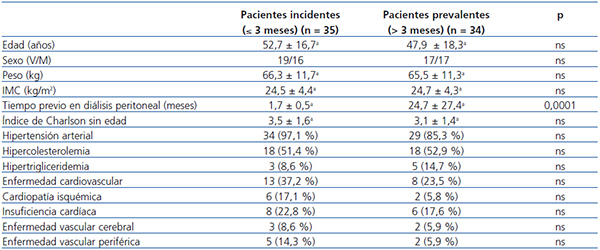
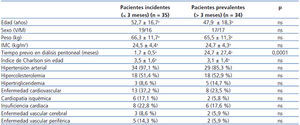
En la tabla 1 se exponen las características clínicas basales de los dos grupos de pacientes, clasificados según tiempo previo en DP (incidentes y prevalentes). No se encontraron diferencias significativas entre ambos grupos.
El tiempo medio de seguimiento en DP fue de 32,1 ± 16,0 meses (rango: 11-87).
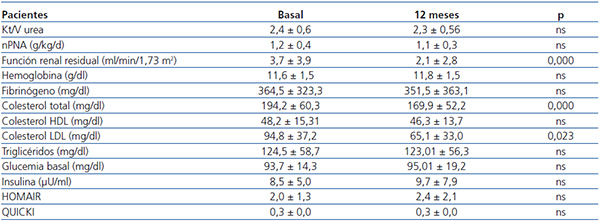
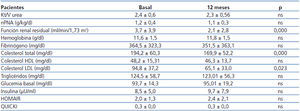
En la tabla 2 se reflejan los parámetros de diálisis, datos analíticos e índices de resistencia a la insulina (HOMAIR y QUICKI), en situación basal y a los 12 meses de seguimiento. Solo se observaron diferencias estadísticamente significativas en la función renal residual, colesterol total y colesterol LDL.
El porcentaje de utilización de icodextrina en pacientes incidentes al inicio fue de 60 % y a los 12 meses de 57,1 %, mientras que en pacientes prevalentes fue de 73,5 % en ambos casos.
HOMAIR e insulina basal
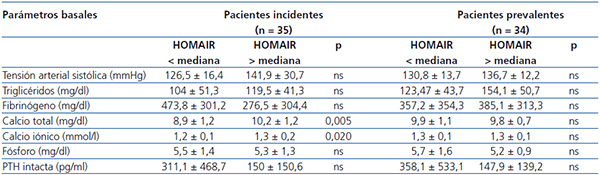
Cuando se clasificaron los pacientes en función de la mediana del HOMAIR basal (HOMAIR, 1,7, rango: 6,29), observamos que los pacientes incidentes con el HOMAIR más elevado tenían niveles de calcio total y calcio iónico significativamente más altos, comparados con los que presentaban valores de HOMAIR más bajos. En los pacientes prevalentes no se encontraron diferencias significativas (tabla 3). Al distribuir los pacientes según la mediana de la insulinemia (7,0, rango: 2-25), los hallazgos fueron similares a los anteriores.
No encontramos diferencias en el índice HOMAIR ni en el QUICKI en función de las diferentes concentraciones de glucosa de las soluciones de diálisis peritoneal, tanto basalmente como al año (datos no mostrados).
Análisis de comorbilidad
Cuando analizamos los pacientes con HOMAIR basal según el valor de la mediana, no encontramos diferencias estadísticamente significativas en relación con la comorbilidad CV, cardiopatía isquémica, insuficiencia cardíaca o comorbilidad vascular cerebral y periférica. Estos resultados se repiten cuando realizamos el análisis en función de la mediana de la insulina basal.
En relación con el índice de Charlson sin edad, la comorbilidad de los pacientes con HOMAIR por encima y por debajo de la mediana fue similar (3,2 ± 1,6 vs. 3,4 ± 1,3, no significativa).
La existencia de enfermedad CV previa no influyó de manera significativa en los niveles de HOMAIR.
Análisis de supervivencia
Dieciocho pacientes (26 %) murieron durante el seguimiento, siendo el origen vascular la causa más frecuente de mortalidad (n = 5, 27,8 %), seguida por la causa cardíaca (n = 4, 22,2 %), infecciosa (n = 4, 22,2 %), deterioro (n = 2, 11,1 %), tumoral (n = 1,5, 6 %) y otras (n = 2, 11,1 %).
La comparación entre los pacientes que fallecieron y los que sobrevivieron mostró que los primeros eran preferentemente varones (11 vs. 7, p = 0,001), más ancianos (63,6 ± 12,3 vs. 45,7 ± 16,8 años, p = 0,000) y con un mayor índice de Charlson sin edad (4,5 ± 1,1 vs. 2,9 ± 1,3, p = 0,000). No se encontraron diferencias estadísticamente significativas en los índices de medición de la RI (datos no mostrados).
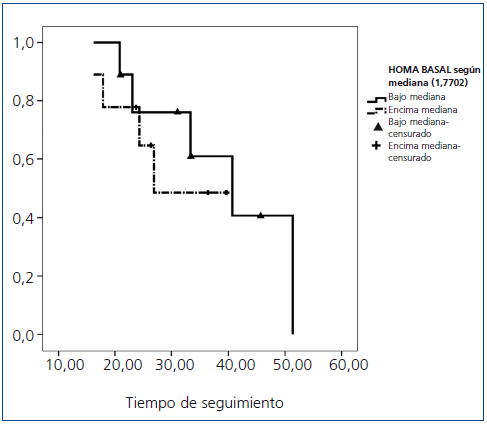
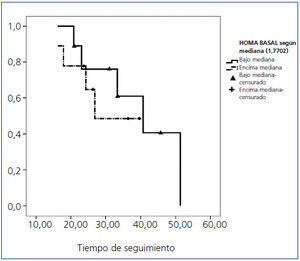
El análisis de supervivencia global de Kaplan-Meier no reveló diferencias significativas en la mortalidad entre los pacientes con niveles de índice HOMAIR por encima y por debajo de la mediana (figura 1). De igual forma, no se evidenciaron diferencias en mortalidad CV y evento CV fatal y no fatal a lo largo del estudio (datos no mostrados).
DISCUSIÓN
En el presente estudio analizamos los efectos de la DP sobre parámetros de resistencia insulínica (HOMAIR y QUICKI) y su influencia sobre la aparición de eventos CV y mortalidad en un grupo de pacientes en DP no diabéticos.
En pacientes urémicos, la RI se presenta de manera muy frecuente, ocurriendo incluso en fases tempranas15. Se han descrito varias hipótesis que tratan de explicar la RI: 1) hiperproducción de factores proinflamatorios endógenos, como la homocisteína16, el estrés oxidativo17 o los niveles elevados de lipoproteína (a)18; y exógenos, como las infecciones crónicas, a veces silentes, por Helicobacter pylori19, prótesis vasculares infectadas o administración de hierro intravenoso entre otras20; y 2) aumento del tejido graso21 por sobrealimentación, que conlleva la formación de un círculo vicioso con aumento de la producción de adipocitoquinas (leptina, resistina) y otros mediadores proinflamatorios como el factor nuclear kappa beta, factor de necrosis tumoral alfa e interleuquina 622. Estas quimoquinas actúan como proteínas quimiotácticas de monocitos y macrófagos (MCP-1)23,24 perpetuando la RI.
En pacientes en DP, el desarrollo de IR se atribuye a la gran cantidad de glucosa absorbida desde los líquidos de diálisis, lo que contribuye a otras alteraciones metabólicas, como la obesidad central, hipertrigliceridemia, y diabetes de novo25. Además se induciría la hipersecreción de adipocitoquinas que perpetuarían el hiperinsulinismo y sus efectos metabólicos y sistémicos deletéreos. Según un estudio de Fortes et al.26, los pacientes en DP tienen mayores niveles de glucosa en ayunas, HbA1c e índice HOMAIR que los pacientes en hemodiálisis. Por otro lado, los pacientes con líquidos de diálisis libres de glucosa demostraron menor absorción de glucosa, menor ganancia de peso y acumulación de grasa, además de disminución de niveles de leptina en plasma y aumento del nivel plasmático de adiponectina, mejoría en la RI y la dislipidemia27,28. En nuestro estudio, las concentraciones medias de glucosa, insulina y RI medida por el HOMAIR y QUICKI fueron similares en situación basal y al año de seguimiento tanto en pacientes incidentes como en prevalentes.
Bonora et al.29 encontraron en una gran muestra de pacientes diabéticos tipo 2 que la RI, estimada por HOMAIR, era un fuerte predictor de enfermedad CV, tanto al inicio del estudio como durante el seguimiento. Este hecho ocurrió con independencia de los factores de riesgo CV clásicos y las variables más estrictamente relacionadas con la IR, como el índice de masa corporal. Asimismo, a pesar de que varios estudios mostraron que la hiperinsulinemia era capaz de predecir las enfermedades CV4,30, otros, sin embargo, no encontraron una asociación significativa entre niveles plasmáticos de insulina y enfermedades CV31. En nuestro estudio no evidenciamos diferencias significativas en relación con la comorbilidad CV, cardiopatía isquémica, insuficiencia cardíaca o comorbilidad vascular cerebral, ni en función del índice HOMAIR, ni en los niveles de insulina. Asimismo, el índice de Charlson sin edad fue similar en los pacientes. Tampoco encontramos relación entre la presencia de enfermedad CV previa y el valor de HOMAIR.
La glucosa de las soluciones de DP podría tener un efecto sobre el adipocito abdominal que, a través de un incremento en la secreción de adipocitoquinas, incrementara la RI favoreciendo el desarrollo de un síndrome metabólico y acelerando el proceso de ateroesclerosis del estado urémico. Al analizar nuestros datos, no encontramos diferencias en el índice HOMAIR ni en el QUICKI en función de las diferentes concentraciones de glucosa de las soluciones de DP utilizadas.
En la población general, la RI se considera un factor de riesgo CV y de mortalidad32,33, mientras que este comportamiento parece diferir en los estudios realizados con pacientes con ERC. Un estudio de Shinohara et al.34 mostró que el índice HOMAIR predecía la mortalidad en pacientes no diabéticos con ERC. Otros estudios, sin embargo, no han demostrado esta asociación35. En nuestro análisis de supervivencia no encontramos diferencias estadísticamente significativas en los índices de RI, ni tampoco al clasificar los pacientes en función de los valores medianos de HOMAIR analizados por Kaplan-Meier. Probablemente, otros aspectos característicos de estos pacientes, como la edad o la comorbilidad, tengan más peso en la supervivencia que la resistencia a la insulina. Además, los valores de HOMAIR encontrados en nuestro estudio se hallan dentro de los límites normales, lo cual dificulta aún más la existencia de diferencias significativas en la supervivencia.
Bonora et al.36 encontraron valores de HOMAIR de 2,06 (2,06 ± 0,14) en una población de 62 sujetos sanos, utilizando un radioinmunoanálisis de doble anticuerpo para la medición de la insulina plasmática. En un estudio realizado en 490 voluntarios no diabéticos, 77 % caucásicos, de ambos sexos, edad entre 19 y 79 años e índice de masa corporal entre 18 y 42,2, los investigadores hallaron un índice de HOMAIR de 2,7 ± 0,137. El valor de HOMAIR en sujetos normales (sin alteración del metabolismo de la glucosa) en un trabajo previo nuestro fue de 2,22 ± 0,2638. Los valores de HOMAIR que encontramos en nuestra población de estudio, tanto en pacientes incidentes como en prevalentes, se situaron entre el P50-P75 de la población general española según un estudio reciente39. Caravaca et al.40 encontraron en pacientes con ERC no diabéticos niveles medios de HOMAIR más elevados que los de nuestro estudio (4,28 ± 2,07). Estos datos apoyan los resultados obtenidos demostrando que los pacientes no diabéticos en DP no presentan elevación significativa de los niveles de HOMAIR, con respecto a la población general, y que este hecho no se modifica con el tiempo en diálisis, al menos en un año.
Reconocemos como una limitación de nuestro estudio el hecho de haber incluido solo aquellos pacientes con glucemia basal > 140 mg/dl en lugar del corte diagnóstico de diabetes en la población general de ≥ 126 mg/dl, pero, al tratarse de pacientes en DP con un aporte continuo de glucosa, pretendíamos conseguir una cohorte de pacientes con una glucemia basal próxima a la normalidad, aunque excluyendo los casos de diabetes. Es posible que mediante este umbral más permisivo se hayan incluido pacientes con grados menores de alteración del metabolismo de la glucosa, como la intolerancia hidrocarbonada, pero nuestra intención fue solo excluir aquellos pacientes con diabetes franca. El hecho de que todos los pacientes, para poder ser incluidos en el estudio, tuvieran que tener al menos un año de evolución en DP supone un sesgo en el estudio de supervivencia. Además, este estudio está limitado por el corto número de pacientes estudiados, pero ofrece un doble abordaje sobre diferentes etapas de tratamiento en DP, inicial y tardía, con consistencia de los resultados en ambas. Asimismo, su carácter prospectivo avala de forma considerable los resultados obtenidos.
En conclusión, los pacientes no diabéticos en DP no presentan elevación significativa de los niveles de HOMAIR, ni modificación de dicho índice tras un año de tratamiento en DP, lo que sugiere que la DP no es causa de aumento del riesgo de RI. El hecho de que los índices de RI no se asocien a morbilidad o mortalidad CV parece sugerir el menor peso de este factor en el ámbito de la DP.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características basales de los pacientes en diálisis peritoneal incidentes y prevalentes
Tabla 2. Parámetros de diálisis, datos analíticos e índices de resistencia periférica a la insulina en pacientes en diálisis peritoneal, basal y al año de seguimiento
Tabla 3. Comparación de los datos analíticos basales según los valores de la mediana del HOMAIR (mediana: 1,7, rango: 6-29)
Figura 1. Curva de Kaplan-Meier, mediana HOMAIR frente a éxitus