La enfermedad de Dent tipo 1 (DD1) es una enfermedad hereditaria rara ligada al cromosoma X causada por mutaciones en el CLCN5 que se caracteriza principalmente por una disfunción del túbulo proximal, hipercalciuria, nefrolitiasis o nefrocalcinosis, enfermedad renal crónica progresiva y proteinuria de bajo peso molecular, rasgo distintivo de la enfermedad. En la actualidad no existe un tratamiento curativo específico, únicamente sintomático, y no previene la progresión de la enfermedad. En este estudio hemos aislado y caracterizado las vesículas extracelulares urinarias (uEV) enriquecidas en exosomas que nos permitirán identificar biomarcadores asociados a la progresión de DD1 y ayudarán a una mejor comprensión de las bases fisiopatológicas.
Materiales y métodosA través de una convocatoria nacional de la Sociedad Española de Nefrología (SEN) y la Sociedad Española de Nefrología Pediátrica (AENP), se obtuvieron orinas de pacientes y controles de distintos hospitales españoles, las cuales se procesaron para obtener los uEV. Los datos de estos pacientes fueron proporcionados por los respectivos nefrólogos o extraídos del registro RENALTUBE. Los uEV se aislaron mediante ultracentrifugación, fueron caracterizados morfológicamente y se extrajo su contenido de proteína y micro-ARN.
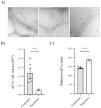
ResultadosSe seleccionó a 25 pacientes y 10 controles, de los cuales se procesaron las orinas para aislar los uEV. Nuestros resultados mostraron que la concentración relativa de uEV/ml era menor en los pacientes que en los controles (0,26×106 vs. 1,19×106 uEV/ml; p<0,01). Además, se vio que los uEV de los pacientes eran significativamente más grandes que los de los sujetos control (diámetro medio: 187,8 vs. 143,6nm; p<0,01). Por último, nuestros datos demostraron que se había extraído correctamente el ARN tanto de los exosomas de pacientes como de los controles.
ConclusionesEn este trabajo describimos el aislamiento y caracterización de uEV de pacientes con DD 1 y controles sanos, útiles para el posterior estudio de moléculas cargo diferencialmente expresadas en esta enfermedad.
Dent's disease type 1 (DD1) is a rare X-linked hereditary pathology caused by CLCN5 mutations that is characterized mainly by proximal tubule dysfunction, hypercalciuria, nephrolithiasis/nephrocalcinosis, progressive chronic kidney disease, and low-weight proteinuria, the molecular hallmark of the disease. Currently, there is no specific curative treatment, only symptomatic and does not prevent the progression of the disease. In this study we have isolated and characterized urinary extracellular vesicles (uEVs) enriched in exosomes that will allow us to identify biomarkers associated with DD1 progression and a better understanding of the pathophysiological bases of the disease.
Materials and methodsThrough a national call from the Spanish Society of Nephrology (SEN) and the Spanish Society of Pediatric Nephrology (AENP), urine samples were obtained from patients and controls from different Spanish hospitals, which were processed to obtain the uEVs. The data of these patients were provided by the respective nephrologists and/or extracted from the RENALTUBE registry. The uEVs were isolated by ultracentrifugation, morphologically characterized and their protein and microRNA content extracted.
ResultsTwenty-five patients and 10 controls were recruited, from which the urine was processed to isolate the uEVs. Our results showed that the relative concentration of uEVs/ml is lower in patients compared to controls (0.26×106 vs. 1.19×106uEVs/ml, P<0.01). In addition, the uEVs of the patients were found to be significantly larger than those of the control subjects (mean diameter: 187.8 vs. 143.6nm, P<0.01). Finally, our data demonstrated that RNA had been correctly extracted from both patient and control exosomes.
ConclusionsIn this work we describe the isolation and characterization of uEVs from patients with DD1 and healthy controls, that shall be useful for the subsequent study of differentially expressed cargo molecules in this pathology.
La enfermedad de Dent tipo 1 (DD1) es una enfermedad hereditaria rara descrita por primera vez en 19641, con unas 400 familias descritas hasta el momento. Se caracteriza por hipercalciuria y proteinuria de bajo peso molecular, que constituye el rasgo distintivo de la enfermedad2. Los pacientes pueden desarrollar nefrocalcinosis, cálculos renales o enfermedad renal crónica3. En la DD1, el tráfico de vesículas y el transporte intracelular se interrumpen debido a mutaciones en el antiportador electrogénico 2Cl- / H+ ClC-5 codificado por el gen CLCN54,5 (OMIM # 300009). El CLCN5 se encuentra en el cromosoma Xp11.22 y la isoforma más común contiene 746 aminoácidos6. El ClC-5 controla la acidificación y el reciclaje de los compartimentos endosomales, se expresa predominantemente en las células renales del túbulo proximal y se localiza en los endosomas y en la membrana apical6, aunque también se ha descrito en podocitos humanos6. La inactivación por mutaciones en CLCN5 produce una proteinuria de bajo peso molecular grave debido a una captación endocítica defectuosa en las células renales del túbulo proximal, que se ha asociado a la desaparición de megalina y cubilina en el brush border de dichas células renales5. Aunque la DD1ha sido considerada como una enfermedad tubular, también se han descrito casos con lesiones de glomerulosclerosis focal en biopsias renales7.
El fenotipo de la DD1 se puede confundir con el de otros trastornos hereditarios relacionados que también conducen a enfermedad renal crónica, lo que dificulta el diagnóstico. Existe una considerable variabilidad intrafamiliar en la expresión clínica y progresión de la enfermedad, sin que haya sido posible establecer una correlación genotipo-fenotipo clara8-10. Actualmente, no hay tratamiento específico ni ensayos clínicos para esta enfermedad, por lo que la atención del paciente se centra en el tratamiento de la hipercalcuria y la prevención de la nefrolitiasis3.
Con el fin de entender en mayor profundidad las bases fisiopatológicas de la DD1, así como el de obtener nuevos biomarcadores de progresión de la enfermedad, nuestro grupo ha propuesto un estudio basado en la obtención de vesículas extracelulares urinarias (uEV, por las siglas en inglés de urinary extracellular vesicles) enriquecidas en exosomas a partir de las cuales se puedan obtener perfiles de mi-ARN asociados a la enfermedad. Los exosomas parecen derivar de cada uno de los tipos de células epiteliales que se encuentran frente a la luz del túbulo renal11 y, por lo tanto, pueden brindar información valiosa para monitorizar los cambios fisiológicos y patológicos en toda la nefrona a través de un procedimiento no invasivo como es la recolección y análisis de orina12.
En este trabajo describimos la metodología utilizada para la obtención de las vesículas urinarias y su caracterización en pacientes con DD1 y en controles.
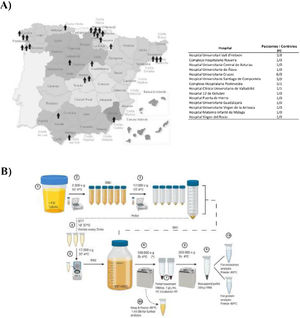
Materiales y métodosPacientesSe recogieron las muestras de orina de 25 pacientes varones afectos de DD1 con diagnóstico genético confirmado y de 10 donantes sanos de la misma edad y sexo en diferentes hospitales de España para su procesamiento en el Hospital Universitari Vall d’Hebrón (Barcelona, España) (fig. 1A). El estudio fue aprobado por el Comité Ético del Hospital Vall d’Hebron (PR(AG)149/2020/ 314/C/2020). La tasa de filtración glomerular estimada (TFGe) se calculó utilizando la fórmula CKD-EPI13.
Obtención de las muestras y aislamiento de uEV. A) Mapa de España con la distribución geográfica de los centros que participaron en este estudio. B) Representación gráfica del protocolo de extracción de uEV de la orina de pacientes o controles.
uEV: vesículas similares a exosomas urinarios.
El aislamiento de uEV se realizó de acuerdo con el protocolo previamente descrito por nuestro grupo14. Este proceso se muestra en el esquema de la figura 1B.
Nanoparticle tracking analysisLa cuantificación y distribución de la medida de los uEV se analizó mediante la técnica de nanoparticle tracking analysis (NTA) (NanoSight NS300, Malvern Instruments, Reino Unido). Dicho equipo utiliza la dispersión de la luz y el movimiento browniano para obtener la medida y la concentración de las partículas en suspensión15,16. Dichos parámetros se registraron con una cámara de alta sensibilidad y las imágenes obtenidas se analizaron con el programa NTA v3.1 (NanoSight Ltd., Malvern Instruments, Reino Unido) en el Institut de Ciència de Materials de Barcelona (ICMAB-CSIC), en la Universitat Autònoma de Barcelona (España).
Microscopía electrónica de transmisión criogénicaLa microscopía electrónica de transmisión criogénica (Cryo-TEM) se realizó en el Centro de Microscopía de la Universitat Autònoma de Barcelona. Se aplicaron 10μl de uEV diluidos en PBS 1x en rejillas Formvar-Carbon EM y se congelaron en etanol líquido enfriado a –179°C. Las muestras se analizaron en un microscopio electrónico de transmisión Jeol JEM 2011 a un voltaje de aceleración de 200kV.
Extracción de proteínas exosomalesLos uEV en suspensión se incubaron con tampón de lisis 1:1 (Tris-HCl 100mM pH 7,5, EDTA 2mM, pH 8, NaCl 300 mM, SDS 0,2%, NP-40 2%, desoxicolato de sodio 0,5%, PIC 1:200, NaF 1 mM, Na 3VO 1 mM) a 4°C en rotación constante durante 1h. A continuación, las muestras se sonicaron a máxima amplitud durante 5 ciclos de 5 segundos y, luego, se centrifugaron a 13.000 xg durante 15 min a 4°C. Los sobrenadantes se recogieron y almacenaron a –20°C. Los lisados de uEV se procesaron y analizaron por western blot.
Extracción y cuantificación de ARNPara la extracción del ARN de los lisados de uEV previamente caracterizados se utilizó el kit miRNeasy Mini (Qiagen). La cuantificación de los niveles de ARN se realizó utilizando el BioAnalyzer 2100 en combinación con el kit ARN 6000 Pico LabChip.
Análisis estadísticoLos resultados se presentan como media±error estándar de la media (SEM). La prueba t de Student (2 colas) fue utilizada para el análisis estadístico. Un valor de p menor de 0,05 fue considerado para indicar diferencias estadísticamente significantes. Los análisis estadísticos se hicieron con programa comercial (GraphPad Prism, versión 9 para MacOS, GraphPad Software, La Jolla California, EE. UU.).
ResultadosPoblación de estudioLa DD1 es una enfermedad ultrarrara con un bajo número de pacientes diagnosticados. Por ello, para conseguir un número suficiente de pacientes para este estudio, se hizo una convocatoria nacional a través de la Sociedad Española de Nefrología (SEN) y la Sociedad Española de Nefrología Pediátrica (AENP). Un total de 25 pacientes con mutaciones confirmadas en el gen CLCN5 procedentes de 14 hospitales de España participaron en este estudio, de los que se recogieron muestras y datos clínicos (fig. 1A). También se incluyó a 10 controles sanos emparejados por edad y raza (todos los individuos estudiados eran varones). Los datos demográficos y clínicos de los pacientes confirmaron que no había diferencias significativas en la edad entre los 2grupos (p=0,67), pero mostraron que el 44% de ellos (p=0,012) presentaban una función renal reducida (TFGe <90ml/min/1,73 m2) y el 52%, nefrocalcinosis (p=0,0052) (tabla 1). No había diferencias significativas en el resto de los parámetros estudiados entre pacientes y controles.
Características clínicas de la cohorte (controles y pacientes)
| Pacientes (n=25) | Controles (n=10) | p | |
|---|---|---|---|
| Edad al último seguimiento, años mediana, [RIQ] | 11,5 [4,75-19] | 10 [8,5-25] | 0,67 |
| Sexo, masculino n (%) | 25 (100) | 10 (100) | >0,99 |
| Enfermedad renal crónica | |||
| Sin fallo renal (>90 ml/min/1,73 m2) | 12 (52,2) | 10 (100) | 0,0129 |
| Estadio 2 (60-89 ml/min/1,73 m2) | 5 (21,7) | 0 (0) | |
| Estadio 3 (30-59 ml/min/1,73 m2) | 3 (13) | 0 (0) | |
| Estadio 4 (15-29 ml/min/1,73 m2) | 3 (13) | 0 (0) | |
| Estadio 5 (<15 ml/min/1,73 m2) o TRR | 0 (0) | 0 (0) | |
| Nefrocalcinosis, sí n (%) | 13 (52) | 0 (0) | 0,0052 |
| Litiasis, sí n (%) | 4 (16) | 0 (0) | 0,303 |
| Síndrome de Fanconi incompleto (glucosuria o aminoaciduria) n (%) | 4 (16) | 0 (0) | 0,303 |
| Raquitismo, sí n (%) | 3 (12) | 0 (0) | 0,542 |
Negrita: diferencia significativa.
RIQ: rango intercuartílico; TRR: terapias de reemplazo renal.
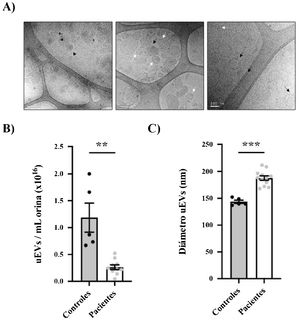
Las orinas de los pacientes y controles se procesaron para obtener los uEV como nuestro grupo ya ha descrito (fig. 1B)14. Los uEV enriquecidos en exosomas obtenidos de pacientes y controles se caracterizaron morfológicamente utilizando la técnica de cryo-TEM, que permite una visualización directa de las vesículas sin la adición de metales pesados ni fijadores, que podrían causar artefactos. Nuestros resultados revelaron vesículas de una, 2o varias capas, así como uEV de diferentes tamaños sin impurezas evidentes (fig. 2A).
Caracterización morfológica de los uEV de pacientes y controles. A) Micrografías de una muestra representativa con diferentes escalas (500nm, 200nm y 100nm de izquierda a derecha) que muestran vesículas simples (flecha blanca), dobles (flecha negra continua) o multicapa (flecha negra discontinua). B) Cuantificación de la concentración de uEV por ml de orina en controles (círculos negros) o pacientes (círculos grises). Cada punto representa un sujeto. En la gráfica también se muestra la media±SEM. C) Cuantificación del diámetro de los uEV de controles (círculos negros) y pacientes (círculos grises). Cada punto representa la media del diámetro de los uEV para un único sujeto. La gráfica también muestra la media±SEM.
CD81: grupo de diferenciación 81; GRP78: proteína reguladora de glucosa 78; HepG2: línea celular de carcinoma hepatocelular G2; uEV: vesículas similares a exosomas urinarios; SN: sobrenadante.
** p<0,01.
***p<0,001.
La distribución de tamaño y la concentración relativa de uEV se evaluaron mediante análisis de seguimiento de nanopartículas (NTA) en muestras seleccionadas al azar (n=12 pacientes, n=5 controles)15,16. Fue muy interesante observar que la concentración relativa de uEV/ml era significativamente menor en pacientes que en controles (0,26±0,04×1016 vs. 1,19±0,27×1016 uEV/ml; p=0,0004) (fig. 2B). Como se ve en la figura 2C, la mayoría de las vesículas detectadas tenían menos de 200nm de diámetro, como se espera para los exosomas. Cabe señalar como curiosidad que los exosomas de los pacientes eran significativamente más grandes que los de los sujetos control (diámetro medio 187,8±4,053 vs. 143,6±2,994nm, respectivamente; p<0,0001) (fig. 2C).
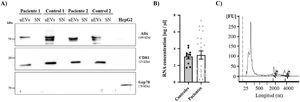
Por último, se evaluó la expresión de 2marcadores asociados con exosomas (ALIX y CD81)17 mediante la técnica de western blot para confirmar la presencia de exosomas urinarios (fig. 3A). Ambos marcadores se detectaron en todas las muestras de exosomas (tanto en pacientes como en controles) y estuvieron ausentes en el sobrenadante de esas mismas muestras, que se utilizaron como control negativo para confirmar la ausencia de contaminación por restos celulares. Además, utilizamos un marcador de retículo endoplásmico (GRP78) para demostrar la ausencia de estructuras intracelulares en las suspensiones de exosomas.
ARN y proteína obtenidos de los uEV. A) Los niveles de Alix y CD81 (marcadores de exosomas) fueron analizados por western blot en muestras de pacientes y controles. El lisado de la línea celular HepG2 se utilizó como control positivo para la detección de Grp78, un marcador de retículo. B) Concentración de ARN (ng/μl) en muestras de controles (círculos negros) y pacientes (círculos grises). Cada punto representa un único sujeto. La gráfica también muestra la media±SEM. C) Electroferograma representativo que muestra una buena integridad del ARN obtenido de los uEV. En la gráfica se marcan los picos correspondientes al ARN ribosomal 18S o 28S.
FU: unidades arbitrarias de fluorescencia; nt: nucleótidos.
El ARN extraído de los uEV se cuantificó utilizando el BioAnalyzer 2100. La cuantificación total de ARN no mostró diferencias entre controles y pacientes (fig. 3B) y se obtuvieron electroferogramas similares en todas las muestras, así como una buena integridad del ARN en todos los casos. Tal como se expone en el ejemplo de la figura 3C, se observa un pico alto correspondiente a ARN de 250nt y 2picos más bajos pero de mayor tamaño correspondientes al ARN ribosomal 18S o 28S (fig. 3C).
DiscusiónEl objetivo de este estudio ha sido identificar y seleccionar a pacientes españoles con diagnóstico genético confirmado de DD1 para el aislamiento y la caracterización de los uEV enriquecidos en exosomas tanto en su orina como en la de controles sanos. Además, se ha extraído el ARN de los uEV para determinar en un futuro el posible perfil diferencial de expresión entre pacientes y controles con el fin de identificar biomarcadores diagnósticos y de progresión, así como posibles dianas terapéuticas contra la DD1. De hecho, el análisis de muestras de orina es insustituible como método no invasivo para el diagnóstico y el seguimiento de algunas enfermedades, en particular, de las renales. A diferencia de la biopsia de tejido, procedimiento invasivo y no exento de complicaciones que solo permite obtener una muestra parcial del órgano, los uEV enriquecidos en exosomas proporcionan una representación completa de todo el sistema urinario y su estudio resulta atractivo en el campo del descubrimiento de biomarcadores. Se ha evaluado el uso potencial de los uEV como marcadores diagnósticos y pronósticos en estudios clínicos, así como su contribución en procesos fisiopatológicos utilizando modelos experimentales18-20.
Aislamiento de exosomasLas muestras de orina procedentes de pacientes de toda la geografía española fueron congeladas, tras una primera centrifugación, hasta su procesamiento. Aunque algunos autores han señalado que la congelación directa a –80°C podría conservar mejor los exosomas21, otros han demostrado que los exosomas y sus cargos son estables en la orina en diferentes condiciones de almacenamiento, al obtener resultados comparables con muestras recién procesadas o después de ciclos repetidos de congelación-descongelación22. Para el aislamiento de uEV, se prefirió el método de centrifugación diferencial a otras técnicas23. No se han publicado datos previos sobre uEV en pacientes con DD1 y, por lo tanto, se desconocía la eficiencia del aislamiento de exosomas por muestra de orina en estos pacientes poliúricos, que, además, tienen la endocitosis y la vía endolisosomal afectadas (las cuales están involucradas en la formación de exosomas).
Esta técnica ha sido muy utilizada en nuestro laboratorio y ya ha demostrado su eficacia en el aislamiento de exosomas para estudiar otra tubulopatía rara renal que cursa con poliuria14.
Diferencias en el número y tamaño de los exosomasLa cuantificación de los uEV mediante la técnica de NTA mostró una concentración sustancial de ellos, aunque muy variable entre muestras individuales. Esta variación fue independiente del filtrado glomerular o del grado de proteinuria, pero otros factores podrían desempeñar un papel, como la cantidad de proteína Tamm Horsfall. Es interesante constatar que se observó que los pacientes tenían casi 5veces menos concentración de uEV/ml de orina que los controles. Este hecho puede estar relacionado con la poliuria con la que cursan los sujetos afectos por DD1.
No obstante, también se observaron diferencias significativas en el tamaño de los exosomas de los pacientes en comparación con los de los controles, como ya ha sido comentado. Una posible hipótesis sería que algunos defectos en la vía endolisosomal, resultado de la disfunción de ClC-5, produjeran, por algún mecanismo aún desconocido, la liberación de vesículas de mayor tamaño en pacientes con DD1 que en controles. De hecho, este cambio en el tamaño también podría explicar la reducción en el número de partículas entre pacientes y controles: se libera menos cantidad de exosomas, pero estos son más grandes.
La disfunción tubular que se produce en la enfermedad de Dent podría tener impacto en la producción y liberación de exosomas, ya que su biogénesis comienza en el sistema endosomal, donde los endosomas tempranos maduran a endosomas tardíos o a cuerpos multivesiculares24. El antiportador electrogénico (2Cl-/H+) ClC-5 se localiza en los endosomas tempranos y tiene un papel muy relevante en el tráfico de vesículas y el transporte intracelular4,5, que se altera cuando se producen mutaciones en el gen CLCN5, como ocurre en la enfermedad de Dent. Asimismo, se ha señalado que el destino de los cuerpos multivesiculares, ya sea su degradación o la secreción de exosomas, depende de la homeostasis celular, probablemente alterada en pacientes con enfermedad de Dent. Los cuerpos multivesiculares pueden dirigirse a los lisosomas, donde su contenido es degradado, o transportados a la membrana plasmática para la liberación de exosomas25. Poco se sabe sobre los mecanismos moleculares y celulares que regulan este equilibrio y el rol de ClC-5 en estos procesos está por determinar.
En otras enfermedades, como las demencias neurodegenerativas, se ha visto también una reducción en la concentración de vesículas extracelulares en el plasma, con un incremento de su tamaño26. Sin embargo, aún no se ha reportado en la literatura ningún mecanismo que explique este cambio. Por otro lado, Paulaitis et al. han caracterizado las distribuciones de tamaño de exosomas basándose en la escala dinámica del crecimiento de cuerpos multivesiculares en la vía de biogénesis de exosomas27. Estos autores encuentran diferencias estadísticamente significativas en los exponentes de escala que caracterizan las distribuciones de tamaño de exosomas en muestras de suero de pacientes con cáncer comparados con los de donantes sanos. Estos autores consideran que tales cambios podrían reflejar alteraciones en la composición de la membrana de los exosomas y proponen que se podría considerar el exponente de escala como un biomarcador biofísico comparable a los biomarcadores bioquímicos de exosomas y complementario a ellos, en particular, las proteínas de membrana específicas, como las tetraspaninas.
ConclusionesEn este estudio hemos aislado y caracterizado por primera vez exosomas de pacientes con DD1. De hecho, la caracterización morfológica de dichos exosomas ha mostrado que hay una disminución de su concentración en la orina conjuntamente con un incremento de su tamaño. Aunque no tenemos una explicación para justificarlo, un estudio en profundidad con relación a esta observación debería permitir observar el posible papel de ClC-5 en la biogénesis de los exosomas. Finalmente, estos resultados permitirán estudiar los micro-ARN obtenidos de los exosomas urinarios para obtener posibles biomarcadores y dianas terapéuticas para la enfermedad de Dent.
Contribución de los autoresAM concibió y diseñó el proyecto. CB y MD llevaron a cabo la parte experimental. AM, CB y GCR analizaron e interpretaron los datos. AM preparó el borrador del artículo. CB, MD, CM, GCR, GA y AM participaron en la revisión y la redacción del manuscrito final.
FinanciaciónEste trabajo ha sido financiado principalmente por la fundación SENEFRO (SEN2019 a AM), por ASDENT y por subvenciones del Ministerio de Ciencia e Innovación (SAF201789989 a AM) y de la Red de Investigación Renal REDinREN (12/0021/0013). El Grupo de Fisiopatología Renal tiene la Mención de Calidad de la Generalitat de Cataluña (2017 SGR).
Conflicto de interesesLos autores no declaran ningún conflicto de intereses.
Agradecemos a la asociación de pacientes ASDENT (www.asdent.es) por su apoyo continuado; sin ellos, este proyecto no habría sido posible. Damos las gracias también a todos los miembros del Grupo de Fisiopatología Renal por las valiosas discusiones. Este trabajo refleja solamente el punto de vista de los autores.
MD fue contratada gracias a la generosa contribución de ASDENT y CB consiguió una beca del programa PhD4MD para médicos del VHIR y el CRG.