Se presentan dos casos en edad pediátrica diagnosticados de acidosis tubular renal (ATR) asociada a hipotiroidismo de causa autoinmune.
El caso 1 desarrolló un íleo intestinal a los 5 años de edad en el seno de un problema respiratorio. En los exámenes realizados se constató acidosis metabólica, hipercloremia, hipopotasemia y nefrocalcinosis. El caso 2 fue diagnosticado de hipotiroidismo a los 11 años de edad y 2 años después, de ATR.
En ambos pacientes, se comprobó el diagnóstico de ATR al observarse una pCO2 urinaria máxima reducida. En el caso 2 se constató, además, una fuga proximal de bicarbonato (ATR tipo 3), que constituye el primer caso publicado sobre el tema.
Se revisan las causas de ATR en pacientes con hipotiroidismo. El efecto deletéreo sobre el riñón puede ser debido a la propia ausencia de hormona tiroidea y/o a los autoanticuerpos en los casos de hipotiroidismo autoinmune.
Two cases of children diagnosed with renal tubular acidosis (RTA) associated with autoimmune hypothyroidism are presented.
Case 1 developed an intestinal ileus at the age of five in the context of a respiratory problem. The tests performed confirmed metabolic acidosis, hyperchloraemia, hypokalaemia and nephrocalcinosis. Case 2 was diagnosed with hypothyroidism at the age of 11, and with RTA two years later.
In both patients, the diagnosis of RTA was verified when decreased maximum urinary pCO2 was found. In case 2, a proximal bicarbonate leak (type 3 RTA) was also confirmed. This was the first case to be published on the topic.
The causes of RTA in patients with hypothyroidism are reviewed. The deleterious effect on the kidneys may be due to the absence of thyroid hormone and/or autoantibodies in the cases of autoimmune hypothyroidism.
La acidosis tubular renal (ATR) integra un grupo de trastornos que cursan con un defecto en algunos de los transportadores relacionados con la reabsorción de bicarbonato en el túbulo proximal (ATR proximal o tipo 2), con la excreción de iones hidrógeno (H+) en el túbulo colector (ATR tipos 1 y 4) o ambas (ATR tipo 3)1. Se caracterizan por la presencia de acidosis metabólica hiperclorémica persistente con un anión gap normal.
Las formas primarias son más frecuentes en lactantes y niños2. La ATR distal es la variante más frecuente. En los últimos años, las técnicas de biología molecular han permitido conocer las bases genéticas que originan un defecto en la excreción urinaria de H+ y amonio, en el caso de la ATR distal3. Ese defecto puede demostrarse tras el estímulo con alguna sustancia rica en H+ (ClNH4) o determinando la pCO2 urinaria (UpCO2) máxima4. Clínicamente, la ATR distal se caracteriza por la presencia de poliuria, polidipsia, nefrocalcinosis, hipopotasemia, orinas persistentemente alcalinas, hipercalciuria, hipocitraturia y defecto en la capacidad de concentración con tendencia a la deshidratación5.
Las formas secundarias de ATR distal, más comunes en adultos, están asociadas a la administración de medicamentos o tóxicos, o bien a enfermedades sistémicas o inmunológicas. En niños, las causas secundarias son más raras; se han descrito en casos de síndrome de Sjögren6 o de lupus eritematoso sistémico7 o tras la ingestión de algunos medicamentos.
Se han comunicado pocos pacientes con ATR distal asociada a hipotiroidismo clásico o a enfermedad tiroidea de causa autoinmune. En niños se han descrito muy pocos pacientes. Presentamos los casos de dos niñas con hipotiroidismo adquirido asociado a ATR distal secundaria. En uno de ellos, la asociación con ATR tipo 3 constituye la primera descripción de la literatura.
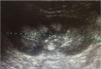
Caso 1Niña de 5 años y 7 meses de edad, con el antecedente de distensión abdominal desde los primeros meses de vida y detención de peso y talla desde los 2 años de edad (por debajo del percentil 3). Ingresa por fiebre de 39°C, rinorrea verdosa, tos productiva y dolor faríngeo de 3 días de duración, acompañados de dificultad respiratoria progresiva, polipnea y distensión abdominal. A su ingreso, se observaron datos de deshidratación severa, mucosas orales secas, taquicardia, signos de condensación pulmonar en el hemitórax derecho y abdomen distendido con peristalsis disminuida. En una radiografía de tórax se corroboró el diagnóstico de neumonía y en la de abdomen se observaron datos compatibles con un íleo de origen metabólico. En los exámenes de laboratorio, se constató acidosis metabólica, hipercloremia e hipopotasemia, que persistieron a pesar de restablecerse el estado de hidratación (tabla 1). En el estudio urinario se observó hipercalciuria e hipocitraturia (tabla 1) y, en el ultrasonido renal, una nefrocalcinosis de gradoII (fig. 1). Se realizó una prueba de acidificación urinaria con estímulo de acetazolamida y bicarbonato sódico, alcanzándose una pCO2 urinaria máxima de 47mmHg a los 60min (gradiente pCO2 orina-sangre: 15mmHg) (tabla 2). El estudio audiológico fue normal.
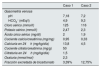
Exámenes bioquímicos sanguíneos y urinarios
| Caso 1 | Caso 2 | |
|---|---|---|
| Gasometría venosa | ||
| pH | 7,18 | 7,2 |
| HCO3− (mEq/l) | 4,9 | 9,3 |
| Cloro sérico (mmol/l) | 125 | 116 |
| Potasio sérico (mmol/l) | 2,47 | 2,3 |
| Ácido úrico sérico (mg/dl) | 2 | 1,9 |
| Cociente calcio/creatinina (mg/mg) | 0,95 | 0,33 |
| Calciuria en 24h (mg/kg/día) | 13,8 | 4,5 |
| Cociente citrato/creatinina (mg/g) | 50 | |
| Citraturia en 24h (mg/kg/día) | 1,5 | |
| Oxaluria (mmol/mol) | 2,3 | |
| Fracción excretada de bicarbonato | 3,39% | 12,75% |
Tras el diagnóstico de ATR distal se inició tratamiento con solución de citrato potásico (4mEq/kg/día), sin objetivarse mejoría del peso y la talla, al tiempo que persistía la astenia, la adinamia y la somnolencia. El estudio del perfil tiroideo mostró unos niveles de TSH de más de 150mU/l, de T3 de 0,19ng/ml y de T4 indetectables. Los anticuerpos antitiroglobulina (181,6UI/ml) y antiperoxidasa (373,2UI/ml) fueron positivos. Inició tratamiento con levotiroxina, mejorando peso y talla. Actualmente, con 11 años de edad, tiene un peso de 29kg (p8%) y una talla de 133cm (p6%), persistiendo con defecto de acidificación urinaria (pCO2 urinaria máxima de 49mmHg).
No se observó ninguna alteración molecular en los genes ATP6V0A4, ATP6V1B1 y SLC4A1 analizados por secuenciación directa de los exones y de las transiciones exón-intrón.
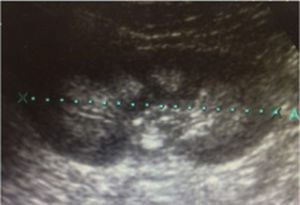
Caso 2Niña de 13 años de edad, sin antecedentes heredofamiliares de relevancia que exhibe detención de peso y talla desde los 7 años de edad. Desde entonces, ha tenido 4 episodios de parálisis de extremidades y flaccidez generalizada, con incapacidad para el sostén cefálico y mostrando genu valgo bilateral. A los 11 años se le diagnosticó hipotiroidismo, por lo que se inició tratamiento con levotiroxina. Posteriormente, fue remitida al hospital para completar estudio por hipopotasemia. Los exámenes bioquímicos sanguíneos y urinarios y los resultados de la prueba de acidificación se muestran en las tablas 1 y 2. Junto con el defecto de acidificación distal se observó una fuga proximal de bicarbonato compatible con ATR tipo 3 (tabla 1). La ecografía renal mostró una nefrocalcinosis gradoII bilateral. La valoración audiológica fue normal. Los anticuerpos antitiroglobulina (246,8UI/ml) y antiperoxidasa (92,6UI/ml) fueron positivos. Un año después del diagnóstico de ATR, la paciente requiere mayores dosis de citrato y persiste el defecto de acidificación urinaria (pCO2 urinaria máxima de 53mmHg). Ahora, con 14 años de edad, tiene un peso de 40kg (p5%) y una talla de 138cm (p0%).
DiscusiónLas hormonas tiroideas influyen en el desarrollo renal, la estructura del riñón, la hemodinámica renal, la tasa de filtración glomerular y la función de muchos transportadores, especialmente los relacionados con el manejo de sodio, el equilibrio ácido-base y la capacidad de concentración renal. Estos efectos de la hormona tiroidea son, por un lado, debidos a acciones renales directas y, por otro, a efectos hemodinámicos cardiovasculares y sistémicos que intervienen en la función renal8.
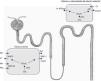
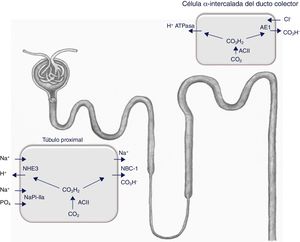
La hormona tiroidea influye directamente en la expresión y/o en la actividad de algunos canales iónicos y transportadores. Estudios pioneros de micropunción realizados en ratas hipotiroideas mostraron, además de la presencia de una reducción en el filtrado glomerular renal (FGR), un incremento en la excreción urinaria de sodio y agua9. Más tarde, se comunicó que la hormona tiroidea regula la actividad del intercambiador Na+/H+ (NHE3) del túbulo proximal10 (fig. 2); ese efecto es debido a la unión directa de la hormona con la región promotora del gen que lo codifica11.
La expresión del intercambiador Na+/H+ (NHE3), del cotransportador Na/fosfato NaPi-IIa y de la subunidad B2 de la H+-ATPasa vacuolar (no representada en la figura) se reduce en la membrana del borde en cepillo del túbulo proximal de las ratas hipotiroideas. Además, existe una reducción de la actividad del cotransportador tubular proximal Na+/HCO3− (NBCe1) y una mayor expresión del intercambiador Cl−/HCO3− (AE1) de las células α-intercaladas sitas en el túbulo conector y en el ducto colector cortical. En condiciones de acidosis, la expresión de NBCe1 aumenta en las ratas hipotiroideas y se incrementan el número de células α-intercaladas12. ACII: anhidrasa carbónicaII.
En 2007 se comprobó la actividad de varios transportadores involucrados en el equilibrio salino y ácido-base en ratas que se habían transformado en hipotiroideas mediante la administración de metimazol12. Los resultados obtenidos se resumen en el pie de la figura 2. Básicamente, se observó una reducción en la actividad de varios transportadores que actúan en el túbulo proximal, lo que se traduce en pérdida salina y en una reducción en la eliminación de hidrogeniones a ese nivel. En cambio, se constató una mayor expresión del intercambiador Cl−/HCO3− (AE1) que es funcional en las células α-intercaladas del túbulo conector y del ducto colector cortical12. Por tanto, el déficit de hormona tiroidea se asocia con un defecto en el manejo renal del sodio y del equilibrio ácido-base que está localizado principalmente en el túbulo proximal y que intenta compensar la nefrona distal. En consecuencia, en fisiología, la hormona tiroidea modula la respuesta renal a una sobrecarga ácida y altera la expresión de varios transportadores que son claves en el mantenimiento del equilibrio ácido-base.
Podríamos preguntarnos por qué razón no existe pérdida salina en los casos de hipotiroidismo si existe una importante pérdida salina proximal. La causa ha sido estudiada en ratones transgénicos deficientes en el intercambiador Na+/H+ (NHE3)13 y en adultos con mutaciones en el gen que lo codifica14. En estos casos, se ha comprobado un mecanismo compensador ante la pérdida de NHE3 que consiste en una reducción del FGR originado por vasoconstricción de la arteriola aferente vía adenosina. Esta es una de las razones por las que existe reducción del FGR en los pacientes hipotiroideos15,16.
En los años 70, se describió, en 5 adultos afectos de hipotiroidismo primario sin acidosis metabólica y sin evidencia clínica de padecer una enfermedad sistémica autoinmune, una incapacidad de descender adecuadamente el pH urinario tras una sobrecarga ácida17; este hecho es propio de una ATR distal incompleta. Posteriormente, se han descrito sendos casos de ATR tipo 1 en adultos con hipotiroidismo no inmune18,19. En uno de los pacientes existía hiperpotasemia (ATR tipo 4) compatible con un incremento de la concentración de Na+ en la luz tubular del ducto colector e imposibilidad secundaria para la secreción distal por defecto de gradiente de H+ y K+18.
No obstante, en la mayoría de los pacientes en quienes se incluían ambas condiciones clínicas, el hipotiroidismo fue de causa autoinmune. Esta circunstancia dual se ha descrito tanto en adultos20-22 como en niños23,24; en uno de estos casos de ATR, los niveles séricos de T3, T4 y TSH fueron normales22, lo que apoya el concepto de que los anticuerpos antitiroideos per se pueden tener un efecto negativo en la capacidad de acidificación renal, tal y como está descrito en otras enfermedades autoinmunes6,7. Existen varios casos en la literatura en los que se ha descrito la triple asociación de ATR, hipotiroidismo y otra enfermedad autoinmune como diabetes mellitus25 o síndrome de Sjögren26,27. El hecho de que a nuestra paciente del caso 2 se le diagnosticara ATR 2 años después de iniciarse el tratamiento con hormona tiroidea, constituye un argumento a favor del efecto deletéreo directo de los anticuerpos antitiroideos sobre la capacidad de acidificación renal, aunque no es descartable tampoco un posible defecto en el cumplimiento del tratamiento sustitutivo. El mecanismo fisiopatológico de la ATR distal en relación con la autoinmunidad no es bien conocido. En casos de síndrome de Sjögren se ha demostrado, en estudios inmunohistoquímicos, la ausencia de la H+-ATPasa vacuolar de las células del ducto colector obtenidas a partir de biopsias renales28. Más recientemente, en la misma enfermedad, se han descrito autoanticuerpos contra la enzima anhidrasa carbónicaII (fig. 2)29.
La prueba en la que se determinó la pCO2 urinaria máxima en nuestros 2 pacientes es una variante de la misma descrita por nuestro Grupo en la que se administran simultáneamente acetazolamida y bicarbonato sódico a unas dosis inferiores de las habituales, con lo que se consiguen pruebas válidas (HCO3− urinario >80mEq/l) sin efectos secundarios reseñables4,30,31.
La pérdida proximal de bicarbonato relatada en el caso 2 debe estar en relación con una reducción en la actividad tanto del intercambiador Na+/H+ (NHE3) como del cotransportador Na+/HCO3− (NBCe1), tal y como se ha descrito más arriba (fig. 2)12, aunque al tratarse de una ATR tipo 3 (proximal y distal) cabe la posibilidad teórica de que la paciente fuera portadora de autoanticuerpos contra la anhidrasa carbónicaII que es funcional en ambas porciones proximales y distales de la nefrona.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.