Analizar las asociaciones entre el nivel urinario de IL-6, EGF, MCP-1 y TGFβ1 y las características clínicas, bioquímicas y anatomopatológicas en enfermos con nefropatía IgA primaria y determinar su capacidad para realizar una estimación de la extensión de las lesiones de esclerosis glomerular e intersticial.
Pacientes y métodosSe estudió a 58 enfermos con nefropatía IgA. Se determinaron los niveles urinarios de IL-6, EGF, MCP-1 y TGFβ1 en el momento del diagnóstico. Tras realizar un análisis de la extensión de las lesiones renales mediante morfometría cuantitativa y mediante los criterios de Oxford, se analizó la capacidad de dichas moléculas para estimar la extensión de las lesiones glomerulares e intersticiales de fibrosis.
ResultadosLa IL-6, MCP-1 y TGF-β1 se asociaron a glomeruloesclerosis focal y a la extensión de la fibrosis intersticial, pero no a la presencia de proliferación mesangial, intracapilar o extracapilar. EGF presentó una asociación negativa con la fibrosis intersticial. Al categorizar a los enfermos según la clasificación de Oxford, los enfermos con scores T1 y T2 presentaron niveles significativamente superiores de IL-6, MCP-1 y TGFβ1, y niveles de EGF significativamente inferiores que los enfermos con T0. Tanto mediante regresión múltiple como mediante regresión logística, los niveles de MCP-1, IL-6 y EGF fueron predictores independientes de la superficie de fibrosis, tras ajustar por edad y FGe.
ConclusiónLa determinación de la concentración urinaria de IL-6, EGF y MCP-1 proporciona una información adicional que mejora de forma significativa la estimación de la superficie de fibrosis intersticial.
To analyse the associations between urinary levels of IL-6 EGF, MCP-1 and TGFβ1 and clinical, biochemical and histopathological characteristics in patients with primary IgA nephropathy and their ability to predict the extent of lesions of glomerular and/or interstitial sclerosis.
Patients and methodsA total of 58 patients with IgA nephropathy were studied. We determined the urine levels of IL-6, EGF, MCP-1, and TGFβ1 at the time of diagnosis. The extent of glomerular and interstitial fibrosis was analyzed by quantitative morphometry and kidney biopsies were classified according to the Oxford criteria. We analysed the ability of these molecules to predict the extent of glomerular and interstitial fibrosis lesions.
ResultsIL-6, TGFβ1 and MCP-1 were associated with focal glomerulosclerosis and interstitial fibrosis extension but not with the presence of mesangial, extracapillary or endocapillary proliferation. EGF showed a negative association with interstitial fibrosis. By categorising patients according to the Oxford classification, patients with T1 and T2 scores had significantly higher levels of IL-6, MCP-1, TGF-β1 and significantly lower levels of EGF than patients with T0 scores. By multiple regression and logistic regression analyses, the levels of MCP-1, IL-6 and EGF were independent predictors of the fibrosis surface, after adjusting for age and eGFR.
ConclusionThe urinary concentration of IL-6, EGF and MCP-1 provides additional information that significantly improves the estimation of the surface of interstitial fibrosis in patients with IgA nephropathy.
La nefropatía mesangial IgA es una de las nefropatías primarias más frecuentes y tiene un curso clínico muy variable que incluye desde formas indolentes hasta formas con insuficiencia renal rápidamente progresiva1–4. Aproximadamente un 20-25% de los enfermos presenta evolución a insuficiencia renal crónica a largo plazo. Los factores de mal pronóstico identificados hasta la fecha son la presencia de insuficiencia renal, proteinuria persistentemente superior a 1 g/día, la hipertensión arterial y los depósitos mesangiales de C4d5. La extensión de las lesiones glomerulares e intersticiales tiene valor pronóstico en enfermos no tratados, pero no en enfermos que han recibido tratamiento con glucocorticoides u otros inmunomoduladores6. En la actualidad, se acepta que, tras el depósito mesangial de IgA, la lesión renal se inicia a través de la activación del complemento por la vía alternativa, por la vía de las lectinas o por ambas7. Este proceso resulta en la generación de diversas citocinas y factores de crecimiento que actúan como mediadores del daño renal, estimulando la proliferación celular y el aumento en la producción de la matriz mesangial7,8. Hay también datos que indican que las citocinas producidas por la célula mesangial pueden inducir alteraciones en la estructura y función de los podocitos y de las células del túbulo proximal, que se relacionan con la aparición de lesiones de glomeruloesclerosis y de fibrosis intersticial9–11. De las diferentes moléculas potencialmente implicadas, la interleucina-6 (IL-6)12–15, el factor de crecimiento epidérmico (EGF)16–18, la proteína quimioatractante de monocitos de tipo 1 (MCP-1)19–23 y el factor de crecimiento transformante β1 (TGFβ1)24 han sido objeto de estudios detallados. Los datos disponibles demuestran una correlación significativa entre la excreción urinaria y la expresión renal de IL-615 y de EGF15 y de una correlación significativa entre los niveles urinarios de IL-615,16, EGF15,17,18, MCP-122,23 y TGFβ124 y la extensión de las lesiones de fibrosis intersticial y atrofia tubular. Estos datos señalan que el nivel urinario de estas citocinas y factores de crecimiento podría proporcionar información funcional sobre la patogenia de la lesión renal o ser biomarcadores indirectos de la extensión de la fibrosis glomerular e intersticial.
Tres estudios independientes han demostrado que la medición de la excreción urinaria de algunas de estas moléculas podría tener valor pronóstico en la nefropatía IgA15,17,18. En concreto, se ha descrito que el cociente IL-6/EGF15 podría ser un indicador de la progresión hacia la fibrosis renal y que la relación MCP-1/EGF identificaría, en el momento del diagnóstico, a los pacientes con mayor riesgo de progresión a la insuficiencia crónica renal, con independencia de la función renal y de la proteinuria inicial17,18. Por otra parte, el potencial valor pronóstico de la excreción urinaria de EGF también se ha puesto de manifiesto en un reciente estudio que la identificó como predictor de progresión independiente en 3cohortes de enfermos con enfermedades glomerulares25. Estos datos indican que la medición de la excreción urinaria de uno o varios de estos biomarcadores podría tener utilidad en la práctica clínica. Sin embargo, hasta la fecha, no se ha realizado ningún estudio comparativo para analizar cuál de ellos es el que se correlaciona mejor con las lesiones de fibrosis renal.
El objetivo del presente estudio fue analizar las asociaciones entre el nivel urinario de IL-6, EGF, MCP-1 y TGFβ1 y las características clínicas, bioquímicas y anatomopatológicas en enfermos con nefropatía IgA primaria, y cuáles de estas moléculas permiten una estimación más precisa de la extensión de las lesiones de fibrosis glomerular o intersticial.
Pacientes y métodosSe estudió un total de 58 pacientes con nefropatía IgA idiopática diagnosticada por biopsia renal. En el momento de la biopsia renal y antes de iniciar cualquier tratamiento, se registraron las variables demográficas y clínicas, se realizaron determinaciones de creatinina sérica, filtrado glomerular estimado (FGe) mediante la ecuación CKD-EPI26, excreción urinaria de sodio y cociente proteinuria/creatinina y se obtuvieron muestras de orina de la segunda micción de la mañana para medir los niveles de IL-6, EGF, MCP-1 y TGFβ1. En las muestras de orina, se descartó la presencia de piuria mediante estudio del sedimento urinario. Las muestras de orina se centrifugaron a 1.500g durante 10 min y se almacenaron a −80°C hasta su procesamiento.
En el momento de obtener las muestras de orina, ningún paciente recibía tratamiento con bloqueadores de los receptores de la angiotensina II, inhibidores de la ECA, combinaciones de ambos ni con antagonistas de la aldosterona. Ningún paciente fue tratado con esteroides ni otros medicamentos inmunosupresores y ningún paciente recibió paricalcitol. La adecuación de la colección de 24h se evaluó mediante la comparación de la creatinina total en la muestra con la creatinina predicha: 28- (0,2×edad)×kg en hombres y 23,8- (0,17×edad)×kg en mujeres en mg/día27. Los valores de creatinina se obtuvieron utilizando un compensado IDMS trazable (Hitachi Modular P-800 Roche Diagnostics, Berlín, Alemania).
Los niveles de a EGF, IL-6, MCP-1 y TGFβ1 en orina se midieron mediante análisis ELISA comerciales (Quantikine R & D Systems, Minneapolis, EE. UU.) siguiendo las instrucciones del fabricante. Para medir el TGFβ1 total (latente+activo), las muestras de orina se diluyeron con 4volúmenes de solución salina tamponada con fosfato y se añadió HCl hasta obtener un pH de 2,5 a 2,0. Después de 30min a temperatura ambiente, el pH se reajustó a 7,4 con NaOH28. Todos los análisis se realizaron por duplicado y fueron calibrados con estándares purificados y sueros de referencia de los fabricantes. La precisión intraanálisis se calculó realizando 10 determinaciones en la misma placa de 3 muestras con concentraciones conocidas y fueron <5% para todas las moléculas, tanto a baja como a alta concentración. La precisión interanálisis se estudió con 10 determinaciones en distintas placas de 3 muestras con concentraciones conocidas, que fueron <6,8% para todas las moléculas, tanto a bajas como a altas concentraciones. Las concentraciones urinarias se ajustaron por concentración de creatinina y se expresaron en pg/mg creatinina (IL-6) o ng/mg de creatinina (EGF, MCP-1 y TGFß1).
El estudio se realizó siguiendo las normas de Helsinki, fue aprobado por el Comité de Ética del hospital y todos los pacientes firmaron un consentimiento informado.
Estudio anatomopatológico de las biopsias renalesEl tejido renal se fijó en parafina, y se realizaron cortes de 4μm, que se tiñeron con hematoxilina-eosina, tricrómico de Masson, ácido periódico de Schiff y metenamina de Jones. Los estudios de inmunofluorescencia se realizaron en muestras de tejido congeladas, utilizando anticuerpos contra las inmunoglobulinas A, G y M, fibrinógeno y C3.
En las biopsias renales, se contabilizó la proporción de glomérulos con lesiones de proliferación mesangial y esclerosis segmentaria, la presencia de proliferación intra- y extracapilar y la extensión de la fibrosis intersticial mediante morfometría cuantitativa, utilizando un autoanalizador Olympus WCE2. Las biopsias renales fueron, además, clasificadas siguiendo el documento de consenso internacional de Oxford 200929.
Análisis estadísticoLa comparación de 2medias se realizó mediante la t de Student para datos independientes. La comparación de proporciones se realizó mediante la prueba de chi cuadrado o el test exacto de Fischer. Para el análisis de correlaciones entre variables cuantitativas se utilizó el coeficiente de correlación de Pearson. Con objeto de analizar la relación entre cada una de las moléculas estudiadas y la extensión de las lesiones de la fibrosis glomerular e intersticial, se realizó un análisis univariado, seguido de un análisis de regresión múltiple paso a paso, tomando la superficie de fibrosis como variable dependiente tras transformación logarítmica y tras comprobar de la normalidad de su distribución. Asimismo, se clasificó a los pacientes en 2grupos en función de la presencia (T1+T2) o la ausencia (T0) de lesiones de fibrosis intersticial en la clasificación de Oxford y, tras un análisis univariado de selección de variables, se realizó un análisis de regresión logística paso a paso, con un método de introducción manual, basado en el cambio de –LR, para identificar las variables independientemente asociadas a la presencia de fibrosis intersticial. La calibración del modelo por categorías de riesgo se realizó mediante la prueba de Hosmer-Lemeshow30. En todos los casos se consideró estadísticamente significativo un valor de p<0,05. Para el análisis estadístico se utilizó el programa SPSS versión 20.0.
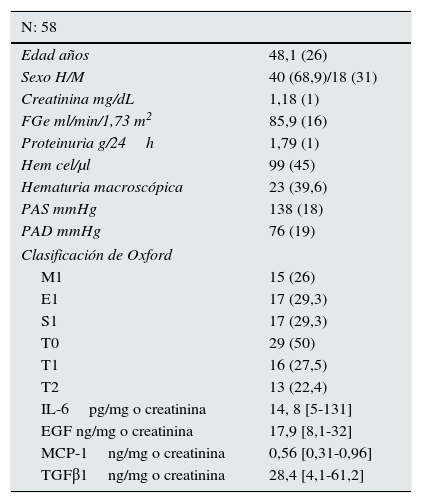
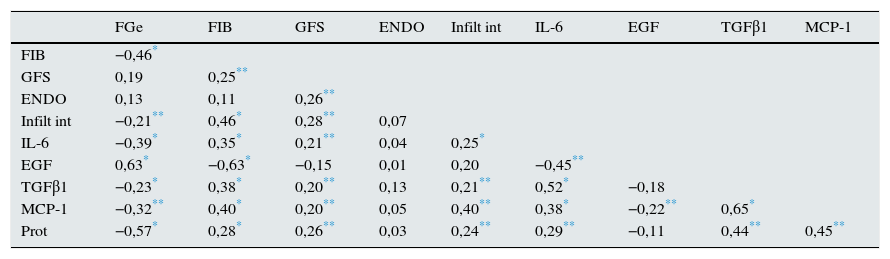
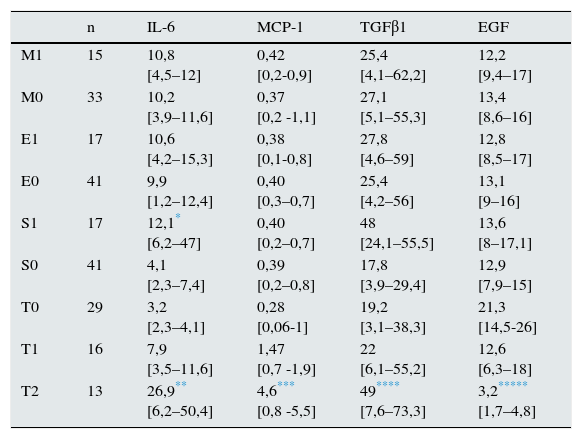
ResultadosEn la tabla 1 se resumen las características clínicas y anatomopatológicas de la muestra de enfermos incluida en el estudio. En la tabla 2 se resume la matriz de correlaciones entre las variables analizadas en el estudio. En lo que respecta a la relación con las variables histológicas, se apreció una asociación estadísticamente significativa entre los niveles de IL-6, MCP-1 y TGFβ1 y la extensión de la glomeruloesclerosis focal, pero no con la presencia de proliferación intra- o extracapilar. Asimismo, se apreció una correlación positiva entre la extensión de las lesiones de fibrosis intersticial y el nivel urinario de IL-6, MCP-1 y TGFβ1 y negativa entre las lesiones de fibrosis intersticial y el nivel urinario de EGF. Al categorizar a los enfermos según la clasificación de Oxford (tabla 3), no se apreciaron diferencias significativas en ninguna de las moléculas estudiadas en función de los criterios M, E o S. Los enfermos con scores de fibrosis intersticial T1 y T2 presentaron niveles significativamente superiores de IL-6, MCP-1 y TGFβ1, y niveles de EGF significativamente inferiores que los enfermos T0, pero no se apreciaron diferencias significativas entre T1 y T2. Se apreció una correlación significativa entre niveles urinarios de IL-6, MCP-1, TGFβ1 y proteinuria. Los niveles de EGF solo tuvieron asociación con el grado de esclerosis intersticial y con el filtrado glomerular.
Características clínicas, bioquímicas y anatomopatológicas de la muestra de enfermos estudiada
| N: 58 | |
|---|---|
| Edad años | 48,1 (26) |
| Sexo H/M | 40 (68,9)/18 (31) |
| Creatinina mg/dL | 1,18 (1) |
| FGe ml/min/1,73 m2 | 85,9 (16) |
| Proteinuria g/24h | 1,79 (1) |
| Hem cel/μl | 99 (45) |
| Hematuria macroscópica | 23 (39,6) |
| PAS mmHg | 138 (18) |
| PAD mmHg | 76 (19) |
| Clasificación de Oxford | |
| M1 | 15 (26) |
| E1 | 17 (29,3) |
| S1 | 17 (29,3) |
| T0 | 29 (50) |
| T1 | 16 (27,5) |
| T2 | 13 (22,4) |
| IL-6pg/mg o creatinina | 14, 8 [5-131] |
| EGF ng/mg o creatinina | 17,9 [8,1-32] |
| MCP-1ng/mg o creatinina | 0,56 [0,31-0,96] |
| TGFβ1ng/mg o creatinina | 28,4 [4,1-61,2] |
EGF: factor de crecimiento epitelial; IL-6: interleucina 6; MCP-1: proteína quimioatractante de monocitos de tipo 1; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TGFβ1: factor de crecimiento transformante β1.
Los datos cualitativos se expresan como frecuencia absoluta (porcentaje). Los datos cuantitativos representan la media±DE o la mediana y [P25-P75].
Matriz de correlaciones entre variables
| FGe | FIB | GFS | ENDO | Infilt int | IL-6 | EGF | TGFβ1 | MCP-1 | |
|---|---|---|---|---|---|---|---|---|---|
| FIB | −0,46* | ||||||||
| GFS | 0,19 | 0,25** | |||||||
| ENDO | 0,13 | 0,11 | 0,26** | ||||||
| Infilt int | −0,21** | 0,46* | 0,28** | 0,07 | |||||
| IL-6 | −0,39* | 0,35* | 0,21** | 0,04 | 0,25* | ||||
| EGF | 0,63* | −0,63* | −0,15 | 0,01 | 0,20 | −0,45** | |||
| TGFβ1 | −0,23* | 0,38* | 0,20** | 0,13 | 0,21** | 0,52* | −0,18 | ||
| MCP-1 | −0,32** | 0,40* | 0,20** | 0,05 | 0,40** | 0,38* | −0,22** | 0,65* | |
| Prot | −0,57* | 0,28* | 0,26** | 0,03 | 0,24** | 0,29** | −0,11 | 0,44** | 0,45** |
EGF: factor de crecimiento epitelial; ENDO: porcentaje de glomérulos con proliferación intracapilar; EXTRA: porcentaje de glomérulos con proliferación extracapilar; FGe: filtrado glomerular estimado por CKD- EPI; FIB: superficie total de fibrosis intersticial; GFS: porcentaje de glomérulos con esclerosis segmentaria; IL-6: interleucina 6; Int Infilt: superficie total de infiltrado intersticial; MCP-1: proteína quimioatractante de monocitos de tipo 1; Prot: proteinuria de 24 h; TGFβ1: factor de crecimiento transformante β1.
Niveles urinarios de IL-6, MCP-1, TGFβ1 y EGF en los enfermos, clasificados según los criterios de Oxford
| n | IL-6 | MCP-1 | TGFβ1 | EGF | |
|---|---|---|---|---|---|
| M1 | 15 | 10,8 [4,5–12] | 0,42 [0,2-0,9] | 25,4 [4,1–62,2] | 12,2 [9,4–17] |
| M0 | 33 | 10,2 [3,9–11,6] | 0,37 [0,2 -1,1] | 27,1 [5,1–55,3] | 13,4 [8,6–16] |
| E1 | 17 | 10,6 [4,2–15,3] | 0,38 [0,1-0,8] | 27,8 [4,6–59] | 12,8 [8,5–17] |
| E0 | 41 | 9,9 [1,2–12,4] | 0,40 [0,3–0,7] | 25,4 [4,2–56] | 13,1 [9–16] |
| S1 | 17 | 12,1* [6,2–47] | 0,40 [0,2–0,7] | 48 [24,1–55,5] | 13,6 [8–17,1] |
| S0 | 41 | 4,1 [2,3–7,4] | 0,39 [0,2–0,8] | 17,8 [3,9–29,4] | 12,9 [7,9–15] |
| T0 | 29 | 3,2 [2,3–4,1] | 0,28 [0,06-1] | 19,2 [3,1–38,3] | 21,3 [14,5-26] |
| T1 | 16 | 7,9 [3,5–11,6] | 1,47 [0,7 -1,9] | 22 [6,1–55,2] | 12,6 [6,3–18] |
| T2 | 13 | 26,9** [6,2–50,4] | 4,6*** [0,8 -5,5] | 49**** [7,6–73,3] | 3,2***** [1,7–4,8] |
Los valores representan medianas y [P25-P75].
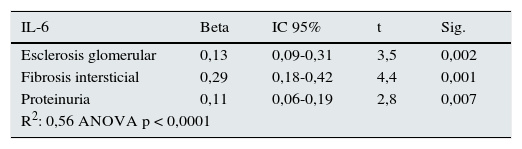
En la tabla 4 se resumen los predictores independientes de la excreción urinaria de cada una de las moléculas estudiadas en los análisis de regresión múltiple y el porcentaje de la variabilidad de cada una de ellas explicada por el conjunto de variables independientes. En todos los casos se aprecian asociaciones independientes y significativas con la superficie de fibrosis intersticial. En el caso de la IL-6 y del TGFβ1, se aprecian también asociaciones significativas con la esclerosis glomerular y, en el de la IL-6 y MCP-1, con la proteinuria.
Predictores independientes de los concentraciones de IL-6, MCP-1, TGFβ1 y EGF en orina en los modelos de regresión múltiple
| IL-6 | Beta | IC 95% | t | Sig. |
|---|---|---|---|---|
| Esclerosis glomerular | 0,13 | 0,09-0,31 | 3,5 | 0,002 |
| Fibrosis intersticial | 0,29 | 0,18-0,42 | 4,4 | 0,001 |
| Proteinuria | 0,11 | 0,06-0,19 | 2,8 | 0,007 |
| R2: 0,56 ANOVA p < 0,0001 | ||||
| MCP-1 | Beta | IC 95% | t | Sig. |
|---|---|---|---|---|
| Esclerosis glomerular | 0,41 | 0,22-0,53 | 8,9 | 0,000 |
| Fibrosis intersticial | 0,39 | 0,10-0,75 | 3,9 | 0,002 |
| Infiltrado intersticial | 0,20 | 0,13-0,39 | 2,5 | 0,021 |
| Proteinuria | 0,16 | 0,81-0,22 | 3,7 | 0,035 |
| R2: 0,49 ANOVA p: 0,026 | ||||
| fTGFβ1 | Beta | IC 95% | t | Sig. |
|---|---|---|---|---|
| Esclerosis glomerular | 0,20 | 0,13-0,29 | 3,4 | 0,004 |
| Fibrosis intersticial | 0,18 | 0,05-0,27 | 1,8 | 0,041 |
| R2: 0,47 ANOVA p: 0,035 | ||||
| EGF | Beta | IC 95% | t | Sig. |
|---|---|---|---|---|
| Fibrosis intersticial | 0,25 | 0,16-0,31 | 17,7 | 0,000 |
| R2: 0,39 ANOVA p: 0,008 | ||||
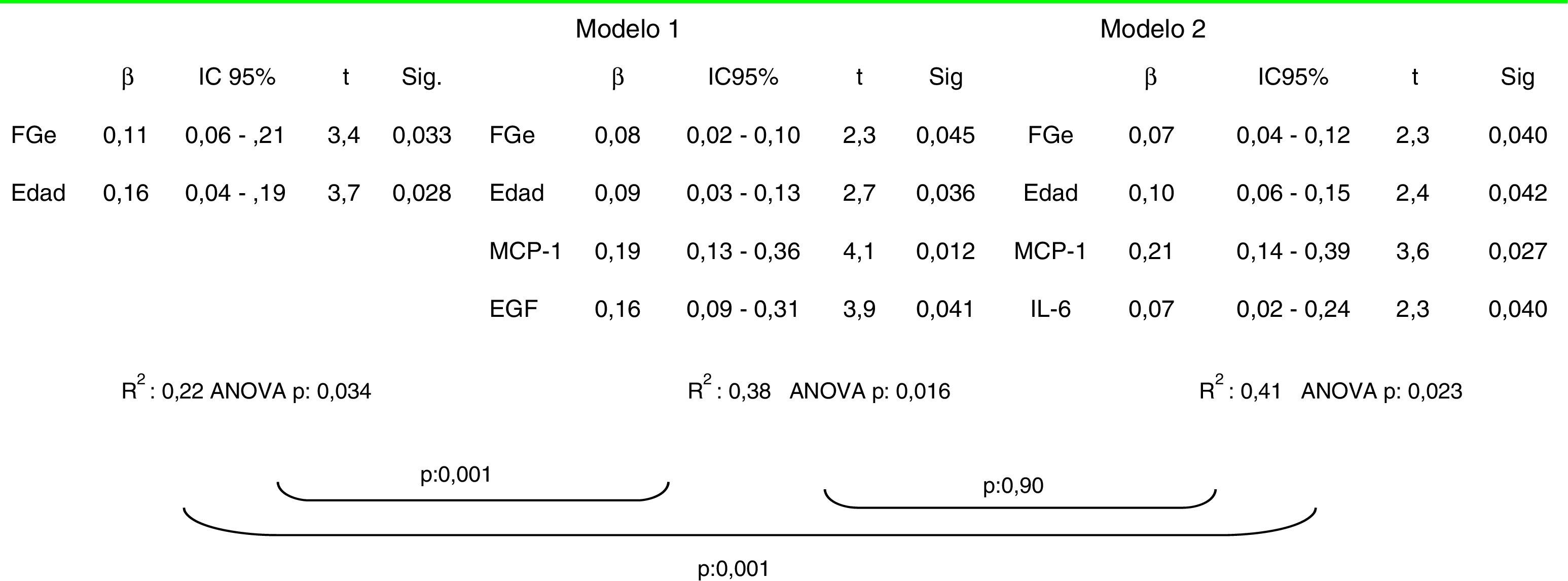
En los análisis de regresión múltiple para predecir la extensión de las lesiones de fibrosis intersticial, la mayor capacidad predictiva se apreció con los modelos que incluyeron la edad, el FGe, la MCP-1 y, o bien la el EGF o bien la IL-6, pero no ambos a la vez, ya que entre ellos se detectó colinealidad (tabla 5).
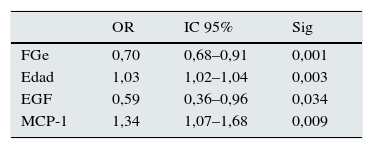
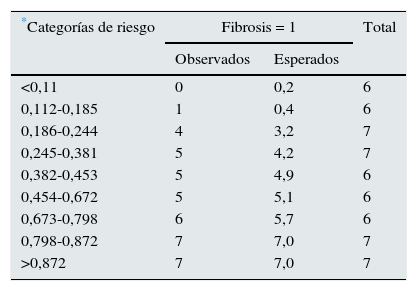
Al clasificar a los enfermos en 2categorías en función de la presencia (T1+T2) o ausencia (T0) de fibrosis en las biopsias según la clasificación de Oxford, en el análisis de regresión logística se apreció que los predictores independientes de fibrosis fueron la edad, el FGe, la MCP-1 y el EGF (tabla 6). El modelo tuvo una buena capacidad predictiva con un área bajo la curva de 0,87±0,07 (p: 0,0001) y una buena calibración para todas las categorías de riesgo (tabla 7). Los niveles de TGFβ1, además de asociarse con la esclerosis glomerular y con la fibrosis intersticial, tuvieron una asociación muy significativa con los de IL-6 y MCP-1. La introducción del nivel de TGFβ1 en los modelos, manteniendo MCP-1 e IL-6, causó colinealidad y, al introducir el nivel de TGFβ1 en lugar del de MCP-1 o el de IL-6, en los modelos tanto el de regresión múltiple como el de regresión logística perdieron capacidad predictiva de forma significativa.
Modelo de regresión logística para estimar la probabilidad de presentar fibrosis grado T1-T2 de Oxford en la biopsia renal
| OR | IC 95% | Sig | |
|---|---|---|---|
| FGe | 0,70 | 0,68–0,91 | 0,001 |
| Edad | 1,03 | 1,02–1,04 | 0,003 |
| EGF | 0,59 | 0,36–0,96 | 0,034 |
| MCP-1 | 1,34 | 1,07–1,68 | 0,009 |
Edad (por año). ABC: 0,87±0,07.
P: 0,0001.
EGF: epidermal growth factor (por cada aumento en 1ng/mg de creatinina); FGe: filtrado glomerular estimado mediante la ecuación CKD-EPI (por cada aumento de 1ml/min/1,73 m2); MCP-1: proteína quimiotractante de monocitos de tipo 1 (por cada aumento en 1ng/mg de creatinina).
Calibración del modelo logístico por categorías de riesgo, mediante la prueba de Hosmer-Lemeshow
| *Categorías de riesgo | Fibrosis = 1 | Total | |
|---|---|---|---|
| Observados | Esperados | ||
| <0,11 | 0 | 0,2 | 6 |
| 0,112-0,185 | 1 | 0,4 | 6 |
| 0,186-0,244 | 4 | 3,2 | 7 |
| 0,245-0,381 | 5 | 4,2 | 7 |
| 0,382-0,453 | 5 | 4,9 | 6 |
| 0,454-0,672 | 5 | 5,1 | 6 |
| 0,673-0,798 | 6 | 5,7 | 6 |
| 0,798-0,872 | 7 | 7,0 | 7 |
| >0,872 | 7 | 7,0 | 7 |
No se apreciaron diferencias significativas entre el número de enfermos con lesiones de fibrosis intersticial observados y esperados por el modelo en ninguna de las categorías de riesgo.
Fibrosis=1: presencia de fibrosis de grado T1 o T2.
Chi2: 6,98; p: 0,90.
Los resultados de nuestro estudio indican que, en enfermos con nefropatía IgA, el nivel urinario de IL-6, EGF, MCP-1 y TFGβ1 se correlaciona de forma significativa con el grado de esclerosis glomerular e intersticial observado en las biopsias renales, pero no con las lesiones proliferativas intra- o extracapilares ni con el grado de proliferación mesangial. Los niveles de dichas moléculas no permitieron diferenciar entre subgrupos de la clasificación de Oxford en cuanto al grado de proliferación mesangial, proliferación intracapilar o esclerosis focal, pero fueron significativamente distintos en los enfermos con estadios de fibrosis T1 y T2 con relación a T0. En los modelos multivariados, el mejor predictor de la superficie de fibrosis intersticial fue el filtrado glomerular, pero los modelos que incluyeron FGe, edad, MCP-1 y EGF o IL-6 tuvieron capacidad predictiva significativamente superior, por lo que aportan una información adicional y más precisa sobre la superficie de fibrosis intersticial. Por otra parte, en los modelos de regresión logística, estas mismas variables tuvieron capacidad para identificar a los enfermos que presentaron niveles de fibrosis T1-T2 en las biopsias, con alto poder predictivo y con buena discriminación para cualquier categoría de riesgo. En conjunto, estos datos indican que la información que proporciona la medición de la excreción del nivel urinario de IL-6, MCP-1 y EGF permite la estimación de la superficie de fibrosis de forma más precisa que el filtrado glomerular de forma aislada y, en consecuencia, pueden aportar datos relevantes en la práctica clínica. Estudios previos, combinando técnicas de hibridación in situ e inmunohistoquimia, han demostrado que, en la nefropatía IgA, la síntesis de IL-6 está incrementada tanto en las células mesangiales como en las células del túbulo proximal y de las células del infiltrado intersticial13–15. El aumento en la expresión de IL-6 se ha correlacionado con la extensión de la fibrosis glomerular y con la de la fibrosis intersticial, con o sin lesión proliferativa mesangial13–15. Los niveles de IL-6 urinarios observados en nuestros enfermos y su correlación con las lesiones de fibrosis intersticial concuerdan con los datos previamente publicados12–15 y, por tanto, corroboran la idea de que su determinación podría ser útil como indicador de la severidad de las lesiones renales. MCP-1ha sido identificada como una de las moléculas directamente implicadas en el reclutamiento de células inflamatorias al intersticio renal tanto en modelos experimentales como en diversas enfermedades glomerulares, incluyendo la nefropatía IgA20,22. En nuestros enfermos, MCP-1 se correlaciona con el filtrado glomerular y con la extensión de la fibrosis e infiltrado intersticial y, en menor grado, con la proteinuria, lo que coincide con los datos descritos en estudios previos19–23. El TFGβ1 es considerado como uno de los moduladores claves en la reparación tras la lesión. Sin embargo, un exceso de producción se ha asociado a depósito de colágeno y cicatrización31,32. En diversas glomerulopatías crónicas, se ha demostrado que la expresión renal de TFGβ1 se encuentra incrementada y que los niveles urinarios de TFGβ1 reflejan su producción local a nivel renal24,31. Los datos de nuestros enfermos coinciden con los previamente publicados en la nefropatía IgA, en hallar una correlación entre los niveles urinarios de de TFGβ1 y en la severidad de las lesiones de esclerosis glomerular e intersticial. En los enfermos estudiados, los niveles de IL-6, MCP-1 y TFGβ1, además de estar correlacionados con la fibrosis glomerular e intersticial, están altamente correlacionados entre sí, lo que indica que probablemente reflejan aspectos de un proceso patogénico común. La elevada correlación entre el nivel de TFGβ1 y el de MCP-1 motiva que, en los modelos predictivos, la introducción de ambas variables resulte en colinealidad y, por ello, no sea posible introducir más que una de ellas. Los diferentes modelos analizados tienen mayor poder predictivo y mejor calibración al introducir el nivel de MCP-1 que el de TFGβ1. El EGF está considerado como un factor trófico para las células tubulares renales33,34. Diversos estudios indican que su excreción urinaria se halla reducida en presencia de lesiones tubulares crónicas que implican reducción del número de células tubulares17,18 y recientemente se ha identificado como un predictor pronóstico independiente en enfermos con diversas glomerulopatías25. En nuestros enfermos, los niveles urinarios de EGF se correlacionaron con el filtrado glomerular y con la extensión de las lesiones de fibrosis intersticial y atrofia tubular, lo que concuerda con la evidencia previa e indica que podrían también ser un estimador indirecto de la extensión de las lesiones de fibrosis intersticial y de atrofia tubular. Nuestros datos, además, indican que la mejora en la predicción de la superficie de fibrosis puede también obtenerse mediante la determinación de la excreción de MCP-1 o de IL-6. Los niveles de MCP-1 contribuyen de forma significativa ya que, en los modelos multivariados, tras ajustar por edad y filtrado glomerular, o bien complementan la información que proporciona el nivel de EGF, o bien aparecen como predictor independiente, en asociación con IL-6, sin tener en cuenta los valores de EGF.
Los datos de nuestro estudio tienen la limitación de carecer de estudios preanalíticos que permitan definir con exactitud el tipo de muestras y la metodología más adecuada para su procesamiento, de haber utilizado una única técnica de medición y de no haber sido validados de forma independiente en otras cohortes de enfermos. Por ello, los modelos predictivos descritos solo pueden considerarse válidos para las condiciones en las que se han realizado las mediciones y para el grupo de enfermos estudiado. Hacer extensivos estos resultados a otros grupos de enfermos con nefropatía IgA requeriría previamente estandarizar los aspectos técnicos relacionados con las mediciones y analizar, de forma independiente, su reproductibilidad.
En resumen, nuestros datos indican que en la nefropatía IgA, la concentración urinaria de IL-6, EGF, MCP-1 y TFGβ1 no permite estimar adecuadamente la extensión de las lesiones de proliferación mesangial, intracapilar o extracapilar ni el grado de esclerosis glomerular, pero proporciona una información adicional, no invasiva, que complementa la que aporta el filtrado glomerular, tras ajustar por la edad, y mejora de forma significativa la estimación de la superficie de fibrosis intersticial. Entre los biomarcadores estudiados, la combinación de EGF y MCP-1 o de IL-6 y MCP-1 tiene un valor predictivo similar sobre la superficie de fibrosis y parecen las más adecuadas para realizar estudios en la práctica clínica.
FinanciaciónEl presente estudio ha sido financiado mediante una ayuda del Fondo de Investigaciones Sanitarias FISS n.° de expediente: PI14/01831.
Conflicto de interesesNinguno de los autores declara tener conflictos de interés.