En los pacientes con enfermedad renal crónica que desarrollan hiperparatiroidismo secundario (HPTS), las técnicas de imagen pueden ser de utilidad, fundamentalmente para valorar la localización, el tamaño y el funcionalismo de las glándulas paratiroides. Esta revisión valora las técnicas de imagen de las que se dispone actualmente para evaluar las glándulas paratiroides en el contexto del HPTS. Se hace referencia a: 1) ecografía cervical (modo B, Doppler, Doppler-color y power-Doppler); 2) estudios gammagráficos (talio, 99mTc-MIBI y 99mTc-tetrofosmin), incluyendo técnicas especiales de adquisición de imágenes (Pinhole, SPECT); 3) estudios PET (tomografía por emisión de positrones); 4) tomografía computarizada (TC) y resonancia magnética, y 5) escáneres híbridos (SPECT/TC y PET/TC). Nuestra recomendación es practicar, en todos los pacientes con HPTS que no responden inicial y fácilmente al tratamiento médico, una gammagrafía con 99mTc-MIBI que puede complementarse con un Eco-Doppler color. Si la gammagrafía es positiva y, tras gradación de la intensidad de captación, alguna de las glándulas (no ectópicas) presenta un índice intenso, aunque se puede intentar intensificar el tratamiento, debería pensarse en la realización de una paratiroidectomía. Si la gammagrafía es positiva y, tras gradación de la intensidad de captación, ninguna de las glándulas (no ectópicas) presenta un índice intenso, debería intentarse la intensificación del tratamiento, y si no existe buena respuesta, considerar la paratiroidectomía. Si la gammagrafía es negativa, debería practicarse un PET si se dispone de dicha prueba. En caso de no disponer de PET, lo aconsejable sería realizar una resonancia magnética.
For patients with chronic renal failure who develop secondary hyperparathyroidism (SHPT), imaging techniques can be useful, especially to evaluate the location, size and functional status of parathyroid glands. This review analyzes all available imaging procedures in the context of SHPT. We evaluate: 1) Cervical ultrasound (B-mode, Doppler, colour-Doppler and power-Doppler), 2) Scintigraphic studies (Tallium, 99mTc-MIBI and 99mTc-tetrofosmin), including non-standard image acquisition techniques (Pinhole, SPECT), 3) Positron emission tomography (PET), 4) Computed tomography (CT) and magnetic resonance imaging (MRI) and 5) hybrid scanners (SPECT/CT and PET/CT). Our recommendation is that SHPT patients who are initially non responders to medical therapy should be investigated using parathyroid scintigraphy and cervical ultrasound. 99mTc-MIBI uptake can be graded in a semiquantitative scale. Intense uptake indicates a low probability of success using medical treatment and parathyroidectomy should be considered. A moderate to faint uptake indicates that a more intensive medical therapy would probably be beneficial. In the case of no uptake of 99mTc-MIBI, PET should be performed. Where this is not available, MRI could be a possible alternative.
INTRODUCCIÓN
En los pacientes con enfermedad renal crónica, que desarrollan hiperparatiroidismo secundario (HPTS), las técnicas de imagen nos pueden ser útiles, fundamentalmente para valorar su localización, su tamaño y su funcionalismo.
La embriología de las glándulas paratiroides es compleja y su conocimiento, así como el de las posibles localizaciones anatómicas de las glándulas, pueden ser de utilidad en la evaluación de las técnicas de imagen.
El 85% de los individuos poseen 4 glándulas paratiroides, dos superiores y dos inferiores, que suelen estar localizadas por detrás del tercio medio-superior y del polo inferior, respectivamente, de cada uno de los dos lóbulos tiroideos1. Entre el 1 y el 7% de los individuos tienen sólo 3 glándulas paratiroides, y entre un 3 y un 13% presentan paratiroides supernumerarias. En este último caso, las glándulas suelen ser de localización ectópica.
Esta variabilidad en cuanto al número y localización se debe a su diferente desarrollo embriológico. Las paratiroides superiores se originan de la cuarta bolsa faríngea del tiroides, y necesitan poco desplazamiento para colocarse en su situación definitiva, mientras que las glándulas inferiores se originan a partir de la tercera bolsa faríngea y migran caudalmente. Debido a esta mayor migración embrionaria, las paratiroides inferiores pueden localizarse en situación ectópica con mayor frecuencia que las paratiroides superiores.
El tamaño medio de las glándulas paratiroides es de 2-7 mm de longitud, 2-4 mm de anchura y 0,5-2 mm de altura.
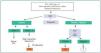
En cuanto a las técnicas de imagen de que disponemos para evaluar las glándulas paratiroides en pacientes con HPTS, se encuentran las que se exponen a continuación (figura 1).
ECOGRAFÍA CERVICAL
La ecografía cervical fue la primera prueba de imagen que se empleó para el estudio de paratiroides y sigue siendo una prueba recomendada, sobre todo porque se trata de una alternativa económica e inocua, aunque presenta la desventaja de ser un método diagnóstico dependiente del operador y, por tanto, con una dispar sensibilidad.
Para el estudio de las glándulas paratiroides se utilizan transductores lineales multifrecuencia (7,5-12 MHz) Doppler color, aunque en pacientes obesos o que presentan un bocio multinodular se emplean transductores de frecuencias inferiores (5-7,5 MHz).
Técnica de exploración
El estudio debe realizarse con el cuello del paciente colocado con una ligera hiperextensión. Cada lado del cuello se explora en secciones longitudinales y transversales, en antero-posterior y también con la cabeza rotada 45º hacia el lado contralateral.
La glándula tiroides se utiliza como referente anatómico, debido a que la mayoría de las glándulas paratiroides patológicas se van a encontrar por detrás, laterales o en localización inferior al tiroides. Otros referentes anatómicos son el músculo largo del cuello, el paquete neurovascular inferior (arteria tiroidea inferior y nervio recurrente) y el esófago. El examen debe abarcar desde la glándula submandibular a la vena subclavia y lateralmente desde la línea media traqueal a la carótida y vena yugular, así como el área correspondiente al cayado aórtico, para excluir la presencia de glándulas patológicas en esta situación ectópica.
DIAGNÓSTICO ECOGRÁFICO
Ecografía modo B
Mientras que los primeros ecógrafos sólo permitían imágenes unidimensionales (modo A), con el desarrollo de la modulación del brillo (modo B) en el que las variaciones de la amplitud del pulso se representan en cada punto como una escala de grises, fue posible la visualización de una imagen anatómica.
Las glándulas paratiroides normales no son visibles en la ecografía en modo B. Esto se atribuye a su pequeño tamaño y a que su ecogenicidad es muy similar a la del tiroides.
Las glándulas paratiroides aumentadas de tamaño se objetivan como una imagen nodular, hipoecoica, homogénea, de morfología redondeada u oval y de contornos lisos delimitados por una fina línea ecogénica que corresponde a la cápsula glandular. Cuando son ovales su eje longitudinal es paralelo al eje longitudinal del tiroides. En alrededor de un 15-20%, la ecoestructura glandular puede ser heterogénea, debido a la presencia de necrosis y/o de hemorragia, o bien de calcificación, sobre todo en paratiroides muy aumentadas de tamaño.
Diversos estudios han demostrado una excelente correlación entre las mediciones ecográficas y el peso de la glándula resecada, y algunos de ellos han relacionado el tamaño glandular con la gravedad y el pronóstico del hiperparatiroidismo secundario, así como con la respuesta al tratamiento3.
Ecografía-Doppler y Doppler-color
Doppler pulsado
La asociación de ecografía y Doppler permitió el estudio de estructuras vasculares junto a la imagen, lo que permite valorar velocidades y flujos.
Doppler-color
Con el Doppler-color se realiza la conversión a color de los datos de velocidades y frecuencias obtenidos. La dirección del flujo se expresa en rojo si es positivo y en azul si es negativo, independientemente de que se trate de arteria o vena.
En el Doppler-color, las glándulas patológicas suelen presentar un patrón hipervascular4, siendo el aumento de la vascularización de distribución intraparenquimatosa, sin componente perinodular, aunque esta última es una característica que no siempre se observa.
Ecografía power-Doppler
Se basa en el análisis de la amplitud de ecos móviles en el interior del vaso y, por ello, las estructuras vasculares aparecen contrastadas, permitiendo identificar vasos de menor tamaño, lo que facilita no sólo identificarlos sino también evaluar la vascularización.
En este caso, el patrón vascular es el característico de un lecho arterial de baja resistencia y se observa un flujo continuo durante la diástole.
Un estudio reciente5 objetivó que el 60% de las glándulas sin registro power-Doppler correspondían a hiperplasia difusa o hiperplasia con nodularidad inicial, mientras que el 83,7% de las glándulas con registros power-Doppler presentaban hiperplasia nodular, incluso en paratiroides con un peso inferior o igual a 0,5g.
Se ha descrito la ausencia de vascularización en aproximadamente el 10% de las glándulas paratiroides patológicas, debido a: 1) tamaño inferior a 1 cm; 2) localización profunda; 3) localización próxima a grandes vasos, por lo que existen artefactos de transmisión, y 4) cuando existen áreas de necrosis.
PROBLEMAS DIAGNÓSTICOS
En general, la sensibilidad y la especificidad de la ecografía en el estudio de la patología paratiroidea están condicionadas por diversos factores.
En la sensibilidad diagnóstica de la ecografía influye: a) localización de la glándula patológica (localización atípica, ectópicas); b) el tamaño (<1 cm); c) la coexistencia de bocio, y d) los antecedentes de cirugía cervical.
Respecto a la especificidad, además de los problemas de diagnóstico que pueden plantearse con las adenopatías de la cadena cervical y los nódulos tiroideos, existen dos que están relacionados con las estructuras anatómicas: la vena tiroidea (puede cruzar el tercio inferior del lóbulo tiroideo y confundirse con una glándula paratiroides agrandada) y el músculo largo del cuello.
INDICACIONES
La indicación clásica de la ecografía en modo B en el estudio del HPTS es la localización prequirúrgica de las glándulas patológicas (figura 2).
Si bien en el HPTS la afectación glandular es múltiple y, por lo tanto, la cirugía mínimamente invasiva no es aplicable, la localización de las glándulas permite limitar la exploración quirúrgica, reduciendo de este modo el tiempo de intervención y el trauma quirúrgico.
El estudio con Doppler-color nos será de utilidad cuando en el estudio en modo B se planteen problemas diagnósticos con nódulos tiroideos o con adenopatías cervicales.
Con el power-Doppler se puede valorar el flujo arterial y, por tanto, en cierta manera el grado de actividad y, con ello, probablemente la respuesta al tratamiento, aunque para ello parece ser más aconsejable la gammagrafía.
Intervencionismo guiado por ecografía
Las aplicaciones de la ecografía como guía de los procedimientos intervencionistas en HPTS incluyen:
1. La punción-aspiración con aguja fina (PAAF).
2. El tratamiento ablativo percutáneo de adenomas o hiperplasia de paratiroides.
La PAAF tiene interés para caracterizar lesiones nodulares cervicales cuando existe sospecha de paratiroides intratiroidea.
La ablación percutánea con alcohol o incluso calcitriol6-8 consiste en la inyección percutánea de etanol o calcitriol, en las glándulas hiperplásicas/adenomas, con la intención de disminuir la masa productora de PTH.
Puede estar indicada en pacientes con problemas médicos que contraindiquen la cirugía. En la actualidad se utiliza en algunos centros como adyuvante de la terapia médica. El tamaño glandular a partir del cual se indica la ablación percutánea varía entre los diferentes centros (generalmente >5-10 mm).
Los resultados descritos en los trabajos publicados recientemente son mucho mejores que los de estudios iniciales. Se describen niveles séricos de PTH normales a largo plazo (1-3 años) en aproximadamente el 80% de los pacientes tratados, siendo los resultados mejores cuanto menor es el número de glándulas aumentadas de tamaño.
Se ha descrito una mayor efectividad de la alcoholización en las paratiroides menos vascularizadas que en las que muestran importante registro Doppler inicial.
Las complicaciones que puede presentar el procedimiento son fundamentalmente la parálisis del nervio recurrente, que suele ser temporal, y la fibrosis periglandular, que puede dificultar la práctica de una cirugía posterior.
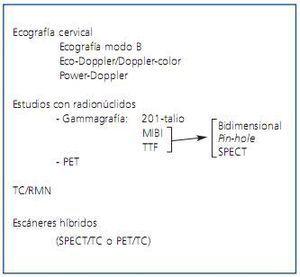
ESTUDIOS CON RADIONÚCLIDOS
Gammagrafía
Los primeros estudios de funcionalismo del tejido paratiroideo se efectuaron principios de la década de 1980 con el uso de análogos del potasio como el 201-talio9-11.
Aunque la gammagrafía con 201-talio sigue estando en uso, hoy en día se opta por otros radiofármacos como el tecnecio-99m metoxiisobutil isonitrilo (MIBI) o el tecnecio-99m tetrofosmin (TTF), debido especialmente a las mejores propiedades físicas del tecnecio-99m. De hecho, el MIBI ha comenzado a ser el principal radiofármaco utilizado en la mayoría de los departamentos de medicina nuclear.
Radionúclidos
Gammagrafía con talio (201-talio)
Es un análogo del potasio. Alcanza los tejidos de una manera proporcional al flujo sanguíneo y entra en la célula de forma activa, a través de la bomba Na-K-ATPasa.
Cuando se realiza una gammagrafía con talio, simultáneamente hay que realizar una sustracción de la captación del tiroides mediante gammagrafía tiroidea con tecnecio-99m para obviar interferencias del tejido tiroideo10.
Aunque algunos estudios iniciales han referido una buena sensibilidad del 201-talio para identificar glándulas paratiroides hiperplásicas9,11, la calidad de las imágenes es bastante inferior a las obtenidas con TTF y MIBI10.
Gammagrafía MIBI doble fase
La gammagrafía paratiroidea con MIBI en doble fase es la técnica de medicina nuclear más empleada para visualizar las glándulas paratiroides anómalas. El compuesto es el hexaquis isobutil isonitrilo (sestamibi) (MIBI).
El MIBI utiliza como marcador el 99mTc, radionúclido de vida media muy corta que permite administrar dosis altas sin someter al paciente a altas exposiciones radiactivas, lo que a su vez permite mejor calidad de imagen y menor absorción por parte de otros tejidos12.
Se realiza mediante la inyección intravenosa de 20 mCi (740 MBq) de MIBI.
Las imágenes se obtienen con el paciente en decúbito supino, a ser posible con el cuello en hiperextensión. Se adquieren imágenes anteriores en un área que abarca cuello y tórax superior.
El MIBI lo captan tanto el tejido paratiroideo hiperfuncionante como el tiroideo, pero, a diferencia del talio, existe una diferencia de lavado entre las glándulas tiroides y las paratiroides hiperfuncionantes, siendo más rápido en las tiroideas.
Para el estudio gammagráfico se obtiene una fase inicial (fase tiroidea) a los 15 minutos y una fase tardía (fase paratiroidea) a los 60 minutos. El tejido tiroideo presenta una afinidad fisiológica en la fase inicial, pero el aclaramiento es rápido y normalmente la actividad de la glándula tiroidea desaparece. El tejido paratiroideo normal no capta en ninguna de las dos fases. Las glándulas anómalas tienen tendencia a retener el trazador visualizándose en la fase tardía. Así, en caso de hiperplasia/adenoma se visualizan áreas hipercaptantes más o menos marcadas, a veces visibles ya incluso en la imagen precoz.
Se recomienda una gammagrafía de la glándula tiroides complementaria a la gammagrafía con MIBI en zonas endémicas de bocio, para evitar falsos positivos. También se ha descrito la posibilidad de depuraciones en tiempos similares entre ambos tejidos, lo que podría provocar falsos negativos13,14.
Para calcular el índice de captación de las glándulas paratiroides patológicas en la gammagrafía con MIBI se pueden utilizar métodos cualitativos, cuantitativos o semicuantitativos:
1. Cualitativos se limitarían a constatar la presencia o la ausencia de glándulas hiperfuncionantes.
2. Cuantitativos incluyen una visualización digital que corresponde a la fase tardía o fase paratiroidea. La imagen es utilizada para crear una zona ROI (region of interest) en la paratiroides hipercaptante y en un área tiroidea. La media de la actividad/píxel en la lesión paratiroidea se divide por la media de la actividad/píxel del tiroides, obteniéndose el incremento de actividad de la glándula paratiroidea.
3. Semicuantitativos, que emplean diferentes alternativas de gradación. En nuestra experiencia, empleamos un sistema semicuantitativo que nos ha sido de gran utilidad. El sistema puntúa con un «0» la ausencia de captación, con un «1» (leve), si la captación es similar al hueso o tejido blando, con un «2» (moderada) entre el 1 y las glándulas salivales, «3» (intensa) similar o superior a las glándulas salivales15.
Este sistema semicuantitativo nos ha sido útil para aconsejar qué glándula dejar remanente o emplear para autotrasplante (la de menor captación) cuando se practica partiroidectomía subtotal o con autotrasplante, respectivamente. Por otro lado, nos ha sido de gran utilidad para valorar la efectividad del tratamiento médico del HPTS, tanto con análogos de vitamina D como con calcimiméticos. Y, por último, nos ha servido para prever los resultados del tratamiento médico y decidir la paratiroidectomía (un paciente con un grado de captación intenso difícilmente va a responder al tratamiento médico)15-17.
Gammagrafía con tetrofosmin
El tetrofosmin (TTF) es una molécula similar al MIBI y ha sido propuesto como un trazador para la detección prequirúrgica y cribado de glándulas paratiroides anómalas, aunque su aclaramiento en el tejido tiroideo es más lento que el del MIBI y la interpretación de las imágenes en doble fase es más compleja18,19.
TÉCNICAS ESPECIALES DE ADQUISICIÓN DE IMÁGENES
Gammagrafia con colimador Pinhole
Las imágenes gammagráficas suelen ser planares (bidimensionales), pero existen técnicas de adquisición especiales que permiten mejorar la resolución y sensibilidad. Una de ellas es el uso de un colimador Pinhole, que tiene forma cónica y la particularidad de generar una imagen invertida magnificada.
La adición de imágenes con colimador Pinhole en la fase tardía de la gammagrafía con 99mTc-MIBI puede aumentar la tasa de detección de adenomas en estudios indeterminados o inicialmente negativos.
Gammagrafía con técnica SPECT (Single-photon emision computed tomography)
La gammagrafía con técnica SPECT que permite adquirir imágenes con una órbita de 360º en los tres planos del espacio (imagen tridimensional) ha aumentado la sensibilidad en la localización de las paratiroides y ha permitido la detección de pequeñas lesiones, lo que ha dado lugar a una mayor precisión de la técnica.
Algunos grupos de trabajo realizan SPECT junto con pinhole, lo que conlleva un significativo aumento de la sensibilidad20,21. Sin embargo, el uso de esta técnica en la práctica clínica es controvertido, ya que el pin-hole no resulta adecuado para la detección de glándulas ectópicas situadas en el mediastino.
Factores que influyen en la captación del radiotrazador
Si bien el principal factor que influye en la localización de las glándulas paratiroides hiperfuncionantes que se realizan por técnicas de medicina nuclear parece estar relacionado con el tamaño de las mismas, la comparación de datos morfológicos y funcionales sugiere que la gammagrafía con TTF o MIBI no sólo revela el aumento de tamaño de la glándula sino que identifica además la presencia de un hiperfuncionalismo del tejido paratiroideo.
Se han identificado fácilmente pequeños adenomas y, por el contrario, se han descrito falsos negativos en glándulas bastante aumentadas de tamaño. Por lo tanto, el tamaño no es el único factor que determina su detectabilidad.
Se desconoce el mecanismo por el cual, en glándulas hiperfuncionantes, el radionúclido permanece durante un largo período de tiempo, lo que puede ser probablemente el resultado de una o varias circunstancias como fase del ciclo celular, tipo de célula, riqueza de mitocondrias, la presencia/ausencia de proteínas de expresión como la P-glicoproteína, así como marcadores bioquímicos específicos como PTHi y la calcemia22.
En general, se ha visto que la captación tanto del MIBI como del TTF es mayor para la hiperplasia nodular que para la hiperplasia difusa. En pacientes con HPS se ha observado una relación directa entre la intensidad de la captación focal de MIBI en las paratiroides y la fase del ciclo celular. Mayores grados de captación se correlacionaron con la fase activa de crecimiento celular, lo que indica que la gammagrafía con MIBI refleja el estado funcional de la glándula23.
El radiotrazador parece mostrar una acumulación más intensa en las glándulas que presentan grandes áreas de células oxifílicas ricas en mitocondrias que en áreas con células principales24.
Algunos autores han encontrado una correlación entre los niveles de calcio sérico, los niveles de PTH y el contenido en células oxifílicas de las células, así como entre los niveles de calcio y la captación inicial del trazador24. De este modo, los valores séricos de calcio podrían desempeñar un papel importante modificando las propiedades cinéticas del MIBI por la influencia del potencial de membrana.
El grado de captación del radiotrazador se ha relacionado de forma significativa con la presencia de un mayor número de mitocondrias en las glándulas25. La relación existente entre la captación y retención de MIBI y el número de mitocondrias podría explicar también que la captación sea mayor en el tejido paratiroideo anómalo, siendo por tanto un indicador de la actividad metabólica en el interior de las células.
La relación entre la captación del radiotrazador y la expresión de P-glicoproteína se ha estudiado en glándulas paratiroides hiperfuncionantes y se ha observado que se eliminan rápidamente de las glándulas paratiroides que contienen P-glicoproteína y, por tanto, la captación de las imágenes será negativa. En las glándulas paratiroides que no poseen P-glicoproteína, el radiotrazador permanece en las células, lo que hace más fácil detectarlos mediante gammagrafía26-28.
El aumento de la expresión de P-glicoproteína podría ser la responsable de algunos falsos negativos de las gammagrafías de paratiroides. Resultados similares se han obtenido con la utilización de TTF.
Existe una correlación significativa entre la captación de MIBI y los valores séricos de PTHi, pero no con valores séricos de calcio, fósforo, 25-OH vitamina D o 1,25-OH vitamina D29.
Los bloqueadores de los canales del calcio, normalmente prescritos como antihipertensivos, han demostrado in vitro frenar la secreción de PTH y tener un efecto sobre el potencial de membrana de las células paratiroideas, lo que podría reducir la sensibilidad al MIBI30.
Cirugía radioguiada con gammagrafía MIBI
Mediante una sonda detectora de radiación gamma que permite obtener señales acústicas y recuento de la actividad radiactiva se puede guiar al cirujano intraoperatoriamente para la exéresis de las glándulas paratiroides patológicas.
Las indicaciones recomendadas son los adenomas solitarios visibles en el MIBI sin presencia de nódulos tiroideos activos que puedan interferir en su detección, sin historia previa de irradiación cervical o historia familiar de MEN31. Esta técnica también está indicada en pacientes reoperados por persistencia o recurrencia de su hiperparatiroidismo y si se sospechan glándulas ectópicas.
Las ventajas más evidentes son la reducción del tiempo de cirugía y la posibilidad de verificar la correcta exéresis del tejido paratifoideo, ya que se puede medir la actividad radiactiva del tejido resecado ex vivo32.
Tomografía por emisión de positrones (PET)
La PET es una técnica no invasiva que permite obtener imágenes que reflejan la actividad metabólica de las glándulas paratiroides.
Esta técnica emplea isótopos emisores de positrones (electrones positivos). Los emisores de positrones suelen tener una vida media muy corta, lo que también acorta el período de exposición y de exploración. Los agentes usados para la PET tienen una mejor resolución que los usados para la gammagrafía.
Para el estudio de las glándulas paratiroides se aconseja el carbono-11 marcado con metionina.
Algunos estudios han demostrado una buena correlación entre la captación de 11C-metionina y la PTH y los niveles de calcio33-35.
La PET con 11C-metionina puede ser un método útil en pacientes con hiperparatiroidismo secundario cuando la ecografía y la gammagrafía son negativas o no concluyentes. Además, las glándulas ectópicas se identifican con mayor precisión con la PET que con la gammagrafía convencional, ya que permite obtener imágenes tridimensionales.
INDICACIONES
Podemos considerar a la gammagrafía con MIBI como primera opción para identificar glándulas paratiroides hiperfuncionantes (figura 2).
Si bien los pacientes con HPS que no han sido intervenidos quirúrgicamente no precisarían la localización previa por el elevado porcentaje de éxito de la exploración cervical, debería considerarse la no despreciable tasa de recidiva de HPTS (10-30%), cuya principal causa sigue siendo la incompleta localización de las glándulas.
Este hecho es especialmente evidente en pacientes que son reintervenidos, en quienes el MIBI adquiere un importante papel en la detección de glándulas ectópicas, recidivas in situ o hiperfunción de un autotrasplante36.
También puede ser útil para aconsejar qué cantidad de glándula debe dejarse remanente o para emplear para autotrasplante cuando se practique paratiroidectomía subtotal o total con autotrasplante, respectivamente. En estos casos, sería aconsejable extirpar las glándulas más hipercaptantes y dejar las que lo son menos, con lo que se reduce el riesgo de recidiva.
Puede ser también de utilidad para valorar y/o predecir la respuesta al tratamiento médico.
En los trabajos más recientes, la mayoría de los autores coinciden en considerar a la ecografía y a la gammagrafía con 99mTc-MIBI técnicas complementarias, y en recomendar el uso combinado de ambas37.
La PET se reservaría para localizar hiperplasia/adenoma de paratiroides cuando tanto la ecografía como la gammagrafía MIBI han sido negativas.
Tomografía computarizada y resonancia magnética nuclear
La tomografia computarizada (TC) puede localizar paratiroides de un tamaño inferior a 4 mm, así como masas de tejido blando yuxtatiroideo, subesternal o retroclavicular. Algunas series han referido que la sensibilidad es similar a la de la gammagrafía y a la de la ecografía en el diagnóstico de la enfermedad paratiroidea multiglandular, pero el coste es mayor y la detección de tejido paratiroideo adyacente al tiroides puede ser dificultosa38.
Con la administración de contraste intravenoso y los actuales dispositivos que realizan cortes de 0,5 mm se incrementa la sensibilidad de la técnica, que alcanza el 80%.
La TC puede detectar glándulas paratiroideas ectópicas, aunque las situadas a la altura de los hombros o del esternón son difíciles de visualizar debido a los artefactos causados por los huesos, al igual que sucede en pacientes reintervenidos por los artefactos metálicos de cirugías previas.
La resonancia magnética nuclear (RMN) parece ser más sensible y además ofrece la posibilidad de mejorar la imagen con el uso de contraste y de reconstrucción en 3-D. Los adenomas de paratiroides tienen poca intensidad de señal en imágenes ponderadas en T1 y alta intensidad de señal en imágenes en T2, que mejora si se puede emplear gadolinio.
Son varios los estudios que hacen referencia a la RMN como una prueba de imagen con mayor sensibilidad que la TC39,40, aunque con más dificultad para la diferenciación de adenomas de paratiroides de lesiones tiroideas.
Indicaciones
Localización de hiperplasia/adenoma de paratiroides cuando las anteriores pruebas (ecografía y gammagrafía MIBI) han sido negativas y no se dispone de técnica PET.
ESCÁNERES HÍBRIDOS
La reciente introducción de escáneres híbridos para el diagnóstico puede aportar ventajas sobre la gammagrafía o la PET aislada.
Tanto la SPECT/TC como la PET/TC proporcionan imágenes que fusionan la modalidad tanto anatómica como funcional de la glándula, lo que mejora de forma considerable la interpretación de los hallazgos obtenidos con cada una de las técnicas de manera individual41.
Indicaciones
De momento sólo están indicados para la localización de glándulas hiperfuncionantes cuando fracasan todas las anteriores alternativas.
CONCEPTOS CLAVE
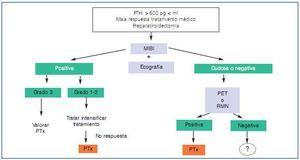
1. En síntesis (figura 3), hoy día nuestra recomendación es practicar, en todos los pacientes con HPTS que no responden inicial y fácilmente al tratamiento médico, una gammagrafía MIBI que puede complementarse con un Eco-Doppler color.
2. Si la gammagrafía es positiva y, tras gradación de la intensidad de captación, alguna de las glándulas (no ectópicas) presenta un índice intenso (3), aunque se puede intentar intensificar el tratamiento, deberíamos ir pensando en la paratiroidectomía.
3. Si la gammagrafía es positiva y, tras gradación de la intensidad de captación, ninguna de las glándulas (no ectópicas) presenta un índice intenso (3), es decir, se encuentran en grados 1 o 2, se debería intentar intensificar tratamiento y, si no existe buena respuesta considerar la paratiroidectomía.
4. Si la gammagrafía es negativa, deberíamos practicar una PET o un escáner híbrido si disponemos de ello. En caso de no disponer de PET lo aconsejable sería una RMN. Una vez localizada la(s) glándula(s) ya indicaríamos la paratiroidectomía.
Figura 1. Técnicas de imagen en hiperparatiroidismo secundario.
Figura 2. Tablas de imagen en hiperparatiroidismo secundario: indicaciones.
Figura 3. Técnicas de imagen en hiperparatiroidismo secundario: algoritmo de aplicación.