Los efectos de cinacalcet en el hiperparatiroidismo secundario (HPTS), persistente o asociado a hipercalcemia han sido descritos en pacientes en diálisis.
ObjetivosAnalizar la eficacia y seguridad de cinacalcet en HPTS no sometido a diálisis y sus efectos sobre marcadores de recambio óseo.
MétodosEstudio analítico observacional, no aleatorizado, longitudinal, de pacientes con enfermedad renal crónica (ERC) e HPTS (PTH > 80 pg/mL); con normohipercalcemia (≥8,5mg/dL), tratados con cinacalcet.
ResultadosLa dosis media de cinacalcet fue de 30mg/día en un 66,7%. Estudiamos 15 pacientes (10 mujeres), con edad de 66,0±17,93 años. Etiología desconocida en 20% de los casos. Registramos variables sociodemográficas y parámetros de función renal. Comparamos valores basales, tras 6 y 12 meses. Descendieron los niveles de iPTH (392,4±317,65 vs. 141,8±59,26) y calcio (10,3±0,55 vs. 9,4±1,04). Aumentaron los valores de fósforo (3,7±1,06 vs. 3,9±0,85) y ß-CTX (884,2±797,22 vs. 1.053,6±999,00), sin variaciones significativas del FG, calciuria y demás marcadores óseos. Registrados 2 abandonos (intolerancia digestiva y paratiroidectomía, respectivamente).
ConclusionesCinacalcet a dosis bajas es eficaz en el manejo del HPTS del paciente con ERC no tratado mediante diálisis, al disminuir la iPTH y la calcemia, sin ocasionar efectos adversos graves ni variación significativa de la función renal.
The effects of cinacalcet in persistent and/or hypercalcaemia-associated secondary hyperparathyroidism (SHPT) have been described in patients on dialysis.
ObjectivesTo evaluate the efficacy and safety of cinacalcet in SHPT not on dialysis and its effects on bone turnover markers.
MethodsNon-randomised, longitudinal, observational, analytical study of patients with chronic kidney disease (CKD) and SHPT (PTH> 80 pg/mL) as well as normo- or hypercalcaemia (≥8.5mg/dL), treated with cinacalcet.
ResultsMean cinacalcet dose was 30mg/day in 66.7%. We studied 15 patients (10 women), aged 66.0±17.93years. The aetiology was unknown in 20% of cases. Sociodemographic variables and renal function parameters were recorded. We compared values at baseline as well as after 6 and 12 months. Calcium (10.3±0.55 vs. 9.4±1.04) and iPTH (392.4±317.65 vs. 141.8±59.26) levels decreased. Increased levels of phosphorus (3.7±1.06 vs. 3.9±0.85) and ß-CTX (884.2±797.22 vs. 1053.6±999.00) were detected, although there were no significant changes in GFR, urinary calcium or other bone markers. Two patients withdrew from the study (gastrointestinal intolerance and parathyroidectomy, respectively).
ConclusionsCinacalcet at low doses is effective in the management of SHPT in CKD patients who are not on dialysis. Its use reduces iPTH and calcaemia, without causing serious side effects or significant changes in renal function.
Cinacalcet (Mimpara®) es actualmente el único calcimimético con indicación aprobada en el tratamiento del hiperparatiroidismo secundario (HPTS) de pacientes con enfermedad renal crónica (ERC) tratados mediante diálisis1–3, así como en el hiperparatiroidismo primario (HPTP) causado por adenoma o carcinoma de paratiroides de pacientes no subsidiarios de paratiroidectomía, o con enfermedad persistente tras ella2. Se ha empleado con éxito en el HPTS residual del trasplante renal, si bien no dispone de la indicación4.
Actúa como un modulador alostérico positivo del receptor sensible al calcio que se expresa en múltiples tejidos como las glándulas paratiroides, riñón, hueso (sobre todo en osteoclastos) y vasos sanguíneos5. Su activación aumenta la transducción de señales, presumiblemente induciendo cambios conformacionales intracelulares y reduciendo el umbral de sensibilidad al calcio, lo que, a nivel glandular, se traduce en menor producción y secreción de hormona paratiroidea (PTH), esencial en el manejo del HPTS resistente o asociado a hipercalcemia de pacientes en diálisis, en los que también ha mostrado modificación sobre los marcadores de recambio óseo6,7.
Menos conocidos son sus efectos en pacientes con función renal alterada no tratados con diálisis, en los cuales el trastorno mineral-óseo (TMO) asociado a la ERC es prácticamente una constante5–7. Dentro de esta última denominación encontramos no solo alteraciones del calcio, fósforo, PTH o vitamina D propiamente sino también del remodelado, volumen y resistencia esquelética, además de calcificaciones vasculares o de tejidos blandos7,8. Se sabe que en pacientes con ERC la determinación de productos de degradación del colágeno y de los marcadores clásicos de recambio óseo ha mostrado mayor utilidad que la densitometría ósea como predictores del riesgo de fracturas, de ahí la importancia de su estudio7.
El presente trabajo pretende determinar la eficacia y seguridad de cinacalcet en el tratamiento del HPTS del paciente con ERC no tratado con terapia renal sustitutiva, en el que por sus niveles de calcio sérico no sea seguro el uso de vitamina D y sus derivados, o en aquellos con enfermedad severa y contraindicación quirúrgica, además de describir sus efectos sobre los marcadores de remodelado óseo.
Pacientes y métodosRealizamos un estudio observacional, longitudinal, en una cohorte de pacientes seguidos en las consultas externas de nuestro centro. Se incluyó a pacientes con diagnóstico de HPTS (nivel de iPTH > 80 pg/mL), ya con hipercalcemia (lo que limitaba el uso de quelantes cálcicos del fósforo, vitamina D o sus análogos), ya con normocalcemia (calcio corregido ≥ 8,5mg/dL) resistente a dichos tratamientos, y con ERC en estadios 3-5 (filtrado glomerular estimado [FGe] entre 60 y <15mL/min/1,73 m2).
Se registraron variables sociodemográficas de la muestra.
En cada paciente se solicitó el empleo de cinacalcet por uso compasivo en esta indicación, y fue autorizado.
Los pacientes iniciaron tratamiento con cinacalcet a dosis de 30mg en dosis única administrada por la mañana, y se ajustó la dosis según resultado evolutivo.
Se calculó el FGe empleando la fórmula MDRD-4, y se determinaron niveles de iPTH, calcio, P, osteocalcina (OC), fosfatasa alcalina total (FA), betacrosslap (ß-CTX) y P1NP, empleando las técnicas estándares de nuestro laboratorio9. Tales variables se registraron en los momentos basal, al 6.° y al 12.° mes respecto a la fecha de inicio del tratamiento con cinacalcet. Registramos reacciones adversas e interrupciones de este tratamiento, así como medicación asociada a base de quelantes del fósforo (cálcico o no cálcico), análogos de la vitamina D y bifosfonatos.
Los variables discretas se resumieron mediante frecuencias y porcentajes, y las continuas tanto en medias ± desviación estándar (DE), como en medianas y percentiles (P25 y P75). El análisis se realizó con el mayor número de sujetos con datos observados y registrados para cada variable, ya que no se reemplazaron valores perdidos; en todo caso siempre fue n ≥ 9. Recurrimos al análisis de 2 vías de Friedman para el estudio del cambio en las variables en los momentos basal, al 6.° y al 12.° mes, y a la prueba de rangos con signos de Wilcoxon para el cambio tras un año. Los análisis estadísticos se realizaron con el programa IBM® SPSS® Statistics v. 19. El nivel de significación se fijó en 0,05.
ResultadosSe incluyó a 15 pacientes, 10 de ellos mujeres, con edad media de 66,0±17,93 años. Según la clasificación de la ERC por estadios, se distribuyeron en estadio 3 (8 pacientes); estadio 4 (3 pacientes) y estadio 5 (4 pacientes). La causa de ERC fue vascular (7 pacientes), glomerular (3 pacientes), intersticial (un paciente), diabética (un paciente) y no filiada (4 pacientes).
Antes de iniciar el tratamiento con cinacalcet, los pacientes tomaban paricalcitol en el 50,0%, quelantes de P no cálcicos en el 13,3%, bifosfonatos en el 26,6%, y se mantuvieron. La dosis de inicio de cinacalcet en la mayoría de los pacientes fue 30mg/día, y al año de 36,2±14,09mg/24 h.
En la tabla 1 se recogen los valores evolutivos de FGe y metabolismo mineral-óseo tras tratamiento con cinacalcet, así como los resultados de las comparaciones realizadas.
Evolución del filtrado glomerular estimado y metabolismo óseo-mineral en pacientes con hiperparatiroidismo secundario por ERC no tratados mediante diálisis tras tratamiento con cinacalcet: comparaciones en los instantes basal, al 6.° mes y al 12.° mes
| N | Basal | 6 meses | 12 meses | pa | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Media (DE) | Mediana (P25; P75) | Media (DE) | Mediana (P25; P75) | Media (DE) | Mediana (P25; P75) | |||||||||
| Creatinina (mg/dL) | 12 | 2,45 | (1,30) | 2,03 | (1,43; 3,57) | 2,51 | (1,52) | 1,68 | (1,21; 4,25) | 2,75 | (1,52) | 1,87 | (1,58; 4,32) | 0,099 |
| Urea (mg/dL) | 12 | 99,60 | (51,10) | 72 | (59; 133) | 93,67 | (51,10) | 72,0 | (59; 133) | 117,83 | (57,05) | 95 | (75,7; 138,2) | 0,117 |
| PTH (pg/ml) | 10 | 392,47 | (317,65) | 294 | (176,0; 556 | 293,1 | (464,6) | 146 | (110; 253) | 141,8 | (59,26) | 142,0 | (98,7; 178,8) | 0,009 |
| Calcio sérico (mg/dl) | 14 | 10,3 | (0,55) | 10,45 | (10,1; 10,7) | 9,8 | (1,06) | 9,3 | (8,9; 10,6) | 9,37 | (1,04) | 9,3 | (8,5; 10,4) | 0,005 |
| Calciuria (mg/24h) | 10 | 0,16 | (0,18) | 0,09 | (0,7; 0,17) | 0,26 | (0,21) | 0,15 | (0,10; 0,48) | 0,18 | (0,90) | 0,21 | (0,1; 0,26) | 0,154 |
| P sérico (mg/dl) | 10 | 3,7 | (1,06) | 3,55 | (2,95; 4,32) | 3,71 | (0,67) | 3,65 | (2,97; 4,37) | 3,88 | (0,85) | 3,6 | (3,3; 4,4) | 0,011 |
| Filtrado glomerular estimado (mL/min/1,73 m2) | 11 | 29,78 | (15,35) | 28,81 | (14,4; 41,03) | 33,44 | (24,00) | 28,63 | (14,9; 48,1) | 31,02 | (17,42) | 33,28 | (14,3; 44,46) | 0,807 |
| Betacrosslaps (pg/ml) | 11 | 884,92 | (797,2) | 616 | (248; 1309) | 1657,67 | (1291,71) | 1785 | (571; 2109) | 1053,63 | (999,0) | 763 | (461; 1129) | 0,041 |
| Osteocalcina (ng/ml) | 11 | 226,9 | (460,7) | 53,0 | (19; 219) | 122,1 | (91,32) | 140,0 | (23; 181) | 86,45 | (125,6) | 29 | (18; 83) | 0,919 |
| Fosfatasa alcalina total (U/l) | 10 | 110,83 | (88,21) | 81,5 | (65,0; 126,8) | 133,85 | (86,67) | 121,0 | (91; 130,0) | 78,3 | (26,9) | 73,0 | (54,5; 100,7) | 0,833 |
| P1NP (ng/ml) | 10 | 149,08 | (166,0) | 99 | (42,5; 207,5) | 217,7 | (250,62) | 123,5 | (55,8; 282) | 126,9 | (132,6) | 82,5 | (46; 171) | 0,314 |
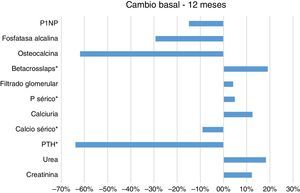
La iPTH media al inicio era 392,4±317,65, y de calcemia 10,3±0,55. Se evidenció una disminución del 64% de los niveles de PTH a los 12 meses (Media12mes=141,8) comparados con los valores de PTH iniciales (MediaInicial=392,4), siendo esta diferencia estadísticamente significativa (Friedman, X2(2)=8,222; p=0,016; Wilcoxon, Z=−2,599; p=0,009). Los valores de calcio sérico descendieron en una proporción de 9,0% a los 12 meses (Media12 mes=9,4) comparados con los valores de calcio iniciales (MediaInicial=10,3) en forma significativa por ambos métodos (Friedman, X2 (2)=7,800; p=0,020; Wilcoxon, Z=−2,832; p=0,005) (tabla 1 y fig. 1).
Por otro lado, encontramos aumento del nivel medio de P sérico del 5,0% tras un año (Media12mes=3,9) comparados con los valores iniciales (MediaInicial=3,7) sin significación estadística según Friedman, X2 (2)=5,250; p=0,072; aunque significativa según Wilcoxon, Z=−2,599; p=0,011; y de los niveles del marcador de resorción ósea ß-CTX del 19,0% a los 12 meses (Media12mes=1.053,6) comparados con los valores de CTX iniciales (MediaInicial=884,9), que alcanzan significación estadística según el test de rangos de Wilcoxon (Z=−2,045; p=0,041); no así según Friedman X2 (2)=1,000; p=0,607. No hubo diferencias evolutivas de los valores medios de calciuria, FGe, OC, P1NP y FA.
Durante el estudio 2 pacientes (13,3%) abandonaron cinacalcet: uno por intolerancia digestiva y otro por paratiroidectomía.
DiscusiónHemos demostrado en nuestro estudio piloto que cinacalcet es eficaz en el control del HPTS asociado a ERC en pacientes no tratados mediante diálisis, con descenso de los niveles de PTH y calcio, y sin detectar efectos adversos graves.
El HPTS y el TMO son habituales en el manejo de pacientes con ERC1,3,5–7. Ambas entidades clínicas suponen una carga sanitaria importante debido a su amplia asociación con el aumento del riesgo cardiovascular, de mortalidad y del desarrollo de fracturas en este grupo de pacientes3,5,8. Algunos estudios incluso destacan la implicación diferencial de cada factor del TMO con la mortalidad (relación calcio-mortalidad > fósforo-mortalidad > PTH-mortalidad)3,8. En pacientes con ERC habitualmente se recurre al control de las alteraciones relacionadas con el HPTS y el TMO, manejando factores desencadenantes: a través de restricción dietética de fósforo, el uso de quelantes tanto cálcicos como no cálcicos, e incluso mediante aporte de aquellos deficitarios como la vitamina D (o sus análogos)3,6,10. En algunas ocasiones las medidas antes mencionadas se vuelven improductivas, e incluso contraproducentes, al aumentar el riesgo de calcificación vascular o de tejidos blandos, en pacientes con calcemias basales elevadas5,11.
Los calcimiméticos ofrecen una ventaja terapéutica al actuar sobre los principales factores fisiopatológicos de ambas entidades, de por sí ampliamente relacionadas. En primer lugar, reducen los niveles séricos de PTH mediante la disminución de su expresión génica y, ejerciendo un estímulo para la síntesis del receptor de vitamina D en la glándula paratiroides, se aumenta la sensibilidad a su acción y posterior supresión2,5,6,12,13. Algunos estudios demuestran estímulo de la calcitonina, lo que se vería implicado en la reducción de los niveles de calcio. En cuanto al P, sabemos que con FG < 60mL/min/1,73 m2, existe una activación y aumento de los niveles de la hormona fosfatúrica FGF-23, inhibiendo esta última la misma síntesis de calcitriol2,3. Lo anterior probablemente estaría implicado en una adaptación fisiológica del organismo con la intención de mantener niveles mejor controlados de P hasta estadios de ERC avanzada3.
Se dispone de escasos trabajos que hayan estudiado los efectos de cinacalcet en ERC fuera de diálisis: en nuestro conocimiento al menos 24,5, de los cuales ninguno indaga sobre los efectos del fármaco en estadios de ERC tan tempranos ni sobre efectos sobre el remodelado óseo, por lo que nuestros hallazgos serían novedosos. Encontramos que, tras un año de uso de cinacalcet en pacientes con ERC en estadios 3-5 (K/DOQUI), se verifica una disminución significativa de los niveles séricos de PTHi de alrededor del 65% y de calcio de casi un 10% respecto a niveles basales. Lo anterior se corresponde con efectos demostrados de fármaco en pacientes en diálisis1,5,12, incluso guardando bastante corelación con los niveles de reducción encontrados en dicho grupo de pacientes1,3,11. Por otro lado, se evidencian resultados discordantes con pacientes en diálisis en cuanto a la respuesta de los niveles séricos de P y de ß-CTX, cuya respuesta en los estudios realizados ha sido normalmente a la baja8,10–13, por lo tanto, no se corresponde con el aumento de un 5% y un 19%, respectivamente, presentado en nuestra cohorte. Probablemente lo anterior se explique debido a la disminución de la PTH y sus efectos fosfatúricos en pacientes que todavía conservan FG, además de la reciente implicación de cinacalcet en reducción de los niveles de FGF-2312.
Los marcadores de remodelado óseo son un reflejo dinámico de la actividad síntesis/degradación de todo el esqueleto, a diferencia de la densitometría/radiografía, que se enfocan en una parte estática de dicha actividad. El ciclo de remodelado óseo tarda de 3 a 6 meses en condiciones normales. Cuando se produce degeneración de colágeno tipo i, tanto porciones amino- como carboxiterminales son detectadas en el torrente sanguíneo y orina14. Existen marcadores más específicos de formación ósea, relacionándose algunos sobre todo con actividad osteoblástica (OC, P1NP y FA) y otros con resorción ósea o actividad osteoclástica (ICTP, CTX y NTX)14. Su utilidad se basa en la determinación de la tasa de recambio óseo, riesgo de fracturas y como factor pronóstico de respuesta al tratamiento de las enfermedades óseo-metabólicas7,14. Para determinar la salud ósea, sin embargo, la biopsia y marcaje con tetraciclina continúa siendo el gold standard7,14. La monitorización de ß-CTX es útil en la verificación de respuesta a terapia antirresortiva, con mayor respuesta cuantos más altos sean los valores iniciales de dicho marcador1,6,7,12. La evolución de los niveles de ß-CTX no se corresponde con la que se ha encontrado en trabajos previos realizados a pacientes que usan cinacalcet en hemodiálisis1; sin embargo, no disponemos de estudios realizados en pacientes no tratados mediante diálisis. Cabe mencionar que alrededor del 27% de los pacientes que estudiamos estaban tratados con antirresortivos, al contar con FG superiores a 30mL/min, aunque desconocemos si existen implicaciones asociadas al uso de cinacalcet y nuestros hallazgos, por lo que creemos que debería profundizarse en el tema.
No apreciamos tendencias a la mejoría del FG ni a la reducción o aumento de la calciuria, por lo que la reducción de los niveles de calcio sérico en nuestros pacientes probablemente no se relacione con una mayor eliminación de dicho ión.
Nuestras conclusiones pueden verse limitadas por el reducido número de pacientes y el método de recogida de datos que puede prestarse a sesgos de selección o información.
ConclusiónCinacalcet es efectivo disminuyendo los niveles de iPTH y calcio en pacientes con ERC que no siguen técnicas de depuración renal. Su margen de seguridad es similar al de pacientes en diálisis, ya que durante el período de observación no se mostraron efectos adversos graves. No se encontró variación significativa de la función renal en los sujetos seguidos. Se observó aumento del fósforo sérico y del marcador de resorción ósea ß-CTX.
Conflictos de interésLos autores declaran no tener ningún conflicto de interés relacionados con el contenido del presente artículo.