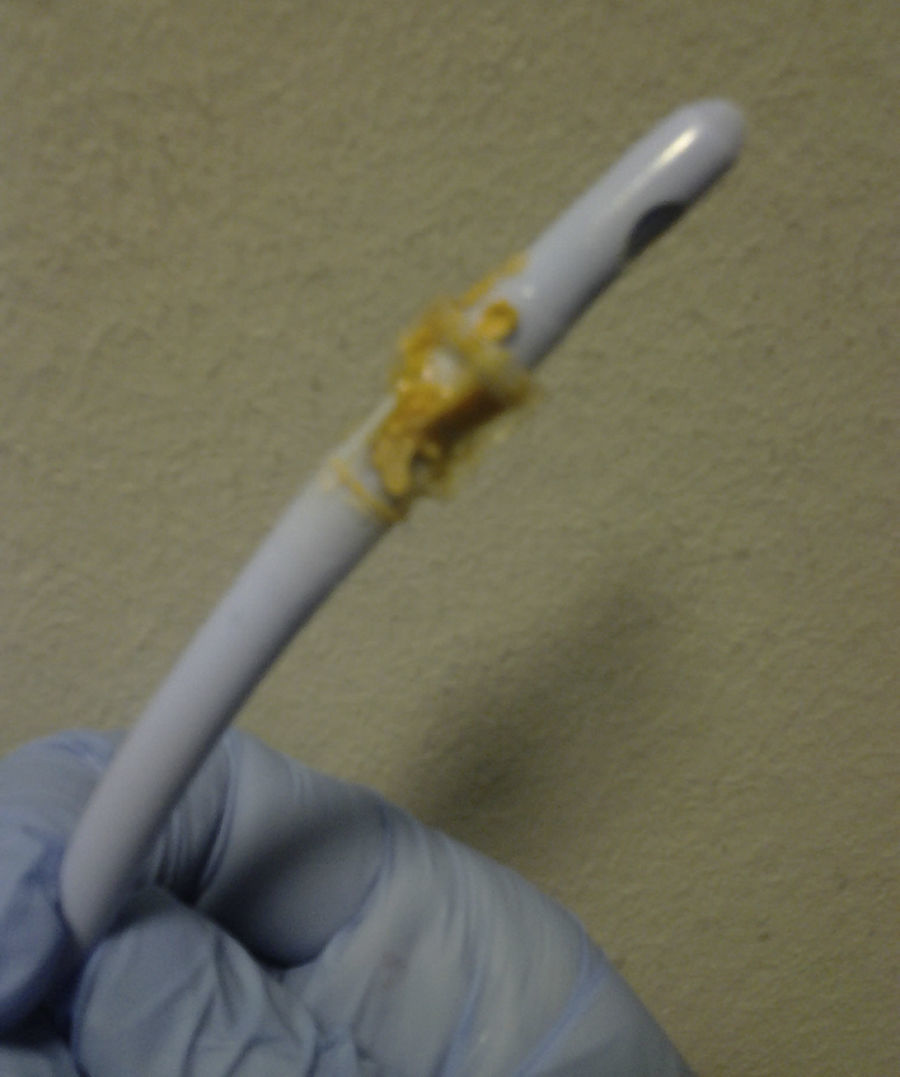
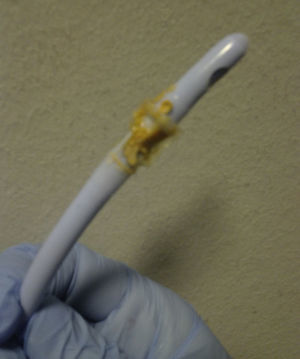
La urolitiasis por estruvita es un cuadro poco frecuente, asociado habitualmente a infecciones urinarias por gérmenes ureasa positivos y a trasplante renal1, que exige un alto grado de sospecha clínica y colaboración microbiológica para su diagnóstico. Reportamos el caso de un varón de 76 años afecto de EPOC, cor pulmonale e ictus isquémico previo. Infecciones respiratorias con múltiples ingresos, que requieren prolongada antibioterapia. Sonda vesical permanente por uropatía obstructiva prostática. En tratamiento con acenocumarol, beta-estimulantes inhalados, furosemida y dutasterida-tamsulosina. Infecciones urinarias de repetición en los 3 últimos meses por diversas bacterias, pH urinario ácido, tratadas con quinolonas y beta-lactámicos. Comienza a acudir a urgencias de forma repetida por obstrucción de la sonda. Orina turbia, espesa, lechosa y de olor amoniacado. Los urocultivos, cultivo de micobacterias y hongos en orina son repetidamente negativos. Pese a recambios de sonda, diversas pautas de antibioterapia oral y quimioprofilaxis antibiótica nocturna, el cuadro continúa reproduciéndose con orinas progresivamente alcalóticas y un sedimento con cristales de fosfato amónico magnésico. Durante uno de esos episodios, al retirar la sonda observamos un material pétreo con forma de cristales hexagonales de color pardo anaranjado (figs. 1 y 2) que se identifica posteriormente como estruvita. Se realiza nuevo urocultivo y crece un Corynebacterium urealyticum (CU) sensible a glucopéptidos. Se trata con teicoplanina durante 15 días con práctica resolución del cuadro.
El CU es un coco bacilo Gram positivo difteriforme, aerobio estricto que se caracterizó entre 1985 y 19922. Inicialmente se denominó coryneforme D2. Es habitante habitual de la piel y las mucosas, principalmente en la región perigenital de las mujeres. Puede aislarse a partir de fómites y en el aire de habitaciones con individuos colonizados. Actúa como un oportunista del aparato urinario e infecta a partir de un inóculo abundante y por selección antibiótica, facilitado por maniobras que permitan su penetración (sondaje, cistoscopia, cirugía, trasplante renal). Se caracteriza por poseer un gen de ureasa sin su represor, capacidad de sintetizar pilis proteináceos, biofilms y adquirir resistencia a múltiples antibióticos por medio de genes (macrólidos, lincosamidas, ketólidos, cloranfenicol, tetraciclina, estreptomicina y a otros AMG) y por mutaciones de DNA girasa (a beta-lactámicos y quinolonas). Provoca cistitis, pielonefritis y cistitis incrustante que en trasplantados puede derivar en una pielitis incrustante con pérdida del injerto. Con menor frecuencia endocarditis, infecciones de partes blandas y osteomielitis. No suele crecer en medios habituales, por lo que se aconseja prolongar el tiempo de incubación y usar medios enriquecidos (Agar sangre a 35°C, agar chocolate, CLED, Agar MacClonkey). Debemos sospecharlo ante cuadros de infecciones urinarias con orinas de pH alcalino, cristales de fosfato amónico magnésico (estruvita) en el sedimento y retenciones urinarias de repetición. Suelen ser resistentes a beta-lactámicos, aminoglucósidos y quinolonas, y sensibles a vancomicina y teicoplanina (in vitro a synercid, linezolid y glicilciclinas). El tratamiento exige la eliminación y desincrustación de cuerpos extraños (sondas, cistoscopia…) y se debe acidificar la orina, para lo cuál es útil el ácido acetohidroxámico (Uronefrex®), la vitamina C, los ácidos fusídico y cítrico y las irrigaciones intravesicales con ácido cítrico, glucono-delta-lactona y carbonato de magnesio (Renacidin®).
En la literatura podemos encontrar principalmente casos aislados3–6 y una revisión en 163 trasplantados1 en la que se dan un 9,8% de cultivos positivos a CU. La patogenia se explica7 a partir de una inflamación prolongada que induce estimulación de citoquinas y factores de crecimiento en la vejiga, con la consecuente activación de células musculares lisas, endoteliales y pericitos que se desdiferencian a osteoblastos, capaces de generar hueso (calcio, hidroxiapatita y colágeno) al estimular proteínas reguladoras de la calcificación. Los restos apoptóticos de las células dañadas actuarían como núcleos de cristalización y el pH alcalino permitiría la precipitación de los cristales. El mecanismo puede bloquearse con tratamiento antibiótico adecuado y acelerarse con inhibidores de la vitamina K, ya que la osteocalcina, esencial en el proceso de calcificación, depende de esta. El acenocumarol, pues, induciría su sobreexpresión lo que supone un factor de riesgo sobreañadido.
Nuestro caso resulta comunicable por la presencia de un material pétreo, conformado por cristales hexagonales que obstruía la sonda vesical repetidamente como puede verse en las figuras.