Cinacalcet resulta efectivo en el control del hiperparatiroidismo secundario de los pacientes en hemodiálisis (HD). Algunos estudios han reportado un buen control del hiperparatiroidismo secundario y un mejor cumplimiento terapéutico tras la administración de calcimiméticos intradiálisis.
ObjetivosAnalizar el efecto de la administración de calcimiméticos posdiálisis sobre el metabolismo óseo mineral y la tolerancia gastrointestinal en nuestra unidad de HD.
Material y métodosEstudio prospectivo unicéntrico de 12 semanas de duración en pacientes en HD tratados con cinacalcet (>2 meses). Dos períodos de estudio (6 semanas): Administración habitual ambulatoria (fase 1) y posthemodiálisis (fase 2). Datos analizados: 1.- Datos bioquímicos metabolismo óseo mineral. 2.-Test síntomas gastrointestinales (Gastrointestinal Symptom Rating Scale [GSRS]) y grado de satisfacción (escala visual analógica [EVA]). 3.-Adherencia: Test de Morisky-Green (MG) y recuento final comprimidos (RC).
ResultadosSesenta y dos pacientes en HD. Catorce recibían cinacalcet (22,5%). Diez pacientes incluidos, edad media 60,9 años y 80,9 meses en HD. Charlson medio: 9. Datos bioquímicos: fase 1 (inicio vs. fin): Ca 8,8±0,5 vs. 9,1±0,7mg/dl (p<0,05); fósforo 5,2±0,8 vs. 4,5±1,6mg/dl, PTHi 353±129 vs. 360±232pg/ml. Adherencia (MG): 70%. Fase 2 (inicio vs. fin): Ca 9,1±0,7 vs. 8,8±0,6mg/dl; fósforo 4,5±1,6 vs. 4,6±1,3mg/dl; PTHi 360,3±232,7 vs. 349±122pg/ml. Adherencia (RC): 89%. Con relación al GSRS y el grado de satisfacción, fueron mejores en la fase 2 (GSRS 7,5±5,2 vs. 4,3±1,9; EVA 4,8±2,3 vs. 6,9±2,8). No se objetivaron cambios significativos en la dosis de calcimiméticos (201 vs. 207mg/sem), número captores fósforo (9 vs. 8,2pac/día), vitamina D nativa (70 vs. 60%) o activadores selectivos receptor vitD (30%), ni en los parámetros de adecuación dialítica.
ConclusionesLa administración de calcimiméticos post diálisis permitió controlar el hiperparatiroidismo secundario de forma eficaz, mejorando la sintomatología gastrointestinal y el grado de satisfacción. Se debe considerar la administración de calcimiméticos post diálisis en aquellos pacientes con escaso cumplimiento terapéutico.
Cinacalcet has proved effective to control secondary hyperparathyroidism in patients on haemodialysis (HD). Some studies have reported an appropriate secondary hyperparathyroidism control and a better compliance after intradialytic use of calcimimetics.
ObjectivesTo assess the effect of post-dialysis calcimimetics use on mineral bone disorders and calcimimetics gastrointestinal tolerability in our HD unit.
Material and methodsA 12-week single-centre prospective study in HD patients treated with cinacalcet (>2 months). Two study periods: Usual outpatient use (Stage 1) and use after HD session (Stage 2). Endpoints: 1) Biochemical MBD data; 2) Gastrointestinal Symptom Rating Scale (GSRS) for gastrointestinal tolerability, and visual analogic scale (VAS) for satisfaction; 3) Adherence: Morisky-Green test (MG) and final tablet count (TC).
ResultsSixty-two HD patients. Fourteen received cinacalcet (22.5%). TEN patients were included, mean age was 60.9 years; patients had received HD for 80.9 months. Mean Charlson index: 9. Biochemical data: Stage 1 (initial vs. final): Ca 8.8±0.5 vs. 9.1±0.7mg/dl (p<0.05); P 5.2±0.8 vs. 4.5±1.6mg/dl, iPTH 360.3±232.7 vs. 349±122 pg/ml. MG: 70%. Stage 2 (initial vs. final): Ca 9.1±0.7 vs. 8.8±0.6mg/dl; P 4.5±1.6 vs. 4.6±1.3mg/dl, iPTH 360.3±232.7 vs. 349±122 pg/ml. TC: 89%. GSRS and VAS were better in Stage 2 (GSRS 7.5±5.2 vs. 4.3±1.9; VAS 4.8±2.3 vs. 6.9±2.8). No significant changes were observed in calcimimetic dose (201 vs. 207mg/wk), number of phosphate binders (9 vs. 8.2 pts/day), native vitamin D (70 vs. 60%), selective vit D receptor activators (30%), or suitable dialysis parameters.
ConclusionsPost-dialysis use of calcimimetic was effective in secondary hyperparathyroidism control, improved gastrointestinal tolerability and ameliorated patients’ satisfaction. Based on our findings, post-dialysis use of calcimimetics should be considered in selected patients with low therapeutic compliance.
La enfermedad renal crónica (ERC) representa un importante problema de salud pública, tanto por su elevada prevalencia como por su importante morbimortalidad cardiovascular y coste socioeconómico1,2.
La prevalencia de la ERC se sitúa aproximadamente en torno al 10% de la población general, aumentando en mayores de 64 años. Alrededor del 1-1,5% requieren tratamiento sustitutivo renal, siendo en la mayoría de los casos mediante hemodiálisis (HD)3–5.
Los objetivos terapéuticos están dirigidos a disminuir y tratar las complicaciones asociadas a la ERC, como la anemia y el hiperparatiroidismo secundario; ya que se ha demostrado una fuerte asociación de estas alteraciones con un incremento de eventos cardiovasculares y fracturas patológicas6–9.
La hipocalcemia, el déficit de vitamina D (calcitriol) y el acúmulo de los niveles de fósforo en los pacientes con ERC son algunos de los múltiples factores que estimulan la síntesis de hormona paratiroidea (PTH) que conduce a la proliferación de las glándulas paratiroideas así como a las diversas anomalías óseas y sistémicas. Actualmente existe una amplia gama de fármacos para su control, entre los cuales destacan los captores del fósforo, la vitamina D nativa, los análogos selectivos de los receptores de la vitamina D y los calcimiméticos10–12.
El mecanismo de acción de los calcimiméticos consiste en aumentar la sensibilidad del receptor sensible al calcio situado en la superficie de la célula principal de la glándula paratiroides, reduciendo así las concentraciones séricas de PTH, así como las de calcio y fósforo13–15.
La utilización de calcimiméticos está indicada en aquellos casos de hiperparatiroidismo secundario de difícil control en el cual no se consiguen los niveles óptimos de PTH a pesar de la administración de captores de fósforo o vitamina D. Es un fármaco con un coste elevado, de administración vía oral y de dispensación hospitalaria por lo que los pacientes deben acudir periódicamente a recoger el fármaco a su centro hospitalario de referencia. Sus principales efectos adversos se evidencian a nivel gastrointestinal, fundamentalmente en forma de náuseas y vómitos asociados a dosis elevadas para el control del hiperparatiroidismo16–18.
Teniendo en cuenta las características de los pacientes con ERC en HD y todas las particularidades relacionadas con la administración de los calcimiméticos, no es difícil entender que exista un pobre cumplimiento terapéutico y un difícil control del hiperparatiroidismo, con las implicaciones que ello conlleva.
Son escasos y muy limitados los trabajos previos disponibles en la literatura que han analizado la efectividad de la administración controlada de calcimiméticos intradiálisis, consiguiendo como resultados, por una parte, un buen control del hiperparatiroidismo secundario sin efectos adversos significativos y, por otra, un mejor cumplimiento terapéutico19–21.
Con este estudio se pretende analizar el efecto sobre el control de las alteraciones del metabolismo óseo mineral así como evaluar la tolerancia gastrointestinal tras la administración controlada de los calcimiméticos posdiálisis en nuestra unidad de HD con la finalidad de conseguir un mejor cumplimiento terapéutico y una menor aparición de efectos secundarios.
Material y métodosDurante los meses de noviembre 2012 a febrero 2013 se realizó un estudio prospectivo unicéntrico observacional de 12 semanas de duración en los pacientes en programa de HD periódica de nuestro centro, aprobado por el comité de ética y realizado de acuerdo con las normas de la declaración de Helsinki.
Los criterios de inclusión fueron estar en programa de HD al menos durante 2 meses previos en nuestra unidad, recibir tratamiento con calcimiméticos al menos 2 meses previos a la inclusión y otorgar el consentimiento informado. Los criterios de exclusión fueron hipocalcemia mantenida (<8,8mg/dl) tras ser corregida por albúmina sérica y no otorgar el consentimiento informado.
Se establecieron 2 fases de estudio de 6 semanas de duración cada una. En una primera fase (fase 1) los pacientes incluidos recibían el tratamiento con calcimimético prescrito según la práctica clínica habitual (toma diaria y ambulatoria) previa recogida en el servicio de Farmacia de nuestro centro por parte del paciente. En la segunda fase (fase 2), el calcimimético fue administrado al final de cada sesión de HD (3 veces a la semana) bajo supervisión de enfermería, sin modificaciones en la dosis prescrita en la fase 1 ni necesidad de acudir a la farmacia hospitalaria. Se utilizaron comprimidos de 30 y 60mg de calcimimético. La totalidad de comprimidos prescritos fueron custodiados y almacenados por el personal de enfermería de HD. Se realizó la suma de la dosis diaria de una semana, obteniendo la dosis semanal (mg/sem) que se dividió en 3 para su administración al finalizar la sesión de HD, intentando dar el menor número de comprimidos posible. Por ejemplo: si la dosis a administrar era de 210mg/sem (30mg/día); se repartía de la siguiente manera: 1.er día 60mg (un comprimido), 2.o día 60mg (un comprimido) y 3.er día 90mg (un comprimido de 60mg y un comprimido de 30mg) dejando siempre la mayor dosis para el último día de HD.
Se recogieron las principales variables demográficas y bioquímicas relacionadas con el metabolismo óseo mineral así como las variables relacionadas con la adecuación y características de HD al inicio y final de cada fase de estudio, coincidiendo con los controles analíticos programados de forma habitual de los pacientes en HD.
Con relación al tratamiento con calcimiméticos, se recogió la dosis semanal (mg/sem), la hora habitual de administración y el tiempo previo bajo tratamiento (meses). Asimismo se recogió el número de comprimidos y tipo de captores del fósforo (captores cálcicos, no cálcicos, hidróxido aluminio), análogos selectivos de los receptores de la vitamina D y vitamina D nativa.
Durante la tercera semana de cada fase se valoró la tolerancia gastrointestinal y grado de satisfacción. Para la tolerancia gastrointestinal se utilizó como instrumento de evaluación el test de enfermedad gastrointestinal, Gastrointestinal Symptom Rating Scale (GSRS), que incluye 15 ítems agrupados en 5 bloques con diferentes síntomas gastrointestinales. Los 5 grupos de síntomas representan: reflujo, dolor abdominal, diarrea, indigestión y estreñimiento. Contiene una escala tipo Likert de 7 grados, donde 1 representa la opción más positiva y 7 la opción más negativa. Para la evaluación del grado de satisfacción se utilizó como instrumento de medida una escala visual analógica, con puntuaciones y representación visual entre 0 (peor grado) y 10 (mayor grado de satisfacción).
La adherencia terapéutica se valoró al inicio de la fase 1 a través del test de Morinsky-Green que consiste en un método indirecto para evaluar la adherencia terapéutica mediante un autocuestionario de 4 preguntas. Valora si el paciente adopta actitudes correctas en relación con la terapéutica. Para considerar una buena adherencia, la respuesta a todas las preguntas debe ser adecuada. Al finalizar, la fase 2 se valoró a través del recuento de comprimidos administrados.
El análisis estadístico se realizó con el programa SPSS versión 18.0 (SPSS Inc, Chicago, IL, EE. UU.). Las variables cuantitativas se expresaron mediante la media y desviación estándar. Las variables cualitativas mediante porcentaje. La comparación de los datos cuantitativos se realizó mediante el test de Wilcoxon para variables relacionadas no paramétricas y los datos cualitativos mediante el test de McNemar; considerando significación estadística aquellas relaciones con un valor de p <0,05.
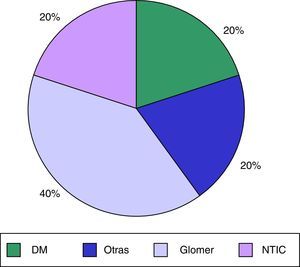
ResultadosSe analizaron 62 pacientes en programa de HD prevalentes en nuestra unidad de HD, de los cuales 14 (22,5%) recibían tratamiento con calcimiméticos (cinacalcet), 10 pacientes fueron incluidos y 4 excluidos (uno por alteración psiquiátrica y 3 por tiempo con tratamiento<2 meses). Un 40% eran hombres, con una edad media de 60,9±14,1 años y un tiempo medio en HD de 80,9±114,9 meses. La principal etiología de la ERC de nuestros pacientes fue la diabetes mellitus en un 40%. El resto de las etiologías se muestran en la figura 1. El índice de Charlson medio fue de 9±4,2. La dosis media de cinacalcet fue de 201±155mg/semana y el tiempo medio de uso previo fue de 23,7±20,5meses. Ninguno de nuestros pacientes presentaba enfermedad digestiva previamente conocida.
Los principales datos bioquímicos del metabolismo óseo mineral quedan reflejados en la tabla 1.
Principales datos bioquímicos del metabolismo óseo mineral. Fase 1 y fase 2 de estudio
| Fase 1 | Fase 2 | |||||
|---|---|---|---|---|---|---|
| Inicio | Final | SE | Inicio | Final | SE | |
| Ca (mg/dl) | 8,8±0,5 | 9,1±0,7 | 0,045* | 9,1±0,7 | 8,8±0,6 | 0,049* |
| P (mg/dl) | 5,2±,8 | 4,5±1,6 | 0,270 | 4,5±1,6 | 4,6±1,3 | 0,766 |
| Ca x P (mg/dl)2 | 45,7±0,4 | 40,9±11,2 | 0,652 | 40,9±11,2 | 40,48±7,81 | 0,983 |
| PTHi (pg/ml) | 353±129 | 360±232 | 0,929 | 360±232 | 350±122 | 0,880 |
Ca: calcio; Ca×P: producto calcio-fósforo; P: fósforo; PTHi: hormona paratiroidea intacta; SE: significación estadística.
Durante la fase 1 se objetivó un incremento significativo del calcio sérico (inicio vs. fin: Ca 8,8±0,5 vs. 9,1±0,7mg/dl; p=0,045). No se observaron modificaciones relevantes en los valores de fósforo (P 5,2±0,8 vs. 4,5±1,6mg/dl; p=0,270) y hormona paratiroidea intacta (PTHi 353±129 vs. 360±232 pg/ml; p=0,929). Durante la fase 2, se vio una disminución significativa del calcio sérico (inicio vs. fin: Ca 9,1±0,7 vs. 8,8±0,6mg/dl; p=0,049) y al igual que en la primera fase no se observaron modificaciones relevantes en los valores de fósforo (P: 4,5±1,6 vs. 4,6±1,3mg/dl; p=0,766) ni hormona paratiroidea intacta (PTHi 360,3±232,7 vs. 349±122 pg/ml; p=0,880). Del mismo modo, no evidenciamos modificaciones relevantes en los valores de albúmina sérica (39±4,9 vs. 38,4±3,85mg/dl; p=0.678), fosfatasa alcalina sérica (FA 151,2±148,8 vs. 155,3±162mg/dl; p=0,515), magnesio (Mg 2,44±0,52 vs. 2,44±0,54mg/dl; p=0,472) o vitamina D nativa (36,49±19,26 vs. 37,22±10,44ng/ml; p=0,861) a lo largo del estudio.
En ambas fases no hubo cambios significativos en relación con la dosis media de cinacalcet (201±155mg/semana vs. 207±151mg/sem; p=0,816), ni en cuanto al número (9 vs. 8,2mg/semana captores/paciente/día; p=0,678) y tipo de captores de fósforo (85% captores cálcicos, 40% no cálcicos, 15% alumínicos; en ambas fases respectivamente), ni en el porcentaje de utilización de vitamina D nativa (70 vs. 60%) o análogos selectivos de la vitamina D (30% en ambas fases). No se observaron diferencias en los parámetros de adecuación dialítica (Kt/V Daugirdas segunda gen: 1,69±0,26 vs. 1,71±0,27; p=0,649) ni en las características de HD (baño calcio 2,5mEq/l: 20%, 3mEq/l: 50% y 3,5mEq/l: 30%; en ambas fases)
Tolerancia gastrointestinal y grado de satisfacciónSe observó una mejoría significativa de la gravedad de los síntomas gastrointestinales en aquellos pacientes en tratamiento con cinacalcet de forma controlada al finalizar la sesión de HD (fase 1 vs. fase 2 GSRS: 7,5±5,2 vs. 4,3±1,9; p=0,011). En el análisis en las diferentes dimensiones del GSRS, observamos una menor puntuación en todas ellas, fundamentalmente a expensas de la presencia de diarrea e indigestión, si bien no se alcanzó la significación estadística (tabla 2). No observamos cambios en la toma de medicamentos antiácidos ni protectores gástricos a lo largo del estudio (90% en ambas fases). La totalidad de los pacientes completaron el estudio.
Valoración del la sintomatología gastrointestinal (GSRS) y el grado de satisfacción (EVA)
| Inicio | Final | SE | |
|---|---|---|---|
| GSRS | 7,5±5,2 | 4,3±1,9 | 0,011* |
| Reflujo | 0,6±0,2 | 0,2±0,2 | 0,487 |
| Dolor abdominal | 1,6±0,3 | 1±0,4 | 0,335 |
| Estreñimiento | 1,5±0,3 | 1,4±0,3 | 0,235 |
| Diarrea | 1,6±0,2 | 0,6±0,2 | 0,085 |
| Indigestión | 2,2±0,4 | 1,1±0,4 | 0,074 |
| EVA | 4,8±2,3 | 6,9±2,8 | 0,021* |
EVA: escala visual analógica; GSRS: Gastrointestinal Symptom Rating Scale; SE: significación estadística.
Promedio de la puntuación (1-5) de los síntomas según las distintas dimensiones. Inicio vs. final: Dimensiones GSRS: reflujo, dolor abdominal, estreñimiento, diarrea e indigestión.
Asimismo, se observó una mayor puntuación en el grado de satisfacción mediante la escala visual (4,8±2,3 vs. 6,9±2,8; p=0,021) en los pacientes que recibieron tratamiento con cinacalcet de forma controlada al finalizar la sesión de HD.
Adherencia terapéuticaDurante la fase 1, a través del test de Morisky-Green se observó una adherencia terapéutica del 70%. Durante la fase 2, mediante el recuento de comprimidos, obtuvimos una adherencia del 89% (245 comprimidos administrados/276 comprimidos prescritos).
DiscusiónLa administración controlada de calcimiméticos de forma intermitente después de las sesiones de diálisis resultó efectiva en el control del hiperparatiroidismo secundario de nuestros pacientes. Existen en la literatura algunos estudios recientes que han analizado la efectividad de la administración controlada de calcimiméticos intradiálisis, consiguiendo como resultados, por una parte, un buen control del hiperparatiroidismo secundario sin efectos adversos significativos y, por otra, un mejor cumplimiento terapéutico. Al Hilali et al.19 evidenciaron en un grupo de 27 pacientes en programa de HD, un efecto similar en la supresión de la PTH tras la administración de calcimiméticos 2 veces/sem después de diálisis comparada con la pauta diaria. Igualmente, Haq y Chaaban20,21 observaron que la administración de cinacalcet posdiálisis fue igual de efectiva que la pauta habitual domiciliaria diaria en un grupo de 11 pacientes tras 16 semanas de seguimiento. A diferencia de los mencionados anteriormente, en nuestro estudio no se disponía de grupo comparativo, no se realizaron modificaciones en los tratamientos involucrados en el control del hiperparatiroidismo ni las características de la diálisis y además nuestros pacientes recibían tratamiento con calcimiméticos previamente. Si bien es cierto que con un mayor cumplimiento terapéutico se esperaría encontrar mejores valores en el control del metabolismo óseo mineral (sobre todo de calcemia y PTHi), en nuestro estudio únicamente obtuvimos cambios estadísticos significativos en los valores de calcio sérico en las distintas fases, sin evidenciar cambios en los valores de fósforo y PTHi. En este sentido, las variaciones del Ca sérico podrían traducir una toma incompleta de calcimiméticos en la fase 1, así como un correcto cumplimiento terapéutico de calcimiméticos en la fase 2. La ausencia de cambios significativos en los valores de PTHi podría atribuirse, en parte, al empleo de un único valor aislado y no promedios de valores de PTHi, así como a la gran variabilidad de los valores promedios en una muestra con tamaño reducido y analizados con test no paramétricos. No obstante, nuestros pacientes permanecieron dentro de los objetivos terapéuticos de las guías del metabolismo óseo mineral de las distintas sociedades nefrológicas en ambas fases del estudio sin cambios en las dosis administradas, por lo que entendemos que las 2 pautas de administración son igual de eficaces en el control del hiperparatiroidismo secundario.
Los efectos adversos de los diversos fármacos pueden contribuir al consumo irregular de los mismos. Son ampliamente conocidos los efectos secundarios de los calcimiméticos a nivel gastrointestinal siendo los síntomas más frecuentes las náuseas (21-43%) y los vómitos (13-30%)11,12. La toma nocturna y la toma asociada a ingesta alimentaria son algunas estrategias utilizadas para minimizar estos efectos adversos22–25. En nuestro estudio, se observó una mejoría de la sintomatología gastrointestinal tras la administración controlada de calcimiméticos posdiálisis, fundamentalmente a expensas de la presencia de diarreas e indigestión, alcanzando reducciones del 50% en la presencia de estos síntomas. Estos hallazgos fueron atribuidos a la toma intermitente del mismo y se suprimió su toma durante un total de 4 días/sem, evitando así la aparición de molestias gastrointestinales asociadas a su pauta diaria. En este sentido, la baja dosis prescrita en nuestros pacientes (la mayoría de los pacientes recibía una dosis habitual no superior a 60mg/día) así como la habitual ingesta alimenticia intradiálisis, podrían minimizar la sintomatología gastrointestinal. De todos modos, fue tras la administración controlada cuando nuestros pacientes recibieron dosis más elevadas de las que tenían habitualmente prescritas y tampoco hubo ningún abandono por intolerancia gastrointestinal a lo largo del estudio. Por otra parte, durante la administración controlada posdiálisis se observó una mejoría significativa del grado de satisfacción. Este hallazgo se podría explicar en primer lugar por la menor sintomatología gastrointestinal observada, y en segundo lugar, por el simple hecho de evitar las molestias derivadas de la recogida del mismo en la farmacia hospitalaria de nuestro centro, alejada físicamente de la Unidad de diálisis y con un horario establecido no siempre coincidente con las sesiones habituales de HD. Tras los resultados obtenidos en nuestro estudio, consideraremos la administración posdiálisis en aquellos pacientes con dificultades para acceder a la farmacia del hospital (tanto por condición física como por turno de HD asignado).
Como se ha comentado con anterioridad, los pacientes en HD tienen una gran carga farmacológica asociada su elevada patología concomitante, pudiendo originar un mal cumplimiento terapéutico. El promedio de las tasas de cumplimiento terapéutico en ensayos controlados aleatorizados en pacientes con ERC en programa de HD se sitúa en torno al 42-78% y va disminuyendo con el paso del tiempo26–30. En nuestro estudio, la tasa de adherencia es similar a la previamente publicada y como era previsible, con la administración controlada posdiálisis se consiguió mejorar el cumplimiento terapéutico a pesar de no haber asumido la misma forma de valoración del cumplimiento del tratamiento en las distintas fases del estudio. La utilización del test de Morisky-Green en la fase inicial, ampliamente usado en diversos estudios poblacionales de inercia y cumplimiento terapéutico fundamentalmente en el ámbito de la población hipertensa, fue considerado el más neutral de cara a evitar factores de confusión e interpretación posterior (como podría ser por ejemplo el incitar a la toma del medicamento en aquellos pacientes supuestamente incumplidores). Por el contrario, en la fase 2, de cara a ser más objetivos, se decidió utilizar el recuento final de comprimidos C, al disponer de toda la cantidad y número de comprimidos del medicamento utilizado. No obstante, a pesar del control por parte de enfermería se evidenció un 11% de incumplimiento terapéutico. Este hecho podría ser atribuible tanto a descuidos en la administración del medicamento por parte del personal de enfermería en los momentos finales de la desconexión del paciente, en las que existen otras tareas asistenciales; como a posibles errores en el número de comprimidos a administrar (por ejemplo, 2 comprimidos en vez de 3) tras la sesión de HD. Tal vez utilizar una única pauta de administración o la toma del medicamento en otro momento de la sesión de HD podría minimizar este leve incumplimiento, si bien se eligió el final de la sesión de HD para asegurar el mismo momento en la toma del medicamento en la fase 2 por todos los pacientes y evitar errores en la valoración de la sintomatología gastrointestinal (fundamentalmente con la comida intradiálisis), así como para no coincidir con la administración de otros medicamentos habituales en las sesiones de HD por parte de enfermería.
Un punto a destacar en nuestro trabajo es que se realizó siguiendo la práctica clínica habitual. En este sentido, a pesar de la indicación médica, no resulta infrecuente a día de hoy administrar pautas a días alternos y dosis bajas de calcimiméticos, hechos derivados del mejor control del hiperparatiroidismo secundario en los últimos tiempos. Por otro lado, dentro de las múltiples limitaciones de nuestro estudio, algunas ya mencionadas previamente, destacar el escaso número de pacientes que condiciona la utilización de test estadísticos no paramétricos y el corto tiempo de seguimiento de nuestros pacientes; si bien se eligió un período de 12 sem para evitar los posibles cambios en los medicamentos asociados al metabolismo mineral habituales tras la determinación analítica trimestral habitual. Lamentablemente tampoco se pudo realizar un análisis coste-económico. Estudios con mayor número de pacientes y tiempo de duración serían necesarios para confirmar la efectividad y tolerancia gastrointestinal de los calcimiméticos para el control de hiperparatiroidismo secundario administrados de forma controlada post-HD.
Como conclusiones podemos decir que en nuestro estudio la administración controlada de calcimiméticos posdiálisis resultó efectiva en el control del hiperparatiroidismo secundario, con menos efectos gastrointestinales y mayor grado de satisfacción. Con estos resultados consideramos que la administración de calcimiméticos posdiálisis resultó efectiva y sobre todo puede ser beneficiosa en determinados pacientes con escasa adherencia terapéutica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.