INTRODUCCIÓN
La infección por citomegalovirus es común en la población general. Cursa en numerosas ocasiones de forma asintomática y el virus queda latente en el organismo sin clínica aparente. A los 30 años de edad hasta un 70% de la población ha desarrollado anticuerpos contra el CMV. Sin embargo, cuando el paciente está inmunodeprimido, como es el caso de los receptores de TOS, el virus puede abandonar su estado de latencia y causar morbilidad significativa y mortalidad en los primeros meses del trasplante1-4. El cuadro clínico de la enfermedad por CMV tiene un amplio rango de intensidad y severidad pudiendo oscilar desde una apariencia pseudogripal con fiebre, malestar general, mialgias y neutropenia hasta formas más graves con afectación digestiva (colitis, hepatitis, gastritis), respiratoria (neumonitis) y/o neurológica (encefalitis)3. También se ha relacionado el CMV con efectos perjudiciales sobre el órgano trasplantado como son la menor supervivencia del injerto5,6, el aumento del número de episodios de rechazo agudo y de la frecuencia de rechazo crónico7, ateroesclerosis8, de procesos linfoproliferativos9 de costes sanitarios10 y de infecciones oportunistas en el receptor de tipo bacteriano y fúngico11.
Como consecuencia de la enorme importancia del CMV en los pacientes trasplantados, son numerosas las estrategias de prevención y tratamiento de la enfermedad por CMV que se han desarrollado hasta la fecha. En una reciente revisión sistemática, Hodson y cols., compararon los diferentes regímenes de profilaxis y tratamiento de la infección por citomegalovirus y concluyeron que las medicaciones antivirales ganciclovir, valganciclovir y aciclovir, usadas como profilaxis, mejoraban el pronóstico de los receptores de trasplante de órgano sólido. Reducían el riesgo de mortalidad por CMV en un 60% y la enfermedad derivada de herpes simple, herpes zoster e infecciones bacterianas entre un 35% y un 70%12. En estudios de comparación directa se vio que ganciclovir era más efectivo que aciclovir en la prevención de la infección y enfermedad por CMV. En un ensayo llevado a cabo comparando ganciclovir y su prodroga valganciclovir no se encontraron diferencias estadísticamente significativas entre ambas, sugiriendo que los beneficios hasta ahora demostrados por ganciclovir podrían extrapolarse a valganciclovir13.
En nuestro centro, las estrategias de prevención de la enfermedad por CMV han seguido las orientaciones generales que venían marcadas por la época del trasplante. En la década de los 80, no se realizaba ningún tipo de profilaxis para la enfermedad por CMV y el índice de enfermedad grave diagnosticada era del 62%. En la década de los 90 se adoptó la profilaxis universal de todos los trasplantes renales con aciclovir oral durante 3 meses siguiendo la pauta recomendada por Balfour14. Los resultados obtenidos con dicha profilaxis universal fueron satisfactorios y mejoraron claramente la política anterior en la que no existía ningún tipo de tratamiento profiláctico. La enfermedad grave cayó del 62% al 9%15. Posteriormente, se abandonó el tratamiento profiláctico universal con aciclovir y se adoptó una postura terapéutica de tratamiento anticipado de la infección por CMV con ganciclovir oral. El diagnóstico de infección por CMV se hacía con antigenemia (pp65) y no se hacía profilaxis en los casos identificados de riesgo de infección-enfermedad por CMV. El tratamiento anticipado no fue capaz de evitar la enfermedad, ya que una vez iniciada la replicación viral el diagnóstico precoz con la antigenemia no evitaba la progresión de la infección a enfermedad16. Por todo ello decidimos realizar un nuevo cambio de protocolo en el que incorporaríamos nuevos cambios diagnósticos y terapéuticos. La PCR-CMV cuantitativa en tiempo real sustituyó a la antigenemia con el pp65 y el valganciclovir oral al ganciclovir oral. El tratamiento profiláctico debía ser general a todas las situaciones de riesgo.
Valganciclovir es un éster valina prodroga de ganciclovir que fue desarrollado para superar las limitaciones del ganciclovir oral y endovenoso. Una dosis diaria única de 900 mg vía oral proporciona unos niveles plasmáticos comparables a los conseguidos con 5 mg/kg de ganciclovir ev. La biodisponibilidad es hasta 10 veces más alta que la del ganciclovir oral13. Dicha biodisponibilidad contribuye a disminuir los casos de resistencia al ganciclovir que pueden ocurrir cuando hay una baja exposición a la droga17-19.
El objetivo de nuestro estudio fue evaluar la incidencia e intensidad de la enfermedad por CMV en un grupo de trasplantados renales recientes que iban a realizar tratamiento profiláctico o anticipado de la enfermedad por CMV según la situación de riesgo basal de sufrir la misma. El fármaco que se iba a usar como base de tratamiento era valganciclovir oral a dosis de 900 mg/día. Los resultados se compararían con nuestras series históricas anteriormente descritas y con la literatura.
MATERIAL Y MÉTODOS
El estudio comprendió desde mayo de 2004 hasta abril de 2006. Se eligieron 150 pacientes con edad superior a 18 años y con adecuada función renal y hematológica, que fueron receptores de un trasplante renal en nuestro centro (102 de donante cadáver y 48 de donante vivo). Los criterios de exclusión incluyeron tratamiento contra CMV durante los 30 días previos, diarrea severa o incontrolada y evidencias de mal absorción.
La inmunosupresión estándar inicial fue triple (tacrolimus 0,1 mg/kg/12 horas vo, micofenolato mofetil 1 g/12 horas vo y prednisona 1 mg/kg/día vo y descenso progresivo). Aquellos pacientes que experimentaron disfunción inicial del injerto suspendieron temporalmente la administración de tacrolimus y recibieron 1,25 mg/kg/dia de Timoglobulina® (suero antilinfocitario policlonal de conejo) hasta la resolución de la disfunción del injerto. Las dosis de Timoglobulina® se ajustaron diariamente según recuento linfocitario y no se prolongó el tratamiento más allá de 10 días o de una dosis total acumulada de 10 mg/kg. El tacrolimus se reintrodujo progresivamente y de forma solapada con la retirada de la Timoglobulina®.
Desde el momento de recibir el injerto se llevó a cabo un seguimiento de los pacientes mediante la monitorización de los síntomas de enfermedad por CMV (descritos anteriormente), el tratamiento recibido, el desarrollo de infecciones oportunistas, los episodios de rechazo agudo y la supervivencia del injerto. Entre el primer y el cuarto mes del trasplante se les practicó de forma semanal una PCR-CMV cuantitativa en tiempo real usando el Cobas Amplicor CMV Monitor® Test (Roche Diagnostics, Branchburg, NJ, USA) y se registraron todos los eventos clínicos relacionados con una posible enfermedad por CMV según intensidad y tipo de afectación, tal y como se detalla en la tabla I. El síndrome pseudomononucleósico fue definido como viremia con > 38º C en > dos ocasiones en > 24 h en un período de 7 días, resultados de laboratorio positivos para CMV, y al menosuno de los siguientes casos: astenia, dos acontecimientos sucesivos de leucopenia (definido como un recuento de leucocitos < 3.500/mL o una disminución del 20% de células si el recuento previo al desarrollo de síntomas clínicos es < 4.000/mL) en un intervalo > 24 h, linfocitosis atípica > 5%, trombocitopenia, o elevación de enzimas hepáticos > 2 veces por encima del límite superior de la normalidad.
Los pacientes se dividieron en dos grupos con relación al riesgo de padecer infección-enfermedad por CMV:
¿ Grupo de alto riesgo: Comprendió 3 tipos de situaciones, aquellos receptores con serología previa negativa para CMV que recibieron un injerto de un donante positivo (D+/R-), aquéllos que requirieron de tratamiento con suero antilinfocitario (SAL) y aquellos que necesitaron un aumento de su inmunosupresión basal como consecuencia de uno o más episodios de rechazo agudo (RA). Determinados pacientes cumplieron más de uno de estos criterios de riesgo. Todo este grupo de pacientes recibió tratamiento con valganciclovir oral durante 3 meses de forma profiláctica. Las dosis se ajustaron a función renal.
¿ Grupo de riesgo estándar: Abarcó a todos los trasplantados que no cumplían ninguno de los criterios anteriores. Cuando la PCR-CMV fue superior a 1.000 copias/mL se inició tratamiento anticipado mediante valganciclovir oral durante 3 meses a las dosis que se detallan en la tabla II. Si los síntomas de enfermedad precedieron a la detección anticipada del CMV en sangre mediante PCR, el tratamiento fue con ganciclovir ev durante 14 días y se completó el tratamiento hasta 3 meses con valganciclovir oral.
El objetivo de eficacia primaria fue evaluar la proporción de pacientes que desarrollaron la enfermedad por CMV durante los primeros tres meses post trasplante.
Se utilizó estadística descriptiva (media, mediana, desviación estándar y proporciones) para analizar las características de los pacientes, los grupos de tratamiento y los eventos acontecidos durante el estudio.
RESULTADOS
Grupo de alto riesgo. Tratamiento profiláctico
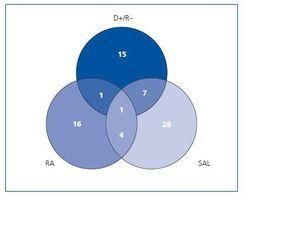
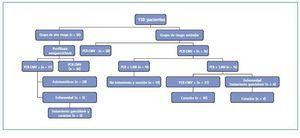
Un total de 66 pacientes (44,29% del total) fue considerado de alto riesgo para enfermedad por CMV y recibió tratamiento profiláctico con valganciclovir oral ajustado a función renal durante un período de 3 meses. Los criterios clínicos y analíticos que condicionaron el inicio de tratamiento profiláctico fueron descritos anteriormente. La distribución de los pacientes de riesgo por grupos se detalla en la figura 1 y fue la siguiente:
¿ Grupo D+/R-, 24 pacientes, los cuales recibieron valganciclovir oral desde el inicio de la tolerancia oral posttrasplante.
¿ Grupo SAL, 40 pacientes, algunos de los cuales ya habían iniciado la profilaxis por ser grupo de riesgo D+/R. El resto de pacientes de este grupo inició la profilaxis concomitantemente con el inicio de tratamiento con suero antilinfocitario.
¿ Grupo RA, 22 pacientes, que iniciaron valganciclovir conjuntamente con los bolus de corticoides si no lo habían recibido previamente por cualquiera de las dos causas anteriores.
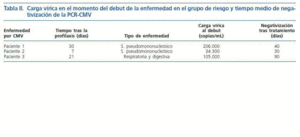
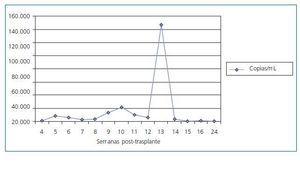
Del conjunto de 66 pacientes del grupo de riesgo, 35 (53%) dieron siempre resultado de PCR-CMV negativa durante todo el período de seguimiento y no presentaron enfermedad en ningún momento. El resto, 31 pacientes (47%), tuvo alguna determinación positiva de la PCR-CMV. 3 de los 66 pacientes (4,5%) cumplió criterios de enfermedad por CMV, siendo definida en 2 casos (3%) como de intensidad leve-moderada (síndrome pseudomononucleósico) y en 1 caso (1,5%) de intensidad grave, por ser afectación pulmonar y digestiva. En los 3 casos la enfermedad surgió tras el cese del tratamiento profiláctico con una media de 20 días tras el cese del mismo. En ningún caso la enfermedad ocurrió durante el tratamiento profiláctico (tabla II). Dos de los pacientes evolucionaron positivamente a la curación mediante el uso de ganciclovir ev y en un caso necesitó adición de foscarnet al ganciclovir por resistencia clínica a éste último. La PCR-CMV media de todo el grupo de riesgo se describe en la figura 2. Se aprecia el aumento de carga vírica que se produce al cese del tratamiento profiláctico y que viene dada por los 3 pacientes que sufrieron a enfermedad. Los 24 pacientes D+/R- demostraron una evolución similar al resto del grupo de riesgo, detectándose PCRCMV + en 11 de ellos (45,8%).
Grupo de riesgo estándar. Tratamiento anticipado
El resto de pacientes (grupo de bajo riesgo) fue seguido durante 12 semanas a partir del primer mes mediante PCRCMV semanal. Cuando las copias estaban entre 100 y 1.000 se intensificó el seguimiento (2 veces por semana) pero no se inició tratamiento. Se trató mediante valganciclovir oral (900 mg/día ajustado a función renal) a aquellos pacientes que presentaron PCR-CMV > 1.000 copias/mL sin signos o síntomas de enfermedad (tratamiento anticipado). Cuando el paciente tenía PCR-CMV+ y signos o síntomas de enfermedad se trató con ganciclovir ev 14 días y se finalizó el tratamiento hasta 3meses con valganciclovir oral.
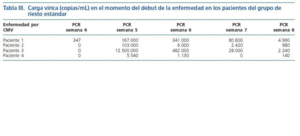
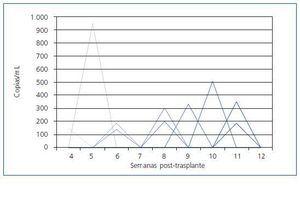
Un total de 84 de los 150 pacientes fueron catalogados como de bajo riesgo para enfermedad por CMV (56%). Del conjunto de 84 pacientes, 58 (70%) dieron siempre resultado de PCR-CMV negativa durante todo el período de seguimiento y no presentaron enfermedad en ningún momento. El resto, 26 pacientes (30%), tuvo alguna determinación positiva de la PCR-CMV, aunque en su mayoría asintomáticos (85%). Diez de estos 26 pacientes tuvieron siempre su PCR-CMV por debajo de 1.000 copias/mL y nunca fueron tratados (fig. 3). Dieciséis pacientes fueron tratados por distintas causas. Doce pacientes fueron tratados de forma anticipada por tener una PCR-CMV >1.000 copias/mL. La evolución de la carga vírica media de estos pacientes hasta la negativización durante el tratamiento con valganciclovir oral se detalla en la figura 4. El número medio de copias estaba en torno a 3.000/mL en la primera PCR-CMV+. Todos ellos permanecieron asintomáticos y sin recidivas. Los 4 restantes cumplieron criterios de enfermedad, lo que supone una incidencia de enfermedad del 4,7% (4/84 pacientes) en el grupo de bajo riesgo, siendo definida en todos ellos de intensidad leve-moderada. El tiempo medio de debut de la enfermedad fue a los 35 días del trasplante (31-40 días) y el número de copias/mL fue en general superior a 100.000 ya en la primera determinación (tabla III). Un sólo caso de los 4 anteriores progresó a enfermedad tras no haberse iniciado tratamiento al detectarse una PCR inicial < 1.000 copias/mL. Los otros 3 debutaron como enfermedad. El tratamiento combinado con ganciclovir ev 14 días seguido de valganciclovir oral 3 meses resolvió todos los casos sin dificultad.
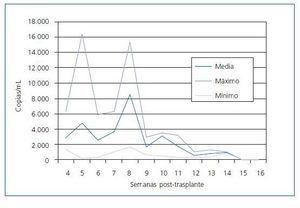
La evolución de todos los pacientes se detalla en la figura 5.
DISCUSIÓN
Grupo de alto riesgo
El tratamiento profiláctico con valganciclovir oral se manifestó como de gran efectividad en la prevención de la enfermedad por CMV en el grupo de pacientes con alto riesgo de sufrirla. Del total de 66 pacientes de alto riesgo, únicamente 3 (4,5%) desarrollaron la enfermedad y, de ellos, dos lo hicieron con intensidad leve-moderada, y en 1 caso de entendida grave (1,5%). Nuestra experiencia15,16 con los pacientes de riesgo a principios de los 90 había traducido unos superiores índices de enfermedad. La serie histórica de pacientes de riesgo que no siguieron ningún tipo de profilaxis frente al CMV sufrió enfermedad por CMV en un 62,5% de ocasiones, siendo de intensidad leve-moderada en un 37% y de intensidad grave en un 25%. Un 38% de pacientes permaneció asintomático. Posteriormente y mediante la profilaxis con aciclovir oral durante 3 meses siguiendo el esquema ideado por Balfour14 nuestros porcentajes de enfermedad por CMV en el grupo de riesgo descendieron del 62,5% al 28%, existiendo una diferencia estadísticamente significativa (p < 0,05) con el grupo que no llevó profilaxis. La conveniencia del tratamiento profiláctico en el grupo de riesgo ya había sido ampliamente demostrada en la literatura por numerosos autores. En un reciente meta-análisis que abarcaba un importante número de estudios al respecto, Kalil y cols.20 concluyen que el tratamiento profiláctico universal, ya sea con aciclovir o con ganciclovir ral, disminuye la incidencia y severidad de la infección por CMV así como el número e intensidad de los episodios de rechazo agudo aunque en dicho meta análisis no se pudo hacer una comparación directa entre ambos fármacos. También aporta beneficios en número de infecciones bacterianas y fúngicas así como en disminuir la posibilidad de fallecimiento del paciente. En nuestro Centro y, coincidiendo con la introducción del ganciclovir oral, abandonamos en 1997 la profilaxis universal con aciclovir de los pacientes de riesgo y utilizamos en ellos tratamiento anticipado con ganciclovir oral cuando la detección del antígeno pp65 fue positiva16. Mediante dicha estrategia, se detectó antigenemia positiva en el 67% de los pacientes del grupo de riesgo, pero el 100% de los casos que tenía antigenemia positiva desarrolló enfermedad grave. Ello demostró que los pacientes del grupo de riesgo requerían siempre un tratamiento profiláctico anti-CMV. La detección anticipada del virus no permitía evitar la enfermedad si no había profilaxis previa. Bajo estos preceptos adquiridos en nuestra propia experiencia decidimos realizar un protocolo clínico del grupo de riesgo basado en las siguientes ideas:
a) La profilaxis era imprescindible en este grupo ya que, en caso contrario, no podríamos evitar la enfermedad.
b) Valganciclovir oral tiene una alta biodisponibilidad y permite realizar tratamiento profiláctico durante un período largo de tiempo de forma cómoda para el paciente, evitando ingresos hospitalarios, hospital de día y administración de medicación intravenosa.
c) La adición de la PCR-CMV cuantitativa en tiempo real con carácter semanal nos podría ayudar a tener un buen control de la evolución de la infección por CMV en el paciente de riesgo e indicarnos cuales serían los factores predictivos del desarrollo de enfermedad.
Finalizado el período de seguimiento de los pacientes llegamos a las siguientes observaciones:
a) Ninguno de los 66 pacientes de riesgo sufrió enfermedad por CMV durante el período de tratamiento profiláctico.
b) Un 53% de los pacientes de alto riesgo nunca tuvo una determinación positiva de la PCR-CMV. Este hecho es muy importante en cuanto demuestra que el tratamiento con valganciclovir oral controla de forma muy efectiva la posibilidad de infección primaria y/o reactivación viral en pacientes que la experiencia anterior demostraba la iban a sufrir en porcentajes muy elevados (62%).
c) Un 47% de los pacientes de alto riesgo tuvo alguna determinación positiva de su PCR-CMV. Sin embargo, el control de la replicación viral realizado por valganciclovir oral permitió que ningún paciente desarrollara criterios de enfermedad durante la profilaxis. Únicamente 3 pacientes (4,5%) desarrollaron enfermedad al cese del tratamiento profiláctico (20 días de media post-profilaxis,7-30). Todos ellos evolucionaron a la curación total de la enfermedad por CMV, manifestándose tanto mediante criterios clínicos como por negativización permanente de su PCR-CMV.
En todos estos pacientes con PCR-CMV positiva en algún momento del seguimiento, exceptuando los 3 casos que desarrollaron enfermedad, la carga vírica descendió sin la adición de ganciclovir ev. El tratamiento con valganciclovir oral permitió que, a pesar de la positivización de la PCRCMV, ésta no adquiriera entidad suficiente para causar signos de enfermedad. En la figura 2 se detalla la carga vírica promedio de los pacientes del grupo de riesgo con PCRCMV positiva en función del tiempo de seguimiento. En ella se aprecia los períodos en que dicha carga experimenta su máxima frecuencia e intensidad coincidiendo con el cese del tratamiento profiláctico a las 12 semanas post-trasplante. Los pacientes que no desarrollaron enfermedad por CMV negativizaron definitivamente o disminuyeron su carga viral, mientras que aquéllos que desarrollaron enfermedad aumentaron rápidamente la misma por encima de 100.000 copias/mL. El tratamiento de la enfermedad con ganciclovir ev permitió la mejoría de los síntomas y la negativización de la viremia en todos los casos menos en uno que presentó resistencia clínica y analítica al ganciclovir y requirió de foscarnet para su resolución. A pesar de dicho tratamiento el paciente mantuvo su función renal estable y dentro de la normalidad.
La tabla IV compara las posibilidades de sufrir enfermedad por CMV en función de las distintas opciones de tratamiento (ausencia de tratamiento, profiláctico, anticipado) y de la técnica usada para el diagnóstico precoz de la infección por CMV (antigenemia con pp25 o PCR-CMV cuantitativa). En ella se puede observar la importante disminución de la enfermedad por CMV en el grupo de pacientes de riesgo seguido con PCR-CMV y tratado de forma profiláctica con valganciclovir oral.
Grupo de riesgo estándar
Este grupo también demostró una excelente respuesta clínica al protocolo. En primer lugar se demostró que es un grupo en el que no es necesario el tratamiento profiláctico universal. Un 70% de pacientes de este grupo tuvo todas sus determinaciones de carga vírica negativas. El resto, un 30%, tuvo alguna PCR-CMV+, no excediendo las preestablecidas 1.000 copias/mL en una buena parte de los casos (38% de ellos y 12% del total de pacientes de esta serie), no requiriendo tampoco de tratamiento profiláctico y/o anticipado. Finalmente un 14%, del total de esta serie de bajo riesgo (12 /84 pacientes), se trató de forma anticipada con éxito y únicamente 4 pacientes de 84 (4,75%) sufrieron la enfermedad de forma leve-moderada. No existió ningún caso de enfermedad grave en este grupo de pacientes. La baja incidencia y severidad de la enfermedad por CMV en el grupo de riesgo estándar nos confirma en la elección de la monitorización de la infección mediante PCR-CMV cuantitativa en tiempo real dado que nos permite un diagnóstico muy precoz de la misma y el valganciclovir oral nos es altamente efectivo en el control ambulatorio de esta infección, no desarrollándose enfermedad grave en ningún caso de esta serie. El uso de la PCR-CMV ayuda a que únicamente necesite tratamiento un 18,75% (16/84 pacientes) de los pacientes del grupo de riesgo estándar (14% de forma anticipada y 4,75% de la enfermedad leve-moderada).
La experiencia adquirida en nuestra serie de pacientes trasplantados renales nos lleva a las siguientes conclusiones:
¿ El grupo de pacientes con riesgo de enfermedad por CMV (D+/R-, tratamiento con suero antilinfocitario y/o incremento de la inmunosupresión por rechazo agudo) requiere necesariamente de tratamiento profiláctico anti-CMV. En caso contrario, el riesgo de sufrir enfermedad grave por CMV es muy alto en este grupo de trasplantados (62%).
¿ El tratamiento profiláctico con valganciclovir oral durante 3 meses ha demostrado ser de alta eficacia en la prevención de la enfermedad por CMV. Únicamente un 4,5% de pacientes del grupo de riesgo han sufrido enfermedad por CMV, aunque en general de intensidad levemoderada y solamente un caso presentó enfermedad de intensidad grave.
¿ Ningún paciente ha sufrido enfermedad por CMV durante el curso del tratamiento profiláctico, lo cual ayuda a evitar la enfermedad por CMV en fases iniciales del trasplante.
¿ El tiempo medio de aparición de la enfermedad tras el cese del tratamiento profiláctico ha sido de 20 días (7-30) y se ha producido en muy pocos pacientes (3/66). La carga vírica media en el debut de la enfermedad fue de 115.000 copias/mL (34.300-206.000). Esto nos indica que el seguimiento con PCR-CMV tras el cese del tratamiento profiláctico debería alargarse como mínimo un mes al objeto de detectar precozmente los signos de replicación viral.
¿ Ganciclovir ev ha sido eficaz en el tratamiento de los pacientes con enfermedad por CMV tras el cese de la profilaxis.
¿ El grupo de riesgo estándar no requiere de tratamiento profiláctico. La monitorización de la infección mediante la PCR-CMV permite el diagnóstico precoz de la misma y el valganciclovir oral el control efectivo, impidiendo el desarrollo de enfermedad grave en la práctica totalidad de pacientes.
Tabla 1.
Tabla 2.
Tabla 3.
Tabla 4.
Figura 1.
Figura 2.
Tabla 3.
Figura 4.
Figura 5.