INTRODUCCIÓN
El trasplante renal (TR) es el tratamiento de elección en los pacientes con insuficiencia renal crónica terminal, al proporcionar una mejoría en la supervivencia y la calidad de vida, tanto en los pacientes jóvenes como en los de mayor edad1,2.
La proporción de pacientes > 50 años en las listas de espera para trasplante renal ha ido aumentando debido tanto al envejecimiento de la población en diálisis como a los resultados obtenidos en el trasplante de receptores añosos, con una supervivencia del paciente al primer y quinto año del 80-90% y 70% respectivamente, y para el órgano del 80% y 55-60%3. El incremento de la demanda de órganos frente a la situación de estacionamiento del número de donantes y el aumento de la media de edad de los donantes ha motivado la aceptación creciente de órganos de donantes añosos4.
Las reticencias a usar riñones de donantes añosos estaban basadas en los cambios estructurales y funcionales asociados a la edad, haciéndoles más susceptibles al daño isquemia-reperfusión, lo que conduce a una mayor predisposición al retraso de la función del injerto y al rechazo intersticial agudo3. Además, una vez ocurrido el episodio de rechazo agudo, la capacidad de desarrollar una respuesta reparadora ante las lesiones resulta disminuida.
Por otra parte, la menor demanda metabólica que caracteriza al receptor de edad avanzada hace que la masa disminuida del riñón del donante añoso sea suficiente para responder a sus necesidades, mientras que su respuesta inmunológica disminuida determina que el riesgo de padecer rechazo agudo sea inferior5,6. Esto justifica que los riñones de donante añoso tiendan a emplearse en receptores de edad avanzada. Además, se ha atribuido una mejor supervivencia a los riñones añosos cuando se colocan a receptores mayores, aunque este hallazgo no ha sido confirmado7.
Los inhibidores de la calcineurina (ICN) que se utilizan en la actualidad como base del mantenimiento inmunosupresor a dosis plenas y desde el inicio del tratamiento pueden empeorar la incidencia y duración del retraso de la función renal y aumentar el riesgo de nefrotoxicidad aguda8. De ahí que pautas con bajas dosis o incluso libres de estos fármacos estén en constante investigación9-11 mostrando tasas aceptables de rechazo agudo y una buena preservación de la función renal. Tales pautas libres o con dosis de ICN reducidas se apoyan principalmente en el uso de inducción con anticuerpos12,13 y/o el uso de dosis plenas de MMF14 y/o Sirolimus15.
Aunque tiene gran interés establecer cuál es la inmunosupresión más adecuada en los TR de donante y receptor añosos, la información actualmente existente es escasa. En el presente trabajo, que recoge los resultados finales de un estudio prospectivo multicéntrico, abierto y no controlado realizado en 13 centros españoles, se planteó si el uso de anticuerpos anti-IL-2R combinados con MMF podría ofrecer la suficiente protección para retrasar la introducción y reducir los niveles de ICN, como pauta de inmunosupresión específicamente planteada para la pareja donante-receptor añoso. El presente trabajo viene a confirmar los análisis preliminares publicados previamente16,17.
MATERIAL Y MÉTODOS
El objetivo del estudio fue evaluar la eficacia del tratamiento inmunosupresor, tanto en términos de función renal, como de tasa de rechazo agudo. También se evaluó el perfil de seguridad del tratamiento.
Los pacientes incluidos debían tener una edad > 50 años y ser receptores de un único órgano (riñón), procedente de un donante con edad > 55 años. Se excluyeron los receptores de donante vivo, de órganos con un tiempo de isquemia fría > 30 horas, y los pacientes con un PRA > 25% en los 6 meses anteriores a la inclusión. También se excluyeron los pacientes con un recuento leucocitario < 2,5 x 109/L, plaquetas < 100 x 109/L o hemoglobina < 6 g/dL. La inclusión definitiva se llevó a cabo en pacientes que superaron los primeros días del postoperatorio inmediato. Se realizaron 9 visitas programadas en un periodo de seguimiento de 12 meses.
La evaluación pretrasplante incluyó datos demográficos de donante y receptor, antecedentes clínicos del paciente, histocompatibilidad, isquemia fría, analítica completa y constantes vitales. Se llevaron a cabo nueve visitas post-trasplante con los mismos controles clínicos y analíticos, así como registro de efectos adversos, inmunosupresión y dosis empleada, niveles valle de Tacrolimus, y niveles de MPAen el caso de que su determinación formara parte de la práctica habitual del centro. La función renal se estimó por la creatinina sérica y el aclaramiento de creatinina (Cockroft-Gault). En ausencia de contraindicaciones médicas, todos los episodios de rechazo agudo debían confirmarse mediante biopsia, efectuándose el tratamiento según la práctica de cada centro.
Se definió como función renal retrasada la necesidad de diálisis en la primera semana post-trasplante.
Como tratamiento inmunosupresor del estudio se administró Daclizumab en combinación con MMF, tacrolimus y esteroides. Los pacientes recibieron dos dosis de Daclizumab de 1,0 mg/kg (máximo 100 mg). La primera dosis en el plazo de 6 horas antes de iniciar la cirugía del trasplante (día 0 del estudio) y la segunda dosis el día 14º. La dosis de MMF fue de 2 g diarios por vía oral (1 g cada 12 horas) hasta el día 45 del estudio, ajustándose luego al criterio clínico de cada centro. Respecto a Tacrolimus, la dosis inicial fue de 0,1 mg/kg/día y se administró entre el 5º y el 7º día después del trasplante, en el caso de estabilización de la función renal (creatinina menor a 3,0 mg/dl o aclaramiento de creatinina > 30 ml/min) y nunca después de los 7 días posttrasplante. La dosis se ajustó para alcanzar unos niveles valle objetivo entre > 4 y > 8 ng/ml. Por lo que respecta a los esteroides, se administró metil- prednisolona 250-500 mg en el momento de la cirugía, reduciéndose la dosis de la siguiente manera: día 1: 125 mg iv/24 horas; días 2 a 14: 20 mg/24 horas; días 15 a 30 15 mg/24 horas; días 31 a 90: 5 a 10 mg; y días 91 a 360: según la práctica de cada centro. Se recomendó tratamiento profiláctico de citomegalovirus y pneumocistis carini de acuerdo con la pauta protocolizada de cada centro.
Estadística
Para los análisis descriptivos e inferenciales de los datos se utilizó el programa SPSS Versión 11.0. El análisis se realizó por intención a tratar.
El análisis de la variable principal (tasa de episodios de rechazo agudo) se realizó a través de la frecuencia absoluta y relativa. Se calculó el tiempo libre de rechazo mediante el modelo de Kaplan Meier. El resto de las variables se describieron mediante frecuencias absolutas y relativas en el caso de parámetros cualitativos y de media, desviación estándar, mediana y rango intercuartílico para los cuantitativos.
En los casos en que presentamos contrastes estadísticos entre distintas variables estudiadas en dos momentos diferentes (basal y al año post-trasplante), se utilizó la prueba bilateral estadística t-test para muestras relacionadas. Se consideró como estadísticamente significativo una p < 0,05.
RESULTADOS
Se incluyeron un total de 133 pacientes. El 64% de los donantes y el 60% de los receptores eran varones. La edad media de los receptores y de los donantes fue 61,3 ± 6,2 años y 64,4 ±5,3, respectivamente. En el 88% de los casos la causa de muerte del donante fue vascular. El 35,3% de los donantes y el 61,7% de los receptores presentaban hipertensión arterial (HTA), y el 11,3% y 6,1% diabetes, respectivamente.
La creatinina media previa a la muerte del donante fue de 1,1 ± 0,5 mg/dl. El tiempo medio de isquemia fría fue de 18,2 ± 5,7 horas. En los receptores hubo 12 casos de enfermedad isquémica cardíaca o periférica o procedimientos de revascularización y 22 casos de otras cardiopatías con expresión clínica. 8 casos tenían antecedentes de cáncer.
Ningún donante fue positivo para el virus hepatitis B y C. Sólo hubo un receptor positivo para el virus hepatitis B (0,8%) y 9 receptores positivos para el C (6,7%). El 91% de los receptores tenían una serología positiva para citomegalovirus, y hubo un 9% de injertos de donante con serología positiva a receptores citomegalovirus negativos.
De los 133 pacientes incluidos, 123 completaron el año de seguimiento programado en el estudio, registrándose 4 muertes (1 por pielonefritis, 2 por muerte súbita y 1 de causa desconocida), 2 pérdidas del injerto (1 por fallo renal primario y 1 por rechazo agudo) y 4 abandonos por otros motivos.
La supervivencia a los 12 meses fue 97,7% para el paciente y el 96,1% para en injerto, siendo del 98,5% en el caso de la supervivencia del injerto censurada para muerte.
El grado de seguimiento del protocolo de inmunosupresión fue muy alto en el caso de Daclizumab. Los pacientes recibieron dos administraciones, con un tiempo medio entre ellas de 14,0 ± 0,9 días. Tanto la dosis pretrasplante como la segunda dosis fue de 1,0 ± 0,1 mg/kg.
En el caso de MMF la dosis media el día 7 era prácticamente de 2 g/día (1,96 ± 0,18 g/día), aunque se produjo una reducción de dosis en muchos casos de forma que al final del primer mes del estudio solo 53 pacientes (de los 130 pacientes que continuaban en el estudio en ese momento) continuaban con 2 g diarios de MMF, siendo la dosis media de la población global de 1,5 g/día. Durante el resto del año continuó la disminución de dosis, de manera que a los doce meses posttrasplante ningún paciente tomaba 2 g/día, 14 recibían una dosis superior a 1 g/día, 65 tomaban 1 g/día y el resto dosis inferiores. Se dispuso de los niveles de MPAen 71 pacientes: Los niveles medios fueron de 4,3 ± 2,9 μg/ml el día 7 postrasplante, 3,6 ± 2,0 el primer mes, y el resto del año los valores medios se mantuvieron entre 2,87 ± 1,6 (2º mes) y 2,63 ± 1,7 (12º mes).
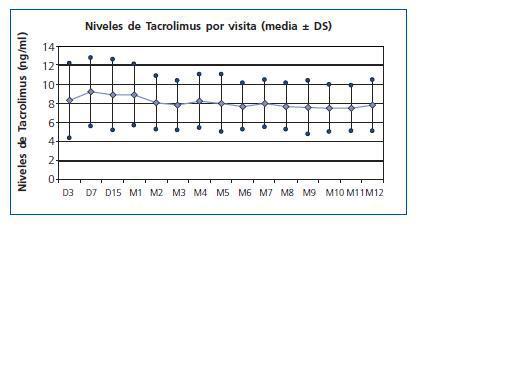
En el caso del manejo de Tacrolimus, hubo un buen cumplimiento respecto al momento de la introducción, con un tiempo hasta la administración de la primera dosis de 5,5 ± 1,4 días, a una dosis inicial de 6,3 ± 2,4 mg. En el momento de la introducción del fármaco los valores medios de creatinina sérica eran de 5,3 ± 2,9 mg/dl y el aclaramiento de creatinina de 19,9 ± 13,3 ml/min. En lo que se refiere al mantenimiento de los niveles objetivo durante el estudio, el cumplimiento fue peor: Se tendió durante todo el estudio a superar el rango de niveles valle establecido, aunque con tendencia a ajustarlo hacia el final del año (fig. 1). En el primer mes postrasplante 56 pacientes (44%) mantenían unos rangos dentro de los objetivos del estudio, pero este número fue en aumento hasta llegar a 78 pacientes dentro del rango establecido a los 12 meses (66%). No se suspendió el Tacrolimus en ningún caso.
Al final del primer año el 93,9% de los pacientes tomaba esteroides, a una dosis media de 5,1 ± 1,2 mg/día.
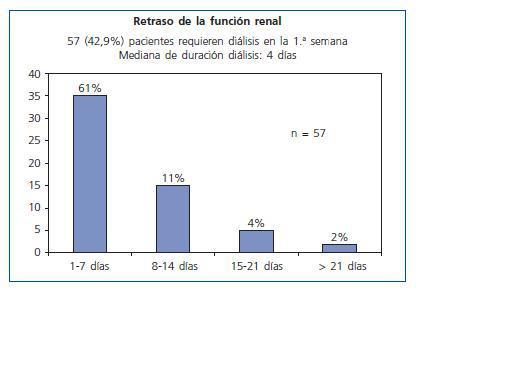
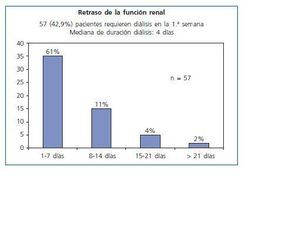
57 pacientes precisaron diálisis durante la primera semana (42,86%). La mediana de duración del retraso funcional fue de 4 días y sólo 7 casos requirieron hemodiálisis durante más de dos semanas (fig. 2).
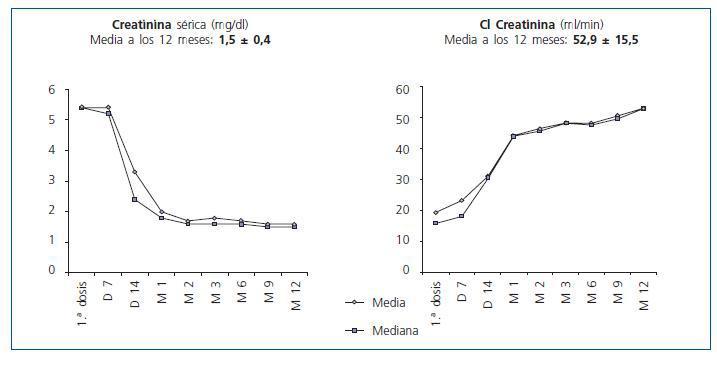
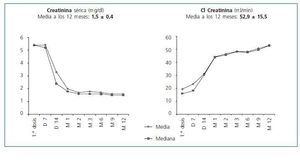
La creatinina mejoró hasta 2,0 ± 1,0 mg/dl al 1º mes y 1,7 ± 0,6 mg/dl al 2º mes. A lo largo del primer año, no se observó empeoramiento funcional, e incluso hubo una discreta mejoría hasta 1,57 ± 0,4 mg/dl al final del 1º año (fig. 3). Los aclaramientos de creatinina calculados por la fórmula de Cockroft-Gault evolucionaron en paralelo: 42,8 ± 15,0 y 46,5 ± 14,5 ml/min el primer y segundo mes, aumentando hasta 52,6 ± 16,4 ml/min al final del año.
Se registraron 19 episodios de rechazo agudo en 18 pacientes (13,5%), de los cuales 14, se confirmaron mediante biopsia (9,8% del total de pacientes). Según la clasificación de Banff-97, la severidad de los rechazos fue: 1 borderline; 5, grado 1A; 5 grado 1B y 3 rechazos grado 2A. De los 5 casos diagnosticados clínicamente (no biopsiados por problemas técnicos), 3 mostraron respuesta completa al tratamiento y 2, parcial. Sólo se emplearon anticuerpos (timoglobulina) en un paciente. La curva de supervivencia libre de rechazo confirmado por biopsia fue del 90% a los 12 meses.
No hubo cambios significativos en las cifras de glucosa durante el año del estudio. En el momento basal la media era de 111,6 ± 56,2 mg/dl y tras el año de seguimiento 106,1 ± 40,6 mg/dl. Las variables relacionadas con el perfil lipídico mostraron un ligero empeoramiento de las cifras de colesterol total entre el momento basal y al año de tratamiento (182,9 ± 55,6 vs 199,9 ± 41,3 mg/dl, p < 0,01). También aumentaron las cifras de LDL colesterol (109,3 ± 44,0 vs 120,1 ± 37,9 mg/dl, p = NS) y el HDL colesterol (47,0 ± 16,3 mg/dl vs 57,7 ± 17,7, p < 0,001). Hubo una reducción no significativa de los triglicéridos (145,7 ± 81,6 vs 132,0 ± 62,4 mg/dl). También se objetivó un aumento en las cifras de hemoglobina entre la situación basal y el año postrasplante (12,5 ± 2,4 vs 13,7 ± 2,9 mg/dl, p < 0,05). Asimismo, hubo un incremento en las cifras de leucocitos (7,1 ± 1,9-7,7 ± 2,6 x 103/mm3; p < 0,05).
Los acontecimientos adversos con incidencia > 5% fueron diarrea (7,1%), anemia (6,5%), edema (4,8%) y leucopenia (4,5%). En el 54% de los casos la intensidad de los eventos fue leve, en el 35,5% moderada, en el 8,1% grave y en el 1,7% supuso una amenaza para la vida del paciente. No se dispone de datos de intensidad en el 0,7% de los casos.
Por lo que respecta a las infecciones, el 79,7% de los pacientes presentaron alguna infección, con una media de 3 ± 2,3 infecciones por paciente (siendo las más frecuentes, 49,2% de las vías urinarias y el 17,1% de las vías respiratorias). El 58,6% de las infecciones fueron bacterianas, el 14% víricas (de las cuales aproximadamente la mitad fueron por citomegalovirus) y el 3,1% fúngicas. No se obtuvo información sobre la filiación en el 24% de las infecciones. 14 pacientes sufrieron un total de 23 infecciones graves.
No se comunicó ningún caso de cáncer. 15 pacientes (12%), desarrollaron diabetes de novo post-trasplante, y otros 8 (7,2%) presentaron en algún momento cifras de glucosa alterada.
DISCUSIÓN
El incremento de la media de edad tanto de los donantes omo de los receptores de trasplantes renales ha hecho necesario el desarrollo de enfoques específicos18. En este sentido se ha trabajado en la búsqueda de nuevas estrategias en el tratamiento inmunosupresor que aúnen una intensidad suficiente para evitar los episodios de rechazo agudo asociado al retraso de la función renal (característicos del riñón añoso), pero que eviten el riesgo de sobreinmunosupresión y nefrotoxicidad, incrementado en estos sujetos.
El programa Eurotransplant Senior Programme desarrolló un esquema para adjudicar órganos de donante > 65 años a receptores > 65 años. Los resultados 5 años después de su inicio avalan su éxito19,20, mostrando un incremento en la disponibilidad de donantes añosos del 43%, así como la reducción de los tiempos de espera de los receptores añosos, con tasas de supervivencia del injerto a los tres años del trasplante tan buenas como la de los trasplantes emparejados en función del HLA (64% vs 67%).
Pero en el éxito del trasplante de injertos añosos en receptores añosos el tipo de inmunosupresión juega un papel fundamental. El uso de anti-CD25 se ha mostrado altamente eficaz en la reducción del rechazo agudo, mejorando la supervivencia del injerto sin empeorar el perfil de seguridad13. En particular Daclizumab ha mostrado su capacidad para permitir regímenes con pautas reducidas de ICN o corticosteroides21, tras el intento inicial de Vincenti y cols. de utilizarlo para permitir el uso de una pauta libre de ICN22. En nuestro estudio se utilizó una pauta de dos dosis, debido a la larga vida media del fármaco (aproximadamente 20 días). Vincenti y cols.23 establecieron que dos dosis de Daclizumab mantenían niveles de Daclizumab por encima de 1 μg/ml hasta el día 59 tras el trasplante. En un estudio en trasplante de páncreasriñón se observó que el uso de dos dosis de Daclizumab estaba asociado con las tasas más bajas de rechazo agudo, la mayor tasa de supervivencia libre de rechazo y la menor pérdida del injerto24.
En lo referente a la combinación de Daclizumab con dosis bajas de Tacrolimus, Kuypers y cols.25, con una pauta muy parecida a la utilizada en nuestro estudio, encontraron resultados similares en términos de rechazo agudo, función renal y supervivencia del paciente y el injerto, si bien, al no establecerse ningún tipo de restricciones respecto a la edad avanzada de donantes y/o receptores del trasplante, ha hecho que hubiesen diferencias en la frecuencia de pacientes con retraso en la función renal con respecto a nuestros datos. En cambio, en términos de retraso en la función renal, nuestros resultados se ajustan mucho más a los obtenidos por Pallet y cols.26, en un estudio retrospectivo realizado en pacientes receptores de riñones con criterios de donación ampliados27, tratados con una inmunosupresión basada en el uso de anticuerpos (ATG o Basiliximab), dosis elevadas de MMF (3 g/día), Csa y esteroides.
Como es conocido, la reducción de dosis de los ICN constituye un objetivo en la población general de pacientes trasplantados y en particular, en los pacientes añosos, en los que, tal como establecen Land y cols.28, el uso de ICN, al ser fármacos que inducen estrés oxidativo, debe evitarse, mientras que el uso de inhibidores de la inosin monofosfato deshidrogenada, como el MMF, que reducen el estrés oxidativo, debe promoverse. Además, el uso prolongado de ICN empeoran algunos factores de riesgo cardiovascular como la HTA, la diabetes o la hiperlipidemia, y aumentan el riesgo de desarrollar tumores (especialmente de linfoma y cáncer de piel)29,30.
En la población general, los primeros estudios randomizados focalizados en la reducción y/o retirada de ICN, apoyándose en el uso de MMF, objetivaron el beneficio de la reducción/ retirada de Csa en la función renal de los pacientes31,32. Los resultados tras 5 años del estudio en el que se proponía la retirada de Csa a pacientes en triple terapia Csa + MMF + esteroides33 mostraron cómo una retirada definitiva del ICN se asociaba a mayores tasas de rechazo agudo y unas cifras ligeramente inferiores de supervivencia si bien la función renal fue mejor en el grupo libre de ICN.
Arbogast y cols. presentaron recientemente los resultados de un estudio en 89 receptores añosos de riñones procedentes de donantes mayores, en los que se utilizó un régimen libre de ICN34. Los resultados mostraron una tasa de rechazo superior a la de nuestro estudio, pero con muy buenos resultados tanto en lo que respecta a la función renal como a la supervivencia del paciente y del injerto. Parece evidente que los beneficios del uso de dosis reducidas de ICN apoyadas en el uso de anticuerpos y MMF son superiores a la retirada total de estos fármacos, por lo que las nuevas pautas se basan en la cuádruple terapia, con dosis reducidas de ICN: Anticuerpos + MMF + dosis bajas de ICN + esteroides, o en la incorporación de Sirolimus, como un nuevo agente inmunosupresor potencialmente no nefrotóxico.
Respecto a la incorporación de Sirolimus en la búsqueda de regímenes con una nefrotoxicidad reducida, son cada vez más numerosos los estudios publicados, y en todos los casos Sirolimus se utiliza combinado con MMF y esteroides35,36.En lo referente al uso de sirolimus en pacientes receptores de órganos de donantes marginales, se han presentado datos de dos pequeños estudios37,38. El hecho de que Sirolimus se haya explorado poco en pacientes añosos podría estar ligado al temor sobre su impacto en la recuperación del daño isquemia-reperfusión, establecido en modelos animales y confirmado en pequeños estudios clínicos39. Las conclusiones en la práctica totalidad de los estudios que utilizan Sirolimus y MMF es que se obtienen mejores resultados en términos de función renal, con cifras aceptables de rechazo agudo y similar o mejor perfil de seguridad, si bien la reciente comunicación de los datos del estudio Symphony40, han mostrado unos resultados que matizan significativamente las conclusiones de anteriores estudios.
A la vista de los datos expuestos y los resultados de nuestro estudio, parece que la pauta inmunosupresora que seleccionamos: 2 dosis de 1 mg/kg de Daclizumab, en combinación con 2 g/día de MMF y esteroides, introducción tardía de Tacrolimus (día 5-7), y mantenimiento de niveles bajos durante el seguimiento (niveles valle de 4-8 ng/ml), se consolida como una uena opción de inmunosupresión en la pareja donante-receptor añoso, a pesar de la dificultad en mantener las dosis plenas de MMF (2 g/día) y los niveles bajos de Tacrolimus (existiendo la tendencia a bajar la dosis de MMF y subir los niveles del ICN, posiblemente por conservadurismo de las ideas preestablecidas). Este éxito parcial en el cumplimiento del protocolo ¿el objetivo de niveles bajos de Tacrolimus solo se mantuvo en una fracción del grupo a lo largo del tiempo¿ es una limitación que comparte con otros estudios de minimización como el Symphony. Por otro lado, hay que convenir que nuestro estudio presenta claras limitaciones metodológicas, especialmente su carácter abierto no controlado que impide una valoración comparativa adecuada con la introducción inmediata de a anticalcineurina; también es cierto que la forma de reclutamiento ha podido excluir casos de trombosis intraoperatoria, no excepcionales en este tipo de parejas donante-receptor. Pero aún con estas limitaciones, en nuestro estudio se consiguen buenos resultados en supervivencia y función renal media, teniendo en cuenta las características del donante (edad media elevada, con una causa de muerte predominante cardiovascular y con una frecuencia alta de HTA y de diabetes) y del receptor (también individuos añosos que representaban a una población de mayor riesgo que la población general de trasplantados), aunque hay que tener en cuenta que las frecuencias relativamente bajas de diabetes y nefropatía vascular podrían indicar la existencia de una selección positiva de entre los pacientes de diálisis de este grupo de edad. Por lo que respecta al retraso en la función del injerto, a pesar de su elevada incidencia cabe destacar que la duración del retraso tendió a ser corta, con una mediana de duración del retraso de 4 días, por lo que se minimizó la repercusión negativa del retraso sobre el manejo de los pacientes. Finalmente, los datos de seguridad encajaron con los esperados, destacando una baja incidencia de los efectos adversos tradicionalmente relacionados con la combinación Tacrolimus + MMF: incidencia de diabetes de novo post-trasplante del 12%, de diarrea del 7,1%, anemia 6,5% e incidencia de infección por CMV del 7,5%.
Abreviaturas
Csa. Ciclosporina. HTA. Hipertensión arterial. ICN. Inhibidores de la calcineurina. MMF. Micofenolato MofetilPRA. Panel de anticuerpos reactivos. TR. Trasplante renal.
Figura 1.
Figura 2.
Figura 3.