En el Hospital Universitario de Canarias pusimos en marcha, en mayo de 2008, un protocolo de tratamiento de inducción para pacientes hipersensibilizados que reciben injerto renal de cadáver utilizando inmunoglobulinas intravenosas, plasmaféresis y rituximab más una inmunosupresión triple con prednisona, tacrolimus y micofenolato mofetil. Presentamos los resultados de 4 pacientes. Todos ellos presentaban una tasa de anticuerpos anti-HLA (PRA por CDC) superior al 75%, llevaban en lista de espera de 4 a 17 años, el tiempo de seguimiento posterior al trasplante fue de 10-14 meses y la supervivencia de paciente y del injerto en este período fue del 100%. Sólo un paciente sufrió un rechazo agudo mediado por anticuerpos y otro uno celular, en ambos casos reversibles con el tratamiento. En la evolución no se objetivó aparición de novo de anticuerpos donante-específicos. Todos los pacientes habían reducido significativamente el número de células CD19+ después de la infusión de rituximab. No se han detectado síntomas neurológicos indicativos de leucoencefalopatía multifocal progresiva ni infecciones virales graves después del trasplante y tampoco se han observado efectos secundarios inmediatos tras la administración de la medicación. En resumen, el tratamiento de inducción combinado con inmunoglobulinas, plasmaféresis y rituximab en pacientes hipersensibilizados permite la realización del trasplante renal procedente de donante cadáver con buenos resultados a corto y medio plazo y sin graves efectos secundarios. Queda por conocer si estos buenos resultados se mantendrán a más largo plazo.
In our Universitary Hospital of Canarias we iniciated in May 2008 a induction therapy protocol for sensitized patients receiving cadaveric renal graft using intravenous immunoglobulins, plasmapheresis and rituximab plus immunosuppression with prednisone, tacrolimus and mycophenolate mofetil. We present the results of four patients. Everyone had anti-HLA antibodies rate (PRA by CDC) more than 75%, were on a waiting list during 4 to 17 years and follow-up time was 10-14 months after transplantation. Patient and graft survival in this period was 100%. Only one patient suffered a humoral acute rejection and another one cellular rejection, in both cases reversible with treatment. During the first year, no evidence of de novo donor-specific antibodies was detected. All patients had significantly reduced the CD19+ cells percentage after infusion of rituximab. Neurological symptoms suggestive of progressive multifocal leukoencephalopathy or serious viral infections after transplantation have not been observed. Additionally, no immediate side effects were observed after administration of medication. In summary, induction therapy by combining immunoglobulin, plasmapheresis and rituximab in hypersensitive patients allows the realization of deceased kidney transplantation with good results in the short and medium-term without serious side effects. It remains to know whether this success will continue in the long term.
INTRODUCCIÓN
Los recientes tratamientos de inducción usando la combinación de plasmaféresis o inmunoadsorción más la administración de inmunoglobulinas intravenosas y/o rituximab han hecho posible el trasplante en pacientes de alto riesgo inmunológico con aceptables supervivencias del injerto a medio y largo plazo1-7.
En el Hospital Universitario de Canarias pusimos en marcha, en mayo del año 2008, un protocolo de tratamiento de inducción para pacientes hipersensibilizados utilizando inmunoglobulinas intravenosas, plasmaféresis y rituximab más una inmunosupresión triple con prednisona, tacrolimus y micofenolato mofetil (MMF). Presentamos los resultados de este protocolo aplicado a 4 pacientes de nuestro centro.
MÉTODOS
Se consideraban pacientes hipersensibilizados si presentaban un título de anticuerpos reactivos contra el panel de antígenos HLA (PRA), superior al 75%, determinado por citotoxicidad mediada por anticuerpos (CDC) y luminex. Los requisitos para realizar un trasplante a un paciente hipersensibilizado en nuestro centro fueron: a) prueba cruzada previa al trasplante renal negativa por citotoxicidad, y b) «prueba cruzada virtual» anterior al trasplante renal negativa, es decir, ausencia de antígenos HLA de clases I o II en el donante que hayan producido alorrespuesta en el receptor históricamente.
El tratamiento inmunosupresor consistió en:
1. Precirugía: tacrolimus 0,1 mg/kg por vía oral, MMF 2 g.
2. Intraoperatoriamente: metilprednisolona 500 mg i.v. y primera dosis de ATG (timoglobulina) (1,25 mg/kg de peso) hasta completar 7 dosis en los días posteriores.
3. MMF 2 g/día.
4. Prednisona 1 mg/kg/día las primeras 48 horas y reducción posterior hasta alcanzar 0,2 mg/kg/día en el primer mes posterior al trasplante.
El tratamiento desensibilizante consistía en:
1. Primer día posterior al trasplante: rituximab 375 mg/m2 que se repitía a igual dosis al séptimo día.
2. Plasmaféresis en los días 3, 5 y 7 posteriores al trasplante, con infusión de inmunoglobulinas i.v. a dosis de 0,5g/kg de peso tras cada sesión y posteriormente un refuerzo de 1 g/kg en los días 10, 11 y 30 posteriores al trasplante.
Los niveles plasmáticos propuestos de tacrolimus en el seguimiento oscilaban entre 10 y12 ng/ml en el primer mes, 8 y 10 ng/ml en los meses 1 a 6 y de 7 a 9 ng/ml a partir del sexto mes. Se monitorizaron las poblaciones linfocitarias CD19+/CD20+ y la posible aparición de infecciones oportunistas por medio de la detección por PCR de CMV, serología de virus de Epstein-Barr, parvovirus B-19 y poliomavirus BK8. La profilaxis de infecciones para citomegalovirus se realizó con ganciclovir/valganciclovir y la de Pneumocistis jirovecii con trimetoprima-sulfametoxazol. En todos los pacientes se obtuvo el consentimiento informado.
Ante cualquier deterioro de la función renal no secundario a una causa evidente, se realizaba biopsia del injerto y tinción con C4d9,10. El rechazo agudo mediado por anticuerpos se trataba con tres sesiones de plasmaféresis diarias y de 2 a 5 a días alternos junto con infusión de inmunoglobulinas (0,25g/kg) tras cada sesión y 1 g/kg tras la última11. Además, se administraban dos dosis, separadas por una semana12-14, de rituximab 375 mg/m2. Si el rechazo era de tipo celular grave se trataba con bolos de metilprednisolona y ATG u OKT315.
Presentamos los resultados de nuestro protocolo aplicado a 4 pacientes de nuestro servicio.
CASOS CLÍNICOS
Caso 1
Varón de 46 años de edad, con nefropatía intersticial que llevaba 8 años en programa de hemodiálisis (HD), con dos trasplantes previos en los años 2000 y 2004, con anticuerpos máximos circulantes y actuales anti-HLA-I y II del 75-80%. El primer injerto lo perdió a los 4 meses posteriores al trasplante por rechazo agudo vascular de grado III y el segundo injerto nunca fue funcionante. Desarrollo un síndrome urémico hemolítico y rechazo mediado por anticuerpos que requirió trasplantectomía al mes del trasplante. Era un paciente politransfundido y las especificidades por luminex anti-HLA-I iban dirigidas contra los antígenos A1, B5, B5c, B35, B53, B51, B8, B15 y las especificidades antiHLA-II iban dirigidas contra DR3, DR6, DR11, DR12, DR13, DR14, DR16, DR 51, DR52.
El tercer trasplante renal se realizó el 2 de julio de 2008 con un donante de 16 años de edad cuyo tipaje era A24, A32, B40, B57, DR4, DR–. El tipaje del receptor era A23, A68, B41, B47, DR1, DR4.
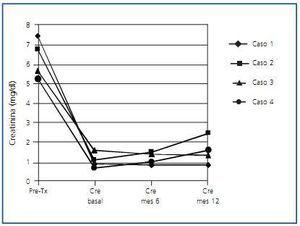
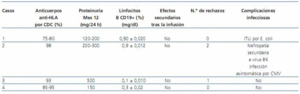
El paciente carecía de positividad previa por luminex de anticuerpos específicos contra los antígenos HLA de su nuevo donante (prueba cruzada virtual negativa). El paciente recibió el protocolo inmunosupresor de inducción como previamente se ha descrito y la evolución posterior fue muy favorable, con función renal inmediata y creatinina al alta de 0,9mg/dl. En la tabla 1 y en la figura 1 se expone la evolución de los parámetros de función renal y otros durante el seguimiento. El paciente no presentó efectos secundarios inmediatos con la infusión de la medicación. Las PCR de CMV, BK virus y virus hepatotropos fueron negativas durante la evolución. El recuento CD19+ fue de 0,90 ± 0,02%.
Caso 2
Varón de 40 años de edad, con diabetes tipo 1 y con nefropatía diabética que llevaba 15 años en HD. No había recibido ningún injerto renal, la tasa de anticuerpos máxima anti-HLA-I era del 100% y la actual del 98%. Era un paciente politransfundido y por luminex no se detectaban anticuerpos anti-HLA-II. Las especificidades anti-HLA-I iban dirigidas contra los antígenos B5, B5c, B15, B15c, B13, B7, B45, B12. Fue sometido a trasplante el 27 de junio de 2008. El tipaje del receptor era A2, A24, B14, B27, DR3, DR4 y la de de su donante, de 43 años de edad, A2, A68, B39, B–, DR4, DR16. La prueba cruzada virtual fue negativa y evolucionó inicialmente con función renal inmediata alcanzando una creatinina al alta de 1,1 mg/dl (tabla 1 y figura 1). No presentó episodios de rechazo agudo en el período posterior al trasplante ni efectos secundarios inmediatos con la medicación. La PCR de BK virus en orina al alta fue de inferior a 107 copias/ml y en plasma 22 copias/ml. El recuento de CD19+ fue de 0,9 ± 0,012%.
A cuarto mes del trasplante el paciente presentó un incremento de la creatinina desde 1,1 hasta 2,2 mg/dl. En la biopsia del injerto se detectaron datos de nefropatía por BK virus estadio B1. La PCR para BK virus en plasma ascendió a 91.905.137 copias/ml y en orina de 260.002.582.000 copias/ml. Se decidió disminuir la inmunosupresión e iniciar tratamiento compasivo con cidofovir a razón de 4 dosis semanales de 0,5 mg/kg/dosis y 4 dosis más quincenales hasta marzo de 2009. La creatinina fue descendiendo hasta 1,5 mg/dl al quinto mes.
Al sexto mes del trasplante el paciente sufrió un nuevo deterioro de la función renal con ascenso de la creatinina hasta 2,2 mg/dl. La segunda biopsia resultó en un rechazo agudo celular de grado Ia, con abundantes células plasmáticas en el intersticio y ocasionales cambios citopáticos en epitelio tubular (antígeno SV40 negativo) y tinción C4d negativa, sin evidencia de nefropatía por BK virus. La PCR para BK en plasma era superior a 104 copias y en orina superior a 107 copias/ml. Ante estos hallazgos el paciente fue tratado con bolos de MP, inmunoglobulinas intravenosas a altas dosis (0,5 g/kg de peso administradas en tres dosis) y recibió la cuarta dosis de cidofovir. La PCR y serologías víricas de infecciones oportunistas fueron negativas y la creatinina se estabilizó en 1,6 mg/dl.
Al octavo mes del trasplante presentó de nuevo un deterioro, con ascenso de la creatinina hasta 3 mg/dl. Se realizó una tercera biopsia renal, en la que se observó un rechazo agudo celular Ia, con tinción C4d negativa y sin evidencia de nefropatía por BK virus (inmunotinción SV-40 negativo y PCR viral en tejido renal negativa). El paciente fue tratado con tres bolos de metilprednisolona de 250 mg e inmunoglobulinas intravenosas (0,5 g/kg de peso administradas en tres dosis). La creatinina descendió hasta 2,1 mg/dl. A los 10 meses del trasplante presentó infección por CMV asintomática tratada con valganciclovir. A los 14 meses del trasplante el paciente se mantiene con función renal estable, creatinina de 2,5 mg/dl y proteinuria oscilante entre 200 y 300 mg en 24 horas. En toda su evolución el PRA por luminex permaneció en una tasa del 33-36%, manteniendo el mismo perfil de especificidades previas al trasplante y sin aparición de anticuerpos específicos del donante.
Caso 3
Mujer de 57 años de edad con poliquistosis renal que llevaba 16 años en HD. Había sido trasplantada en el año 1991 y perdió el injerto por nefrotoxicidad por anticalcineurínicos a los 6 meses. La tasa de anticuerpos anti-HLA-I oscilaba entre el 68 y el 93%. Era una paciente politransfundida y había tenido dos embarazos. Las especificidades anti-HLA-I iban dirigidas contra los antígenos A10, A29, A32, A33, B51, B52, B5c, B7c y B8 y las especificidades anti-HLA-II contra DR4, DR6, DR10, DR13, DR51. El tipaje del receptor era A2, A–, B44, B50, DR1, DR5. Se realizó el trasplante renal el 23 de mayo de 2008 con un injerto procedente de un donante cadáver de 41 años cuya tipificación era A2, A30, B44, B–, DR1, DR7. La prueba cruzada virtual fue negativa. Inicialmente no recibió la inducción ya descrita porque el trasplante fue anterior a la puesta en marcha de nuestro protocolo. La inducción que recibió fue ATG, metilprednisolona y una dosis de inmunoglobulinas de 0,5 g/kg, junto con tacrolimus y MMF. La paciente evolucionó con función renal retrasada, por lo que se le realizó una primera biopsia a los 8 días del trasplante. Se observó un rechazo agudo mediado por anticuerpos con tinción C4d+ y marginación leucocitaria junto con rechazo agudo celular (t1, i2) y toxicidad leve tubular y vascular por anticalcineurínicos. Se inició tratamiento con siete sesiones de plasmaféresis e inmunoglobulinas intravenosas tras cada sesión, pero la evolución no fue favorable y persistía el deterioro, por lo que una segunda biopsia a los 21 días de nuevo demostró la existencia de datos de rechazo mediado por anticuerpos con tinción C4d+ y marginación leucocitaria junto con rechazo agudo celular IIa (t1, v1, g1, i1) y toxicidad tubular por anticalcineurínicos. Recibió tres bolos de metilprednisolona y dos dosis de rituximab. La evolución posterior fue muy favorable, recuperando la función renal y quedando la creatinina al alta con valores de 1,6 mg/dl (tabla 1 y figura 1). El recuento CD19+ fue de 0,1 ± 0,01%.
Caso 4
Mujer de 50 años de edad, con enfermedad renal de base no filiada que llevaba 4 años en HD. La tasa de anticuerpos máxima y actual anti-HLA-I era del 85-95%. Era una paciente politransfundida sin embarazos previos. Había recibido un trasplante renal en el año 2004 que perdió a los 4 meses por rechazo agudo vascular y trombosis vascular. Las especificidades anti-HLA-I iban dirigidas contra los antígenos A1, A11, A23, A24, B7, B7c, B12c, B13, B15, B27, B37, B40, B41, B44, B45, B47, B48, B49, B60, B61, B63 y los anticuerpos anti-HLA-II eran negativos. El tipaje del receptor era A2, A68, B7, B51, DR4, DR13. La paciente había recibido unos meses antes de su segundo trasplante un tratamiento de desensibilización con plasmaféresis e inmunoglobulinas intravenosas (2 g/kg de peso), pero sin disminución en la tasa de anticuerpos, por lo que se añadieron dos dosis de rituximab. Tras finalizar el tratamiento no se observó un descenso significativo en la tasa de anticuerpos, pero sí desaparecieron algunas especificidades, de manera que se realizó un informe minucioso con los antígenos de clase I permisibles para el trasplante renal.
La paciente recibió un injerto renal de cadáver procedente de un donante de 34 años el 27 de septiembre de 2008, cuyo tipaje era A30, A–, B35, B-, DR13, DR–. Evolucionó con función renal inmediata alcanzando una creatinina al alta de 0,7 mg/dl (tabla 1 y figura 1). No sufrió episodios de rechazo agudo ni efectos secundarios inmediatos con la medicación. La PCR de BK virus y CMV en el seguimiento han sido negativas. El recuento CD19+ fue de 0,3 ± 0,02%.
En julio de 2009 presentó un deterioro de función renal con elevación de creatinina hasta 2,3 mg/dl. En la biopsia no se observaron datos de rechazo agudo si no de toxicidad tubular y vascular por anticalcineurínicos. La función renal mejoró parcialmente hasta alcanzar una creatinina de 1,6 mg/dl tras optimizar niveles de anticalcineurínicos.
DISCUSIÓN
Hoy día existen pocas opciones para el trasplante renal en los pacientes hipersensibilizados en la lista de espera si no son sometidos previamente a tratamientos desensibilizantes o a potentes terapias de inducción. En este sentido, las inmunoglobulinas intravenosas a dosis altas han logrado reducir la tasa de anticuerpos circulantes, pero, a pesar de su eficacia, en muchos pacientes se obtiene sólo una respuesta parcial y su efecto es variable entre individuos4. Otros investigadores han demostrado que la plasmaféresis puede disminuir los anticuerpos circulantes5, pero tras el cese de las sesiones, se produce habitualmente un rebote importante en el título de los mismos y, por tanto, hoy día se considera una técnica complementaria al uso de las inmunoglobulinas para disminuir la tasa de anticuerpos. De igual forma, el rituximab también ha demostrado un efecto beneficioso cuando se combina con inmunoglobulinas y plasmaféresis en la reducción de los anticuerpos anti-HLA y en el tratamiento del rechazo mediado por anticuerpos4,11-13. En cualquier caso, la estrategia de combinar estas medidas pudiera representar la mejor elección terapéutica en estos enfermos, en especial cuando se detecta precozmente el rechazo agudo mediado por anticuerpos mediante técnicas histológicas o serológicas.
En nuestro laboratorio de inmunología se lleva a cabo sistemáticamente el estudio previo al trasplante del paciente con dos tipos de aproximaciones: la monitorización de anticuerpos circulantes periódica y la realización de pruebas cruzadas previas al trasplante. La monitorización de anticuerpos circulantes tiene como principal objetivo la medición del PRA y la identificación de anticuerpos específicos, con el fin de evaluar el riesgo inmunológico del paciente e interpretar una prueba cruzada. Esto lo hacemos mediante CDC y luminex. Esta última técnica nos permite realizar un cribado para saber si el paciente presenta anticuerpos anticlase I o anti-clase II y determinar su especificidad contra los antígenos HLA purificados16,17. Todos los pacientes de nuestro estudio presentaban una tasa PRA por CDC superior al 75%, llevaban en lista de espera de 4 a 17 años, la media de tiempo de seguimiento posterior al trasplante fue de 10-14 meses y la supervivencia de paciente y del injerto en este período fue del 100%. Sólo uno de los pacientes tuvo un episodio de rechazo agudo mediado por anticuerpos, precisamente el que no había recibido la inducción propuesta. En otro paciente se produjo una disfunción inmunológica del injerto pero de tipo celular no humoral, y en ambos casos reversibles con el tratamiento. En la evolución no se objetivó la aparición de anticuerpos donante específicos de novo en nuetros pacientes. Si bien el PRA se mantuvo con perfil similar al de la etapa previa al trasplante en tres de nuestros pacientes, en el caso 2 disminuyó significativamente al 33%18.
Todos los pacientes habían reducido el número de células CD19+ después de la infusión de rituximab a porcentajes promedio del total de linfocitos B del 0,56 ± 0,02%, lo cual habla del potente efecto depletivo que poseen estos fármacos a medio plazo sobre los linfocitos B. Hasta la fecha no se han detectado síntomas neurológicos indicativos de leucoencefalopatía multifocal progresiva ni infecciones virales graves después del trasplante19,20. Tampoco se observaron efectos secundarios inmediatos tras la administración de los fármacos, probablemente debido a la premedicación utilizada antes de la infusión.
En resumen, el tratamiento combinado con inmunoglobulinas a altas dosis, sesiones cortas de plasmaféresis y dosis bajas de rituximab como tratamiento de inducción en pacientes con alta tasa de PRA permite la realización del trasplante renal procedente de donante cadáver con buenos resultados a corto y medio plazo, sin graves efectos secundarios derivados de la inmunosupresión. Queda por conocer si estos buenos resultados se mantendrán a más largo plazo sin efectos secundarios indeseables infecciosos o tumorales. Estudios longitudinales a más largo plazo aclararán estos aspectos.
Figura 1. Evolución de la creatinina en el primer año
Tabla 1. Evolución de los parámetros analíticos y clínicos de los pacientes