Introducción: El síndrome de secreción inadecuada de la hormona antidiurética (SIADH) es la causa más frecuente de hiponatremia en el paciente hospitalizado. Sin embargo, faltan protocolos y algoritmos concretos que faciliten su abordaje terapéutico. Nuestro objetivo fue el desarrollo de dos algoritmos de tratamiento de la hiponatremia secundaria al SIADH en el paciente ingresado. Material y método: Un grupo multidisciplinar español compuesto por 2 especialistas en Endocrinología, 1 en Farmacia Hospitalaria, 2 en Medicina Interna y 2 en Nefrología se reunieron durante un año, bajo la tutela del grupo español del European Hyponatremia Network, y de las respectivas sociedades científicas españolas. Las pautas terapéuticas propuestas fueron basadas en recomendaciones ampliamente aceptadas, la práctica de expertos, guías de consenso, así como en la experiencia clínica de los autores. Resultados: Se elaboraron dos algoritmos de tratamiento. El Algoritmo 1 se dirige al tratamiento de la hiponatremia aguda como urgencia médica de abordaje inmediato, y es de aplicación al tratamiento de la hiponatremia grave tanto de tipo euvolémico como hipovolémico. Se basa en el uso de sueros salinos hipertónicos al 3 % i.v., con pautas de infusión y monitorización. Se expone cómo evitar la hipercorrección de la natremia y cómo corregirla en su caso. El Algoritmo 2 aborda el tratamiento de la hiponatremia no aguda leve o moderada asociada al SIADH. Expone cómo y cuándo usar la restricción hídrica, solutos, furosemida y tolvaptán, para alcanzar eunatremia en el paciente con SIADH. Conclusiones: Se han elaborado dos estrategias complementarias para el tratamiento de la hiponatremia inducida por SIADH, en un intento de fomentar la toma de conciencia acerca de esa patología, simplificar su abordaje y su tratamiento y, así, mejorar su pronóstico.
Introduction: The syndrome of inappropriate antidiuretic hormone secretion (SIADH) is the most frequent cause of hyponatremia in a hospital setting. However, detailed protocols and algorithms for its management are lacking. Our objective was to develop 2 consensus algorithms for the therapy of hyponatremia due to SIADH in hospitalized patients. Material and methods: A multidisciplinary group made up of 2 endocrinologists, 2 nephrologists, 2 internists, and one hospital pharmacist held meetings over the period of a year. The group worked under the auspices of the European Hyponatremia Network and the corresponding Spanish medical societies. Therapeutic proposals were based on widely-accepted recommendations, expert opinion and consensus guidelines, as well as on the authors’ personal experience. Results: Two algorithms were developed. Algorithm 1 addresses acute correction of hyponatremia posing as a medical emergency, and is applicable to both severe euvolemic and hypovolemic hyponatremia. The mainstay of this algorithm is the iv use of 3% hypertonic saline solution. Specific infusion rates are proposed, as are steps to avoid or reverse overcorrection of serum sodium levels. Algorithm 2 is directed to the therapy of SIADH-induced mild or moderate, non-acute hyponatremia. It addresses when and how to use fluid restriction, solute, furosemide, and tolvaptan to achieve eunatremia in patients with SIADH. Conclusions: Two complementary strategies were elaborated to treat SIADH-induced hyponatremia in an attempt to increase awareness of its importance, simplify its therapy, and improve prognosis.
* De acuerdo con los autores y los editores, este artículo se ha publicado asimismo en la revista Medicina Clínica:
Med Clin (Barc) 2013;141(11):507.e1-507.e10. http://dx.doi.org/10.1016/j.medcli.2013.09.002
INTRODUCCIÓN
El síndrome de la secreción inadecuada de hormona antidiurética (SIADH) es un cuadro de hiponatremia hipotónica en el que se aprecia una insuficiente dilución urinaria en relación con la hipoosmolalidad plasmática existente, en ausencia de un descenso del volumen circulante efectivo (por hipovolemia o hipervolemia). Para este diagnóstico, las siguientes condiciones deben ser excluidas: hipotensión arterial, insuficiencia renal, insuficiencia suprarrenal, hipotiroidismo y estímulos fisiológicos no osmóticos de la vasopresina (AVP). En el SIADH, el descenso en la osmolalidad plasmática (Osmp) no da lugar a la inhibición de la secreción de la AVP como se esperaría, sino que induce una reabsorción inadecuada de agua libre en el túbulo colector de la nefrona. Como consecuencia de ello se produce una mayor hemodilución e hiponatremia, a la vez que da lugar a una osmolalidad urinaria (Osmu) inapropiadamente elevada1,2. Con mucha menos frecuencia aparece el síndrome de antidiuresis inadecuada (SIAD), donde la secreción de la AVP está correctamente inhibida por el descenso de la Osmp. Sin embargo, una mutación activadora de los receptores V2 del túbulo colector reproduce la reabsorción excesiva de agua en la nefrona distal3-5.
En los últimos años se han producido avances importantes en nuestro conocimiento de las consecuencias negativas de la hiponatremia: la hiponatremia crónica leve no es asintomática. Así, se acompaña de síntomas mentales, inestabilidad, caídas6, fracturas7-9 y, posiblemente, osteoporosis10, además de una mayor tasa de mortalidad9,11-14. La hiponatremia aguda grave de por sí puede poner en peligro la vida del paciente, induciendo edema cerebral profundo, herniación cerebral y muerte. Además, tras la corrección de una hiponatremia grave, la recuperación neurológica completa puede tardar semanas, y algunos pacientes presentarán secuelas neurológicas permanentes como consecuencia de una hiponatremia profunda15. Sin embargo, una corrección excesivamente rápida de la natremia puede inducir el síndrome de desmielinización osmótica (SDO). Por lo tanto, una temprana y adecuada corrección de la hiponatremia es esencial, evitando o tratando de inmediato la hipercorrección y teniendo como objetivo final la eunatremia.
En torno a un 30 % de los pacientes hospitalizados presentan hiponatremia en algún momento de su estancia hospitalaria13,16,17. A pesar de ello, la hiponatremia, incluso la grave, se infravalora y se trata inadecuadamente en demasiadas ocasiones. Un diagnóstico correcto de la causa de la hiponatremia mejora per se la mortalidad intrahospitalaria, con una menor tasa de muerte en aquellos pacientes a los que se les hace una determinación, tanto de la Osmp como de la Osmu18. Y una intervención terapéutica directa dirigida a la corrección de la hiponatremia se acompaña, a su vez, de una menor tasa de mortalidad19.
El SIADH es la causa más frecuente de la hiponatremia hospitalaria20. Sin embargo, faltan protocolos y algoritmos concretos que faciliten su abordaje terapéutico. Recientemente, una nueva clase de fármacos, los vaptanes, han sido aprobados por la Agencia Europea del Medicamento (EMA) para el tratamiento de la hiponatremia asociada al SIADH en el adulto. Estos fármacos actúan bloqueando el receptor V2 de la AVP en el túbulo colector de la nefrona21. El estímulo de esos receptores da lugar a la inserción de canales de acuaporina-2 en la membrana apical de las células principales del túbulo colector, y en un segundo tiempo al incremento en la síntesis de esos canales, lo que permite la reabsorción de agua desde el túbulo colector. Tolvaptán es el único fármaco de esta clase autorizado por la EMA para su uso en el SIADH, y actúa bloqueando los receptores V2 de manera selectiva. La necesidad de clarificar qué lugar ocupa su uso dentro del arsenal terapéutico tradicional, compuesto principalmente por solución salina hipertónica (SSH) al 3 %, furosemida, los solutos y la restricción hídrica, hace más evidente aún la importancia de disponer de una guía concreta, detallada y actualizada del tratamiento de la hiponatremia inducida por SIADH.
Por todo ello, el objetivo de este consenso es el desarrollo de dos algoritmos de tratamiento de la hiponatremia secundaria al SIADH en el paciente inicialmente hospitalizado. El primero (Algoritmo 1) se dirige al tratamiento de la hiponatremia aguda como urgencia médica de abordaje inmediato. El segundo (Algoritmo 2) aborda el tratamiento de la hiponatremia no aguda leve o moderada asociada al SIADH.
MATERIALES Y MÉTODOS
Un grupo multidisciplinar español compuesto por 2 especialistas en Endocrinología, 1 en Farmacia Hospitalaria, 2 en Medicina Interna y 2 en Nefrología se reunieron durante un año mediante una metodología mixta de reuniones presenciales y de trabajo en red para discutir y elaborar el protocolo. Las reuniones fueron organizadas bajo la tutela del grupo español del European Hyponatremia Network y de las respectivas Sociedades Científicas Españolas. Dada la falta de evidencia que caracteriza a muchos aspectos del tratamiento de la hiponatremia, los algoritmos que a continuación se desarrollan están basados en gran medida en recomendaciones ampliamente aceptadas, la práctica de expertos, guías de consenso22, así como en la experiencia clínica de los autores. Como siempre es el caso en la práctica clínica, la aplicación del protocolo deberá ser flexible y adaptada a cada paciente.
EXPLICACIÓN Y USO DE LOS ALGORITMOS
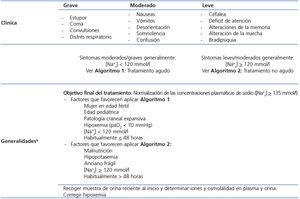
A la hora de decidir cuál de los dos algoritmos aplicar, se deben considerar una serie de elementos presentados en la tabla 1 y tabla 2, siendo el más importante la gravedad de la clínica neurológica22. Una corrección rápida y agresiva de la natremia (Algoritmo 1) es especialmente importante en personas con síntomas agudos y/o graves de hiponatremia indicativos de un importante grado de edema cerebral, en pacientes con hipoxemia23-28, así como en niños y en mujeres en edad fértil27. Al aplicar cualquiera de los dos algoritmos, los medicamentos que potencialmente pueden causar hiponatremia deben interrumpirse cuando sea posible. El dolor y las náuseas son potentes estímulos de la secreción de AVP y deben ser tratados adecuadamente. Si la causa subyacente de hiponatremia inducida por SIADH no es evidente, la realización de una radiografía de tórax, tomografía computarizada de cerebro, cervicotorácica y ecografía abdominal deben ser consideradas. Si se piden, estas pruebas diagnósticas deben seguir la corrección inicial de emergencia de la natremia y la mejora de los síntomas del paciente si la hiponatremia es grave.
Uso del Algoritmo 1
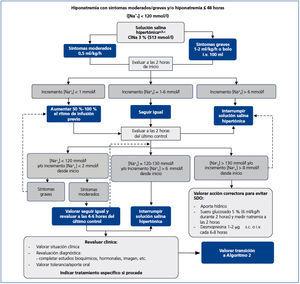
En un contexto de hiponatremia aguda y/o grave, con clínica indicativa de un edema cerebral profundo, el objetivo inicial de este algoritmo (figura 1) es la reducción del grado de edema cerebral, evitando a la vez una sobrecorrección de la natremia. Es de aplicación en cualquier tipo de hiponatremia grave euvolémica o hipovolémica, independientemente de la causa, y podrá iniciarse previo al diagnóstico etiológico. El algoritmo especifica el tratamiento inicial del edema cerebral con SSH al 3 % intravenoso (i.v.), la monitorización de la elevación consiguiente de la natremia, cómo evitar la hipercorrección y cómo corregirla si surge.
Solución salina hipertónica al 3 %
La infusión de SSH al 3 % es la base del tratamiento de la hiponatremia grave. La base del tratamiento de la hiponatremia grave es el uso intravenoso de SSH (cloruro sódico) al 3 %29, para asegurar el movimiento de agua desde el espacio intracelular al espacio intravascular siguiendo un gradiente osmótico, reduciendo de esta manera el grado de edema neuronal. Para la administración de esta solución, no se precisa una vía central, cuya colocación solamente puede retrasar de forma innecesaria la administración de la solución salina hipertónica. La SSH al 3 % se puede preparar añadiendo 60 ml de SSH de ClNa al 20 % a 500 ml de solución salina isotónica de ClNa 0,9 %. Se deberá agitar siempre la preparación antes de su administración. Antes de iniciar el tratamiento, es imprescindible obtener una muestra de sangre para la determinación en suero de la natremia (Nas), potasemia (Kp), urea, creatinina y Osmp. Es también esencial coger una muestra de orina para determinación de sodio urinario (Nau), potasio urinario (Ku) y Osmu lo antes posible, sin que ello suponga retraso en el inicio de la administración i.v. de la SSH al 3 %. Se debe investigar la presencia de hipoxemia y corregirla en su caso, dado que esta empeora el pronóstico de la hiponatremia23-28.
Ritmo de infusión. Proponemos un ritmo inicial de infusión de SSH al 3 % de 0,5 ml/kg/hora o de 1-2 ml/kg/hora en función de la gravedad de la clínica neurológica30,31. Los pacientes que presenten crisis, coma, estupor o distrés respiratorio deberán recibir una infusión inicial de 2 ml/kg/hora. En estos pacientes, un tratamiento alternativo es la administración de bolos i.v. de 100 ml de SSH al 3 %, hasta un máximo de 3 veces con períodos de 10 minutos entre bolos, suspendiéndolos al ceder la sintomatología grave22,32. Desaconsejamos el uso de fórmulas para calcular la cantidad y el ritmo de infusión, dado que con frecuencia llevan a la hipercorrección32-34 y complican el tratamiento de forma innecesaria.
El tratamiento también deberá ser más agresivo en niños y mujeres en edad fértil27, dado que el riesgo de encefalopatía hiponatrémica grave es más alto, pudiendo conducir a una herniación cerebral posterior y muerte o secuelas neurológicas permanentes. Este también es el caso de pacientes con hiponatremia aguda. Aquellos que hayan ingerido en las horas previas grandes cantidades de líquido (intoxicación aguda de agua) presentan un riesgo especialmente elevado, dado que su sintomatología neurológica, así como su Na+s, a menudo siguen empeorando al persistir la absorción de agua desde el tracto gastrointestinal35. Conviene señalar que, en estos pacientes, el sodio arterial puede estar varios mmol/l por debajo del sodio en sangre venosa periférica, por lo que este último valor puede infravalorar el grado real de hiponatremia36.
Una vez instaurado el tratamiento con SSH, es importante asegurar una correcta valoración de la diuresis del paciente, ya que las soluciones hipertónicas pueden inducir una elevada diuresis acuosa (producción de orina 2 ml/kg/hora), que favorece la sobrecorrección de la natremia y exige una mayor monitorización de esta, para identificar la necesidad de inicio de medidas correctoras. Estos pacientes también son candidatos a recibir directamente 1 µg de desmopresina subcutánea (s.c.) o i.v. como medida preventiva en el momento de detección de la poliuria, evitando así una corrección excesiva de los niveles de sodio32,37.
Objetivos específicos del tratamiento con solución salina hipertónica. En el tratamiento de pacientes con hiponatremia crónica (duración de más de 48 horas), la elevación máxima del Na+s actualmente recomendada es de 10 mmol/l en 24 horas, así como de 18 mmol/l en 48 horas, para disminuir el riesgo de desarrollo del SDO22. Se ha observado que incrementos de 4-6 mmol/l en los niveles séricos circulantes de sodio se acompañan de una reducción del nivel de edema cerebral del orden de un 50 %38. En un reciente estudio se ha hallado un aumento en la tasa de mortalidad en pacientes con Na+s de partida inferiores a 120 mmol/l cuyo ritmo de corrección fue inferior a 6 mmol/l en 24 horas39. Por todo ello, el objetivo debería ser un incremento del Na+s del orden de 6 a 8 mmol/l en las primeras 24 horas. Es especialmente importante evitar la hipercorrección en pacientes con mayor riesgo de desarrollo del SDO: pacientes con alcoholismo, desnutrición o hipopotasemia, entre otros40-42, por lo que en estos pacientes los niveles máximos de corrección deberían ser del orden de 6 a 8 mmol/l y 14 a 16 mmol/l entre las 24 y 48 horas, respectivamente. Sin embargo, en pacientes con hiponatremia aguda el Na+s puede aumentar con mayor rapidez, sin consecuencias negativas.
No se deben asociar otros tratamientos susceptibles de elevar la natremia de forma simultánea con la SSH, a excepción de la furosemida endovenosa en pacientes con una historia de insuficiencia cardíaca. En este caso, dado que la combinación de SSH con un diurético de asa incrementará la concentración sérica de sodio de forma más marcada que el uso de SSH sola, el objetivo inicial de elevación del Na+s con la infusión de la SSH deberá ser algo menor, entre 4 y 5 mmol/l.
Monitorización del tratamiento con SSH y su interrupción. Es importante repetir la determinación del Na+s a las dos horas del inicio de la infusión de SSH. Si el aumento del Na+s ha sido superior a 6 mmol/l, se debe suspender la infusión, dado que los niveles séricos de Na+s pueden seguir incrementándose después de interrumpir la administración endovenosa de SSH. En caso de observarse una elevación del Na+s de entre 1 y 6 mmol/l, el ritmo de infusión se puede mantener. Si no se observan cambios en el Na+s, se debe incrementar el ritmo de infusión un 50 a 100 %, en función de la gravedad de la clínica. En caso de haber administrado bolos i.v. de hipertónico, se deberá repetir la natremia a los 30 minutos del último bolo.
A las dos horas, es decir, cuatro horas después del inicio de la infusión, se determina el Na+s de nuevo. En un paciente con sintomatología neurológica de gravedad –coma, convulsiones, estupor o distrés respiratorio– y que no muestra una mejoría analítica, con un incremento inferior a 2 mmol/l desde el inicio, debemos incrementar el ritmo de infusión en un 50-100 %. En caso de aumentar el ritmo de infusión, la natremia se repetirá de nuevo a las dos horas.
Por el contrario, en caso de un incremento insuficiente del Na+s, con una elevación inferior a 2 mmol/l, en pacientes con síntomas moderados de hiponatremia, podemos mantener el ritmo de infusión, repitiendo la natremia y valorando un aumento del ritmo de la infusión 4 horas después. En caso de una elevación mayor de 6 mmol/l desde el Na+s de partida, se suspende la infusión, pudiendo también interrumpirla en caso de haber alcanzado ya un incremento de 6 mmol/l. Si el Na+s se ha elevado más de 8 mmol/l desde el principio, recomendamos iniciar medidas correctoras dirigidas a lograr un nuevo descenso del Na+s (ver a continuación). Si el Na+s se ha elevado entre 2 y 6 mmol/l desde el comienzo de la infusión de SSH, se podrá mantener el ritmo de la infusión, repitiendo la natremia cada dos horas hasta alcanzar el incremento deseado en el Na+s, para entonces suspender la SSH.
Es aconsejable que el médico que haya indicado el tratamiento con SSH supervise personalmente la interrupción de la infusión en cuanto la decisión de suspenderla haya sido tomada. Tras la interrupción de la SSH, los únicos tratamientos que se deberán aplicar hasta pasadas 24 horas del inicio de la infusión son la restricción hídrica y el aporte oral de sal en pacientes con SIADH. Deberán evitarse medidas que puedan aumentar los niveles de Na+s para así prevenir una hipercorrección. Incluimos en esta categoría la administración del cloruro potásico (ClK): la hipopotasemia leve no deberá ser corregida hasta cumplirse las 24 horas desde el inicio de la infusión de SSH, ya que el aporte de potasio elevará la natremia.
Actitud ante una elevación excesiva de la natremia
La reducción de la natremia tras hipercorrección previene el SDO. Un incremento excesivo del Na+s en un período de 24 o 48 horas se asocia al desarrollo del SDO, cuadro que puede llevar a la muerte o a secuelas neurológicas permanentes. Es por esta razón por la que las Guías de 200722 recomiendan un incremento máximo de niveles de sodio de 10 mmol/l y 18 mmol/l en 24 y 48 horas, respectivamente. Sin embargo, una reducción rápida del Na en pacientes que hayan presentado elevaciones excesivas de este previene el desarrollo del SDO37,43,44, además de haber sido utilizado con éxito en el tratamiento de pacientes que ya hayan desarrollado SDO45-49.
Medidas específicas. Por lo tanto, en caso de una elevación en el Na+s superior a 8 mmol/l tras la infusión de SSH, se deben tomar de inmediato medidas encaminadas a lograr un nuevo descenso del Na+s, además de la interrupción de la infusión. Recomendamos el aporte de importantes cuantías de agua por vía oral (v.o.), administración de solución glucosada al 5 % i.v. (4-6 ml/kg/hora durante 2 horas con nueva determinación del Na+s en ese momento). La administración de soluciones glucosadas puede ser acompañada por la administración de desmopresina 1 a 2 μg i.v. o s.c. cada 6 horas37 hasta lograr un incremento neto máximo en la Na+s de unos 8 mmol/l desde el inicio. Cuando se use desmopresina, recomendamos empezar a una velocidad de infusión de 1,5 a 2 ml/kg/hora, repitiendo los niveles de Na+s cada 2 horas después de la infusión e incrementando progresivamente el ritmo de infusión del glucosado si fuera preciso. Se ha recomendado que el ritmo de descenso del Na+s sea en torno a 1 mmol /hora50. Es especialmente importante asociar desmopresina a soluciones glucosadas en el caso de pacientes con polidipsia primaria, y en otros pacientes con Osmu baja, ya que difícilmente reabsorberán en el túbulo colector el líquido administrado, al tener niveles circulantes bajos de AVP y, por tanto, apertura de pocos canales de acuaporina-2. La desmopresina inducirá una elevación importante en la Osmu, por lo que el descenso en el Na+s que ese fármaco induce podrá ser interrumpido mediante la administración de 20 mg de furosemida i.v. en cuanto se haya alcanzado la Na+s deseada.
Pacientes que presentan mayor riesgo de elevación excesiva de la natremia. Existen determinados grupos de pacientes que presentan un mayor riesgo de desarrollar elevaciones excesivas del Na+s y precisan una monitorización más estricta en su seguimiento. Entre ellos están los pacientes con una causa de hiponatremia transitoria; p. ej., hiponatremia inducida por fármacos tras la retirada del medicamento, pacientes con hiponatremia mediada por estímulos fisiológicos de elevación de AVP en los cuales ha desaparecido de forma brusca la causa de la elevación de la AVP32, así como pacientes que hayan tenido un aporte de sal marcadamente bajo en los días previos al ingreso.
Los pacientes con insuficiencia suprarrenal tanto primaria como secundaria representan un caso especial. Estos pacientes deben recibir tratamiento con hidrocortisona a dosis suficientes para asegurar una adecuada acción glucocorticoidea y mineralocorticoidea. Pero el Na+s puede incrementarse a ritmos muy elevados tras inicio de tratamiento esteroideo, especialmente en caso de la administración de dosis altas de hidrocortisona en bolo i.v. como tratamiento de la crisis adrenal. En estos pacientes, si la natremia ya ha subido 8 mmol/l antes de haberse cumplido las 24 horas desde el inicio del tratamiento, se pueden administrar 1-2 µg i.v. o s.c. de desmopresina cada 6-8 horas para frenar el ascenso. Muchos pacientes con insuficiencia adrenal son susceptibles de ser tratados con una infusión de hidrocortisona a un ritmo menor (60-150 mg de hidrocortisona durante un período de 24 horas)51, asociada o no a un bolo inicial de 50 mg i.v., que será acompañado por una elevación más lenta de la natremia. Casos menos graves pueden tratarse con 20 mg de hidrocortisona oral cada 8 horas.
Uso del Algoritmo 2
El objetivo del algoritmo (figura 2) es lograr la eunatremia en pacientes con hiponatremia leve o moderada inducida por SIADH que no supongan una urgencia médica.
Corrección de la hipopotasemia
En presencia de hipopotasemia, se deberán administrar suplementos de ClK v.o., con la precaución de no administrar bicarbonato potásico, ni preparados que induzcan la generación de bicarbonato potásico, ya que este último incrementará la excreción renal de sodio, pudiendo empeorar la natremia e inducir alcalosis metabólica52.
Tratamiento con soluto
Es esencial asegurar el aporte oral de sal. La dieta hospitalaria sin sal no suele contener más de 4 gramos de ClNa/día. Y muchos pacientes ingresados comen menos que lo que se les sirve, y por tanto tendrán un aporte de sal aún menor. Recomendamos la asociación de suplementos de sal, para un consumo mínimo de 5 a 8 gramos de sal al día.
La administración de grandes cantidades de soluto oral puede ser una terapia per se de la hiponatremia inducida por SIADH. En ese caso, se deberán aportar de 3 a 4 gramos de suplemento de sal cada 8 horas, pudiendo llegar a cuantías mayores en algunos casos. Es obligatorio un control estricto de la tensión arterial en todo paciente con suplementos de sal. Otro soluto que ha sido utilizado en el tratamiento del SIADH es la urea, a dosis de 30 g/día (habitualmente 15 g cada 12 horas)53. El tratamiento con urea podría ser especialmente útil en niños con SIADH54, aunque su mala palatabilidad ha impedido la generalización de su uso.
Tratamiento con restricción hídrica
En el momento actual, la restricción hídrica es la base del tratamiento inicial de la hiponatremia por SIADH que no requiere medidas urgentes. Por restricción hídrica nos referimos a la limitación en el aporte de todos los líquidos que se le administran al paciente, tanto medicación i.v. y líquidos orales como los alimentos de la dieta que intrínsecamente contienen agua. Para ello, se debe suspender toda la medicación, tanto oral como i.v., que no sea imprescindible en ese momento y concentrar la medicación i.v. cuando sea factible. Se debe limitar no solamente el aporte de agua, sino también de cafés, zumos, tés, y eliminar de la dieta sopas, caldos, purés, gelatinas y postres semilíquidos (como natillas), e incluso alimentos de alto contenido en agua, como melón, sandía y cítricos.
En nuestra experiencia, la fórmula de Furst55 es útil a la hora de predecir qué pacientes responderán adecuadamente a la restricción hídrica; se calcula la fórmula dividiendo la suma del Nau y el Ku mmol/l por el Na+s. Pacientes que presentan una cifra inferior a 0,5 responderán a una restricción de líquidos de 1000 ml/día, mientras que aquellos con valor de la fórmula de Furst entre 0,5 y 1 pueden responder a una restricción igual o menor a 500 ml. Aquellos pacientes en los que el resultado de la fórmula sea superior a 1 no van a responder a la restricción hídrica, ya que su nefrona no está eliminando agua libre de electrolitos. En este caso, se aplica restricción hídrica a 500 ml al día para que no empeore la natremia del paciente, pero no para corregirla. La respuesta de un paciente determinado a la restricción hídrica puede ser cambiante y puede variar de un día para otro. Por lo tanto, para una correcta aplicación de la fórmula de Furst, se debe repetir el cálculo de electrolitos en suero y orina con frecuencia. Se considerará una respuesta positiva cuando la elevación de la natremia sea de un mínimo de 2 mmol/l cada día durante 2 días seguidos.
La restricción hídrica no es práctica para todos los pacientes y a veces resulta totalmente incompatible con medicación necesaria o nutrición artificial. También hay pacientes que no toleran o no responden a la restricción hídrica. Además, la restricción hídrica a 500 ml/día reduce la palatabilidad de la comida y puede empeorar el estado nutricional del paciente, en caso de prolongarse varios días. En todos estos casos, junto con los pacientes que presenten un resultado igual o superior a 1 en la fórmula de Furst, deberemos iniciar terapia alternativa para elevar la natremia.
Tratamiento con furosemida
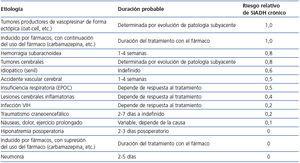
La administración de furosemida puede ser útil como tratamiento de la hiponatremia por SIADH a corto plazo, cuando la Osmu sea suficientemente elevada, ya que este fármaco incrementa el aclaramiento de agua libre por la nefrona. Para que este diurético de asa sea eficaz, la Osmu debe estar por encima de 350 mOsm/kg, y preferiblemente por encima de 400 mOsm/kg. Deberemos reponer con sal oral las pérdidas urinarias de sodio que induce. La furosemida puede ser administrada tanto i.v. como por v.o., en dosis habitualmente de 20 mg i.v. cada 8 a 24 horas, o de 40 mg v.o. cada 8 a 24 horas, aunque se hayan dado dosis mayores con éxito56,57. La furosemida será especialmente útil en pacientes en los que la duración de su cuadro de SIADH se prevé limitada a unos pocos días, como es el caso de personas con neumonía, o con SIADH inducida por fármacos que se puedan suspender (tabla 3).
La furosemida también puede ser útil en pacientes con niveles de Na+s por debajo de 120 mmol/l y que presenten síntomas leves o moderados, niveles de sodio por encima de 115 mmol/l y un bajo riesgo de herniación (p. ej., ancianos). En este caso, la natremia deberá ser repetida a las 3 a 6 horas de la dosis i.v.
Tratamiento con tolvaptán
Se recomienda el uso de tolvaptán, antagonista selectivo del receptor V2 de la AVP58, en pacientes que no sean candidatos a la restricción hídrica ni a la furosemida, y cuyo cuadro previsiblemente pueda durar algunos días, o más, caso del SIADH crónico.
Inicio y motorización de tolvaptán. Se recomienda empezar con tolvaptán en pacientes en los que el Na+s se haya elevado por encima de los 119 mmol/l, antes que en pacientes con sodio plasmático por debajo de este valor, ya que, en nuestra experiencia, así como en la experiencia de otros (Dr. Volker Burst de la Universidad de Colonia, comunicación personal), esos pacientes presentan un mayor riesgo de sobrecorrección.
El tratamiento con tolvaptán se debe iniciar siempre con el paciente hospitalizado. Es importante asegurar que el paciente esté bebiendo adecuadamente a lo largo del primer día de tratamiento, dado que se suele observar el máximo grado de acuaresis tras la administración de tolvaptán precisamente ese día, cuando el exceso de volumen circulante efectivo es mayor. Es especialmente importante asegurar ingesta libre y adecuada de agua en aquellos pacientes que previamente hayan estado en un período de restricción hídrica, acostumbrados a no beber tanto como desean. En el caso de pacientes con patologías que les impiden beber adecuadamente (p. ej., gastrointestinal, oral etc.), será necesario asociar soluciones glucosadas i.v. desde el comienzo del tratamiento. Pacientes con sonda nasogástrica deberán recibir el aporte de agua con infusión de glucosados al 5 % desde el inicio. En estos casos, la valoración de la diuresis será importante para estimar el aumento de las necesidades de líquido.
La dosis inicial recomendada es de 15 mg v.o. en dosis única diaria. Sin embargo, hay grupos que prefieren comenzar con una dosis menor de tolvaptán, 7,5 mg59,60 (Dr. Volker Burst, Universidad de Colonia, comunicación personal). Es preferible que la administración inicial del fármaco sea por la mañana (de 7.00 a 9.00), para facilitar su monitorización, el acceso al agua del paciente y su descanso nocturno.
Se recomienda la determinación de iones en plasma (Nas, Kp) y Osmp, así como iones en orina (Nau, Ku) y Osmu al inicio y a las 6 horas de la dosis inicial, además del control de la ingesta de líquidos y de la diuresis cada 6 horas.
En caso de observarse una elevación del Na+s mayor de 5 mmol/l a las 6 horas, se recomienda el inicio de medidas correctoras dirigidas a frenar el ascenso de la Na+s, ya que la natremia podrá seguir subiendo de forma marcada, con un incremento mayor durante la noche, coincidiendo con un período de menor ingesta de líquidos del paciente. Estas medidas incluyen un aumento en la ingesta oral de agua y la perfusión i.v. de solución glucosada al 5 % (3-4 ml/kg/h durante 2 horas, seguida por una nueva determinación y valoración del Na+s). Puede ser útil la administración de 2-4 μg de desmopresina (s.c. o i.v.) cada 6 horas según se requiera, dado que en nuestra experiencia el uso de este fármaco ayuda a frenar una excesiva corrección del Na+s, a pesar del bloqueo de los receptores V2 por el fármaco. Cuando usemos desmopresina, se recomienda iniciar con una pauta de solución glucosada al 5 % a un ritmo de (2-3 ml/kg/h) durante 2 horas, seguido de con un control del Na+s. Si es necesario, se incrementará el ritmo de infusión cada 2 horas para seguir bajando los niveles de sodio, con el objetivo de lograr un incremento máximo de 4 mmol/l desde el inicio. Una elevación de la natremia superior a 5 mmol/l a las 6 horas desde la dosis inicial de tolvaptán nos obligará a repetir de nuevo la determinación del Na+s a las 12 horas desde la dosis inicial. No todos los pacientes beben lo que necesitan, por lo que algunos podrían presentar un balance hídrico excesivamente negativo. En estos casos, es recomendable una nueva medida del Na+s a las 12 h.
Si un paciente no presenta una elevación de la Na+s superior a 5 mmol/l a las 6 horas de la primera dosis de tolvaptán, y está bebiendo libremente, se repetirá la Na+s a las 24 horas de la toma del fármaco, salvo que el paciente desarrolle balances de ingesta/diuresis excesivamente negativos, en cuyo caso se deberá repetir el Na+s antes.
Si a las 24 horas de la primera administración de tolvaptán un paciente presenta un incremento del Na+s superior a los 10 mmol/l, no se deberá administrar tolvaptán de nuevo ese día, y se podrán aplicar medidas correctoras en su caso, aunque la retirada transitoria del fármaco habitualmente es suficiente para inducir el deseado descenso de la natremia. El fármaco puede ser reintroducido al día siguiente. En caso de lograr una elevación neta del Na+s de 10 mmol/l o menos en 24 horas, se podrá administrar de nuevo 15 mg de tolvaptán, con la monitorización del Na+s al día siguiente. Si el incremento del Na+s ha sido insuficiente, se podrá elevar la dosis de tolvaptán a 30 mg/día, con un máximo de 60 mg/día. La experiencia clínica con tolvaptán en Europa sigue siendo limitada y su uso podrá sufrir modificaciones en un futuro, sobre todo en cuanto a dosificación.
Tolvaptán: consideraciones generales. A la hora de usar tolvaptán, es importante considerar sus interacciones con otros fármacos (tabla 4). Al ser un sustrato para el citocromo P450 3A4, sus concentraciones aumentan en presencia de inhibidores y descienden al asociarse a inductores. Asimismo, dosis elevadas del fármaco (60 mg/día) pueden incrementar la concentración de digoxina en sangre.
Tolvaptán debe utilizarse como monoterapia en el tratamiento de la hiponatremia por SIADH, y nunca deberá ser administrado en el mismo día que el suero salino hipertónico. Está contraindicado en el paciente hipovolémico, por lo que subrayamos la importancia de un correcto diagnóstico de SIADH para su uso. Habitualmente el fármaco es bien tolerado, y en nuestra experiencia es muy efectivo para lograr la eunatremia. No obstante, la sed intensa que en ocasiones induce, acompañada por la ingesta de cantidades importantes de agua, así como el dolor crónico, pueden reducir la eficacia del medicamento. Los pacientes con SIADH tipo D (SIAD secundario a una mutación activadora del receptor V2) probablemente no respondan al tratamiento61.
Duración del tratamiento con tolvaptán y seguimiento posalta. La duración del tratamiento dependerá de la causa del SIADH (tabla 3). Es preferible que la dosis sea reducida progresivamente, y no interrumpida de forma brusca. En caso de mantenerse la medicación posalta, se recomienda repetir los niveles de Na+s a la semana, seguido por analíticas a las 2-4 semanas, y posteriormente cada mes.
En nuestra experiencia, se puede ir reduciendo progresivamente la dosis de tolvaptán en muchos pacientes con SIADH crónico y mantener eunatremia estricta, una vez que la hayan alcanzado. Estos pacientes podrán precisar un incremento en su dosis en caso de hospitalización, u otras situaciones acompañadas por el incremento en el aporte de líquidos y/o por una reducción en la ingesta de sal.
CONCLUSIONES
Se han elaborado dos estrategias complementarias para el tratamiento de la hiponatremia inducida por SIADH, con el objetivo de que la toma de conciencia acerca de la importancia de su tratamiento, junto a la existencia de un protocolo que simplifique su abordaje, puedan mejorar el manejo prudente y juicioso de la hiponatremia y mejorar asimismo el pronóstico de esta alteración electrolítica.
A pesar de que la hiponatremia es frecuente y de que tiene importantes repercusiones negativas, hay una escasez de evidencia en el campo de la hiponatremia en general y de su tratamiento en particular. Necesitamos más investigación dirigida a la generación de evidencia orientada a la optimización del tratamiento de la hiponatremia. Esperamos que la aplicación de este protocolo simplifique el tratamiento de la hiponatremia inducida por SIADH, disminuya la morbilidad y facilite la recopilación de evidencia.
Conflictos de interés
Isabelle Runkle ha trabajado como consultora de Otsuka y ha impartido sesiones esponsorizadas por Otsuka, Amgen y Novartis.
Carles Villabona ha trabajado como consultor de Otsuka y ha impartido sesiones esponsorizadas por Novartis, Ipsen y Otsuka.
Andrés Navarro ha trabajado como consultor de Otsuka.
Antonio Pose ha trabajado como consultor de Otsuka, Boehringer, MSD, Rovi y Almirall, y ha impartido sesiones esponsorizadas por Otsuka, Almirall, Boehringer, Novartis, Astra, Bristol, Lilly, Bayer, Sanofi, Lacer y Novo.
Francesc Formiga ha trabajado como consultor de Otsuka, y ha impartido sesiones esponsorizadas por Otsuka.
Alberto Tejedor ha trabajado como consultor de Nefrología para la Agencia Española del Medicamento y la Agencia Europea del Medicamento. Consultor de Otsuka y Astra Zeneca.
Esteban Poch ha trabajado como consultor de Otsuka, y ha impartido sesiones esponsorizadas por Otsuka.
Tabla 4. Interacciones medicamentosas de tolvaptán
Figura 2. Algoritmo 2: Tratamiento no agudo
Figura 1. Algoritmo 1: tratamiento agudo
Tabla 1. Definiciones principales
Tabla 2. Clasificación de la hiponatremia según gravedad de la sintomatología
Tabla 3. Estimación de la duración del tratamiento del síndrome de secrección inadecuada de la hormona antidiurética o vasopresina según la etiología