La fibrosis sistémica nefrogénica es un trastorno fibrosante que afecta a pacientes con deterioro de la función renal y se asocia a la administración de medios de contraste basados en el gadolinio, empleados en la resonancia magnética. A pesar de tratarse de un grupo de fármacos que se consideraban seguros, la notificación de esta reacción adversa, potencialmente grave, supuso un punto de inflexión en las pautas de administración de estos medios de contraste. Se han intentado establecer parámetros de seguridad a fin de identificar a los pacientes con factores de riesgo por presentar insuficiencia renal. La estrecha farmacovigilancia y el rigor en la observación de las normativas actuales, con especial atención al valor del filtrado glomerular, han reducido los casos publicados relacionados con el uso de medios de contraste basados en el gadolinio. En un encuentro entre radiólogos y nefrólogos revisamos los aspectos más relevantes en la actualidad y las recomendaciones para su prevención.
Nephrogenic systemic fibrosis is a fibrosing disorder that affects patients with impaired renal function and is associated with the administration of gadolinium-based contrast media used in MRI. Despite being in a group of drugs that were considered safe, report about this potentially serious adverse reaction was a turning point in the administration guidelines of these contrast media. There has been an attempt to establish safety parameters to identify patients with risk factors of renal failure. The close pharmacovigilance and strict observation of current regulations, with special attention being paid to the value of glomerular filtration, have reduced the published cases involving the use of gadolinium-based contrast media. In a meeting between radiologists and nephrologists we reviewed the most relevant aspects currently and recommendations for its prevention.
INTRODUCCIÓN
Desde el año 1997, cuando por primera vez fue descrita por Cowper1, una entidad llamada fibrosis sistémica nefrogénica (FSN) ha concentrado la atención de nefrólogos y radiólogos en todo el mundo. Ha sido definida como una enfermedad fibrosante, que afecta de forma predominante a pacientes que han recibido contrastes con gadolinio, con filtrado glomerular (FG) estimado menor de 30 ml/min/1,73 m2 o en hemodiálisis2,3. En este documento nos interesa resumir la expresión clínica de la FSN, los datos conocidos sobre los diferentes contrastes basados en gadolinio, las posibilidades de identificar pacientes de riesgo para prevenir su aparición y los tipos de tratamiento de esta enfermedad.
GADOLINIO
Los medios de contraste basados en el gadolinio (MCG) se utilizan en los estudios de resonancia magnética (RM) por su capacidad magnética para modificar la posición de los protones de las moléculas de agua en los tejidos, un cambio que mejora la capacidad diagnóstica del estudio. Dichos medios de contraste actúan acortando el tiempo de relajación T1 y T2 de los tejidos donde se distribuyen, lo que conlleva fundamentalmente un aumento de señal en secuencias potenciadas en T1. Sin embargo, si la concentración del MCG es alta, predomina el acortamiento T2, produciendo una disminución de la señal. Actualmente existen nueve agentes aprobados y disponibles en Europa; sus características están resumidas en la tabla 1 .
Estructura y farmacocinética
El gadolinio (Gd) es un metal pesado con alta capacidad paramagnética y no hidrosoluble. En estado libre (Gd3) es muy tóxico, por lo que es necesario quelarlo con diferentes ligantes orgánicos, lo que da lugar a quelatos de gadolinio4. Existe cierta tendencia del ión a separarse del ligante en un proceso llamado bloqueo de la quelación5. Si posteriormente este procesto continúa a transmetalación y causa la FSN6. Transmetalación es una reacción química mediante la cual,un metal libre secundario con afinidad por el quelato, permite la liberación de gadolinio (Gd3). En pacientes con fallo renal, disminuye la excreción renal del MCG; su vida media se prolonga, lo que aumenta la posibilidad de que el Gd3 se disocie del quelato. Esto facilitaría el reclutamiento de fibrocitos circulantes, desencadenando la reacción fibrosante7,8. La estructura de los quelatos de gadolinio puede ser lineal o macrocíclica, siendo esta última la que muestra unas constantes de estabilidad termodinámica más elevadas. Al tratarse de compuestos hidrófilos, pueden clasificarse9 en iónicos y no iónicos, estos últimos con una menor osmolaridad para la misma concentración (tabla 1). De todos los agentes, los no iónicos lineares son los que tienen menos estabilidad e incrementan el riesgo de transmetalación y de esta manera estan asociados a major riesgo de FSN10,11.
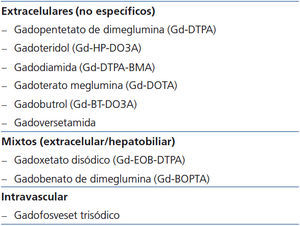
Atendiendo a la distribución tras su administración intravenosa (tabla 1), los MCG se clasifican en tres tipos: extracelulares no específicos, mixtos (de distribución extracelular e intracelular hepatoespecífica, con un porcentaje variable de eliminación biliar) e intravasculares (permanecen más tiempo en el espacio intravascular). La amplia mayoría de los MCG utilizados en la práctica diaria pertenecen al primer grupo12.
Los quelatos de GD tienen un peso molecular que varía entre 500 y 1.000 Da, no van unidos a proteínas plasmáticas y no son lipofílicos, lo que hace que después de su administración endovenosa haya una distribución y un equilibrio dentro del espacio extracelular. Todas esta características influyen en que los quelatos de GD tengan buena capacidad de filtración glomerular6. Son moléculas pequeñas que salen rápidamente del espacio vascular, con una vida media en plasma de unos 15-30 minutos. No atraviesan la barrera hematoencefálica ni la membrana celular, por lo que tras salir del espacio vascular se distribuyen por el espacio intersticial. Se eliminan, sin metabolizar, mediante filtrado glomerular. En pacientes con una función renal normal, el 98% del Gd es eliminado por la orina en las primeras 24 horas13, no se secreta ni se reabsorbe en el tubulo renal14. Estudios farmacocineticos han demostrado su eliminacion por filtrado glomerular, prolongandose en mas de 30 horas la vida media del contraste, pero sin efectos secundarios de nefrotoxicidad. En pacientes con insuficiencia renal el aclaramiento peritoneal del MCG fue de 3,8 ml/minuto/1,73 m2 con un T1/2 de 52,7 horas, lo que no sorprende teniendo en cuenta la lentitud del aclaramiento de las técnicas de diálisis peritoneal. El 75% de las dosis administradas se eliminó mediante diálisis peritoneal al cabo de cinco días por lo que la diálisis peritoneal no es técnica efectiva para eliminar contraste . Tras dos sesiones de hemodiálisis se elimina el 95% de la dosis administrada de gadolinio pero no hay pruebas de su eficacia en la eliminación del riesgo de FSN. No obstante se recomienda en pacientes en diálisis realizar hemodiálisis antes de dos horas después de la administración y otra hemodiálisis al siguiente día. No se recomienda de forma rutinaria en pacientes que no estan en diálisis6.
Dosis y rango de administración
Como un átomo de gadolinio modifica los tiempos de relajación de muchos núcleos de hidrógeno vecinos, la dosis de contraste utilizada es baja, significativamente inferior a la cantidad de yodo administrada para estudios de tomografía computarizada15. Los preparados comerciales más habituales tienen una concentración de 0,5 molar (0,5 M), por lo que la dosis de administración estándar es de 0,1 mmol/kg de peso, equivalente a 0,2 ml/kg de contraste4. Dosis altas e incrementos de la dosis acumulada aumentan el riesgo de FSN6.
FIBROSIS SISTÉMICA NEFROGÉNICA
La FSN es un trastorno fibrosante adquirido que se ha observado en pacientes con un deterioro grave de la función renal. Aunque el término «fibrosis sistémica nefrogénica» se adoptó en el año 2005, fue reconocida por primera vez en 1997 y descrita en el año 2000 por Cowper como un cuadro de escleromixedema-like en pacientes en diálisis1. En nuestro país, Rodríquez Jornet et al. publicaron el primer caso en el año 2009, con la revisión anatomopatológica detallada del paciente, e imágenes macroscópicas y microscópicas están disponibles en: http://www.revistanefrologia.com/modules.php?name=articulos&idarticulo=129&idlangart=ES16. En la tabla 2 se recoge la cronología y evolución del término.
Epidemiología
La FSN afecta en la mayoría de los casos a pacientes con deterioro de la función renal, sobre todo con FG estimado menor de 30 ml/min/1,73 m2 sin importancia del origen del daño renal (agudo, crónico o pacientes en hemodiálisis)2,3, sometidos a MCG. Según Zou et al., los dos grupos más afectados son los pacientes con insuficiencia renal crónica (IRC) en diálisis (85 % de los casos) y aquellos con insuficiencia renal aguda17. Otro grupo de pacientes que pueden estar afectados son aquellos con insuficiencia hepática que presentan síndrome hepatorrenal agudo18,19. Es bien conocido el hecho de que no todos los pacientes de riesgo expuestos a MCG experimentan enfermedad6.
La FSN es más frecuente en los pacientes de edad media (50-60 años)20, aunque puede afectar a niños y ancianos21,22. No existen diferencias según raza o sexo, ni relación con la causa o duración de la IRC20.
Aunque diversos autores han comunicado diferentes prevalencias según la selección de la población, actualmente se estima una incidencia media del 0-18 % en la población de riesgo23. Se ha establecido una clara relación entre la dosis de MCG utilizada y el riesgo de FSN, con una incidencia de FSN próxima a 0 tras una exposición a dosis estándar15,24. También se han comunicado diferencias en la incidencia de FSN según las características de la molécula, habiéndose registrado un mayor número de casos de FSN tras la exposición a compuestos lineales no iónicos. Como hemos mencionado previamente, parece existir mayor riesgo de incidencia en el grupo de pacientes de diálisis peritoneal25.
Gracias al conocimiento de los factores de riesgo y a la mejor utilización de los MCG, el número de casos de FSN ha descendido de forma notable26 . Desde 2008 ya no hay casos descritos con ningun MC sin que se haya cambiado el mismo27. Muchos centros han continuado usando los mismos MCG pero han cambiado los patrones de uso.
Etiopatogenia
Aunque la patogenia exacta de la FSN sigue siendo desconocida, la única asociación sólida, identificada en todos los pacientes con FSN, es la insuficiencia renal, tanto en su forma crónica como en la aguda, y su presencia es condición sine qua non para el diagnóstico de la entidad28. Sin embargo, solo un pequeño porcentaje de la población de riesgo expuesta a MCG desarrolla FSN, y también se han descrito casos de FSN sin exposición a MCG29.
Dado que la exposición a MCG no explica todos los casos de FSN, se ha intentado buscar otros factores coadyuvantes de riesgo que podrían contribuir a su desarrollo, muchos de ellos asociados a situaciones de fallo renal. Factores proinflamatorios: daño vascular, intervención quirúrgica, trombosis, estadios procoagulantes, infección severa, hepatitis crónica C, enfermedad hepática crónica y trasplante hepático, hiperparatiroidismo, hipotiroidismo. Factores bioquímicos: acidosis, hierro endovenoso, eritropoyetina, calcio y fósforo30.
Mecanismos fisiopatológicos
Las dos formas, iones libres de Gd y complejo de quelante-Gd pueden producir liberación de citoquinas estimulando macrófagos de la piel (iones libres de Gd) o monocitos en sangre periférica (complejos de quelante-Gd). Todos estos procesos (activación de macrófagos, liberación de citokinas proinflamatorias, diferenciacion de fibrocitos en la sangre, activación de fibroblastos, vías de TGF-β, metalotioteina, FGF-23, proteina Klotho) llevan a cabo una estimulación de fibroblastos30 una respuesta que crea depósitos de colágeno y fibrosis mediante el aumento de los niveles de factor de transformación de crecimiento beta-131. La presencia de insuficiencia renal contribuye a la liberación de GD3 libre mediante el aumento de la transmetalación en presencia de un entorno urémico y de una disminución de la tasa de filtrado glomerular32. Un esquema completo con mecanismos fisiopatológicos publicado por Chopra y col. está disponible en http://www.hindawi.com/journals/ijn/2012/912189/fig1/30.
Diagnóstico
Clínicamente se presenta como un engrosamiento y endurecimiento de la piel, asociado a dolor, debilidad muscular, dolor óseo y contracturas de las articulaciones, que produce discapacidad severa3. Con el tiempo puede darse pérdida de flexibilidad, limitación de la movilidad y contractura articular2,34. Las lesiones pueden tener forma de placas (58 %) con bordes irregulares y pápulas (32 %), nódulos (17 %), máculas, vesículas, ampollas, bulas y úlceras2,21,35,36. Típicamente afectan a las extremidades inferiores, pero pueden tener cualquier localización y suelen respetar la cara35. Estas lesiones cutáneas en el tiempo progresan a piel leñosa rodeada de arrugas, también llamada como «piel de naranja»37. La mayoría de las lesiones son hiperpigmentadas y eritematosas (39 %), pero pueden variar sus coloraciones (morado, marrón, amarillo, rosado, naranja-rojo, gris-marrón)35,38. A veces se pueden confundir estos cuadros y de forma errónea tratar como celulitis6. Kroshinsky et al. publican el caso de una mujer de 46 años con IRC, edemas en las extremidades inferiores y cambios cutáneos, hacen una revisión con posibles diagnósticos diferenciales y disponen de las imágenes macroscópicas y microscópicas de la dermis39. En el momento de describir por primera vez esta entidad los científicos pensaban que se limitaba a una afectación cutánea, pero actualmente es bien conocida la afectación de las articulaciones, el sistema muscular, testicular, renal, cardíaco y la duramadre31,40,41. Otro signo de interés es la presencia de un cuadro similar a la conjuntivitis en un 75 % de los casos6.
El comienzo de los síntomas es variable; generalmente tiene lugar entre dos semanas y dos meses después de la exposición a MCG. Sin embargo, también se ha descrito un comienzo tardío, años después de la exposición17.
El diagnóstico histológico se basa en la biopsia cutánea, donde se constata fibrosis dérmica, con haces colágenos engrosados y una cantidad variable de fibras elásticas y mucina. La célula mediadora es el fibrocito circulante (CD34 y procolágeno I positivo en el teñido inmunohistoquímico)28,42. En la mayoría de los casos no están presentes las células inflamatorias y en algunas ocasiones se ha visto infiltrado mononuclear perivascular43. Sanyal et al. realizaron una revisión histológica de un caso clínico con microscopio electrónico y fluorescencia de rayos X por energía dispersiva44.
Respecto a su asociación con los MCG, las primeras publicaciones datan de 200645,46, demostrándose la presencia de gadolinio en tejidos solo un año después47,48. En condiciones normales, los MCG son eliminados por FG en 1-2 días.
Pronóstico
La evolución natural de la FSN no es completamente conocida. Se ha descrito que hasta en un 5 % de los casos puede tener un curso fulminante20. Un tercio tendrán un curso ligero sin limitación funcional17. Existe un incremento de la mortalidad a los 24 meses de haberse presentado las manifestaciones cutáneas de FSN49. La mortalidad real es desconocida y difícil de determinar, dada la alta prevalencia de otras comorbilidades34.
Tratamiento
No hay evidencia de tratamientos efectivos y solo en pacientes trasplantados se ha conseguido mejorar o detener la evolución de la enfermedad renal en caso de fracaso renal agudo50.
Como hemos mencionado previamente, su peso molecular permite la filtración glomerular6 y, dadas estas características, la posibilidad de eliminación con hemodiálisis51. Varios autores han realizado estudios confirmando la eliminación de varios tipos de MCG con tres sesiones de hemodiálisis de tres horas. Apoyándose en estos resultados, la Sociedad Europea de Radiología recomienda la realización de hemodiálisis de nueve horas repartida en tres sesiones. No obstante, el gadofosveset es uno de los agentes con dificultad en su eliminación por hemodiálisis, por estar unido a la albúmina sérica en mayor proporción6. Broome et al. presentaron una serie con tres casos que desarrollaron FSN a pesar de las sesiones de hemodiálisis indicadas previamente52. De momento no se han hecho estudios de hemofiltración continua ni hemodiafiltración continua endovenosa.
La mayoría de los tratamientos propuestos están todavía en fase de investigación y de momento dan resultados subóptimos (esteroides orales, fotoforesis extracorpórea, plasmaféresis, talidomida, ciclofosfamida, pentoxifilina, inmunoglobulina intravenosa, interferón alfa y vitamina D, radiación ultravioleta, etanercept)20. Últimamente se han intentado tratamientos combinados con imatinib y fotoforesis extracorpórea53,54. También se ha confirmado la eficacia del tratamiento con alefacept en tres pacientes con FSN55. La mejoría de la función renal (trasplante, resolución de la insuficiencia renal aguda) puede enlentecer e incluso revertir el proceso20. Sin embargo, en realidad ningún tratamiento ha demostrado realmente su eficacia; de ahí la importancia de su prevención.
PREVENCIÓN DE LA FIBROSIS SISTÉMICA NEFROGÉNICA
Identificación de pacientes con enfermedad renal crónica
La clasificación de la enfermedad renal crónica (ERC) ha seguido la publicación inicial de la National Kidney Foundation a través de las guías de la Kidney Disease Outcomes Quality Initiative (K-DOQI)56. La definición de la ERC por la K-DOQI contempla:
Daño renal durante al menos tres meses, definido por anormalidades estructurales o funcionales del riñón con o sin disminución del FG y manifestado por alteraciones patológicas o marcadores de daño renal (alteraciones en la composición de la sangre u orina o alteraciones en las imágenes renales).
FG < 60 ml/min/1,73 m2 durante más de tres meses, con o sin daño renal.
Es frecuente que en las consultas se evalúe la función renal simplemente mediante la medición de la creatinina sérica (CrS). Sin embargo, y aunque es cierto que la CrS es un buen parámetro de seguimiento de la evolución del filtrado, no siempre es equivalente al FG. La CrS depende también de otros factores distintos del FG, como la secreción tubular y la generación y excreción extrarrenal de creatinina, lo que explica el rango amplio para la CrS en personas sanas. Algunos estudios57 demuestran que un importante porcentaje de varones y sobre todo de mujeres presentan reducciones en el FG con CrS normales. Incluso en rangos de creatinina entre 1,3 y 2,5 mg/dl, se encuentran porcentajes importantes de insuficiencias renales muy graves (FG inferiores a 30 ml/min/1,73 m2). Así pues, la verdadera prevalencia de individuos con insuficiencia renal parece ser más elevada que la que a simple vista puede determinarse por el estudio de la CrS. Las consecuencias de estas observaciones son importantes. Esta insuficiencia renal «oculta» puede agravarse fácilmente con la enorme cantidad de medicaciones que interfieren, sobre todo en la hemodinámica glomerular, como son los antiinflamatorios no esteroideos, los inhibidores de la enzima conversora de la angiotensina y otro tipo de fármacos. Asimismo, a menudo los pacientes son sometidos a exploraciones radiológicas con una inadecuada evaluación de la función renal, basada únicamente en la creatinina plasmática.
La organización internacional KDIGO (Kidney Disease Global Outcomes; http://www.kdigo.org/) recomienda el uso de ecuaciones de predicción para calcular el FG basadas en la CrS. En adultos, las fórmulas más empleadas son la derivada del estudio Modification of Diet in Renal Disease (MDRD) y la de Cockcroft y Gault58. Existen determinadas circunstancias en las que la primera no está validada (tabla 3) y para estimar el FG debe recogerse la orina de 24 horas o realizar estudios de aclaramiento de creatinina en orina de 24 horas, iotalamato, iohexol o inulina. De todas formas, la estimación del FG utilizando la fórmula MDRD es más precisa que la CrS, y considerando estas limitaciones el clínico puede obtener una información válida sobre la función renal. Recientemente, la KDIGO ha recomendado una nueva fórmula de cálculo de la función renal llamada CKD-EPI (Chronic Kidney Disease Epidemiology
Collaboration), que es más precisa que la MDRD para valores cercanos a 60 ml/min59. Asimismo, ha actualizado la clasificación de la ERC mediante la incorporación del concepto CGA: C: causa de la ERC; G: FG incorporando grupos 3a y 3b; y A: albuminuria con tres subgrupos: A1 (< 30 mg/g de creatinina), A2 (30-300) y A3 (> 300)60 (tabla 4).
En ocasiones no hay datos de la función renal, En estos pacientes con una función renal desconocida y que requieran una exploración radiológica con gadolinio, se considerará una serie de parámetros, como factores de riesgo de insuficiencia renal, que obligarán a retrasar la exploración hasta conocer con exactitud cuál es su función renal (tabla 5). Los factores de riesgo deben forman parte de la rutina antes de utilizar MCG en cualquier centro.
REACCIONES ADVERSAS INMEDIATAS A LOS MEDIOS DE CONTRASTE BASADOS EN EL GADOLINIO
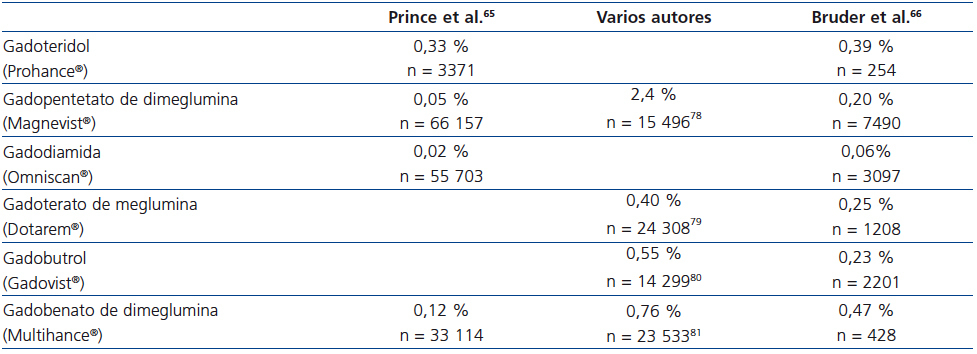
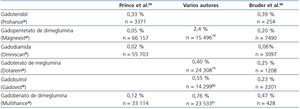
Los MCG son fármacos muy seguros, con un índice de aparición de reacciones adversas inmediatas (RAI) bajo, del 0,07-2,4 %61-63, la mayoría de carácter leve, fundamentalmente náuseas o cefalea en el momento de la inyección.
Aunque todos los MCG muestran una incidencia de RAI bastante similar64, existen diferencias en su aparición que no parecen explicarse en función de sus características fisicoquímicas65,66 (tabla 6).
De entre las RAI a los MCG, hay que destacar por su relevancia las reacciones alérgicas, que se definen como un tipo de reacción adversa mediada inmunológicamente por anticuerpos o linfocitos, caracterizada por ser específica y recurrente si el paciente se expone de nuevo al fármaco67. Según el momento de presentación, se distinguen dos tipos de reacciones alérgicas a los medios de contraste radiológicos: las inmediatas y las no inmediatas o tardías68. Las reacciones alérgicas inmediatas están mediadas por inmunoglobulina E; en caso de que se desarrolle una reacción alérgica sistémica nos enfrentamos a anafilaxia. Se produce por liberación de histamina y otros mediadores, ocasionando síntomas que pueden poner en peligro la vida del paciente: edema laríngeo, angioedema, obstrucción de la vía aérea inferior, urticaria, náuseas, vómitos, hipotensión y/o shock.
La aparición de reacciones alérgicas a los MCG es impredecible, aunque se sabe que su incidencia aumenta en pacientes asmáticos y en aquellos con alergias alimentarias y/o medicamentosas58,69.
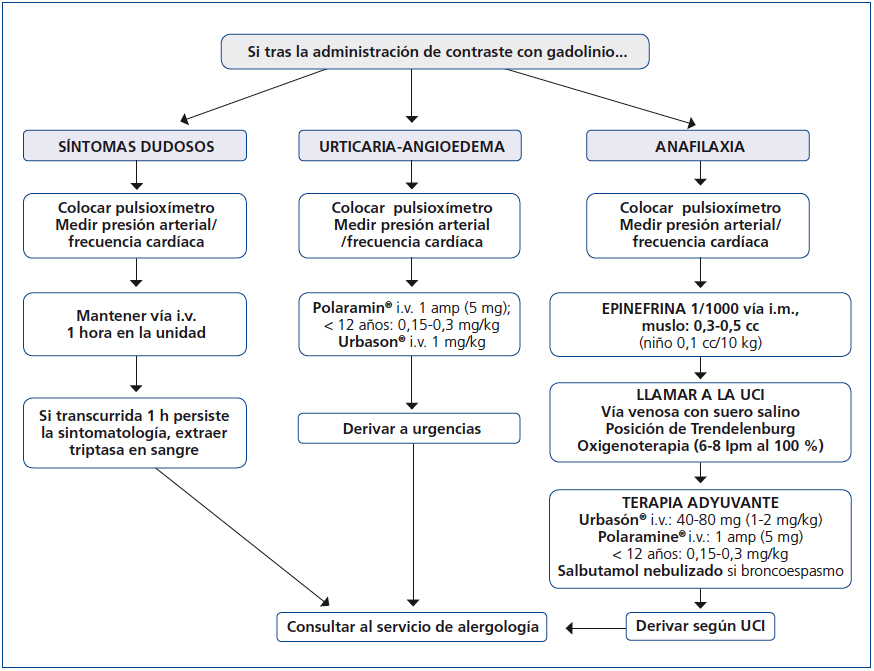
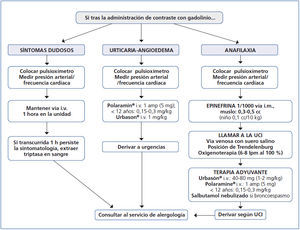
En cuanto a cómo actuar frente a una reacción alérgica a un MCG, la figura 1 ofrece un algoritmo que muestra esquemáticamente cómo manejar estas situaciones de emergencia en el servicio de radiodiagnóstico.
APRENDER DE LA EVIDENCIA
Usos y abusos clínicos
Desde la introducción de los MCG como contraste en la RM, sus aplicaciones han ido aumentando día a día, hasta el punto de que en la actualidad se emplean a diario en prácticamente todos los órganos de la anatomía. Durante los primeros años, se creó una idea de falsa seguridad que llevó a una utilización demasiado entusiasta de los MCG, que en muchos casos se usaban como sustitutos de los contrastes yodados en estudios de tomografía computarizada o angiografía convencional en pacientes alérgicos al contraste yodado o en pacientes con insuficiencia renal e incluso en estudios de RM, en dosis muy superiores a las recomendadas.
Este uso de MCG, previo a la notificación de la FSN, se llevó a cabo sin ningún tipo de control en cuanto a dosis o tiempos de administración y sin adoptar ninguna precaución en relación con la función renal de los pacientes.
La notificación de esta reacción adversa tardía y potencialmente grave supuso un punto de inflexión que obligó a los servicios de radiología a establecer nuevas pautas de actuación encaminadas a proteger a los pacientes de ella. Aunque la información inicial pudiera resultar confusa, algunas evidencias eran claras y arrojaban luz respecto de las medidas que adoptar para la prevención de la enfermedad: solo se había notificado en pacientes con insuficiencia renal grave (FG < 30), su incidencia guardaba relación con la administración de dosis altas de gadolinio y era más habitual en pacientes con cuadros proinflamatorios.
Limitaciones clínicas en el uso de los medios de contraste basados en el gadolinio
La principal limitación respecto al empleo de MCG en la RM deriva de la dificultad de conocer el FG de los pacientes, especialmente de los ambulatorios. En este sentido, es importante la colaboración entre el servicio de radiología, que de forma rutinaria y obligatoria tendría que recoger factores de riesgo de insuficiencia renal (tabla 4) previamente a la realización del estudio con MCG, y por otro lado el médico solicitante de la prueba, que debería informar de forma obligatoria de la función renal del paciente y valorar el riesgo/beneficio de la prueba solicitada para el paciente. En caso de que se confirme alguno de los factores de riesgo de insuficiencia renal o no se pueda descartar ni valorar el FG del paciente, sería preferible posponer su realización hasta determinar el MDRD o CKD-EPI en un nuevo control.
Desde que el gadolinio es considerado un agente potencialmente causante de FSN, se han diseñado guías restrictivas para su administración (tabla 7), siendo los aspectos más importantes el disponer de datos recientes del FG y la adecuación de las dosis empleadas en relación con este (tabla 8).
En el año 2010, la Administración de Alimentos y Medicamentos norteamericana (FDA) estableció precauciones generales de uso de los MCG y limitó el uso de MCG tipo Magnevist®, Omniscan® y Optimark® en pacientes con fracaso renal agudo e IRC severa de alto riesgo43. Dos años más tarde tras las recomendaciones realizadas por la FDA, se observó una disminución del 71 % de las realizaciones de RM en pacientes con MDRD 30 ml/min/1,73 m2 y un aumento del 99 % de las solicitudes de CrS un mes antes de realizar la RM70. Un año antes también la Agencia Europea de Medicamentos contraindicó el uso de dichos MCG en pacientes con insuficiencia renal severa, neonatos y en aquellos pendientes de trasplante hepático43. Según Bennet et al., en Dinamarca desde el año 2007 y en Estados Unidos desde 2009 no ha sido publicado ningún nuevo caso de FSN71.
La posibilidad de que se produzca esta reacción adversa no debe limitar la actuación clínica. Es imprescindible encontrar un equilibrio entre la garantía de seguridad del paciente y la realización de pruebas necesarias para el correcto manejo clínico. Para ello, se discutirá clínicamente la necesidad y el rendimiento de la prueba y se tendrán en cuenta otras opciones diagnósticas, así como contrastes alternativos. En definitiva, se valorará el riesgo/beneficio.
CONCLUSIONES
Los MCG constituyen un grupo de fármacos, de características fisicoquímicas diferenciadas, que cada vez se utilizan más en el diagnóstico por imagen de la RM.
Debido a que inicialmente su uso se llevó a cabo sin tener en cuenta la función renal del paciente y sin un conocimiento exacto de las dosis tóxicas permitidas, aparecieron una serie de efectos adversos, y sobre todo el trastorno fibrosante multiorgánico de predomino dermatológico posteriormente conocido como FSN, que desprestigiaron su empleo.
La notificación de esta reacción adversa tardía y potencialmente grave supuso un punto de inflexión, ya que obligó a establecer consensos para la protección del paciente con valoración del FG y de los factores de riesgo. Todo esto, conjuntamente con la adecuación de las dosis, ha hecho que el número de reacciones adversas haya descendido notablemente, de forma que en los últimos cinco años apenas se han publicado casos relacionados con el uso del gadolinio.
En cuanto a las RAI, todos los MCG muestran una incidencia escasa y similar, aunque con diferencias entre unos y otros, siendo gadodiamida el que presenta la menor incidencia63,64,67. Dichas reacciones, aunque generalmente son leves, en ocasiones pueden ser graves e incluso mortales.
La protección del paciente es fundamental cuando se emplean los MCG en radiología. La identificación y selección de los pacientes de riesgo, y la valoración del riesgo y beneficio, así como la información del paciente sobre efectos adversos, son imprescindibles.
En la mayoría de los casos es necesaria la valoración del paciente, una decisión a nivel multidisciplinar y, sobre todo, individualizar cada caso.
Conflictos de interés
El contenido de esta revisión se basa en una actualización de las presentaciones de la Sesión de Trabajo patrocinada por GE Healthcare: ¿Qué ha pasado con la FSN? Situación actual, que tuvo lugar en el XXXI Congreso de la SERAM (Granada, 2012). La publicación de esta revisión se ha llevado a cabo de forma independiente al sponsor de la Sesión de Trabajo.
Tabla 1. Clasificación de los diferentes contrastes de gadolinio según su distribución
Tabla 2. Cronología y evolución del término «fibrosis sistémica nefrogénica»
Tabla 3. Circunstancias en las que la ecuación MDRD (Modification of Diet in Renal Disease) no es válida para el cálculo del filtrado glomerular
Tabla 4. Clasificación de la enfermedad renal crónica (57)
Tabla 5. Factores de riesgo de la enfermedad renal crónica
Tabla 6. Porcentaje de reacciones adversas inmediatas a los medios de contraste basados en el gadolinio
Tabla 7. Medidas para evitar el desarrollo de fibrosis sistémica nefrogénica
Tabla 8. Administración de gadolinio ajustada a la función renal
Figura 1. Protocolo de tratamiento a las reacciones adversas con gadolinio.