La mitad de los enfermos con síndrome nefrótico causado por glomeruloesclerosis focal y segmentaria (GFS) primaria presentan resistencia al tratamiento con esteroides. En caso de corticorresistencia, la mejor opción basada en la evidencia ha sido clásicamente el tratamiento con inhibidores de calcineurina, aunque estudios recientes indican que micofenolato podría tener una eficacia similar. En los enfermos con resistencia a anticalcineurínicos, no existe ninguna opción capaz de modificar el curso clínico de la enfermedad, avalada por ensayos clínicos de diseño apropiado, aunque en estudios observacionales se ha sugerido la posible utilidad de micofenolato, sirolimus, rituximab, aféresis o altas dosis de galactosa como opciones terapéuticas. En las GFS de origen idiopático, resistentes a esteroides y anticalcineurínicos, antes de tomar la decisión de ensayar o no otros fármacos inmunosupresores, podría ser apropiado realizar un análisis sistemático que contemplara: 1) considerar si la dosis y el tiempo de tratamiento con esteroides y anticalcineurínicos fueron adecuados; 2) analizar el nivel de expresión de la glicoproteína P en los linfocitos; 3) considerar realizar una nueva biopsia renal en caso de que en la primera no se disponga de estudio de microscopía electrónica; 4) en enfermos jóvenes, considerar un estudio genético para descartar la presencia de la variante p.R229Q de la podocina en combinación con mutaciones heterozigotas en NPHS2, y 4) considerar la gravedad y dificultad de manejo del síndrome nefrótico y la probabilidad de pérdida progresiva de la función renal. En la actualidad, hay múltiples vías de estudio para intentar identificar los mecanismos patogénicos causantes de la lesión podocitaria y hay también en curso varios estudios para analizar la eficacia de fármacos como adalimumab, fresolimumab, rosiglitazona, ACTH (corticotropina) o galactosa a altas dosis, cuyos resultados preliminares han generado expectativas que requieren ser confirmadas en estudios clínicos a mayor escala. En un futuro, es posible que el mejor conocimiento de la vía o vías patogénicas causantes de GFS permita diferenciar entre las formas inmunomodulables y las que no lo son, pero, hoy por hoy, este desafío continúa plenamente vigente.
Half of patients with nephrotic syndrome caused by primary focal segmental glomerulosclerosis (FSGS) have resistance to treatment with steroids. In the case of corticosteroid resistance, the best evidence-based option has classically been treatment with calcineurin inhibitors, although recent studies indicate that mycophenolate may have similar efficacy. In patients with resistance to calcineurin inhibitors, there is no option that allows the clinical course of the disease to be modified, and this is supported by appropriately designed clinical trials, although observational studies have suggested the potential usefulness of mycophenolate, sirolimus, rituximab, apheresis or high galactose doses as treatment options. In FSGS of idiopathic origin, resistant to steroids and calcineurin inhibitors, before taking the decision whether or not to test other immunosuppressive drugs, it might be appropriate to conduct a systematic analysis that considers: 1) evaluating whether the dose and duration of treatment with steroids and calcineurin inhibitors were suitable, 2) analysing the level of P-glycoprotein expression in lymphocytes, 3) performing a new renal biopsy if there is no electron microscopic study available for the first, 4) in young patients, considering a genetic study to rule out the presence of the podocin variant pR229Q in combination with heterozygous mutations in NPHS2, and 5) evaluating the seriousness and difficulty of managing the nephrotic syndrome and the likelihood of progressive loss of renal function. Currently, there are multiple study avenues that attempt to identify the pathogenic mechanisms that cause podocyte injury and there are also several studies underway to analyse the efficacy of drugs such as adalimumab, fresolimumab, rosiglitazone, ACTH (corticotropin) or galactose at high doses, whose preliminary results have generated expectations that require confirmation in larger-scale clinical studies. In the future, it is possible that a better understanding of the pathogenic pathway or pathways that cause FSGS may allow differentiation between immunomodulable and non-immunomodulable forms, however, this continues to be a challenge currently.
INTRODUCCIÓN
El término glomeruloesclerosis focal y segmentaria (GFS) define una entidad clínica que tiene un patrón de lesión anatomopatológico característico en la microscopía óptica, pero con múltiples etiologías posibles1. En términos prácticos, la GFS se clasifica en primaria o secundaria en función de si se identifica o no una etiología responsable de esta1,2. No obstante, como el criterio utilizado en distintas clasificaciones al referirse a formas primarias y secundarias no es el mismo, es preciso definir con detalle a qué concepto se hace referencia cuando se habla de una forma primaria. En algunas clasificaciones (tabla 1), se reserva el término para los casos idiopáticos, lo que excluye las formas debidas a mutaciones en proteínas podocitarias y las debidas a infecciones víricas o toxicidad por fármacos. En otras, por el contrario (tabla 2), el concepto de forma primaria se identifica con lesión primaria del podocito independientemente de si esta es de etiología desconocida, vírica, genética o farmacológica. En términos de indicación de tratamiento inmunosupresor, es útil la clasificación expuesta en la tabla 1, ya que difícilmente se puede justificar el uso de dichos fármacos en enfermos con evidencia de mutaciones podocitarias y, en los casos en los que se demuestra infección vírica o toxicidad farmacológica, el enfoque más adecuado es el tratamiento de la infección o la supresión del agente responsable. No obstante, aun aceptando como formas primarias únicamente las que actualmente son idiopáticas, no puede excluirse por completo que algunos de los enfermos seleccionados para tratamiento inmunosupresor sufran formas que, a medida que progrese el conocimiento en la patogenia de la GFS, sean clasificadas más adelante como secundarias o no sensibles a los inmunosupresores. Con estas salvedades, y a pesar de las dudas acerca de que exista una única vía patogénica común e inmunomodulable para todas las formas de GFS idiopática, en la actualidad, con la evidencia disponible3-6, hay acuerdo en que, en los enfermos con formas de GFS idiopáticas que presentan síndrome nefrótico persistente, los esteroides son el tratamiento de primera elección y, en ausencia de respuesta a estos, la mejor opción es el tratamiento con inhibidores de la calcineurina4-6. Sin embargo, aproximadamente el 40 % de los pacientes presentan resistencia tras el tratamiento inicial con estos fármacos o la desarrollan tras una o varias recidivas. La resistencia al tratamiento supone un problema de difícil solución y tiene consecuencias graves, ya que es el predictor independiente más importante del desarrollo de enfermedad renal crónica progresiva7-10.
En la presente revisión, se exponen las normas consensuadas y los resultados esperables tras el tratamiento con esteroides y anticalcineurínicos en la GFS idiopática, se consideran las diferentes opciones terapéuticas disponibles para los enfermos resistentes a estos fármacos y se analizan las variables clínicas que podrían orientar ante el dilema de decidir entre realizar un tratamiento sintomático o proseguir con tratamiento inmunosupresor. Finalmente, se analiza hacia dónde se dirige la investigación en el momento actual.
DIMENSIÓN DEL PROBLEMA. PAUTAS Y RESULTADOS DEL TRATAMIENTO CON CORTICOESTEROIDES E INHIBIDORES DE LA CALCINEURINA EN LA GLOMERULOESCLEROSIS FOCAL Y SEGMENTARIA
Corticosteroides
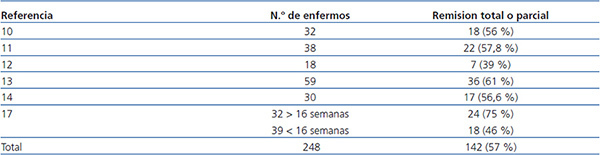
La probabilidad de respuesta a esteroides depende de la función renal inicial, del grado de pérdida podocitaria, del tiempo de evolución de la enfermedad y de la extensión de las lesiones de fibrosis intersticial7-9. La recomendación del tratamiento con esteroides se fundamenta en los resultados de estudios observacionales de series de casos (tabla 3)10-17. La duración del tratamiento y la dosis de esteroides son dos aspectos sobre los que no es posible realizar recomendaciones basadas en altos grados de evidencia; por ello, resulta muy difícil definir un criterio claro e indiscutible de corticorresistencia. Con pautas de duración inferior a 12 semanas, los porcentajes de remisión no superan el 30 %, mientras que las máximas frecuencias de remisión se han descrito con tratamientos de 6 a 12 meses2-6,17. Se aconseja iniciar el tratamiento con una dosis de 1 mg/kg/día y realizar controles mensuales de la excreción urinaria de proteínas. Dado que la exposición a dosis tan elevadas de esteroides durante largos períodos de tiempo puede inducir efectos tóxicos graves, y que la mayor parte de los enfermos que van a responder presentan algún grado de reducción en la proteinuria en el plazo de 14 a 16 semanas, se considera que el criterio de corticorresistencia puede aceptarse si en el plazo de 14-16 semanas no se ha apreciado ningún cambio en la excreción urinaria de proteínas o bien si, en caso de haberla presentado, el enfermo persiste con síndrome nefrótico tras haber finalizado un ciclo de 6 meses de tratamiento. Con este criterio, se han descrito remisiones en un 60-70 % de los pacientes con función renal normal en la evaluación inicial4-6,17. Un 25 % de los enfermos mantienen remisiones estables tras tratamiento con esteroides y aproximadamente el 50 % presentan corticorresistencia tras el tratamiento inicial o la desarrollan tras una o varias recidivas2,10-17.
Inhibidores de la calcineurina
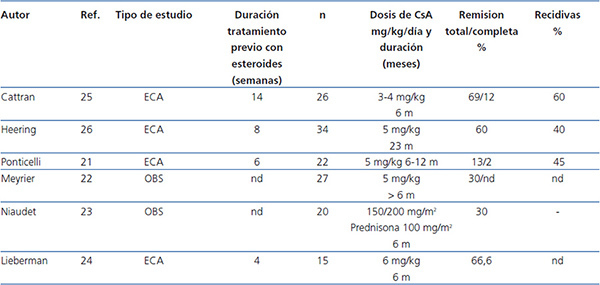
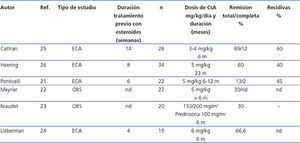
La indicación de anticalcineurínicos en el tratamiento de la GFS se ha basado en la hipótesis de que la lesión del podocito se produce como consecuencia de la activación de la respuesta inmunológica18,19. Sin embargo, se ha demostrado que, además, estos fármacos tienen efectos directos sobre vías de señalización intracelular y la arquitectura del citoesqueleto podocitario20. La eficacia de la ciclosporina A (CsA) para el tratamiento de la corticorresistencia ha sido descrita en distintos estudios observacionales y está avalada por los resultados de ensayos clínicos aleatorios (tabla 4)21-26. Se aconseja iniciar el tratamiento a una dosis de 5 mg/kg/día, dividida en dos dosis, administradas cada 12 horas, para mantener unos niveles valle de entre 150 y 200 ng/ml. El tratamiento debe durar un mínimo de 6 meses y, si al final de este período no se ha conseguido la remisión del síndrome nefrótico, debe considerarse que el paciente presenta resistencia a la CsA. Con esta pauta, suele inducirse remisión completa o parcial aproximadamente en un 60-70 % de los casos2-7. En caso de que haya remisión, se aconseja mantener el tratamiento al menos 12 meses y después disminuir progresivamente un 25 % cada 2-3 meses hasta la supresión de este o la evidencia de recidiva. En los casos recidivantes, se aconseja realizar tratamientos más prolongados, pero no hay evidencia que permita aconsejar un período de tratamiento concreto2,3,5,6. Un 15-20 % de los casos desarrollan dependencia y requieren tratamiento continuo con dosis bajas de CsA para mantener la remisión. Alrededor del 40 % de los enfermos corticorresistentes son también inicialmente resistentes a la CsA, y la mitad de los casos que responden se hacen resistentes a la CsA. Los datos con tacrolimus en adultos con GFS corticorresistente se limitan a estudios observacionales27-30 que sugieren que este fármaco tiene una eficacia y un perfil de toxicidad renal similar a CsA. En niños con GFS corticorresistente, se ha publicado un ensayo clínico31 en el que se compara la eficacia de CsA frente a tacrolimus, en ambos casos asociado a bajas dosis de esteroides, y se concluye que ambos fármacos tienen una eficacia similar pero con un perfil de efectos adversos extrarrenales distinto y una tendencia a un menor número de rebrotes con tacrolimus. Por ello, en función de estos criterios, tacrolimus podría ser una opción a CsA en determinados pacientes. En adultos es aconsejable iniciar el tratamiento a dosis de 0,06 mg/kg, que posteriormente deben ser ajustadas para mantener unos niveles valle entre 7 y 9 ng/ml, ya que dosis superiores (0,15 mg/kg) se asocian a alta incidencia de nefrotoxicidad28. En niños31, se han utilizado dosis algo superiores (0,1-0,2 mg/kg) sin aparente riesgo de nefrotoxicdad. No hay datos en cuanto a la duración del tratamiento ni a la conducta a seguir en caso de obtener remisión total o parcial de la proteinuria, pero, probablemente, las recomendaciones realizadas para el tratamiento con CsA pueden ser válidas también para el tratamiento con tacrolimus.
La utilización de inhibidores de calcineurina debe considerarse contraindicada en enfermos con alteración de la función renal. Parece razonable aconsejar la realización de controles muy frecuentes (mensuales) de función renal en enfermos que presentan reducciones incuso leves de filtrado glomerular (< 80 ml/min) y no aconsejar su uso en los casos en los que los valores de filtrado glomerular son inferiores a 60 ml/min2-5.
Si bien para indicar anticalcineurínicos suele aconsejarse esperar a que el enfermo cumpla criterios de corticorresistencia bien definidos, en los casos en los que el tratamiento con esteroides se asocie a efectos adversos relevantes o sea mal tolerado, es aconsejable acortar el período de exposición a estos fármacos y/o reducir su dosis, asociando anticalcineurínicos de forma precoz. Si tras 6 meses de tratamiento con estos fármacos, asociados o no a bajas dosis de esteroides, no se obtiene respuesta, debe considerarse que el enfermo es también resistente a ellos. En esta situación, que ocurre en un 45-50 % de los enfermos afectos de GFS de adulto, hasta la fecha, no hay ningún tratamiento cuya eficacia haya sido contrastada en ensayos clínicos aleatorios que haya sido capaz de modificar el curso clínico de la enfermedad.
OPCIONES DE TRATAMIENTO PARA ENFERMOS CON RESISTENCIA A ESTEROIDES Y ANTICALCINEURÍNICOS
Micofenolato
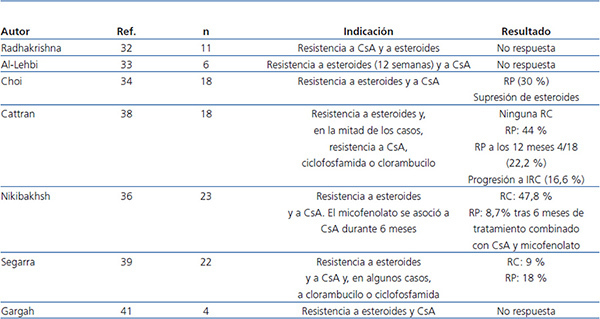
La eficacia de micofenolato (MMF) en enfermos resistentes a corticoesteroides y anticalcineurínicos no ha sido contrastada en estudios de calidad alta. En diversos estudios observacionales, en los que se incluyeron enfermos con distintos criterios de corticorresistencia, tratados con MMF a diversas dosis y durante períodos de tiempo también distintos, se ha descrito una reducción significativa de la proteinuria en un porcentaje de enfermos que oscila entre el 30 y el 50 %, pero muy escaso número de remisiones totales o parciales (tabla 5)32-41. En un ensayo clínico multicéntrico reciente42, se analizó la eficacia de la asociación de MMF y dexametasona (Dx) frente a CsA en enfermos con GFS corticorresistente, sin hallar diferencias entre ambos grupos ni a corto ni a largo plazo. El porcentaje de remisiones obtenidas en ambos brazos fue similar (30 % en el grupo MMF + Dx frente a 45 % en el grupo CsA) e inferior al observado en los ensayos clínicos previos realizados con CsA frente a placebo (60-70 %). El estudio sugiere que MMF podría ser una opción a CsA en caso de corticorresistencia. Sin embargo, adolece de defectos de diseño que dificultan el análisis de los resultados, ya que incluyó enfermos con proteinuria no nefrótica, no se descartaron adecuadamente las formas secundarias y el concepto de corticorresistencia se definió con un criterio distinto al considerado en la mayor parte de las guías. Por estas razones, los resultados obtenidos no pueden ser extrapolados a los enfermos con formas primarias que cursan con síndrome nefrótico que cumple criterios formales de corticorresistencia.
Inhibidores de mTOR
Los estudios realizados con sirolimus en enfermos con GFS corticorresistente son muy escasos. Dos estudios observacionales43,44 han descrito resultados favorables con reducciones significativas de la proteinuria e incluso remisiones totales o parciales del síndrome nefrótico, mientras que un ensayo fase II, diseñado para evaluar la seguridad y la eficacia de sirolimus en enfermos con GFS resistente a otros inmunosupresores, incluyendo esteroides, debió ser finalizado prematuramente ante la evidencia de incremento en la proteinuria y deterioro de la función renal en 5 de los 6 enfermos incluidos45.
Fármacos alquilantes y citotóxicos
Los estudios observacionales en enfermos corticorresistentes describen una probabilidad de respuesta del 25 %, claramente inferior a la observada con anticalcineurínicos26,46,47. Por ello, estos fármacos no se consideran una buena opción terapéutica en caso de corticorresistencia. Su única posible indicación, aunque discutible por no estar avalada por ningún tipo de evidencia, sería el tratamiento de enfermos con síndrome nefrótico en los que se considere que el tratamiento con inhibidores de calcineurina o MMF no es aconsejable por riesgo de toxicidad renal o extrarrenal.
Rituximab
Se han comunicado casos aislados y estudios observacionales que incluyen pocos enfermos48-51 sobre la eficacia del tratamiento con rituximab en enfermos con GFS corticorresistente. Los resultados son discordantes tanto en lo que respecta al efecto sobre la proteinuria como en cuanto al efecto sobre la función renal y los estudios muestran heterogeneidad en la definición de resistencia a tratamientos inmunosupresores previos. Con la evidencia disponible en la actualidad no puede hacerse una recomendación razonable sobre si debe o no indicarse rituximab en enfermos con GFS corticorresistente, pero los escasos datos referentes a enfermos adultos no sugieren una expectativa de éxito alta51,52. Puede resultar aparentemente paradójico que, aunque los resultados son también discordantes, el tratamiento con rituximab, habitualmente asociado a plasmaféresis, se haya asociado a mayor éxito en el tratamiento de la recidiva de la GFS postrasplante53-61 que en la GFS de riñón nativo. Sin embargo, los datos observados en las recidivas postrasplante no pueden ser extrapolables a la GFS primaria de riñón nativo por varias razones. En primer lugar, dado que el porcentaje de enfermos con GFS que presenta recidiva postrasplante es de un 30 % aproximadamente59, es muy probable que la recidiva se asocie a un mecanismo patogénico concreto, que no tiene por qué ser el mismo que el que causa las formas no recidivantes. En segundo lugar, en los enfermos trasplantados, la recidiva se evidencia en un contexto de inmunosupresión intensa y combinada, por lo que los mecanismos responsables de esta parecen poco sensibles a la inmunomodulación. Por último, la recidiva postrasplante suele diagnosticarse por la evidencia de reaparición de proteinuria que en algunos casos puede incluso no llegar a rango nefrótico61. Por ello, es muy posible que el tratamiento en las formas recidivantes se inicie en fases menos avanzadas de lesión podocitaria y, en consecuencia, con mayor probabilidad de respuesta al tratamiento. La utilización de rituximab en el tratamiento de la GFS corticorresistente se basa en la hipótesis de que la lesión podocitaria es causada por un mecanismo patogénico inmunomodulable. Sin embargo, evidencias recientes indican que rituximab podría reducir la proteinuria actuando directamente sobre el podocito62.
Aféresis
El fundamento para la utilización de estas técnicas en el tratamiento de la GFS se basa en la hipótesis de la existencia de un factor circulante capaz de alterar la permeabilidad de la barrera de filtración y de lesionar el podocito de forma irreversible19. Esta hipótesis se ha desarrollado a partir de la evidencia de recidivas tras el trasplante renal53-61 y de la evidencia de transmisión del síndrome nefrótico de madre con GFS al recién nacido63. Los resultados descritos con plasmaféresis e inmunoadsorción en pacientes con GFS corticorresistente de riñón nativo se basan en pequeñas series de casos en las que los criterios de corticorresistencia y las pautas de tratamiento utilizadas difieren significativamente64-68. En algunos estudios, se han descrito resultados favorables en enfermos con múltiple resistencia a fármacos, mientras que en otros no se ha descrito un efecto favorable. Se ha descrito una prueba in vitro para demostrar la presencia del supuesto factor circulante y se ha asociado la respuesta a la inmunoadsorción con la presencia de dicho factor19,69,70, pero estos datos carecen de validación externa. Más recientemente, se ha identificado el receptor soluble de la urokinasa como uno de los posibles mediadores circulantes de la lesión podocitaria y se ha descrito que, en la recidiva de la GFS en el riñón trasplantado, la plasmaféresis reduce los niveles de este y puede inducir remisión71. Estos datos no han sido demostrados en la GFS de riñón nativo. Se han descrito resultados favorables también mediante técnicas de LDL-aféresis selectiva72-74 pero se desconoce la base patogénica que justificaría su efecto beneficioso y la experiencia clínica es muy limitada.
Tratamientos inmunosupresores combinados
En los adultos con resistencia demostrada a esteroides y anticalcineurínicos, no se ha descrito ningún tratamiento que pueda modificar el curso clínico de la enfermedad. En un estudio observacional reciente75, se evaluó la eficacia y seguridad de la asociación de CsA y MMF durante 12 meses en 27 enfermos adultos con GFS y criterios bien definidos de resistencia a esteroides y a CsA. El tratamiento no indujo remisiones del síndrome nefrótico en ningún caso ni tampoco modificó la pendiente de pérdida del filtrado glomerular. En pacientes en edad pediátrica, los resultados parecen más optimistas, ya que se ha descrito que la asociación de CsA y MMF en enfermos con resistencia previa a esteroides y CsA puede inducir remisión en más del 50 % de los casos (total 48 %. Parcial 8,7 %)36.
¿CUÁL ES LA ACTITUD ADECUADA EN CASO DE RESISTENCIA A ESTEROIDES Y A INHIBIDORES DE CALCINEURINA?
El uso de los fármacos y técnicas anteriormente mencionados tiene en común un bajo nivel de evidencia que avala su eficacia, la ausencia de indicadores fiables que permitan predecir el resultado y una probabilidad de respuesta baja, pero no nula. Este último punto es de gran importancia, ya que genera la expectativa de que un enfermo concreto e identificado pueda beneficiarse de ellos. Este escenario, en el que la toma de decisiones no es fácil y las dudas son la norma, enfrenta al profesional a la disyuntiva de decidir entre indicar un tratamiento conservador para controlar las complicaciones relacionadas con el síndrome nefrótico, y así minimizar la exposición a los posibles efectos adversos de los fármacos inmunosupresores, o proseguir con una cadena de inmunosupresión, con resultados inciertos y riesgos potenciales a largo plazo, en la confianza de que alguno de los tratamientos indicados consiga inducir la remisión del proceso. En caso de inclinarse por esta segunda opción, con frecuencia se plantean también dudas acerca de cuándo debe renunciarse a ensayar nuevos fármacos en caso de que no haya respuesta a los previos. Las guías clínicas3,6 habitualmente proporcionan información sobre las evidencias disponibles y dejan abierto al criterio médico la utilización o no de estos fármacos. Ello indica que, en el momento actual, el problema está lejos de ser resuelto. Sin embargo, hay algunas consideraciones que, aunque con importantes limitaciones, podrían ser consideradas en la toma decisiones.
Analizar las posibles causas y el tipo de corticorresistencia
Aunque ciertamente parezca obvio, la revisión detallada de la pauta de tratamiento resulta útil en algunos casos para asegurar que el enfermo cumple criterios formales de resistencia y que esta no se debe, en realidad, a infraexposición a aquel. Una vez valorada esta posibilidad, las razones por las cuales algunos enfermos responden a esteroides y otros no son tan desconocidas como la propia patogenia de la GFS. Es lógico suponer que la ausencia de respuesta a esteroides puede estar directamente relacionada con la patogenia o con un determinado dintel de lesión podocitaria irreversible. Sin embargo, también hay evidencias que indican que podría tener razones farmacodinámicas, relacionadas con el nivel de expresión celular de glicoproteína P76. La glicoproteína P es una proteína transmembrana que actúa como un transportador responsable del eflujo celular de fármacos y tóxicos con peso molecular comprendido entre 300 y 2000 Da, entre los que se encuentran xenobióticos o fármacos tales como alcaloides de la vinca, verapamilo o corticosteroides entre otros77-78. La sobreexpresión de glicoproteína P se considera como uno de los mecanismos que motivan resistencia a quimioterápicos en enfermedades neoplásicas79 y en la resistencia a esteroides en enfermedades autoinmunes, como el lupus eritematoso sistémico o la artritis reumatoide80-82. Recientemente, se ha demostrado que la interleucina (IL) 2 puede inducir un incremento en la expresión de glicoproteína P en los linfocitos83-85. A través de este mecanismo, la activación linfocitaria podría contribuir no solo en la patogenia del síndrome nefrótico, sino también en el desarrollo de resistencia a esteroides, sobre todo en enfermos que se hallan expuestos de forma repetida y durante largos período de tiempo a estos76. Estos datos tienen gran interés potencial en la medida en que podrían ser útiles para predecir la respuesta al tratamiento con esteroides, el riesgo de recidivas posteriores o corticorresistencia y/o aconsejar la introducción precoz de anticalcineurínicos en función de los niveles de expresión y funcionalidad de glicoproteína P en el momento del diagnóstico o de la evolución de estos durante el seguimiento. La respuesta inicial al tratamiento con esteroides puede orientar en alguna medida sobre el tipo de resistencia. En los enfermos que desarrollan corticorresistencia tras una o varias recaídas después de una buena respuesta inicial, probablemente tendría mayor sentido investigar causas farmacodinámicas de resistencia que en los enfermos que nunca han respondido a los esteroides.
Reanálisis del diagnóstico: consideraciones sobre rebiopsia y estudios genéticos
Si ya es importante de por sí intentar asegurar que el enfermo presenta una GFS idiopática antes de iniciar un tratamiento inmunosupresor, cuando este fracasa en inducir la remisión, parece razonable y prudente plantear la necesidad de reanalizar con detalle los datos clínicos e histológicos disponibles para asegurar que se trata de una forma de GFS primaria –en la medida en la que los recursos actualmente disponibles lo permiten– y plantear si debe o no realizarse un estudio para descartar formas genéticas esporádicas, partiendo de la base de que la probabilidad esperable de estas es muy baja si el cuadro se inicia en edad adulta y en ausencia de antecedentes familiares. La diferenciación entre las formas de GFS primarias y secundarias se basa en el perfil clínico y el examen ultraestructural renal mediante microscopía electrónica1,2. Aunque no es criterio incuestionable, como norma se considera que las formas idiopáticas se caracterizan por presentar síndrome nefrótico y borramiento generalizado de los pies podocitarios en la microscopía electrónica. En las formas secundarias a reducción de parénquima renal, hiperfiltración y obesidad puede observarse proteinuria de rango nefrótico, pero es inhabitual la presencia de síndrome nefrótico y el examen de microscopía electrónica permite demostrar que el borramiento de los pies podocitarios tiene una distribución focal y segmentaria más que difusa86. A pesar de que esta diferenciación entre casos extremos parece clara, cuando no se dispone de estudios de microscopía electrónica la diferenciación puede ofrecer dificultades. Por otra parte, las formas secundarias a infecciones víricas, toxicidad farmacológica o mutaciones podocitarias pueden tener un perfil clínico y microscópico indistinguible de las formas idiopáticas y, por ello, solo son identificables si se realiza una investigación activa de estas, bien de forma sistemática, bien en función del contexto clínico en el que se presenta el síndrome nefrótico.
En los enfermos que en la biopsia inicial presentan datos inequívocos de GFS con un patrón bien definido en la microscopía óptica y electrónica, la utilidad de la rebiopsia en caso de resistencia es cuestionable y tal vez solo justificable para valorar la evolución de la fibrosis intersticial. La práctica de una segunda biopsia podría ser útil en los casos que se comportan como resistentes de forma primaria o secundaria, en los que las lesiones observadas en la primera biopsia fueron poco expresivas (sinequias, sospecha de variante celular) y no se dispone de un estudio de microscopía electrónica que permita valorar el estado de los podocitos en los glomérulos cuyo aspecto está preservado en la microscopía óptica. En estos casos, la rebiopsia debería incluir un estudio con microscopía electrónica y permitiría valorar si las lesiones han evolucionado hacia un patrón mejor definido o no.
En lo que respecta al estudio genético, la indicación y las posibles mutaciones a estudiar dependen de la edad de inicio, de la presencia o no de síndromes extrarrenales asociados, de la presencia de antecedentes familiares y, en este último caso, del patrón de herencia observado. Habitualmente, se aconseja realizar un estudio genético en todos los casos congénitos y en los niños con formas corticorresistentes. En los adultos jóvenes con corticorresistencia, la frecuencia de mutaciones descrita es muy baja, no hay un acuerdo en cuanto al tipo de estudio genético a realizar y suele desaconsejarse la investigación sistemática de mutaciones. Recientemente, sin embargo, se han realizado algunas propuestas basadas en datos de estudios epidemiológicos87,88. En un estudio en el que se incluyeron enfermos de diferentes etnias y procedencias geográficas87, se ha descrito que hasta un 10 % de los enfermos de origen europeo, o sudamericano con ascendente hispano, que debutan en la edad adulta/joven –con edad promedio de 19 años– pueden presentar la coincidencia de una mutación heterozigótica patogénica en NPHS2, asociada a la variante p.R229Q de la podocina. Sin embargo, estos datos no han sido confirmados en otros estudios que incluyeron enfermos de otros ámbitos geográficos en los que la coincidencia de p.R229Q con mutaciones en NPHS2 observada fue significativamente inferior (0-2 %)88-90. Otros autores91 han descrito mutaciones en NPHS2 o TRCP6 en el 43 % de los pacientes con formas familiares y en 4 de 41 casos (14 %) (1 NPHS1, 2 NPHS2 y 1 TRCP6), con formas esporádicas de síndrome nefrótico corticorresistente de inicio en edad superior a 18 años. Estas evidencias, aunque muy limitadas, no deberían ignorarse antes de someter a un paciente al efecto prolongado del tratamiento inmunosupresor. Por ello, a falta de más datos, una aproximación razonable para los casos esporádicos de inicio antes de la tercera década, que presentan resistencia demostrada tanto a esteroides como a anticalcineurínicos, podría ser realizar un estudio genético para identificar la presencia de la variante p.R229Q asociada a mutaciones patogénicas en NPHS292. La demostración de la presencia de esta asociación tiene implicaciones prácticas evidentes, ya que es un argumento útil para no proseguir con la inmunosupresión93, permite asesorar a los pacientes en caso de que se planteen tener descendencia y, si se plantea realizar un trasplante renal, es útil para seleccionar posibles donantes familiares.
Análisis adecuado del riesgo. Importancia de las variables pronósticas
Si bien es cierto que la corticorresistencia ha sido identificada como el principal factor de mal pronóstico, ya que implica un mayor riesgo de deterioro progresivo de la función renal9,10, esto no significa que todos los enfermos con corticorresistencia evolucionen de forma inexorable hacia estadios avanzados de enfermedad renal crónica. Un porcentaje variable –aunque minoritario– de los enfermos, tras seguimientos prolongados, mantienen la función renal inalterada a pesar de la persistencia de síndrome nefrótico. Por ello, es aconsejable ponderar el riesgo de incrementar la exposición a fármacos inmunosupresores, en función de la expectativa en cuanto a la evolución clínica. Para ello, hay dos aspectos de gran importancia: 1) analizar con detalle el tipo y extensión de la lesión observada en la biopsia renal y 2) disponer de un seguimiento evolutivo mínimo, para determinar si la ausencia de respuesta implica un riesgo de progresión a insuficiencia renal crónica o se limita al riesgo de aparición de complicaciones relacionadas con el síndrome nefrótico. En este último caso, sería aconsejable también tener en cuenta si el síndrome nefrótico es de manejo fácil o complejo en función de cuál es la dificultad para el control de los edemas y cuáles son las consecuencias de la persistencia de la proteinuria (malnutrición, dislipemia, infecciones, episodios de trombosis, necesidad de tratamiento anticoagulante a largo plazo). En lo que respecta a las lesiones observadas en la biopsia renal, es incuestionable que la presencia de una fibrosis intersticial extensa y de lesiones de esclerosis segmentaria evolucionadas implican un peor pronóstico y reducen la probabilidad de respuesta a inmunosupresores. Los datos en cuanto al valor pronóstico de las diferentes variantes de GFS descritas en la microscopía óptica1,7 indican que las formas colapsantes –cuya adscripción a la categoría de GFS es motivo de controversia– tienen un pronóstico peor que las demás variantes, y que las formas perihiliares se asocian con mayor frecuencia a GFS secundarias/adaptativas. Aunque se ha descrito que la variante tip lesion se asocia a una mayor probabilidad de respuesta a corticoesteroides y mejor pronóstico, las diferencias pronósticas entre tip lesion, formas clásicas (NOS) y formas celulares no han sido adecuadamente validadas y, por ello, la variante histológica se considera, por el momento, de escasa utilidad para la toma de decisiones en cuanto al tratamiento.
PERSPECTIVAS DE FUTURO. ¿HACIA DÓNDE VAMOS?
La evidencia de la escasa respuesta que se obtiene en enfermos resistentes con los tratamientos inmunosupresores actualmente disponibles ha orientado investigaciones en dos líneas paralelas: 1) el estudio de nuevos fármacos capaces de modular aspectos diferentes de la respuesta inflamatoria o el proceso de fibrosis y 2) el estudio de nuevas vías patogénicas y/o biomarcadores que permitan identificar a los pacientes en función de cuál va a ser su respuesta al tratamiento.
Nuevos tratamientos en fase de evaluación
En este aspecto, destacan los estudios realizados con adalimumab –un anticuerpo monoclonal dirigido contra el factor de necrosis tumoral α (TNFα)–, fresolimumab, un anticuerpo monoclonal dirigido frente al factor de crecimiento transformante beta (TGFβ), rosiglitazona, ACTH y galactosa a altas dosis.
Se han publicado resultados preliminares de estudios fase I en los que se analiza la eficacia de adalimumab y rosiglitazona en GFS corticorresistente. Los resultados tras 16 semanas de tratamiento indican que aproximadamente el 50 % de los pacientes tratados con adalimumab y el 71 % de los tratados con rosiglitazona pueden estabilizar la función renal y presentar reducción en la proteinuria. Ambos fármacos están sometidos a evaluación de eficacia y seguridad en estudios fase III94-96. También está en fase de desarrollo un estudio para analizar la potencial eficacia de fresolimumab97 y la de ACTH98. La idea de analizar la eficacia del tratamiento con galactosa a dosis elevadas parte de la evidencia de que uno de los factores solubles recientemente identificados como posible mediador de la lesión podocitaria (carditotrofina like citokina 1) tiene una gran afinidad por la galactosa99. Hasta la fecha se han comunicado resultados positivos del tratamiento con galactosa en recidiva de GFS tras el trasplante renal100,101. No obstante, los resultados descritos son difíciles de atribuir a la galactosa debido a que los enfermos, concomitantemente, recibieron otros tratamientos, incluida la plasmaféresis. También se ha descrito remisión del síndrome nefrótico tras el tratamiento con galactosa en GFS de riñón nativo102.
Biomarcadores predictores de respuesta al tratamiento
En la actualidad, todavía no se ha identificado ningún parámetro clínico, histológico o bioquímico que permita diferenciar a los enfermos en función de su respuesta a esteroides o anticalcineurínicos. A nivel histológico, se ha descrito que el aumento en la expresión podocitaria de CD80103,104 y la reducción en la expresión de alfa-distroglicanos105,106 permitiría diferenciar la nefropatía por cambios mínimos de la GFS y, por ello, en casos con lesiones dudosas en microscopía óptica, podría ser útil en predecir la respuesta, dada la mayor corticosensibilidad de la primera de las dos entidades. Los niveles urinarios de CD8099 y de TGFβ107 han sido también propuestos como candidatos para diferenciar entre ambos procesos, pero no se ha analizado todavía su asociación con la respuesta al tratamiento. Además de la relación entre expresión de ABCB1/glicoproteína P y corticorresistencia76,81, se ha descrito una posible relación entre determinados polimorfismos en los genes que codifican la síntesis de IL-6, IL-4 y TNFα y la respuesta a esteroides en niños con síndrome nefrótico idiopático108. Se han descrito, asimismo, perfiles proteómicos urinarios que serían distintos en función de la respuesta a esteroides, pero estos todavía no se han evaluado en estudios clínicos109-111. Por último, en fecha muy reciente se ha descrito que los niveles circulantes del receptor soluble de la urokinasa (suPAR) se encuentran elevados en enfermos con GSF primaria, pero no en pacientes con otras enfermedades glomerulares71. El análisis de la relación entre niveles de suPAR y las características clínicas de los enfermos, la respuesta al tratamiento o el pronóstico se fundamenta todavía en datos muy escasos que indican que la relación puede ser compleja. En un estudio reciente112, se midieron los niveles de suPAR en dos cohortes de enfermos. La primera cohorte incluyó a los enfermos reclutados en el ensayo clínico realizado en EE. UU. para analizar la eficacia de la asociación de MMF y Dx frente a CsA en enfermos con GFS corticorresistente42. La segunda cohorte incluyó enfermos de edad inferior a 18 años reclutados en el consorcio europeo PodoNet para el estudio del síndrome nefrótico corticorresistente. En ambas cohortes, se apreció que los niveles basales de suPAR fueron significativamente superiores a los de los controles sanos, pero con una distribución heterogénea de valores. En la primera cohorte, se confirmó que un 84,3 % de los enfermos presentó niveles basales de suPAR superiores al punto de corte de 3000 pg/ml –seleccionado por los mismos autores en el estudio previo71 como óptimo para diferenciar a los enfermos con GFS primarias de otras formas de síndrome nefrótico–. Los niveles basales de suPAR tuvieron relación con el filtrado glomerular y fueron superiores en enfermos de raza negra. Tras completar 26 semanas de tratamiento, a pesar de que no hubo diferencias en el número de remisiones entre ambos grupos, los niveles de suPAR aumentaron en los enfermos tratados con CsA y se redujeron en los tratados con MMF, con diferencias significativas entre ambos grupos en el análisis multivariado, tras ajustar por posibles factores de confusión. Los niveles de su PAR fueron independientes de la proteinuria y de la proteína C reactiva tanto antes como después del tratamiento. Los niveles de suPAR basales, el filtrado glomerular y el tratamiento con MMF fueron los únicos predictores independientes de los cambios absolutos en los niveles de suPAR tras el tratamiento, pero ni los niveles basales de suPAR ni su evolución tras el tratamiento fueron predictores del resultado. Por el contrario, los cambios relativos en los niveles de suPAR fueron predictores independientes de la probabilidad de obtener una remisión completa tras el tratamiento, tras ajustar por edad, sexo, etnia, filtrado glomerular y niveles de suPAR basal. En los enfermos que entraron en remisión, el aumento en los niveles de suPAR tras la remisión se asoció a reaparición de la proteinuria a las 52 semanas, mientras que en ninguno de los enfermos en los que suPAR se redujo tras la remisión se apreció recidiva de la proteinuria. Al clasificar a los enfermos en función de los niveles de suPAR tras el tratamiento, se apreció que en los enfermos en los que estos disminuyeron a valores < 3000 pg/ml, la reducción en la excreción urinaria de proteínas fue significativamente superior a la observada en los enfermos que presentaron niveles de suPAR superiores a 3000 pg/ml tanto a corto como a largo plazo (78 meses). En conjunto, estos datos sugieren que, aunque ni los valores basales ni los cambios absolutos en los niveles de suPAR tras el tratamiento se relacionan con la repuesta, los cambios relativos y/o la evidencia de una reducción en los niveles de suPAR a valores inferiores a 3000 pg/ml podrían ser predictores de respuesta. Además, la persistencia de niveles altos o el aumento de niveles tras la remisión podría relacionarse con la aparición de recidivas. Los niveles basales de los enfermos de la cohorte europea Podonet fueron significativamente inferiores a los de la cohorte americana. Sin embargo, ambas cohortes no son comparables por haber, entre ellas, diferencias significativas en edad, distribución étnica y, sobre todo, diferencias muy importantes en el número de enfermos con GFS de causa genética. En la cohorte europea, los niveles de suPAR fueron significativamente más altos en los enfermos con GFS de causa genética, pero también lo fue la proteinuria y la creatinina sérica. Además, la media de proteinuria y de los niveles de albúmina en los enfermos con GFS de causa no genética indica que la mayor parte de los casos no presentaban síndrome nefrótico en el momento en el que fueron estudiados, lo que dificulta poder relacionar niveles de suPAR con actividad.
CONCEPTOS CLAVE
1. Aproximadamente el 40 % de los enfermos con GFS idiopática del adulto presentan resistencia al tratamiento con esteroides y anticalcineurínicos, bien de forma inicial o bien tras una o varias recidivas. La resistencia al tratamiento es el predictor independiente más importante del desarrollo de enfermedad renal crónica progresiva.
2. En los enfermos con resistencia a esteroides y anticalcineurínicos, no existe ningún tratamiento capaz de modificar el curso clínico de la enfermedad, cuya indicación esté avalada por ensayos clínicos de diseño apropiado.
3. La indicación de tratamiento con MMF, sirolimus, rituximab, aféresis o altas dosis de galactosa está avalada por niveles muy bajos de evidencia y debe individualizarse tras un adecuado análisis del riesgo asociado a la persistencia de actividad del síndrome nefrótico.
4. En los enfermos que desarrollan corticorresistencia tras una o varias recaídas después de una buena respuesta inicial, probablemente tendría sentido investigar causas farmacodinámicas de resistencia ligadas a sobrexpresión de glicoproteína P.
5. Aunque la prevalencia esperable es muy baja, en enfermos adultos jóvenes con resistencia a esteroides y a anticalcineurínicos, la identificación de la asociación de la variante p.R229Q de la podocina y una mutación heterozigótica patogénica en NPHS2 puede ser útil para no proseguir con la inmunosupresión, para asesorar a los pacientes en caso de que se planteen tener descendencia y para seleccionar posibles donantes familiares en caso de trasplante renal.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Clasificación etiológica de la glomeruloesclerosis focal y segmentaria
Tabla 2. Clasificación etiológica de la glomeruloesclerosis focal y segmentaria
Tabla 3. Resultados de los principales estudios observacionales en los que se analiza la eficacia del tratamiento con glucocorticoides en enfermos con glomeruloesclerosis focal y segmentaria idiopática
Tabla 4. Resultados de los principales estudios en los que se analiza la eficacia de ciclosporina A en enfermos con glomeruloesclerosis focal y segmentaria idiopática resistente a esteroides
Tabla 5. Resultados de los principales estudios en los que se analiza la eficacia de micofenolato en el tratamiento de la glomeruloesclerosis focal y segmentaria resistente a esteroides y a anticalcineurínicos