Sr. Director:
El pronóstico de la granulomatosis de Wegener (GW) ha mejorado con las terapias actuales, pero aún existe un grupo de pacientes refractarios al tratamiento. Describimos un caso de GW refractaria que con plasmaféresis y rituximab alcanzó la remisión, pero posteriormente el paciente desarrolló un adenocarcinoma de colon.
Los agentes inmunosupresores son fármacos eficaces, pero no están exentos de efectos secundarios graves, como las infecciones y las neoplasias. Nuestro paciente recibió diferentes tratamientos inmunosupresores, entre ellos rituximab, que es considerado un fármaco eficaz, pero su perfil de seguridad a largo plazo se desconoce. Es importante el seguimiento clínico de estos pacientes que reciben múltiples tratamientos inmunosupresores por su alto riesgo de desarrollar enfermedades malignas.
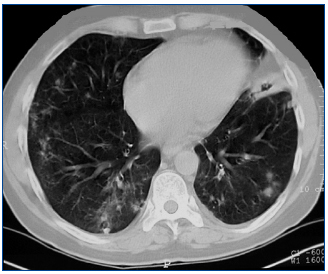
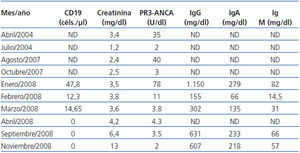
Presentamos el caso de un hombre de 42 años, diagnosticado de GW en el año 2004 mediante biopsia renal. Se inició tratamiento de inducción con bolos de 6-metilprednisolona (500 mg) i.v. durante tres días consecutivos seguida de prednisona oral (1 mg/kg/día) y ciclofosfamida oral a dosis de 100 mg/día (1,5 mg/kg/día). Después de tres meses de tratamiento, el paciente alcanzó la remisión clínica, con negativización de los ANCA-PR3. Durante la fase de mantenimiento, se sustituyó ciclofosfamida por micofenolato mofetil (720 mg/12 h). En 2007, el paciente sufrió una recaída de su enfermedad. Se reinició el tratamiento con ciclofosfamida en bolos intravenosos a dosis de 850 mg (10 mg/kg), junto con prednisona oral (1 mg/kg/día). Las manifestaciones clínicas remitieron y los ANCA-PR3 se negativizaron tras dos meses de tratamiento, pero en enero de 2008 el paciente ingresó por una segunda recaída con hemoptisis e insuficiencia renal. Se administró 1 g de ciclofosfamida intravenosa cada tres semanas junto con prednisona oral (1 mg/kg/día). El paciente continuaba con clínica respiratoria y renal a pesar de haber recibido una dosis acomulada de ciclofosfamida de 16 g y altas dosis de corticoides, por lo que fue diagnosticado de GW refractaria. Se realizó una segunda biopsia renal, que mostró la persistencia de glomerulonefritis necrosante pauci-inmune con reacción extracapilar en el 7% de los glomérulos, fibrosis intersticial-atrofia tubular moderada y glomeruloesclerosis en el 50% del total de glomérulos. Dada la clínica respiratoria de hemoptisis (Figura 1), se iniciaron recambios plasmáticos a días alternos durante 15 días y prednisona oral a dosis de 1 mg/kg/día. Tras finalizar los recambios plasmáticos, se administró rituximab (375 mg/m2 a la semana), durante cuatro semanas. Se monitorizó el tratamiento con rituximab determinando linfocitos B en sangre periférica a través de CD19, niveles de inmunoglobulinas y título de ANCA-PR3 (Tabla 1). Los síntomas respiratorios mejoraron y la función renal se estabilizó (creatinina de 3,6 mg/dl). Todos los marcadores de inflamación disminuyeron, los ANCA-PR3 se negativizaron y no se detectaron linfocitos B en sangre periférica. Como tratamiento de mantenimiento se inició micofenolato mofetil junto con dosis bajas de prednisona. En noviembre de 2008 fue ingresado nuevamente por rectorragia anemizante e insuficiencia renal crónica progresiva sin signos de actividad de vasculitis (ANCA-PR3 negativos); fue diagnosticado de adenocarcinoma de recto y requirió el inicio de la hemodiálisis.
Diez meses después, el paciente permanece en hemodiálisis, sin signos de actividad de vasculitis, ANCA-PR3 negativos y determinación de CD19 en sangre periférica del 0%.
El tratamiento con ciclofosfamida y corticoides ha mejorado el pronóstico de las vasculitis, consiguiendo la remisión entre el 70-90% de los casos1. A pesar de ello, un 10% de los pacientes no consigue alcanzar la remisión o presentan frecuentes recaídas y son considerados pacientes refractarios al tratamiento2. Se han descrito múltiples tratamientos alternativos para los casos de GW refractaria como: infliximab, etanercept, 15-deoxyspergualina, leflunomida, sueros antilinfocitarios y rituximab; por desgracia no hay suficientes estudios que indiquen cuál es la mejor terapia alternativa3.
Rituximab es un anticuerpo monoclonal quimérico contra el antígeno CD20 que se expresa en la superficie del linfocito B; su unión conduce a la eliminación del linfocito B, así como a la inhibición en la síntesis de autoanticuerpos4. Actualmente hay varios estudios sobre su eficacia en algunas enfermedades autoinmunes y se ha descrito también el uso en series de pacientes con vasculitis ANCA positivas refractaria al tratamiento, en los que se han observado tasas de remisión completa del 75%5. En la mayoría de las series de casos de vasculitis refractaria en las que se usó rituximab, se utilizó de forma concomitante con esteroides u otros inmusupresores. Los pacientes consiguieron la remisión clínica en un tiempo medio de dos-seis meses y en la mayoría de los casos la remisión se consiguió junto con una depleción de linfocitos B en sangre periférica y una disminución significativa de los títulos de ANCA. La recuperación de los linfocitos B en sangre periférica suele ocurrir entre los nueve y los 11 meses de media y éste es un factor de riesgo en la aparición de recaídas después de un primer ciclo de rituximab. Se ha descrito que el uso de dosis repetidas de rituximab, tanto de forma preventiva cuando existe una recuperación de los linfocitos B, como en los casos de nuevas recaídas, consigue también tasas elevadas de remisión6. Muchos de los trabajos sobre el tratamiento con rituximab lo consideran un fármaco seguro y eficaz. Los efectos secundarios más comunes son los relacionados con la infusión del fármaco. Entre otros efectos menos comunes se incluyen el desarrollo de neutropenia, infecciones, leucoencefalopatía multifocal progresiva, reactivación de hepatitis, perforación intestinal y neumonitis intersticial, pero hay pocos datos que lo relacionen con el desarrollo de neoplasias7. Es difícil poder obtener conclusiones sobre la seguridad de rituximab en el tratamiento de las vasculitis, ya que los trabajos publicados son de reducido tamaño. Recientemente se ha publicado un estudio que compara rituximab frente a ciclofosfamida en fase de inducción en pacientes con vasculitis ANCA positiva; en él se observaron seis casos de neoplasia de órgano sólido en el grupo de tratamiento con rituximab (dos casos de neoplasia de colon), lo que representó un 5% respecto a un caso en el grupo control8.
Nuestro paciente no tenía antecedentes familiares ni personales de enfermedad maligna, pero desarrolló un adenocarcinoma de colon. Está descrito el riesgo de desarrollar neoplasias en aquellos pacientes que han acumulado dosis altas de ciclofosfamida9. Nuestro paciente recibió dosis elevadas de ciclofosfamida, pero no podemos confirmar que la neoplasia de colon esté únicamente relacionada con este tratamiento. Sugerimos que rituximab pudo haber favorecido la aparición del adenocarcinoma de colon. Creemos que es importante el seguimiento clínico de los pacientes que reciben múltiples tratamientos inmunosupresores por su riesgo de desarrollar enfermedades malignas.
Tabla 1. Evolución de los parámetros bioquímicos en el tiempo
Figura 1. Tomografía computarizada torácica en la que se aprecia una hemorragia pulmonar.