Las patologías reumatológicas, y en primer lugar la artritis reumatoidea (AR), siguen siendo unas de las principales causas de amiloidosis secundaria. La aparición de agentes biológicos como el adalimumab en el tratamiento precoz de la AR puede ser una alternativa eficaz para frenar el desarrollo y la progresión de la amiloidosis secundaria. No todos los pacientes responderán igual al tratamiento; debemos considerar la comorbilidad asociada, los factores de mal pronóstico para predecir la repuesta terapéutica y los posibles efectos adversos. Dentro de los efectos adversos de las terapias biológicas, hay que destacar el aumento de la tasa de infecciones letales y cuadros de insuficiencia cardíaca. Presentamos dos casos clínicos con amiloidosis renal secundaria a AR que han seguido un curso clínico diferente: nuestro primer caso tuvo una buena repuesta al adalimumab, mientras que el segundo caso evolucionó desfavorablemente después del inicio del tratamiento, falleciendo por complicaciones cardiovasculares.
Rheumatological diseases and, firstly, rheumatoid arthritis (RA) remain a major cause of secondary amyloidosis. The emergence of biological agents such as adalimumab in the early treatment of RA can be an effective alternative to stop the development and progression of secondary amyloidosis. Not all patients will respond the same way to treatment; we must consider associated comorbidity, the poor prognosis factors for predicting therapeutic response and possible adverse effects. In the adverse effects of biological therapies, there has been an increase in the rate of lethal infections and congestive heart failure. We present two cases with renal amyloidosis secondary to RA who had a different clinical course: our 1st case had a good response to Adalimumab while the 2nd case evolved unfavourably after treatment, and died from cardiovascular complications.
INTRODUCCIÓN
La amiloidosis secundaria (AA) tiene una incidencia anual de alrededor del 8 % en biopsias renales realizadas a mayores de 65 años según el último Registro de Glomerulonefritis de la S.E.N. La amiloidosis AA se caracteriza por depósitos extracelulares de proteínas fibrilares A derivadas de un precursor plasmático que aumenta ante estímulos inflamatorios. La afectación renal es frecuente y las patologías reumatológicas son sus principales causas; en primer lugar, la artritis reumatoidea (AR)2. Presentamos 2 casos clínicos con amiloidosis renal secundaria a una AR que han presentado un curso clínico diferente.
Primer caso
Paciente mujer de 57 años que tras 8 años de evolución de una AR seropositiva presenta una proteinuria de 5 g/24 h, albúmina plasmática de 3,1 g/dl, creatinina plasmática de 1,3 mg/dl y un estudio inmunológico sin alteraciones significativas. Salvo una hipertensión arterial grado I, la paciente no presentaba más antecedentes personales. Necesitó corticoterapia oral a bajas dosis en contexto de brotes articulares. No constan tratamientos previos con sales de oros ni methrotrexate (MTX), ni toma abusiva de antiinflamatorios no esteroideos. Se realizó una biopsia de grasa subcutánea abdominal identificando depósitos focales, perianexiales en tejido celular subcutáneo y, en paredes vasculares de dermis, depósitos amiloideos AA.
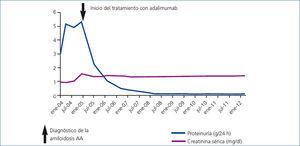
Se estableció el diagnóstico de una amiloidosis AA secundaria a una AR y a continuación se inició tratamiento antiproteinúrico con asociación de inhibidores de la enzima de conversión de angiotensina y antagonistas de los receptores de angiotensina II a dosis plenas tolerables, pero con escaso control de la proteinuria. Se decidió entonces un tratamiento con agentes biológicos: adalimumab (Humira®) para el control de la actividad de su AR. Tras un año de tratamiento remitió progresivamente la proteinuria hasta desaparecer (figura 1).
Segundo caso
Paciente mujer de 78 años diagnosticada de AR de larga data, con actividad articular y antecedentes de enfermedad renal crónica estadio 3B de etiología multifactorial en contexto de una miocardiopatía dilatada con función sistólica conservada, prótesis mitral y aórtica, insuficiencia tricuspídea moderada y fibrilación auricular permanente. Presentaba una proteinuria de 4 g/24 h, microhematuria persistente, albúmina plasmática de 1,7 g/dl y un estudio inmunológico negativo. Seguía tratamiento con MTX 10 mg/día, prednisona 5 mg/24 h. Se añadió enalapril a dosis bajas que se retiró tras mala tolerancia hemodinámica y deterioro renal funcional. Ante la presencia de síndrome nefrótico, se solicitó una biopsia de grasa subcutánea que reveló la presencia de depósitos sugestivos de amiloidosis AA.
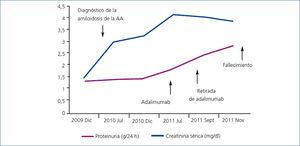
Se inició tratamiento con adalimumab (Humira®) asociado a bajas dosis de MTX (7,5 mg/semanales) y prednisona 5 mg/día. Durante su seguimiento, la paciente presentó cifras tensionales bajas y un deterioro renal progresivo, varios episodios de sobrecarga de volumen y descompensación de su cardiopatía basal (figura 2). En noviembre de 2011 sufre una parada cardiorrespiratoria y es recuperada tras maniobras de reanimación cardiopulmonar avanzada. La evolución en la Unidad de Cuidados Intensivos fue muy desfavorable; presentó un shock cardiogénico refractario a drogas vasoactivas. Se objetivó una disfunción diastólica severa y un fracaso multiorgánico en situación terminal e irreversible, siendo inevitable el fallecimiento.
DISCUSIÓN
La amiloidosis renal puede presentarse en forma de microhematuria y proteinuria en rango nefrótico, con una insuficiencia renal crónica2-4 o rápidamente progresiva, siendo menos frecuentes los cuadros de fracaso renal agudo y afectaciones tubulointersticiales aisladas5. Los depósitos de amiloide se localizan en el glomérulo; en otras ocasiones predominan en vasos o túbulos cursando con disfunción tubular. El pronóstico de la AA empeora con la afectación renal y/o cardíaca. Los principales factores pronósticos son los valores de albúmina, creatinina, niveles séricos de amiloide sérico A y proteinuria de 24 h; cuanto mayores sean esos valores, mayor es la mortalidad debida principalmente a causas infecciosas, cardiovasculares, hemorragias y perforaciones intestinales6.
El tratamiento de la amiloidosis AA está dirigido a atenuar el estímulo inflamatorio a través de un adecuado control del curso evolutivo de la enfermedad responsable. La primera fase de tratamiento tiene por objetivo evitar el depósito de proteínas fibrilares y reducir la síntesis de su precursor, la proteína sérica amiloide (SAA). La monitorización de los niveles de SAA es un parámetro útil para el seguimiento de los pacientes; niveles elevados (superiores a 10 mg/l) se asocian a mayor mortalidad y peor función renal2,7.
Antagonistas del factor de necrosis tumoral alfa
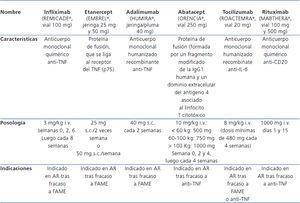
En los últimos años, se ha generalizado el uso de agentes biológicos (antifactor de necrosis tumoral [anti-TNF]) en el tratamiento precoz de la AR moderada o severa, en monoterapia o combinados con el MTX (tabla 1). El primer anti-TNF comercializado fue el infliximab (Remicade®), seguido del etanercept (Enbrel®) y el adalimumab (Humira®). Poseen propiedades antiinflamatorias, capaces de atenuar la actividad inflamatoria de la AR mejorando la sintomatología y disminuyendo la progresión de lesiones radiológicas. Su eficacia se incrementa si se asocian a MTX, no se ha demostrado la superioridad de uno sobre otro y la ausencia de repuesta a uno de ellos no implica la falta de repuesta a otros8-10.
En estudios se ha demostrado, tras iniciar el tratamiento con anti-TNF, una notable reducción del depósito amiloide en biopsias gastroduodenales de control11. El uso de los anti-TNF a nivel renal contribuye a disminuir la inflamación glomerular y reducir la proteinuria disminuyendo las síntesis de mediadores inflamatorios responsables de los cambios de permeabilidad glomerular a la albúmina7. En consecuencia, su uso temprano en la amiloidosis renal puede favorece un mejor control de la proteinuria9, pero se desconoce su eficacia en fases avanzadas de amiloidosis renal y/o cardíacas.
Adalimumab
El adalimumab es un anticuerpo monoclonal humanizado de clase IgG 1 dirigido específicamente contra el TNF-α; su principal mecanismo de acción radica en el bloqueo del TNF- α soluble y de membrana, induciendo una apoptosis de los linfocitos T y monocitos activados. Además, inhibe la producción de citoquinas proinflamatorias, como las interleuquinas (IL) IL-1 e IL-68. El adalimumab ofrece una mayor comodidad para su posología, una vez cada 2 semanas (tabla 1), evitando recurrir a la vía intravenosa (infliximab) o un mayor número de dosis por semana (etanercept). Por otra parte, a diferencia del infliximab, el adalimumab puede administrase en monoterapia sin MTX.
En referencia a nuestras pacientes, los dos casos tuvieron una evolución bien distinta. La primera paciente tenía menor afectación renal, lo que implicó un mejor pronóstico, y presentó una mejor repuesta a agentes biológicos. Nuestra segunda paciente tenía peor función renal, mayor comorbilidad y seguía tratamiento con MTX para el control de su enfermedad. Decidimos entonces un cambio terapéutico a adalimumab; redujimos las dosis de MTX evitando una mayor nefrotoxicidad y valorando la posibilidad de su retirada definitiva según la evolución. La paciente tenía inicialmente una función sistólica conservada, pero más adelante presentó una disfunción diastólica severa reflejada por una posible afectación cardíaca secundaria al depósito amiloideo, aunque el adalimumab podría haber influido negativamente sobre su cardiopatía12. El tratamiento con adalimumab debe interrumpirse si el paciente desarrolla una descompensación de su cardiopatía basal o una insuficiencia cardíaca (IC) congestiva, siendo contraindicado su uso en pacientes con IC moderada a grave. Es recomendable, antes de indicar un tratamiento, individualizar cada caso valorando la comorbilidad asociada, el riesgo de infecciones oportunistas y los factores de pronóstico esencialmente renales y cardíacos13-15. A todos los pacientes que reciban tratamiento con anti-TNF deben haber cumplido la vacunación de la hepatitis B y recibir la vacuna antineumocócica e influenza, se les realizará anualmente la prueba de la tuberculina15.
Alternativas terapéuticas en la amiloidosis secundaria a artritis reumatoidea
Tocilizumab
El tocilizumab es un anticuerpo monoclonal recombinante dirigido contra la IL-6; esta última ejerce un papel relevante en la producción de SAA. Se han descrito casos donde el tocilizumab, en combinación con MTX, ha sido muy eficaz en el tratamiento de la amiloidosis secundaria a AR, capaz de reducir los niveles circulantes de SAA16 y los depósitos amiloides en las biopsias gastrointestinales incluso hasta su desaparición17.
Rituximab
El rituximab (RTX) es un anticuerpo monoclonal quimérico anti-CD20. Se ha descrito un potencial efecto terapéutico del RTX en el tratamiento de la AA secundaria a una AR18. El tratamiento consta de 2 infusiones de 1000 mg de RTX en asociación con MTX.
Inhibidores de la calcineurina (tacrolimus) y azatioprina
El tacrolimus pose un efecto atenuante sobre la repuesta inflamatoria de la AR, disminuyendo la síntesis de citoquinas inflamatorias, en particular el TNF-α, la IL-2 e interferón γ. En un estudio prospectivo con pacientes que tuvieron una escasa repuesta a otros agentes biológicos, se asoció tacrolimus a bajas dosis (2 mg/día) con anti-TNF. A partir de las 4 semanas, se objetivó un descenso notable de la actividad inflamatoria, alcanzando su máxima eficacia a las 54 semanas19.
Por otra parte, se ha reportado un caso de amiloidosis secundaria a AR donde el uso de azatioprina ha permitido con éxito controlar la enfermedad y la remisión del síndrome nefrótico20.
Eprosidato
Por último, mencionaremos el eprodisato, un inhibidor de la polimerización de las fibrillas amiloides y de su depósito en los tejidos. Se ha ensayado en el tratamiento de la amiloidosis AA con afectación renal y, tras un seguimiento de 24 meses, ha mostrado enlentecer el deterioro de la función renal21. En la actualidad estamos a la espera de los resultados de un segundo ensayo clínico que finaliza en mayo de 2014.
CONCLUSIONES
La amilidosis AA secundaria a AR puede responder al tratamiento con agentes biológicos, como adalumimab; su uso permite un mejor control de la proteinuria, pero desconocemos su eficacia en fases avanzadas de amiloidosis renal y/o cardíaca. No todos los pacientes responderán igual a los agentes biológicos. Debemos establecer una selección previa de los pacientes, considerando la comorbilidad asociada, los factores de mal pronóstico para predecir la repuesta a los agentes biológicos y los posibles efectos adversos.
Recordemos que el tratamiento más eficaz de la amiloidosis AA es aquel capaz de frenar precozmente el curso evolutivo de la enfermedad responsable, atenuando el estímulo inflamatorio subyacente.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Fármacos de uso habitual en la artritis reumatoidea activa moderada a severa.
Figura 1. Paciente 1: evolución de la proteinuria y de la creatinina sérica
Figura 2. Paciente 2: evolución de la proteinuria y de la creatinina sérica