EVOLUCIÓN A CORTO, MEDIO Y LARGO PLAZO DEL DONANTE VIVO DE RIÑÓN
Textor et al.1 describen el incremento progresivo en los que llaman donantes de vivo con criterios expandidos. Se están utilizando cada vez más donantes de edad avanzada (>60 años), con antecedentes de un cierto grado de hipertensión arterial «controlada», con dislipemia, alteración inicial del metabolismo hidrocarbonatado, obesidad importante (IMC >32 kg/m2), antecedentes de litiasis renal y de tumor renal e incluso con un filtrado glomerular reducido (<80 ml/min). La reflexión de los autores se centra en que los buenos resultados del donante vivo y las muy escasas complicaciones a largo plazo en el donante y en el receptor han sido determinadas por el uso de donantes óptimos. Los resultados que se obtendrán a medio y largo plazo con los donantes con criterios expandidos están por determinar. Recomiendan la firma de un consentimiento informado por parte del donante, seguimiento a lo largo del tiempo y adopción de correctas medidas higiénico-dietéticas y de estilo de vida.
En la misma línea, Young et al.2 realizaron un completo metaanálisis de las distintas publicaciones que estudian la evolución de los donantes con criterios expandidos. Llegan a la conclusión de que los estudios son retrospectivos carecen de grupo control y el tiempo de seguimiento suele ser de solamente 1 año. Por dicho motivo, la única conclusión a la que pueden llegar dichos estudios es que la evolución a corto plazo de los donantes con criterios expandidos es similar a la de los donantes estándar.
Respecto a las complicaciones a corto plazo de los donantes de vivo, Wainright et al.3 describen la evolución de 13.000 donantes de vivo que realizaron la donación entre 2005 y 2006. El porcentaje de efectos adversos graves fue del 3,9%, las reintervenciones quirúrgicas del 0,5%, las transfusiones sanguíneas del 0,5%, las complicaciones vasculares del 0,3% y la mortalidad del 0%. Concluyen que la evolución perioperatoria de los donantes vivos de riñón es muy segura y altamente satisfactoria, permitiendo contemplar esta opción de tratamiento como altamente recomendable.
Ibrahim et al.4 realizaron un extenso seguimiento de la evolución de los donantes a medio y largo plazo. En primer lugar, estudiaron una serie de 242 donantes con una media de edad de 53 ± 9,6 años y un tiempo medio de seguimiento tras la donación de 11,9 ± 8,8 años. Para obtener la función renal, determinaron el filtrado glomerular con iohexol, hallando un filtrado glomerular en un 82,6% de donantes >60 ml/min/1,73 m2 y en un 17,4% entre 30-60 ml/min/1,73 m2. La hemoglobina fue de 13,7 ± 1,23 g% y la presión arterial sistólica y diastólica de 121,7 ± 14,7 mmHg y 73,2 ± 9,1 mmHg, respectivamente. La microalbuminuria (ratio albúminacreatinina 30-300 mg/g) se halló en un 7,4% y la macroalbuminuria (ratio albúmina-creatinina >300 mg/g) en un 0,9%. Un 91,7% de los pacientes permanecieron con valores de albúmina normales. Dichos resultados avalan que los donantes de riñón no tenían, a 12 años de la donación, una mala evolución en cuanto a función renal, desarrollo de hipertensión arterial y/o macroalbuminuria. Posteriormente, determinaron en el estudio multivariante los predictores de mal filtrado glomerular (<60 ml/min) y de microalbuminuria y macroalbuminuria. En el primer caso fueron la edad del donante, el sexo femenino del donante y el índice de masa corporal del donante. En el segundo, el tiempo transcurrido desde la donación y el nivel de presión arterial sistólica.
Para completar el seguimiento evolutivo, estudiaron a 1.431 pacientes con un tiempo mínimo transcurrido desde la donación de 20 años. Los resultados en cuanto a función renal y presión arterial se muestran en la tabla 1. Este estudio es uno de los más importantes realizados hasta el presente en cuanto a evolución a largo plazo de los donantes de riñón. Los resultados obtenidos son altamente alentadores.
Ibrahim et al.4 también estudiaron si existe una buena correlación entre el aclaramiento de creatinina calculado con iohexol (242 pacientes) y el obtenido mediante fórmula con MDRD y Cockroft-Gault. Los resultados se muestran en la tabla 2, y demuestran que el MDRD infravalora y el Cockroft-Gault sobrevalora el filtrado glomerular cuando se comparan con el obtenido mediante iohexol (tabla 2).
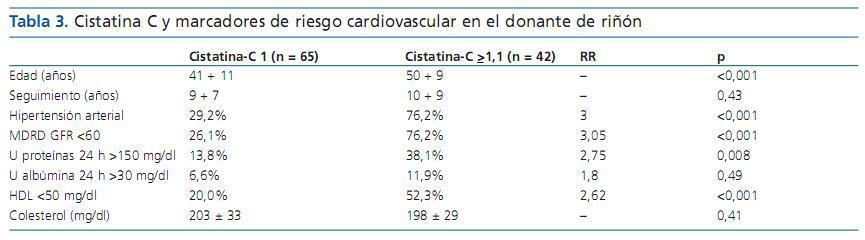
Frederick et al.5 analizaron el papel de la cistatina C como marcador de riesgo cardiovascular en el donante de riñón. La cistatina C es un marcador de función renal bastante independiente de la edad, el sexo y la masa muscular, y ha demostrado ser un excelente predictor de mortalidad y de riesgo cardiovascular. La pregunta que se formulan los autores es si los niveles de cistatina C pueden prever los riesgos de desarrollo de insuficiencia renal, proteinuria, dislipemias y riesgo cardiovascular en los donantes de riñón. Para ello esudiaron a 107 donantes de riñón (entre los años 1975 y 2004) con un seguimiento medio de 10 ± 7 años y los dividieronn en dos grupos en función de los niveles plasmáticos de cistatina C (<1 y >1). Los donantes que tienen los niveles >1 tendrán mayor media de edad, mayor tiempo transcurrido desde la donación, peor función renal, mayor grado de hipertensión arterial, y niveles más altos de proteinuria y colesterol plasmático (tabla 3). La conclusión es que la cistatina C también debería determinarse en donantes de riñón por ser un importante marcador de riesgo cardiovascular.
Otro punto importante de la evolución de los donantes y, generalmente, el menos tenido en cuenta, es el seguimiento de las consecuencias psicológicas que la donación ha podido tener en el donante. Schroder et al.6 preguntaron a 69 centros de trasplante renal acerca del seguimiento psicosocial de sus donantes. Constataron que un 83,1% de los centros aceptaban donantes de riñón sin seguro social. Como es sabido, las posibilidades de realizar el seguimiento de los pacientes sin seguro social donantes son escasas. Sin embargo, son aceptados por la mayoría de centros de trasplante. Cuando dichos centros son preguntados sobre si ofrecen seguimiento psicosocial a sus donantes siguiendo las recomendaciones del Foro de Ámsterdam7, sólo un 38,5% disponen de dicho servicio, generalmente realizado por asistentes sociales o personal de enfermería, y dicho contacto es exclusivamente telefónico en un 83,3% de los casos. En la misma línea social, Gibney et al.8 presentaron un interesante estudio en el que demostraron que los donantes de menor edad y las minorías étnicas acceden a la donación sin seguro médico en un elevado número de casos, siendo el seguimiento a 6 meses claramente inferior al de los pacientes con seguro médico. Mandelbrot et al.9 realizaron una encuesta de 11 preguntas acerca del seguimiento de los donantes en numerosos centros de trasplante de Estados Unidos de los que únicamente contestaron un 40%. En él se constató que a los 10 años de la donación, únicamente un 3% de los donantes seguían siendo controlados por su centro de referencia.
ESTUDIO DEL DONANTE VIVO DE RIÑÓN
Es bien sabido que para la determinación de la función renal del donante, las ecuaciones basadas en la creatinina son subóptimas, siendo el filtrado glomerular con iohexol una técnica más elaborada y que no todos los centros quieren o pueden realizar con cierta facilidad. Por otro lado, la tomografía axial computarizada (TAC) se utiliza cada vez más frecuentemente para ver el árbol vascular renal del donante ya que la reconstrucción tridimensional permite calcular el volumen renal. Por dicho motivo, Poggio et al.10 efectuaron un interesante estudio a 244 donantes de riñón a los que se les realizó un filtrado glomerular con 125 I iothalamato y la medición del volumen renal mediante TAC 3D aprovechando el estudio de su árbol vascular. Una vez obtenido el filtrado glomerular con 125 I iothalamato, se observó que tenía una correlación positiva con el volumen renal obtenido mediante TAC, con la edad del donante, la creatinina plasmática y el peso del donante. Todo ello les permitió crear una ecuación para determinar el filtrado glomerular utilizando estos parámetros que demostró tener una muy buena correlación con filtrado glomerular con 125 I iothalamato y ser mucho más predictiva del filtrado real que el MDRD.
KV-eGFR (ml/min/1,73 m2) = 70,77 ¿ (0,444 x edad) + (0,366 x peso) + (0,2 x volumen) ¿ (37,317 x creat. Pl.)
Sener et al.11 explicaron su experiencia con el hallazgo de tumores durante el estudio del donante vivo de riñón. Describen el uso de cinco injertos (entre los años 1996 y 2005) obtenidos de donantes a los que se les detectó un nódulo renal de pequeño tamaño (<2,3 cm). Las condiciones para la utilización de dichos riñones fueron que el receptor necesitara urgentemente el trasplante renal, que el nódulo fuera de pequeño tamaño y que existiera el consentimiento informado por escrito del receptor. La técnica empleada para la extracción fue la nefrectomía laparoscópica. Posteriormente se realizó una nefrectomía parcial en la cirugía de banco. La anatomía patológica perioperatoria debía confirmar márgenes libres de tumor. A continuación se realizaron los implantes. En este estudio fueron tres carcinomas y dos angiomiolipomas. Tras varios años de seguimiento (en algún caso 12 años), existe un funcionamiento perfecto de los cinco trasplantes. No existió ningún caso de necrosis tubular aguda, ni se produjeron fístulas ni sangrados como consecuencia de la tumorectomía. Hasta el presente, la recurrencia del tumor es del 0%.
TRATAMIENTO INMUNOSUPRESOR
Vo et al.12 han publicado su experiencia en una nueva pauta de desensibilización de pacientes altamente hipersensibilizados. A diferencia de las que usan plasmaféresis o inmunoadsorción combinadas con otras técnicas de reducción de anticuerpos, los autores proponen únicamente el uso de rituximab combinado con dosis altas de inmunoglobulinas (Ig) policlonales. Para ello describen su experiencia con 20 potenciales receptores altamente hipersensibilizados (entre los años 2005 y 2007) (anti-HLA 77 ± 19%). La media de permanencia en diálisis era muy alta (144 ± 89 meses). El tratamiento que proponen se basaba en la infusión de inmunoglobulinas iv. (2 g/kg día 0 y día 30) y rituximab (1 g día 7 y día 22). Los autores pudieron comprobar que después de la segunda infusión de Ig, los anti-HLA se reducen a un 44% de su valor inicial. Ello permitió obtener un cross-match negativo con el donante en un 80% de los casos. El 60% de éstos recibió un trasplante de donante vivo. La inmunosupresión de inducción se realizó con alemtuzumab 30 mg + tacrolimus + micofenolato de mofetilo + corticoesteroides. Los resultados a 1 año fueron altamente satisfactorios: creatinina plasmática 1,5 mg%, supervivencia del paciente 100%, supervivencia del injerto 94% y todo ello sin incremento en la frecuencia de infecciones.
TRASPLANTE CRUZADO
Los tres principales programas de trasplante cruzado que existen actualmente (Países Bajos, Corea del Sur y Estados Unidos) han comunicado los resultados que obtienen con distintas maneras de hacer dichos intercambios. Klerk et al.13 expusieron los resultados del programa holandés y describen que los programas de intercambio aumentan considerablemente la posibilidad de que los pacientes que tienen un donante vivo con incompatibilidad ABO o con prueba cruzada positiva sean trasplantados. Para ello exponen la evolución de 242 parejas donante-receptor (entre los años 2004 y 2007) con incompatibilidad ABO (125) o cross-match positivo (117). En aquellas parejas que tenían cross-match positivo, el porcentaje medio de anticuerpos anti-HLA era del 46% (2-100). Dichas parejas eran adscritas a una base de datos centralizada que intentaba visualizar posibles intercambios cada 3 meses. El número medio de parejas en cada puesta en marcha fue de 46 (16-66). Los criterios de asignación fueron: grupo sanguíneo (primero igual, segundo compatible), compatibilidad HLA (prioridad para hipersensibilizados) y tiempo en diálisis. El cross-match se realizaba en un laboratorio central. De las parejas con cross-match positivo, se encontró pareja compatible en un 71% de casos (83/117), mientras que en las de ABO incompatible fue del 24 % (21/87) cuando el receptor era del grupo O y del 76% (29/38) cuando el receptor era distinto del grupo O. Las supervivencias de injerto y paciente fueron iguales que las del programa estándar de donante vivo.
Lee et al.14 presentaron el programa coreano de trasplante renal de vivo, tipo dominó, utilizando donantes altruistas al principio de cada cadena de intercambios. El uso de donantes altruistas aumentó considerablemente las posibilidades de poder realizar cadenas de diferentes tamaños. La supervivencia del injerto a 1 y 5 años fue del 98,6 y del 87,5%, respectivamente, y la del paciente a 1 y 5 años, del 98,5 y del 93,4%.
Finalmente, Hanto et al.15 expusieron el programa estadounidense de trasplante cruzado. A diferencia de los dos anteriores, contempla el uso de intercambios con la lista de espera de donante cadáver sin menoscabo de los intercambios a varias bandas ni del uso de donantes altruistas. Los resultados son extrapolables a los obtenidos por los grupos anteriores y la utilización de los diferentes sistemas de trasplante cruzado han convertido al programa estadounidense en el principal programa mundial de trasplante renal de donante vivo.
Tabla 1. Evolución a largo plazo de la función renal y necesidad de medicación antihipertensiva
Tabla 2. Diferencia porcentual entre el filtrado glomerular calculado con iohexol, MDRD y Cockroft-Gault
Tabla 3. Cistatina C y marcadores de riesgo cardiovascular en el donante de riñón