Introducción: En los últimos años se ha mantenido estable el número de pacientes en lista de espera para un trasplante renal. El trasplante renal de donante vivo representa actualmente una vía para aumentar el pool de donantes, pero hay un grupo de pacientes que presentan incompatibilidad de grupo sanguíneo ABO, lo que contraindicaba hasta ahora que pudiera llevarse a cabo el trasplante. Nuestro objetivo consiste en describir nuestra experiencia con el programa de trasplante renal de donante vivo con incompatibilidad de grupo ABO. Material y métodos: Se trata de un estudio de retrospectivo-descriptivo de los primeros 11 pacientes sometidos a trasplante renal de donante vivo ABO incompatible en el Hospital Clínic de Barcelona desde octubre de 2006 a enero de 2009. Se utilizó un protocolo de acondicionamiento basado en inmunoadsorción específica (con número sesiones necesarias hasta conseguir títulos de isoaglutininas aceptables pretrasplante), inmunoglobulina policlonal inespecífica y anticuerpo monoclonal anti-CD20, seguido del tratamiento inmunosupresor adaptado a cada receptor. Se determinaron títulos de isoaglutininas antes del tratamiento de acondicionamiento, pretrasplante y postrasplante durante las primeras 2 semanas. La valoración inmunológica, médica y quirúrgica fue la habitual en el programa de trasplante renal de donante vivo. Resultados: La edad media de los donantes y receptores fue de 47,8 ± 12,4 y 44,4 ± 14,1 años, respectivamente. Un 90,1% de los donantes fue mujer y un 72,7% de los receptores, hombres. El tiempo de seguimiento medio fue de 10,2 ± 10,2 meses. Hermanos y esposos fueron las relaciones más frecuentes (n = 4, 36,4%, respectivamente), al igual que la causa de nefropatía fueron la glomerulopatía, poliquistosis y el síndrome de Alport (n = 2, 18,2% para cada enfermedad renal primaria). Todos los pacientes adquirieron un título de isoaglutininas correctos pretrasplante (<8) y requirieron 5,54 ± 2,6 sesiones de inmunoadsorción pretrasplante y 2,82 sesiones postrasplante. Un paciente no requirió ninguna sesión de inmunoadsorción (única con incompatibilidad anti-B) y otro requirió recambios plasmáticos, en vez de inmunoadsorciones, por tratarse de un potencial receptor hipersensibilizado con crossmatch por citometría de flujo positivo. Los títulos de isoaglutininas postrasplante se mantuvieron a títulos bajos. Dos pacientes presentaron un episodio de rechazo agudo celular (Banff IA e IB), con buena respuesta al tratamiento. La supervivencia de paciente y del injerto fue de un 90,9% en el primer año y se mantuvo estable a lo largo del seguimiento. Únicamente se registró una pérdida del injerto por fallecimiento en relación con una complicación hemorrágica en las primeras 72 horas sin relación con la incompatibilidad de grupo ABO. La función de injerto renal al año es excelente, con valores de creatinina sérica de 1,3 ± 0,8 mg/dl, con aclaramiento de creatinina ajustado a superficie corporal 62,6 ml/min/1,73 m2 y proteinuria de 244,9 mg/orina de 24 horas. Conclusiones: El trasplante renal de donante vivo con incompatibilidad de grupo sanguíneo representa una alternativa eficaz y segura en determinados pacientes en lista de espera de trasplante renal, obteniendo resultados excelentes de supervivencia de paciente e injerto y con una buena función de injerto renal.
Introduction: During the last years the number of patients on waiting list for kidney transplantation has been stable. Living donor kidney transplantation is nowadays a chance to increase the pool of donors. However, there are a group of patients with ABO incompatibility, making impossible the transplant until now. The aim of the present study is to describe the experience of Hospital Clinic Barcelona on ABO incompatible living transplantation. Material and methods: A retrospective-descriptive study was made based on 11 living donor kidney recipients with ABO incompatibility in Hospital Clinic of Barcelona from October’06 to January’09. Selective blood group, antibody removal with specific immunoadsortion, immunoglobulin and anti-CD20 antibody were made until the immunoglobulin (IgG) and isoaglutinine (IgM) antibody titters were 1/8 or lower. Immunosuppressive protocol was adjusted to particular recipient characteristics. Isoaglutinine titters were set before, during and post desensitization treatment and two weeks after transplant. Immunological, medical and surgical evaluation was the standard in living donor kidney transplant program. Results: Medium age of donors and recipients were 47.8 ±12.4 and 44.4 ± 14.1 years, respectively. 90% of donors were females and 73% of recipients males. Follow-up time was 10.2 ±10.2 months. Siblings and spouses were the most frequent relation (n = 4, 36.4%, respectively). Chronic glomerulonephritis, adult polycystic kidney disease and Alport syndrome, the most frequent cause of end-stage renal disease. All the patients acquire appropriate isoaglutinine titters pre transplant (<1/8), requiring 5.54 ± 2.6 immunoadsorption sessions pretransplant and 2.82 postransplant. One patient didn´t need any immunoadsorption session (incompatibility blood group B) and another patient plasma exchange instead of immunoadsorption for being hipersensitized with positive flow cytometry crossmath. Postransplant isoaglutinine titters remained low. Two patients had cellular acute rejection episode (type IA and IB of Banff classification) with good response to corticosteroid treatment. Patient and graft survival were 91% at first year and remain stable during the follow-up. A graft lost by death of patient in relation to haemorrhagic shock developed within the first 72 hours after transplantation. Renal graft function at first year was excellent with serum creatinina of 1.3 ± 0.8 mg/dl, creatinine clearance of 62.6 ml/min/1.73 m2 and proteinuria of 244.9 mg/U 24 h. Conclusion: ABO incompatible living donor kidney transplantation represent an effective and safe alternative in certain patients on waiting list for renal transplant, obtaining excellent results in patient and graft survival, with good renal graft function.
INTRODUCCIÓN
El trasplante renal se considera la mejor alternativa terapéutica para los pacientes con insuficiencia renal crónica terminal, pues ofrece mejores tasas de supervivencia y mejora en la calidad de vida1,2. En los últimos años se ha evidenciado un estancamiento en el número de pacientes en lista de espera para trasplante, a pesar de destinar esfuerzos para desarrollar procedimientos que permitan acceder al trasplante al mayor número de pacientes. Pero el problema actual de las listas de espera es que muchos de ellos por sus características de edad, inmunológicas, complejidad quirúrgica o manejo cardiovascular, el trasplante renal de donante vivo puede ser la única opción posible de trasplante3.
Con el incremento de los programas de trasplante renal de donante vivo, es frecuente que el donante a pesar de presentar un alto grado de compatibilidad HLA sea ABO incompatible. Por tanto, en estas condiciones, una buena alternativa es la realización de un trasplante renal de donante vivo con incompatibilidad de grupo ABO4-6.
En 1974, Gelin y Sandberg7 demostraron por primera vez que era posible el trasplante renal con incompatibilidad ABO. Realizaron 21 trasplantes renales de donante cadáver con grupo sanguíneo A2 a receptores del grupo O. No se produjo ningún rechazo hiperagudo y la supervivencia media de los injertos renales fue similar a la obtenida en los trasplantes renales ABO compatible realizados en aquel momento8,9. Desde entonces numerosos grupos han destinado esfuerzos para desarrollar tratamientos que permitan la eliminación de los anticuerpos anti-A/B de manera que sea posible realizar con seguridad inmunológica trasplantes renales con incompatibilidad ABO10-13.
Los protocolos actuales de trasplante renal ABO incompatible se basan en la combinación de diferentes procedimientos terapéuticos. Existen en la literatura diferentes protocolos, que han ido variando a lo largo de la historia de este tipo de trasplantes. Tradicionalmente se han empleado recambios plasmáticos11,12 para reducir la tasa de isoaglutinina circulante. Más recientemente, en Europa se ha introducido una técnica de inmunoadsorción específica de los anticuerpos anti-A/B (IADS) mediante columnas de adsorción (Glycosorb)14-18. En casi todos los grupos es común la administración de inmunoglobulinas policlonales (IGIV), y lo que ha cambiado es haber abandonado la esplenectomía19,20 por el uso de anticuerpos monoclonales anti-CD20 (Rituximab, RTX)15,16, aunque grupos como el japonés de Tanabe19,20 todavía sigue practicándola, aunque en menor medida, debido a que el uso del RTX no está cubierto por el sistema nacional de salud japonés. La terapia inmunosupresora utilizada no difiere de la empleada en cualquier trasplante renal ABO compatible16,20.
El objetivo del presente trabajo es presentar los primeros resultados obtenidos de nuestro programa de trasplante renal ABO incompatible, así como reflejar cómo ha ido variando el protocolo de actuación con la experiencia acumulada.
MATERIAL Y MÉTODO
Población de estudio
Desde octubre de 2006 a enero de 2009 se han realizado un total de 11 trasplantes renales de donante vivo con incompatibilidad de grupo sanguíneo ABO en el Hospital Clínic de Barcelona de un total de 84 trasplantes renales de donante vivo practicados en ese período. Todos los pacientes siguieron el protocolo de acondicionamiento y desensibilización aprobado por el Comité de Ética Asistencial del Hospital Clínic y firmaron el consentimiento informado.
Protocolo de acondicionamiento
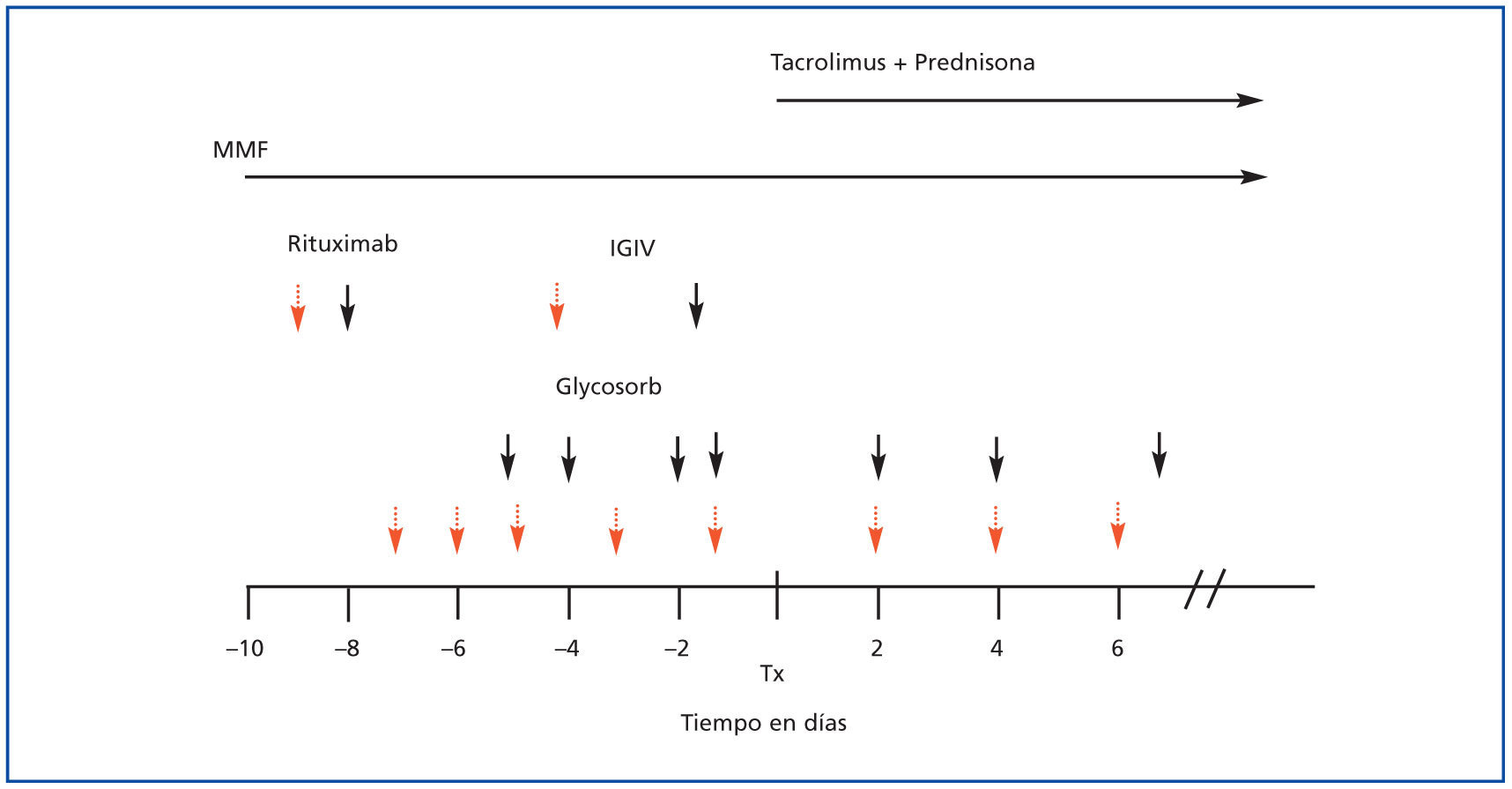
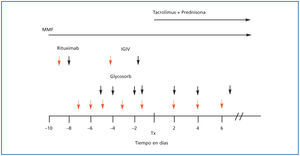
El protocolo utilizado para este tipo de trasplante se muestra en la figura 1. Se expone el protocolo inicialmente aceptado en nuestro centro basado en un tratamiento de acondicionamiento previo al trasplante con una dosis única de RTX (anticuerpo monoclonal anti-CD20, MabThera, Roche®, Nutley, NJ, EE.UU.) a dosis de 375 mg/m2 el día octavo previo al trasplante, 4 sesiones de IADS (GlycosorbABO, Glycorex®, Lund, Suecia) y una dosis de IGIV (Flebogamma IV 5%, Instituto Grífols®, Barcelona, España) posterior a la última sesión de IADS. Se seguía de tres sesiones de IADS posteriores al trasplante durante la primera semana. Según la monitorización de títulos de isoaglutininas se incrementaba o no el número de IADS hasta alcanzar unos títulos de isoaglutininas adecuados. Tras la experiencia de los primeros trasplantes se ha realizado una modificación del protocolo inicial (que se expone en la figura 1 con flechas discontinuas), con la administración más precoz del anticuerpo monoclonal anti-CD20, el incremento a 5 sesiones de IADS y el reparto de la misma dosis de IGIV en dos sesiones, al cuarto y último día pretrasplante. En los casos con sensibilización inmunológica y crossmatch actual por citometría de flujo positivo, se realizarían recambios plasmáticos en vez de IADS. En ningún caso fue necesaria la esplenectomía.
Para la IADS anti-A o anti-B se utilizaron columnas de antígenos de grupo sanguíneo A o B, que poseen los trisacáridos responsables de la especificidad de grupo sanguíneo A o B ligados de forma covalente a esferas de sefarosa14. Antes de entrar en la columna, el plasma fue separado mediante un separador celular (Cobe Spectra, Lakewood, Co., EE.UU.). Se utilizó citrato sódico (ACD-A) como anticoagulante, revertido con una solución de cloruro cálcico y sulfato magnésico a una proporción de 1 M de iones divalentes por cada 10 M de citrato. En cada sesión de IADS se hicieron pasar por la columna entre 2 y 3 volúmenes plasmáticos. En cada paciente se utilizaron 3 columnas, convenientemente regeneradas y conservadas después de cada uso21.
Monitorización de títulos
La titulación de las isoaglutininas se realizó de acuerdo con las técnicas estándares del servicio de hemoterapia y hemostasia. Siempre que fue posible se utilizaron para la titulación hematíes del donante del riñón, a una dilución 3% en solución salina fisiológica. El título de IgM se estimó utilizando una técnica salina en microtarjeta de gel (tarjetas Reverse Diluent, Ortho-Clinical Diagnostics, Raritan, NJ, EE.UU): a 40 µ de la dilución correspondiente se añadieron 10 µl de la dilución de hematíes, tras una incubación de 10 minutos la tarjeta fue centrifugada 10 minutos y leída. El título de IgG se estimó mediante una técnica de antiglobulina en microtarjeta de gel (Anti IgG-C3d, Polyspecific, Ortho). En cada pocillo de la tarjeta se dispensaron 40 µl de BLISS, 10 µl de la dilución de hematíes y 40 µl de la dilución correspondiente. Se incubó 15 minutos a 37 °C, se centrifugó 5 minutos y se procedió a su lectura. El título se consideró como el inverso de la última dilución con la que se observó una intensidad de aglutinación de +2 o mayor. Los títulos de isoaglutininas fueron evaluados de manera sistemática pre y post-IADS y adicionalmente si se requería clínicamente. Fueron excluidos del programa de trasplante aquellos pacientes con unos títulos de isoaglutininas IgG o IgM mayores a 512 antes del trasplante.
Parámetros inmunológicos y protocolo inmunosupresor utilizado
Para la evaluación de los parámetros inmunológicos se siguió del protocolo del centro para cualquier trasplante renal de donante vivo22,23. Se realizaron determinaciones de título de anti-HLA (anticuerpos reactivos contra panel, PRA) por técnica citotóxica. Se realizó prueba cruzada por técnicas de linfocitotoxicidad y citometría de flujo, requiriendo prueba negativa por la primera técnica y en el caso de crossmatch por citometría positiva se realizaron sesiones de recambios plasmáticos (con un total de seis sesiones) en vez de IADS, con tres dosis de IGIV y dos dosis de RTX pretrasplante. El protocolo inmunosupresor empleado para este tipo de trasplante ha estado basado en cuádruple terapia inmunosupresora con tacrólimus, micofenolato mofetilo/micofenolato sódico y prednisona con uso de terapia de inducción con anticuerpos monoclonales (basiliximab) o policlonales (globulina antitimocítica de conejo) según sensibilización inmunológica previa, crossmatch y títulos de PRA históricos y actuales del potencial receptor22.
Parámetros de función de injerto renal, histopatológicos y de profilaxis antimicrobiana
La evaluación de la función de injerto renal se realizó a través de valores de creatinina plasmática (en mg/dl), aclaramiento de creatinina en orina de 24 horas ajustado por superficie corporal, filtrado glomerular equilibrado calculado por fórmula MDRD (medido en ml/min/1,73 m2) y proteinuria en orina recogida en las 24 horas anteriores al análisis (definiéndola como clínica con valores mayores a 300 mg/orina de 24 horas). La función diferida del injerto renal se definió por no descenso de creatinina plasmática mayor al 20% en las primeras 48 horas postrasplante. Se ha seguido la clasificación de Banff24 a la hora de evaluar los datos histopatológicos obtenidos en las biopsias de injerto renal. No se practicaron biopsias de protocolo al no ser una estrategia utilizada hasta ahora en nuestro centro.
Se siguieron las recomendaciones del centro en cuanto a profilaxis de citomegalovirus, según estado sexológico del donante y receptor, y profilaxis anti-Pneumocystis jiroveci en todos los pacientes.
Estudio estadístico
El análisis estadístico ha sido realizado mediante tests no paramétricos descriptivos y de frecuencias. Los resultados se muestran en media ± desviación estándar. Un valor de p menor de 0,05 se consideró significativo. Para el análisis se utilizó el programa estadístico SPSS (versión 14.0, SPSS Inc.®, Chicago, IL, EE.UU.)
RESULTADOS
Características demográficas
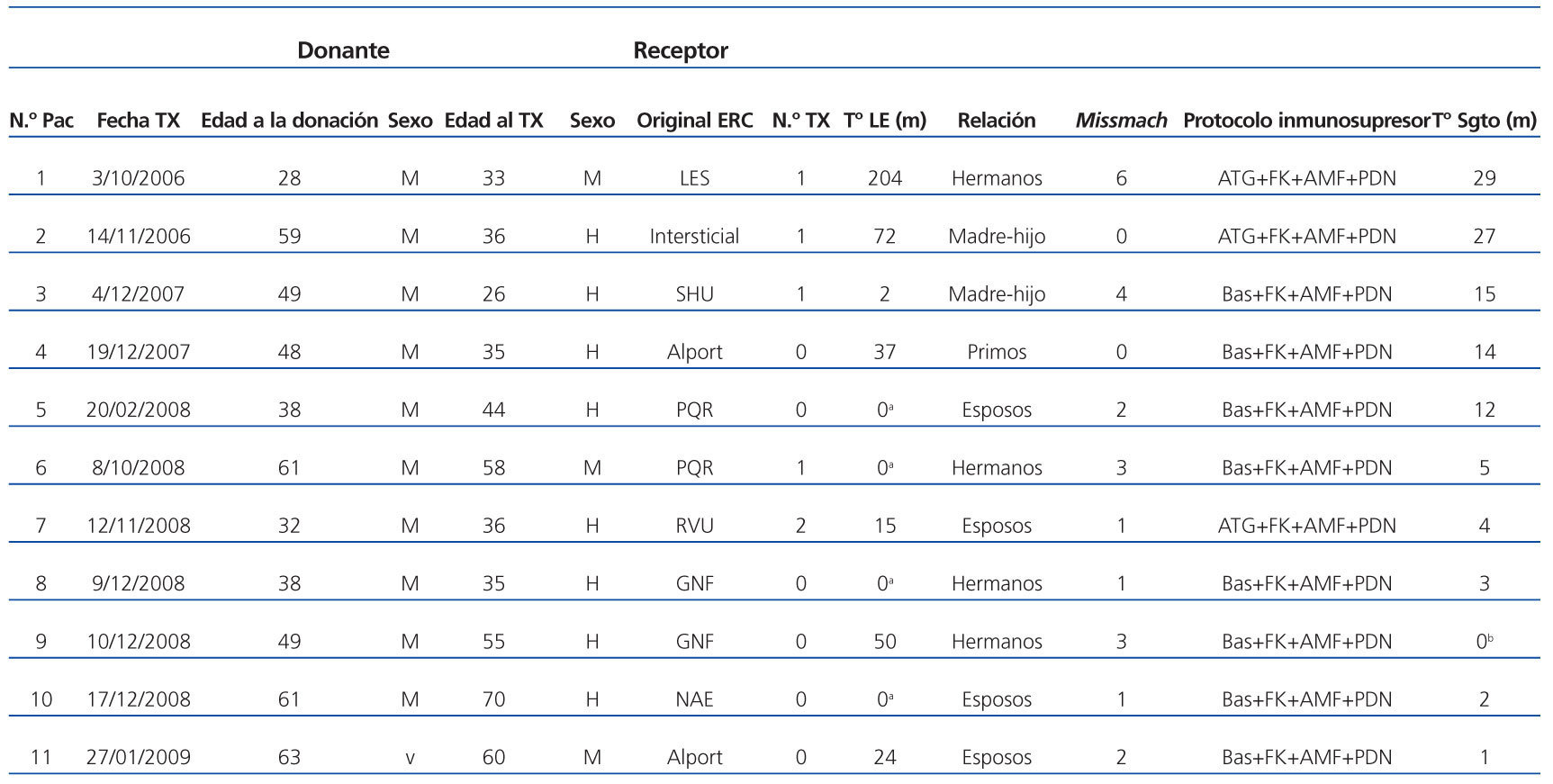
La edad media al trasplante de los receptores fue de 44,4 ± 14,1 (26-70) años, mientras que los donantes tenían una edad media de 47,8 ± 12,4 (27-63) años en el momento de la donación. Hubo más donantes mujeres (90,1%), siendo más los hombres los que recibieron el injerto renal (72,7%). Hermanos y esposos fueron las relaciones donante/receptor más prevalentes con un 36,4%, respectivamente, seguidos de madre/hijo con un 18,2%. En un 18,2% de los receptores las enfermedades renales primarias más prevalentes fueron la glomerulopatía, la poliquistosis renal y el síndrome de Alport, estando un 36,4% en prediálisis, un 54,5% en hemodiálisis y sólo un paciente en diálisis peritoneal.
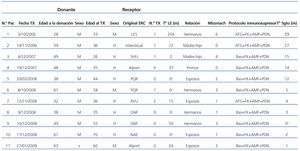
La media de compatibilidad HLA fue de 2,09 ± 1,81, siendo una pareja HLA idénticos y dos no compartían ningún antígeno HLA. Un 18,2% se consideraban hipersensibilizados (PRA >50%), y un 72,7% no estaban sensibilizados (PRA <10%). Una pareja tenía crossmatch positivo, histórico y actual, por citometría de flujo, siendo negativo por linfocitotoxicidad. Un 27,3% de los pacientes recibieron inducción con globulina antitimocítica y el resto con basiliximab. Las características de cada pareja se muestran en la tabla 1.
Protocolo de acondicionamiento ABO
Todos los receptores que iniciaron el tratamiento de acondicionamiento alcanzaron títulos de isoaglutininas pretrasplante considerados aceptables para poder llevar a cabo el trasplante (IgM e IgG <8). Dos parejas habían sido descartadas con anterioridad al presentar títulos de isoaglutininas elevados antes del protocolo de acondicionamiento. Se realizaron un promedio de 5,5 ± 2,6 sesiones de IADS para obtener dicho rango de títulos pretrasplante, siendo los receptores de las parejas 1, 2, 6 y 11 a los que más sesiones tuvieron que realizarse ya que partían de títulos de isoaglutininas más altos. Al receptor de la pareja número 10, única con incompatibilidad anti-B, no precisó ninguna sesión de IADS por títulos de isoaglutininas previos muy bajos (IgM e IgG de 4), aunque se administraron las dosis de IGIV y RTX consiguientes. Al receptor de la pareja número 7 se le realizó el protocolo de desensibilización previo al trasplante con recambios plasmáticos en vez de IADS, debido a que se trataba de un paciente hipersensibilizado con crossmatch por citometría de flujo histórico y actual positivos, junto con tres dosis de IGIV y dos de RTX. Se negativizó el crossmatch y se redujeron significativamente los títulos de isoaglutininas de igual manera que con las sesiones de IADS.
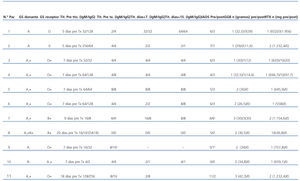
Después del trasplante fueron necesarias 2,8 sesiones de IADS de media postrasplante, destacando al receptor de la pareja 9, al que sólo se administró una sesión porque falleció a las 72 horas postrasplante, al receptor de la pareja 8 que no recibió ninguno debido a que eran los títulos de isoaglutininas negativos pretrasplante y se mantuvieron en el postrasplante, y al receptor de la pareja 10 por el mismo motivo por lo que no se le había administrado previo al trasplante. Los títulos de isoaglutininas monitorizados en el postrasplante se mantuvieron a títulos bajos en los primeros 15 días del trasplante (tabla 2).
Supervivencia de paciente e injerto y episodios de rechazo agudo
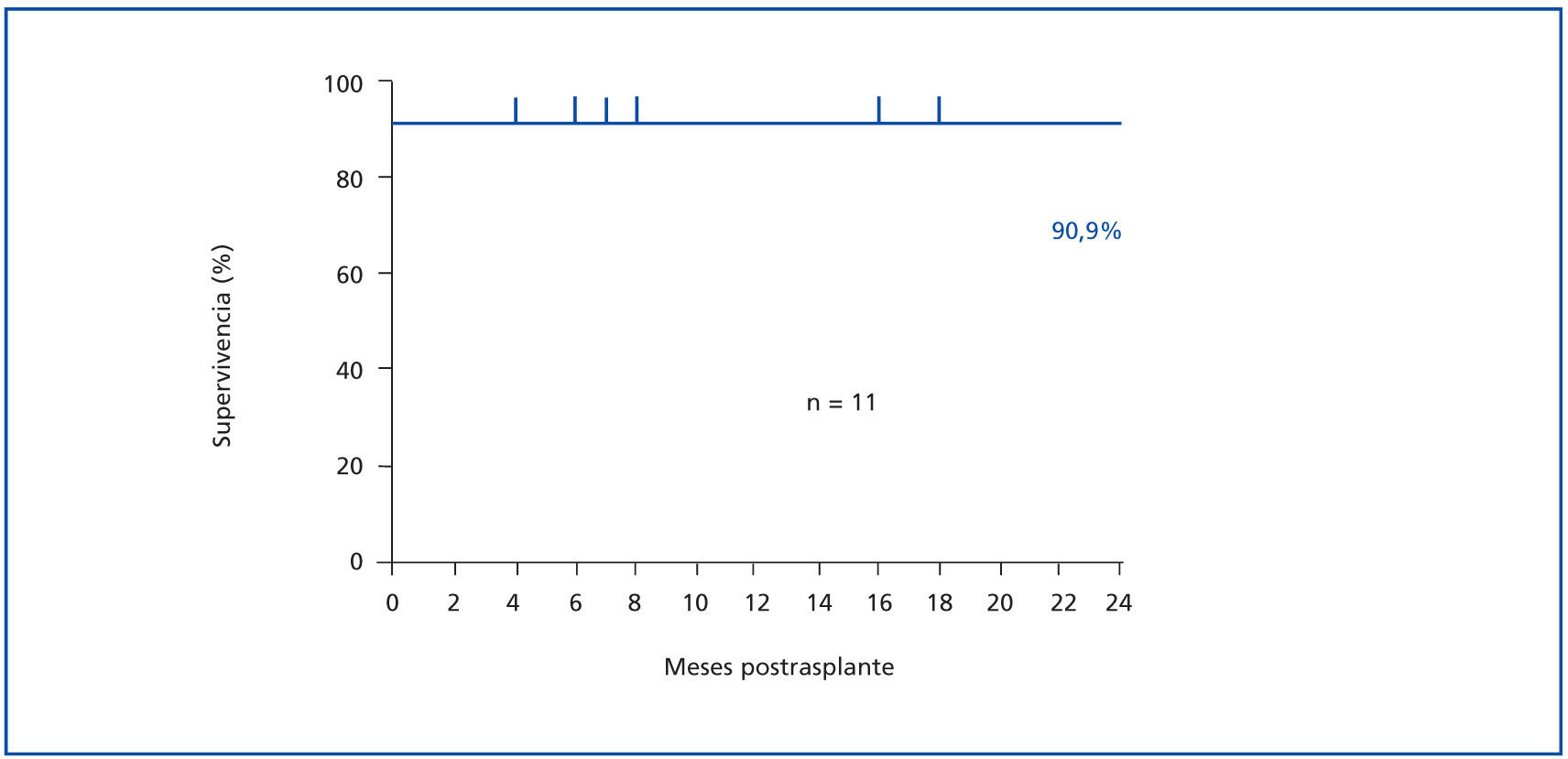
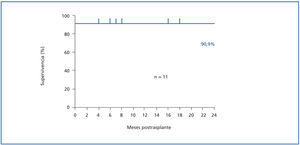
Ha habido un fallecimiento de un paciente por shock hipovolémico en el tercer día postrasplante, por probable dehiscencia de sutura en la anastomosis vascular. El paciente era portador de un bypass aorto-bifemoral con prótesis de Dacron. Los otros 10 receptores se mantienen vivos y con injerto funcionante hasta la actualidad, con un tiempo de seguimiento de 10,2 ± 10,2 meses (figura 2). Dos pacientes (18,2%) presentaron rechazo agudo dentro de los primeros meses postrasplante, siendo los dos de tipo celular, IA y IB según la clasificación de Banff24, que respondieron a la terapia con bolus de metilprednisolona. No hubo ningún episodio de rechazo agudo tardío ni rechazo agudo humoral.
Función del injerto renal
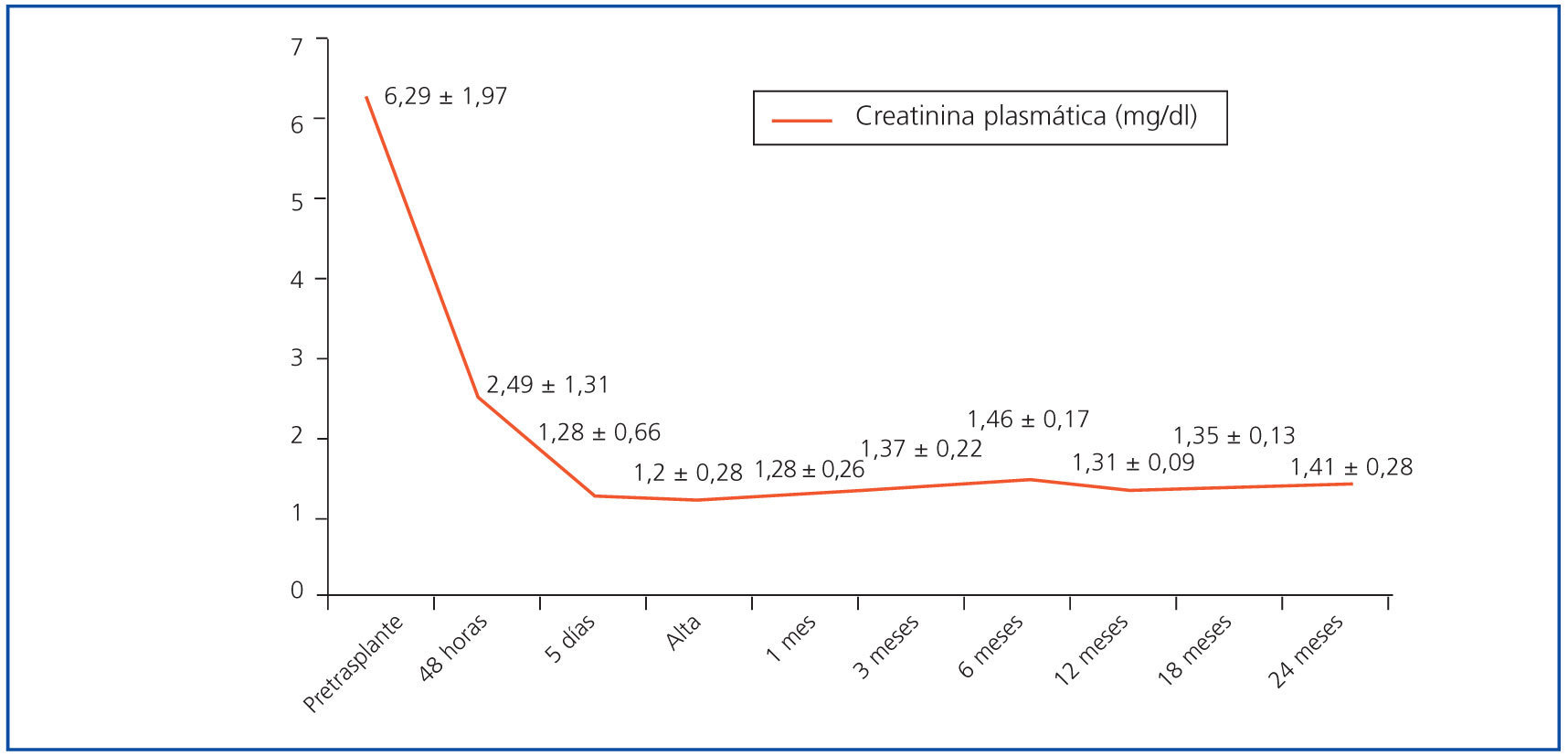
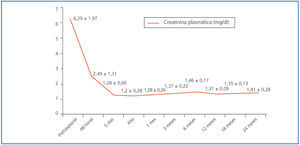
Todos los pacientes mostraron una mejoría inmediata de función de injerto renal desde el primer momento (incluido el paciente que falleció a las 60 horas), sin ningún episodio de función diferida del injerto. La creatinina plasmática a las 48 horas era ya de 2,49 ± 1,31 mg/dl de media (partían de valores de 6,29 mg/dl previos al trasplante) y valores al alta de 1,2 ± 0,28 mg/dl, que se han mantenido estables entre 1,3 y 1,4 mg/dl en el periodo de seguimiento (figura 3), al igual que la proteinuria (244,9 ± 213,4 y 218 ± 106,1 mg en orina de 24 horas a los 12 y 24 meses, respectivamente) con sólo un paciente con proteinuria clínica (>300 mg de orina de 24 horas) al año y 2 años, y aclaramiento de creatinina (62,6 ± 8,1 y 70,5 ± 0,7 ml/min/1,73 m2 a los 12 y 24 meses, respectivamente). Los niveles valle de tacrólimus a los 1, 6, 12 y 24 meses fueron 13,2, 10,3, 7,3 y 5,5 ng/ml de promedio, respectivamente.
Hallazgos histopatológicos
Se han realizado 10 biopsias de injerto renal a 6 pacientes, todas ellas por indicación diagnóstica ante deterioro de función de injerto renal (solamente a la paciente de la pareja número 1 se le practicó biopsia con fin pronóstico), con una media de 6,1 meses desde el trasplante. Los informes anatomopatológicos llegaron a la conclusión de que se trataba de dos episodios de rechazo agudo celular, tipo 1A y 1B, 7 biopsias sin hallazgos anatomopatológicos o mínimos de fibrosis intersticial y/o atrofia tubular, y una con signos de toxicidad por anticalcineurínicos (en la realizada más tardíamente, a los 23 meses del trasplante). En todas ellas se evidenció positividad para el C4d en capilares peritubulares, siendo focal en 8 biopsias y difusa en dos.
Complicaciones asociadas y otros efectos adversos
Durante el período de seguimiento, 9 pacientes tuvieron alguna complicación infecciosa, siendo la infección urinaria con 6 episodios la de mayor incidencia. Todas las infecciones urinarias se produjeron en el período de trasplante inmediato y con heterogeneidad en el agente infeccioso responsable, siendo Escherichia coli el único germen repetido en dos ocasiones. Citrobacter freundii, Staphilococcus coagulasa negativo, Enterococcus faecium, Pseudomonas aeruginosa, Enterobacter cloacae y Klebsiella pneumoniae han sido el resto de agentes infecciosos detectados en los cultivos urinarios diagnósticos. Dos episodios fueron polimicrobianos.
Se diagnosticó una infección por citomegalovirus (CMV), en un donante IgG CMV positivo/receptor IgG CMV positivo, diagnosticada por positividad de antigenemia y PCR en sangre, en un receptor que había tenido rechazo agudo y había recibido bolus de metilprednisolona e incrementada la dosis de inmunosupresión, que había recibido un mes de profilaxis postrasplante con valganciclovir oral ajustado a función de injerto renal. También se evidenció positividad para SV40 en inmunocitoquímica en orina y expresión nuclear de antígeno de poliomavirus (PMV) en la inmunohistoquímica de la misma muestra, pero sin evidencia de nefropatía por PMV, al resultar negativa la inmunohistoquímica del SV40 en tejido histológico de biopsia de injerto.
Hubo una infección de la herida quirúrgica por herpes simple cutáneo en el período inmediato postrasplante, y una meningitis por virus varicela zoster diagnosticado por PCR en el líquido cefalorraquídeo a los 25 meses del trasplante.
En el ámbito vascular, sólo se documentó el fallecimiento del paciente a los 3 días del trasplante, debido a la dehiscencia en la sutura vascular, realizada sobre una prótesis de Dacron de un bypass aorto-bifemoral previo. No se evidenciaron otros problemas vasculares, así como tampoco episodios de trombosis.
No hubo ninguna anemia hemolítica en relación con isoaglutininas circulantes, ni enfermedad linfoproliferativa postrasplante, ni otro tipo de neoplasias.
DISCUSIÓN
En los últimos años se están utilizando nuevas fuentes de órganos para poder afrontar la falta de donantes cadáver por muerte encefálica y el estancamiento en el número de pacientes en la lista de espera. Se están rompiendo barreras, como el trasplante con crossmatch positivo y el trasplante con incompatibilidad de grupo ABO5,25. Con la experiencia del grupo japonés de Tanabe20 e Ichimura19, la americana de Montgomery5 y Gloor6 y la sueca de Tyden15-17,26, se han obtenido resultados satisfactorios del programa ABO incompatible comparables con trasplante ABO compatibles, siguiendo diferentes estrategias de tratamiento (IADS en vez de recambios plasmáticos5,6, RTX en sustitución de esplenectomía19-27). Otros grupos, como el alemán de Séller28, el londinense de Galliford29 o el suizo de Oettle30, han iniciado con éxito sus programas de trasplante con incompatibilidad de grupo sanguíneo. En España hasta 2006 no se había realizado ningún trasplante con incompatibilidad de grupo sanguíneo. El uso de un protocolo de desensibilización basado con IADS, IGIV y RTX se eligió como el adecuado dada la experiencia del grupo de Tyden15,17 y las características semejantes de los potenciales receptores de este tipo de trasplante. Inicialmente empezamos con un protocolo que se ha ido modificando con la experiencia debido a la necesidad de ajustar en cada caso el número de sesiones de IADS a los títulos de isoaglutininas para obtener unos títulos adecuados para realizar el trasplante (figura 1). También se ha dividido la dosis de IGIV en dos administraciones los días –1 y –4, y la dosis de RTX actualmente se administra en el día –9. Con este protocolo de desensibilización hemos mantenido unos títulos de isoaglutininas en el postrasplante a títulos muy bajos que no han hecho que se administrara ninguna sesión de IADS extra pasadas las 2 semanas del trasplante, como ya se había publicado en la literatura26.
Basándose en el trabajo original de Alexandre11, la esplenectomía se considera necesaria, asociada con la eliminación de isoaglutininas con técnica de recambio plasmático o inmunoadsorción9,31, dado el principal papel que juega el bazo en la producción de anticuerpos19. También la esplenectomía ha sido usada para el tratamiento de rechazo agudo humoral severo32. La reciente aparición del RTX, tanto como terapia de inducción15,17,27 como de tratamiento del rechazo agudo mediado por anticuerpos33,34 se ha sugerido como una esplenectomía «farmacológica»31. Con una sola dosis se llega a eliminar linfocitos B periféricos por varios meses, incluso con dosis de 375 mg/m2 más de 2 años postrasplante35, aunque en la mayoría de los protocolos actuales se administran una o dos dosis de 100 mg/m2 pretrasplante19. Por lo tanto, obtendríamos resultados similares o incluso mejores con el RTX que con la esplenectomía, disminuyendo la incidencia de infecciones y sin requerir anticoagulación específica postrasplante, como ha sido revisado por Ichimaru y Takahara26. En nuestro centro desde un inicio se ha utilizado el RTX, con buenos resultados, sin haber tenido que realizar ninguna esplenectomía postrasplante y sin evidenciar ningún episodio de trombosis. La dosis que estamos utilizando es la de 375 mg/m2 en una sola dosis pretrasplante a los 9 días, aunque estamos valorando si con una dosis menor, como se ha mencionado anteriormente, sería suficiente.
También el uso de RTX ha beneficiado en cuanto a la prevalencia de infecciones postrasplante respecto a la esplenectomía. En nuestra serie tenemos una alta tasa de infecciones, aunque casi todas son infecciones urinarias en el postrasplante inmediato. Los resultados son similares a lo publicado por nuestro grupo en trasplante de donante vivo con compatibilidad de grupo sanguíneo16,24,26 y cadáver36,37, así como a los resultados publicados por el grupo de Galliford29, con 8 sepsis urinarias y una infección de herida quirúrgica. A diferencia de otros grupos que no tuvieron infecciones por CMV29,30, en nuestra serie ha habido un caso de infección por CMV, igual que el grupo de Genberg16, en un paciente que había tenido rechazo agudo y en quien se incrementó la inmunosupresión. Los resultados de todos estos grupos difieren con los resultados del grupo de Tanabe, con un 54% de infecciones y 3 enfermedades por CMV, aunque todos respondieron a la terapia antiviral basada en ganciclovir endovenoso20. En nuestro centro seguimos las recomendaciones de la profilaxis anti-CMV basadas en estado serológico del donante y receptor, y la terapia inmunosupresora de inducción utilizada. Respecto al PMV, sólo hemos tenido una replicación vírica con positividad por inmunocitoquímica al SV40 y expresión nuclear de antígeno de poliomavirus (PMV) en orina, sin datos histológicos de nefropatía por PMV en la inmunohistoquímica. Datos similares a los del grupo de Oettl30, que referenció 7 replicaciones del PMV sin tener nefropatía por el mismo y a los del grupo de Genberg16, a diferencia de la serie de Galliford29 con un caso de nefropatía por PMV a los 5 meses en un paciente que había sido tratado por un rechazo agudo y que respondió simplemente a la reducción de inmunosupresión.
Aunque la supervivencia de paciente e injerto es excelente, destacando un solo fallecimiento en relación con complicación quirúrgica, destaca una tasa de rechazo agudo del 18,2% (2 pacientes), que para el momento actual pudiera ser alta22,38-40. Puesto que se trata de un número de trasplantes pequeño y de una población muy específica y de alto riesgo inmunológico consideramos que es aceptable, ya que un episodio de rechazo celular tipo IA fue en un paciente hipersensibilizado con crossmatch positivo previo al trasplante y el otro episodio fue en un paciente con grado de sensibilización previo. Todos ellos respondieron adecuadamente al tratamiento antirrechazo específico. Los datos obtenidos en las biopsias de injerto renal, aún no realizando en nuestro centro biopsias de protocolo, son muy satisfactorios. Un 80% de las biopsias son normales o con mínimas alteraciones de fibrosis intersticial y/o atrofia tubular, resultados parecidos a los publicados con biopsias de protocolo30, siendo la media de la realización de las mismas más tardía (6,1 meses), al ser indicadas por alteración de la función del injerto renal o no alcanzar una función esperada previamente. Cabe destacar que en el 100% de las biopsias obtenemos positividad para el C4d en los capilares peritubulares, siendo en un 80% focal y de los que se obtuvieron de manera difusa, en uno de ellos había un rechazo agudo celular. Los mismos resultados han sido publicados por Oettl; un 100% de las biopsias tuvieron tinción positiva para C4d en un total de 46 biopsias de protocolo en 8 pacientes (hasta el 18 mes), aunque su tinción fue difusa, excepto en un caso que fue focal30, no cumpliendo los criterios de Banff para el rechazo agudo o crónico mediado por anticuerpos24. Especial es el caso de los pacientes con mayor período de seguimiento que, aunque presentan positividad al C4d, siguen sin cumplir dichos criterios y mantienen unos valores de creatinina y proteinuria estables, sin variaciones tampoco en el aclaramiento de creatinina, que den un sentido de marcador de rechazo crónico a tal depósito de C4d en los capilares peritubulares como ha sido publicado por Montogomery este año41.
La función de injerto renal, expresada en creatinina plasmática, en estos pacientes a medio plazo la consideramos excelente si la comparamos con los resultados de trasplante de donante vivo con compatibilidad de grupo sanguíneo16,24,26 y cadáver36,37. Ha resultado similar a los resultados publicados del grupo de trasplante renal de donante vivo ABO compatible (creatinina plasmática al año de 1,16 ± 0,56 frente a 1,41 mg/dl (conversión de 124,4 µmol/l) del grupo de Tydén26, y mejor que los que tenían trasplante renal de donante cadáver (1,4 mg/dl del grupo de Matas36 y 1,53 mg/dl de datos publicados por nuestro grupo37).
En resumen, consideramos que el trasplante renal de donante vivo con incompatibilidad ABO puede ser incorporado al arsenal de técnicas de trasplante de nuestro centro, incrementando el número de trasplantes renales de donante vivo, asegurando resultados comparables con el trasplante renal de donante vivo con compatibilidad de grupo sanguíneo y obteniendo mejores resultados que el trasplante renal de donante cadáver. Sin embargo, es necesario disponer de más información con un mayor número de pacientes y con un mayor seguimiento para evaluar los resultados a largo plazo y para perfeccionar y consolidar el procedimiento.
En conclusión, en nuestra experiencia el trasplante renal ABO incompatible representa una alternativa eficaz y segura en los casos en los que se plantee esta opción de donante vivo.
Figura 1.
Tabla 1. Características de donante/receptor, así como protocolo inmunosupresor y tiempo de seguimiento
Tabla 2. Características ABO de donante y receptor. Aplicación del protocolo de desensibilización específico anti-ABOo
Figura 2.
Figura 3.