El tolvaptán (Jinarc®) es un antagonista del receptor V2 de la vasopresina, cuya acción conlleva una disminución de los niveles de AMPc intracelular1.
Este fármaco está indicado para pacientes entre 18 y 60 años diagnosticados de poliquistosis hepatorrenal autosómica dominante (PQHRAD)2–4 en casos de progresión rápida y estadios de ERC 1-45,6.
Su comercialización en Europa se inicia en 2015 tras los resultados prometedores del ensayo clínico TEMPO 3:47. La posología se divide en 2 tomas diarias, iniciándose en 45+15mg, con incremento progresivo hasta la dosis completa 90+30mg1, manteniendo la dosis más alta que el paciente tolere y vigilando los principales efectos secundarios: hepatotoxicidad y poliuria8.
Dentro de la literatura no existen casos publicados en los que se identifique la toxicodermia como uno de sus efectos adversos.
Presentamos el caso de una mujer de 45 años en seguimiento por PQHRAD desde el año 1992. Entre sus antecedentes personales previos destaca que era exfumadora, sin otros hábitos tóxicos, y no se registran alergias medicamentosas conocidas. En cuanto a sus enfermedades previas presenta hipertensión arterial en tratamiento dietético y dislipidemia en tratamiento con estatinas.
Entre sus antecedentes familiares cabe resaltar que su madre estaba diagnostica de PQHRAD con inicio de terapia renal sustitutiva (TRS) a los 48 años y una hermana también afecta por la enfermedad en programa de diálisis peritoneal desde los 49 años.
Se realiza resonancia nuclear magnética9 en abril de 2018, cumpliendo criterios de rápida progresión clase 1 E del modelo de la Clínica Mayo5. Por ello, en junio de 2018 se inicia tratamiento con tolvaptán a dosis 45-15mg cada 12horas, con pruebas de función hepática normales, previas al inicio del fármaco, con un filtrado glomerular (FG) cuando comenzó con el fármaco de 53ml/min/1,73m2.
En septiembre de 2018 se incrementa la dosis a 60-30mg cada 12horas, y en noviembre de 2018 se instaura la dosis completa a 90-30mg, no habiéndose registrado hasta ese momento, ni clínica ni analíticamente, efectos adversos del fármaco.
En diciembre de 2018 la paciente presenta una erupción cutánea acompañada de palpitaciones, sin dificultad respiratoria asociada, por lo que se decide suspender el fármaco.
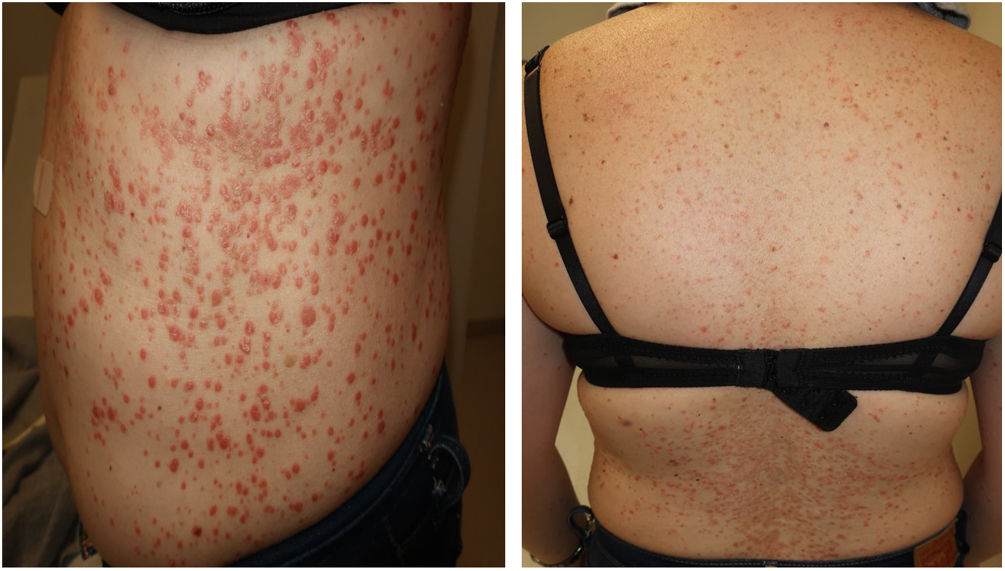
Las lesiones consistían en pápulas eritematosas pruriginosas, algunas con leve hiperqueratosis, en el tronco, las extremidades superiores y en la cara. Se realiza biopsia cutánea indicada por dermatología y se inicia tratamiento con Adventan® en emulsión (fig. 1).
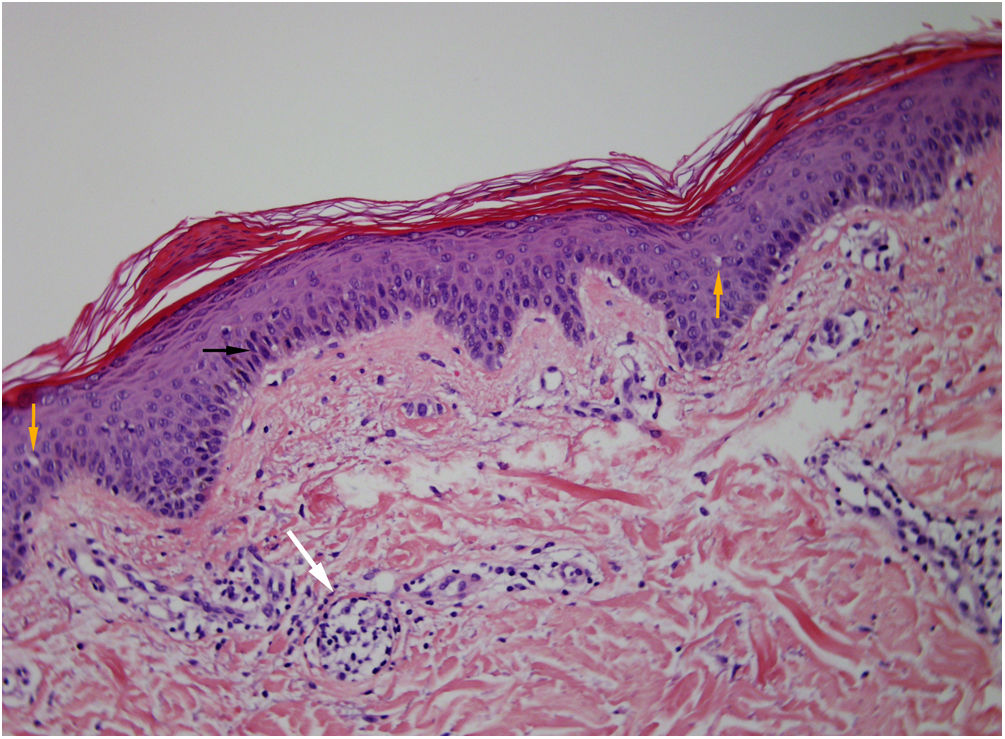
En la biopsia cutánea se describen montículos de paraqueratosis, discreta espongiosis, mínima exocitosis linfocítica muy focal sobre una dermis con un discreto inflitrado linfocitario perivascular superficial (fig. 2).
Fue valorada por alergología, atribuyéndose el cuadro a una posible alergia al tolvaptán, con desaparición de las lesiones en mayo de 2019. Fue comunicada la alerta farmacológica a la casa comercial.
A petición de la paciente, consensuado en sesión multidisciplinar y teniendo en cuenta el beneficio del uso del fármaco en la progresión de la enfermedad, se decide la reintroducción del fármaco a dosis bajas (45-15mg), con vigilancia estrecha por las diferentes especialidades médicas. En agosto de 2019 aparecen nuevamente las lesiones en la frente y en los pómulos, por lo que se reduce dosis a 30-15mg.
Actualmente se mantienen las dosis bajas del fármaco, con control de las lesiones cutáneas y función renal estable (creatinina 1,06mg/dl y urea 37mg/dl, FG 61ml/min).
La reacción cutánea es uno de los efectos adversos extremadamente raros en los pacientes en tratamiento con tolvaptán, no habiéndose descrito hasta ahora ningún caso similar en la literatura.
En nuestra opinión, además de lo excepcionalmente raro del caso, cabe destacar 2 puntos esenciales: 1) la importancia del abordaje multidisciplinar en este tipo de pacientes (valoración conjunta de dermatología, alergología y nefrología, siendo habitual también la participación de la sección de hepatología de digestivo) para una correcta medida del balance riesgo/beneficio del uso del fármaco; y 2) cabe resaltar también que, incluso en situaciones especiales como esta, se puede administrar el tratamiento a dosis inferiores a las establecidas para conseguir mantener el efecto beneficioso del fármaco.
Consideramos que el hecho de poder continuar con el tolvaptán preserva el principio de autonomía de la paciente y repercutirá en un mejor pronóstico de la función renal a largo plazo.
Finalmente, el fármaco se ha podido mantener a dosis baja, con buena tolerancia al mismo y con aparición esporádica de mínimas lesiones cutáneas (una o 2), en seguimiento estrecho por dermatología.
FinanciaciónNo existe financiación.
Conflicto de interesesNo existe conflicto de intereses.