El tejido graso epicardico (EAT) y mediastínico (MAT) se relaciona con el síndrome metabólico y la enfermedad arterial coronaria. Los pacientes con enfermedad renal crónica (ERC) tienen mayor volumen de EAT. El objetivo de nuestro estudio fue determinar si estos depósitos adiposos podrían estar relacionados con un aumento de mortalidad y eventos cardiovasculares en pacientes con ERC avanzada y en hemodiálisis.
MétodosSe realizó un análisis post hoc de una serie prospectiva, de 104 casos, con una tomografía computarizada sincronizada multicorte (MSCT) que permitiera cuantificar el grosor EAT.
ResultadosEl periodo de seguimiento fue de 112,68 (109,94-115,42) meses. El punto de corte de EAT con mayor sensibilidad y especificidad para predecir mortalidad total fue 11,45mm (el 92,86 y el 43,75%, respectivamente). Las variables que se correlacionaron con el EAT fueron la albúmina, el nivel sérico de triglicéridos, de fósforo y el producto fosfo-cálcico. El EAT fue mayor en pacientes en hemodiálisis respecto aquellos con ERC avanzada (p<0,001). Los pacientes con diabetes mellitus tenían mayor grosor de EAT y MAT (p=0,018). La supervivencia media de los pacientes con EAT < 11,45mm fue de 97,48 meses vs. 76,65 meses para un grosor > 11,45mm (p=0,007).
ConclusionesUn mayor grosor de EAT y MAT se relacionó con un incremento de mortalidad total. Además, el EAT se asoció con una menor supervivencia libre de eventos cardiovasculares fatales y no fatales. La cuantificación de EAT y MAT mediante MSCT podría tener valor pronóstico para pacientes con ERC avanzada y hemodiálisis.
Epicardial and mediastinal adipose tissue (EAT, MAT) are linked to metabolic syndrome and coronary artery disease. Patients with chronic kidney disease (CKD) have thicker EAT. We assessed if EAT and MAT could be associated with increased mortality and cardiovascular events in patients with advanced CKD and haemodialysis therapy.
MethodsA post-hoc study was performed. We analyzed a prospective series of 104 cases. EAT thickness was quantified by a multislice synchronized computed tomography (MSCT).
ResultsThe follow-up period was 112.68 (109.94 -115.42) months. The optimal cut-off point of EAT for prediction of total mortality was 11.45mm (92.86% and 43.75%). EAT thickness was associated with serum albumin levels, serum triglyceride levels, phosphorus and calcium phosphate product. The EAT was greater in haemodialysis patients compared to those with advanced CKD (P<.001). Patients with diabetes mellitus had greater EAT and MAT thickness (P=.018). At the end of follow up, the survival average time of patients with EAT thickness <11.45mm was 97.48 months vs. 76.65 months for thickness > 11.45mm (P=.007).
ConclusionsA higher EAT and MAT thickness was associated with increased mortality. Furthermore, EAT was associated with lower free survival time to fatal and non-fatal cardiovascular events. The measurement of EAT and MAT by MSCT could be a prognostic tool to predict cardiovascular events and mortality risk in advanced CKD patients.
La enfermedad renal crónica (ERC) se asocia a un elevado riesgo morbimortalidad cardiovascular (CV)1,2.
El tejido graso epicárdico (EAT) es un factor de riesgo CV emergente3-5. Es un tejido de grasa perivisceral que envuelve las arterias coronarias y el corazón, y contacta directamente con el miocardio subyacente. Procede embriológicamente del mesodermo esplacnopleural y es un tejido metabólicamente activo6. En situaciones patológicas, produce citocinas proinflamatorias. Estas citocinas se liberan al miocardio adyacente y al flujo sanguíneo coronario, de forma que actúan de forma sistémica y paracrina, influyendo en el desarrollo de la ateroesclerosis coronaria7. En población general, el EAT se ha relacionado con el síndrome metabólico, la diabetes mellitus (DM)6-9 y la enfermedad arterial coronaria (CAD)10-12.
El tejido mediastínico (MAT) es el tejido adiposo depositado fuera de la fascia parietal del pericardio. La distinción entre las distintas localizaciones de los depósitos de grasa es importante, puesto que la grasa pericárdica tiene características metabólicas específicas y distinto drenaje sanguíneo13-17.
La cuantificación del EAT no está estandarizada, los estudios son heterogéneos en cuanto a la técnica radiológica empleada y a la localización del depósito graso medido y no existe consenso sobre los rangos de referencia13,18.
En los pacientes con ERC avanzada o en tratamiento renal sustitutivo el volumen de EAT se ha relacionado con la calcificación arterial coronaria (CaC), la ateroesclerosis, la inflamación y la malnutrición12,19-22. Sin embargo, existen pocos datos sobre su capacidad predictiva de eventos CV y mortalidad en estos pacientes23.
El objetivo primario de nuestro estudio es determinar si la cuantificación del EAT y el MAT mediante tomografía computarizada sincronizada multicorte (MSCT) se asocia con un aumento de mortalidad en pacientes con ERC avanzada (estadios 4 y 5) y en hemodiálisis.
Como objetivos secundarios, exploramos la asociación de estos parámetros con la variable objetivo combinada de mortalidad y eventos CV, la relación con el score de CaC y con factores de riesgo CV bioquímicos y clínicos propios de esta población.
Material y métodosSe llevó a cabo un análisis post hoc de una serie prospectiva y de cohortes, diseñada inicialmente para estudiar la capacidad predictiva de riesgo CV del score de CaC24. La población inicial a estudio incluía a 137 pacientes con ERC avanzada o en programa de hemodiálisis crónica, en seguimiento en la Unidad de Nefrología del Hospital Universitario Príncipe de Asturias. El periodo de inclusión fue de 2 años.
Los criterios de inclusión fueron: edad mayor de 18 años, ERC avanzada (estadios 4-5) y en programa de hemodiálisis, al menos durante los 6 meses previos al reclutamiento. Los criterios de exclusión fueron: el fracaso renal agudo, el embarazo, una enfermedad intercurrente que condicionase una supervivencia estimada inferior a 12 meses y la imposibilidad para realizar una MSCT.
Se seleccionaron aquellos casos que tuvieran disponible un estudio de imagen adecuado, el cual permitiera calcular el grosor del tejido graso alrededor del corazón en sus diferentes localizaciones o surcos.
Todos los pacientes firmaron el consentimiento informado. El protocolo del estudio fue aprobado por el comité ético local.
Como parte de la valoración rutinaria de los pacientes en la Unidad de Nefrología, se obtuvo una muestra de sangre en el mes previo a la realización de una MSCT, para la determinación de parámetros bioquímicos relacionados con la función renal, el metabolismo lipídico y mineral-óseo. El tiempo de permanencia en hemodiálisis se definió como el tiempo transcurrido desde la entrada del paciente en hemodiálisis hasta el día de la realización de la MSCT.
Todos los pacientes incluidos tenían MSCT de 16 detectores, Light Speed Plus GE medical System. No se utilizó contraste por vía intravenosa y las imágenes adquiridas fueron reconstruidas en cortes de 2-3mm. El procesado de imágenes se llevó a cabo en una consola Advantage Workstation 4.0 (General Electric, Nueva York, EE. UU.).
Se utilizó un umbral de atenuación entre –200 y –20 unidades Hounsfield (UH) para aislar la grasa pericárdica. La medición del grosor del depósito graso de interés se definió mediante la delineación manual enmilímetros, y siguiendo la distribución propuesta por otros autores11. La cantidad de grasa total de cada compartimento resultó de la suma del grosor del depósito adiposo de cada surco o región:
- –
MAT: depósito graso situado en el mediastino, fuera del pericardio parietal (grasa preesternal, pleural anterior, pleuro-ácigo-esofágica, paravertebrales y senos cardiofrénicos).
- –
EAT: depósito graso visceral situado intrapericárdico y contiguo a la superficie miocárdica (surcos aurículo-ventriculares izquierdo y derecho, surco interventricular, ápex y grosor pericárdico derecho o pared libre del ventrículo derecho.
La cuantificación del score de CaC se determinó mediante el método desarrollado por Agatston, que establece un umbral de 130 UH para determinar si una lesión está calcificada25. Las puntuaciones de CaC con un score entre 100 y 400 UH indican ateroesclerosis moderada y una probabilidad relativamente alta de enfermedad coronaria; los valores de CaC > 400 UH indican una enfermedad ateroesclerótica grave, con elevada probabilidad de CAD obstructiva y elevado riesgo de isquemia26.
Para el objetivo primario se registraron los eventos CV incidentes que causaron hospitalización (insuficiencia cardíaca aguda, cardiopatía isquémica aguda, fibrilación auricular, accidente cerebrovascular y enfermedad arterial periférica). También se recogieron la mortalidad total y la mortalidad asociada a evento CV. La supervivencia global se definió como el tiempo desde el momento del reclutamiento hasta el fallecimiento del paciente.
Análisis estadísticoLas variables cuantitativas se expresaron en sus medias y desviación estándar, o mediana y rango intercuartil, según su ajuste a la normalidad, aplicando la prueba de Kolmogorov-Smirnov. Las variables categóricas se expresaron en porcentajes relativos al tamaño de la muestra, salvo que se especifique lo contrario.
Para llevar a cabo el análisis del objetivo primario se dividió la serie en 2cohortes de casos seleccionados de acuerdo con el punto de corte que determine una mayor sensibilidad (S) y especificidad (E) en la curva ROC para mortalidad total según el índice de Youden.
Los 2grupos así diseñados fueron comparados mediante una prueba de la t de Student o de Kruskal-Wallis, según estuviese indicado. También se llevó a cabo un modelo lineal de regresión múltiple para estimar aquellas variables que se asociaron a un mayor grosor del tejido adiposo definido en el EAT. Las pruebas de correlación de Pearson o Spearman se utilizaron para explorar la relación del tejido adiposo con las diferentes variables de riesgo CV.
La influencia de las variables definidas, EAT y MAT, sobre la mortalidad global y los eventos CV se determinó aplicando modelos proporcionales univariados de Cox. El método de Kaplan-Meier (KM) y el de Mantel-Cox (log-rank test) fueron aplicados para comparar las curvas de supervivencia de cohortes definidas por el mejor punto de corte de EAT.
Los datos fueron analizados utilizando el paquete estadístico versión SPSS 20.0 (SPSS Software, Chicago, IL, EE. UU.) y R versión 3.5.2 (2018); se estableció un nivel de significación de la p<0,05.
ResultadosLas características basales de la serie analizada están recogidas en la tabla 1. Se incluyeron finalmente 104 casos, de los cuales 63 pacientes estaban en programa de hemodiálisis y 41 pacientes tenían ERC avanzada sin tratamiento sustitutivo; el 50% de los casos eran mujeres.
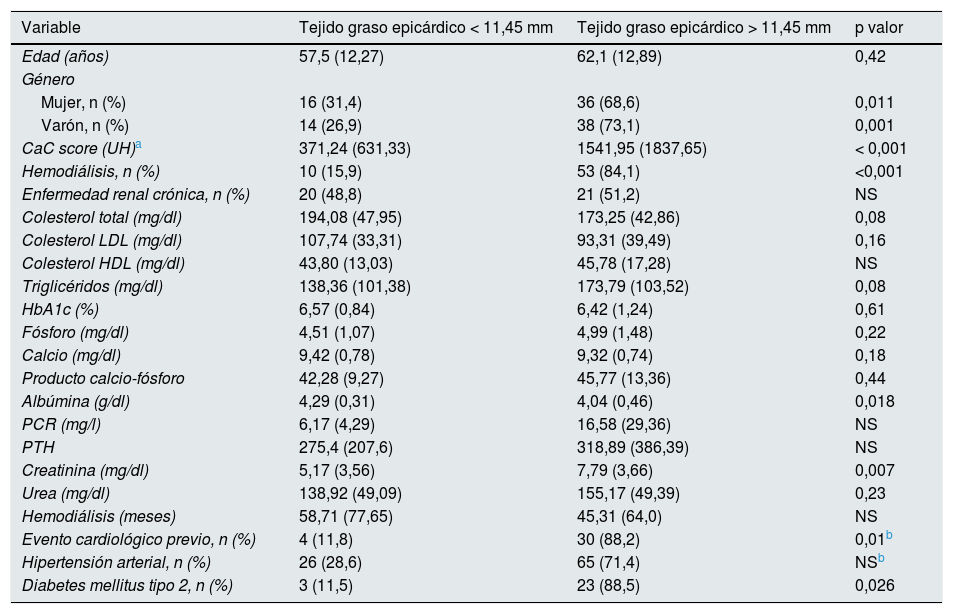
Características clínicas y parámetros bioquímicos basales de la serie, en 2cohortes, según el grosor del tejido graso epicárdico (< 11,45mm vs. > 11,45mm), aplicando test no paramétricos (salvo especificaciones)
| Variable | Tejido graso epicárdico < 11,45 mm | Tejido graso epicárdico > 11,45 mm | p valor |
|---|---|---|---|
| Edad (años) | 57,5 (12,27) | 62,1 (12,89) | 0,42 |
| Género | |||
| Mujer, n (%) | 16 (31,4) | 36 (68,6) | 0,011 |
| Varón, n (%) | 14 (26,9) | 38 (73,1) | 0,001 |
| CaC score (UH)a | 371,24 (631,33) | 1541,95 (1837,65) | < 0,001 |
| Hemodiálisis, n (%) | 10 (15,9) | 53 (84,1) | <0,001 |
| Enfermedad renal crónica, n (%) | 20 (48,8) | 21 (51,2) | NS |
| Colesterol total (mg/dl) | 194,08 (47,95) | 173,25 (42,86) | 0,08 |
| Colesterol LDL (mg/dl) | 107,74 (33,31) | 93,31 (39,49) | 0,16 |
| Colesterol HDL (mg/dl) | 43,80 (13,03) | 45,78 (17,28) | NS |
| Triglicéridos (mg/dl) | 138,36 (101,38) | 173,79 (103,52) | 0,08 |
| HbA1c (%) | 6,57 (0,84) | 6,42 (1,24) | 0,61 |
| Fósforo (mg/dl) | 4,51 (1,07) | 4,99 (1,48) | 0,22 |
| Calcio (mg/dl) | 9,42 (0,78) | 9,32 (0,74) | 0,18 |
| Producto calcio-fósforo | 42,28 (9,27) | 45,77 (13,36) | 0,44 |
| Albúmina (g/dl) | 4,29 (0,31) | 4,04 (0,46) | 0,018 |
| PCR (mg/l) | 6,17 (4,29) | 16,58 (29,36) | NS |
| PTH | 275,4 (207,6) | 318,89 (386,39) | NS |
| Creatinina (mg/dl) | 5,17 (3,56) | 7,79 (3,66) | 0,007 |
| Urea (mg/dl) | 138,92 (49,09) | 155,17 (49,39) | 0,23 |
| Hemodiálisis (meses) | 58,71 (77,65) | 45,31 (64,0) | NS |
| Evento cardiológico previo, n (%) | 4 (11,8) | 30 (88,2) | 0,01b |
| Hipertensión arterial, n (%) | 26 (28,6) | 65 (71,4) | NSb |
| Diabetes mellitus tipo 2, n (%) | 3 (11,5) | 23 (88,5) | 0,026 |
Todos los valores están expresados en su media (desviación estándar), salvo que se especifique porcentaje de individuos.
CaC score: puntuación de calcificación arterial coronaria; HbA1c: hemoglobina glucosilada; NS: no significativo; PCR: proteína C reactiva; PTH: hormona paratiroidea; UH: unidades Hounsfield.
El EAT fue mayor en los pacientes en hemodiálisis respecto a aquellos con ERC avanzada sin tratamiento renal sustitutivo (17,98mm [5,27] vs. 13,1mm [3,98]; p<0,001). Los casos con DM tipo 2 tenían una mayor cantidad de tejido adiposo pericárdico, respecto a aquellos sin DM tipo 2; EAT (18,74mm [6,16] vs. 15,16mm [4,77]; p=0,011) y MAT (59,67mm [20,88] vs. 52,94mm [32,65]; p=0,018).
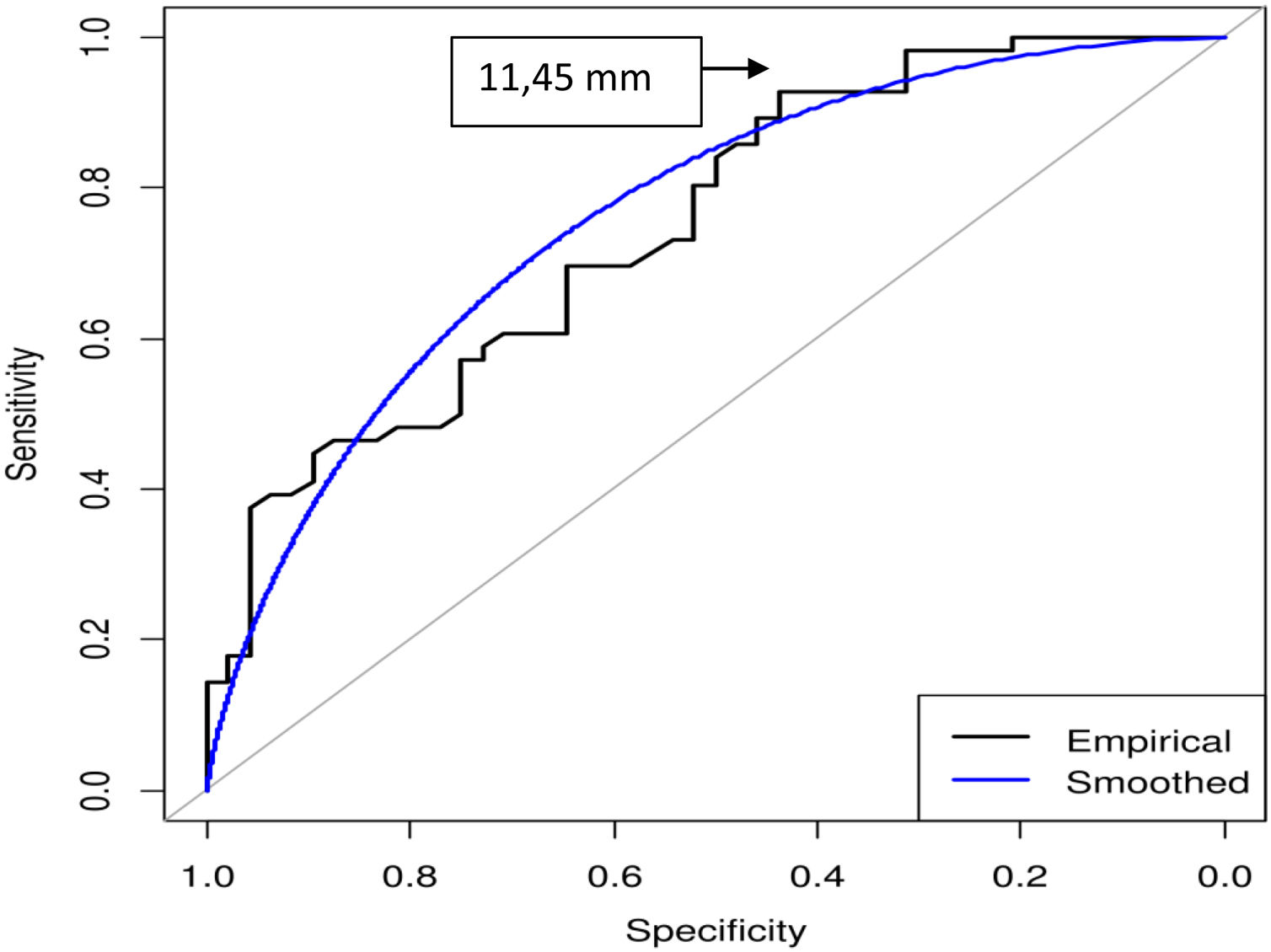
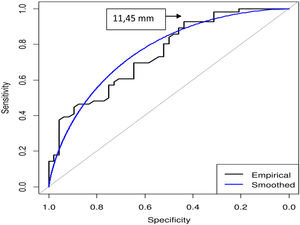
De acuerdo con el índice de Youden, el área bajo la curva (AUC) para EAT y mortalidad total fue de 0,76 (IC del 95%, 0,66-0,84); p<0,001 (fig. 1). El punto de corte de EAT para predecir mortalidad total fue 11,45mm (S 92,86%; E 43,75%; valor predictivo positivo [VPP] 65,82%; valor predictivo negativo [VPN] 84% y precisión 70,2%).
El AUC para MAT y mortalidad total fue de 0,6 (IC del 95%, 0,49-0,71); p=0,08. El punto de corte de MAT para predecir mortalidad total fue de 55,6mm (S 44,64%; E 83,33%. VPP 75,76%; VPN 56,34% y precisión 62,5%).
Se observaron diferencias estadísticamente significativas al comparar ambas curvas AUC (EAT vs. MAT) a favor de EAT (Z=2,44; p=0,015).
Los pacientes con un EAT basal > 11,45mm presentaban niveles de albúmina sérica más bajos (4,04 g/dl [0,46] vs. 4,29 [0,31]; p=0,018) y un mayor score de CaC (1.541,95 [1.837,65] vs. 371,24 [631,33]; p<0,001). También existía en este grupo una mayor prevalencia de casos con hipertensión arterial, DM tipo 2 y antecedentes de eventos cardiológicos previos. No hubo diferencias significativas en relación con la edad y el sexo entre ambos grupos.
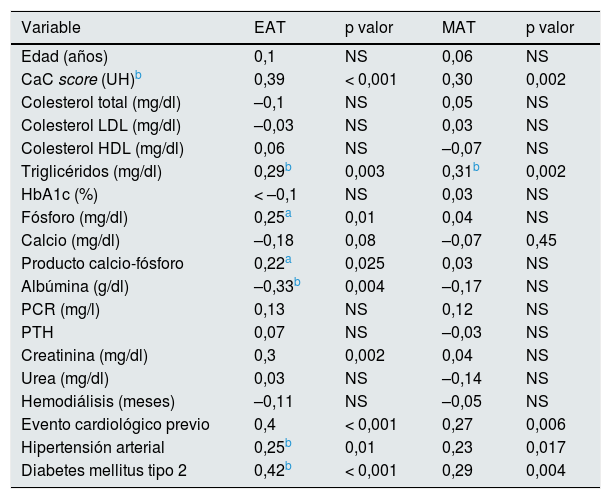
Las variables que se correlacionaron de forma positiva con el EAT fueron: el nivel sérico de triglicéridos, el fósforo y el producto fosfo-cálcico. La albúmina sérica se correlacionó de forma negativa con el EAT (tabla 2). No encontramos correlación con otros parámetros bioquímicos. Los antecedentes cardiológicos, de hipertensión arterial y de DM tipo 2 se correlacionaron de forma positiva con el tejido adiposo en los distintos territorios. No encontramos correlación significativa con la edad ni con el tiempo de permanencia previo en hemodiálisis.
Correlaciones (r) entre el tejido graso epicárdico (EAT) y el tejido graso mediastínico (MAT) con parámetros bioquímicos y clínicos, según la prueba de Spearman (rho) o la χ2 de Pearson, según estuviera indicado
| Variable | EAT | p valor | MAT | p valor |
|---|---|---|---|---|
| Edad (años) | 0,1 | NS | 0,06 | NS |
| CaC score (UH)b | 0,39 | < 0,001 | 0,30 | 0,002 |
| Colesterol total (mg/dl) | –0,1 | NS | 0,05 | NS |
| Colesterol LDL (mg/dl) | –0,03 | NS | 0,03 | NS |
| Colesterol HDL (mg/dl) | 0,06 | NS | –0,07 | NS |
| Triglicéridos (mg/dl) | 0,29b | 0,003 | 0,31b | 0,002 |
| HbA1c (%) | < –0,1 | NS | 0,03 | NS |
| Fósforo (mg/dl) | 0,25a | 0,01 | 0,04 | NS |
| Calcio (mg/dl) | –0,18 | 0,08 | –0,07 | 0,45 |
| Producto calcio-fósforo | 0,22a | 0,025 | 0,03 | NS |
| Albúmina (g/dl) | –0,33b | 0,004 | –0,17 | NS |
| PCR (mg/l) | 0,13 | NS | 0,12 | NS |
| PTH | 0,07 | NS | –0,03 | NS |
| Creatinina (mg/dl) | 0,3 | 0,002 | 0,04 | NS |
| Urea (mg/dl) | 0,03 | NS | –0,14 | NS |
| Hemodiálisis (meses) | –0,11 | NS | –0,05 | NS |
| Evento cardiológico previo | 0,4 | < 0,001 | 0,27 | 0,006 |
| Hipertensión arterial | 0,25b | 0,01 | 0,23 | 0,017 |
| Diabetes mellitus tipo 2 | 0,42b | < 0,001 | 0,29 | 0,004 |
Valores de la p anotados en las correlaciones significativas; en el resto, valor de p no significativo.
CaC score: puntuación de calcificación arterial coronaria; HbA1c: hemoglobina glucosilada; NS: no significativo; PCR: proteína C reactiva; PTH: hormona paratiroidea.
Al realizar el modelo lineal de regresión múltiple, las variables que podían predecir un mayor grosor de EAT fueron: la albúmina, el score de CaC, la creatinina, la DM tipo 2 y el evento cardiológico previo, p<0,001; R2=0,37.
Además, el tejido graso medido en distintos territorios se correlacionó de forma positiva con el score de CaC, alcanzándose una relación más significativa en el caso del EAT (fig. 2) en comparación con MAT (β=0,39, p<0,001 vs. β=0,3, p<0,002).
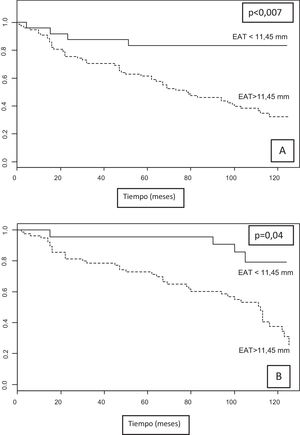
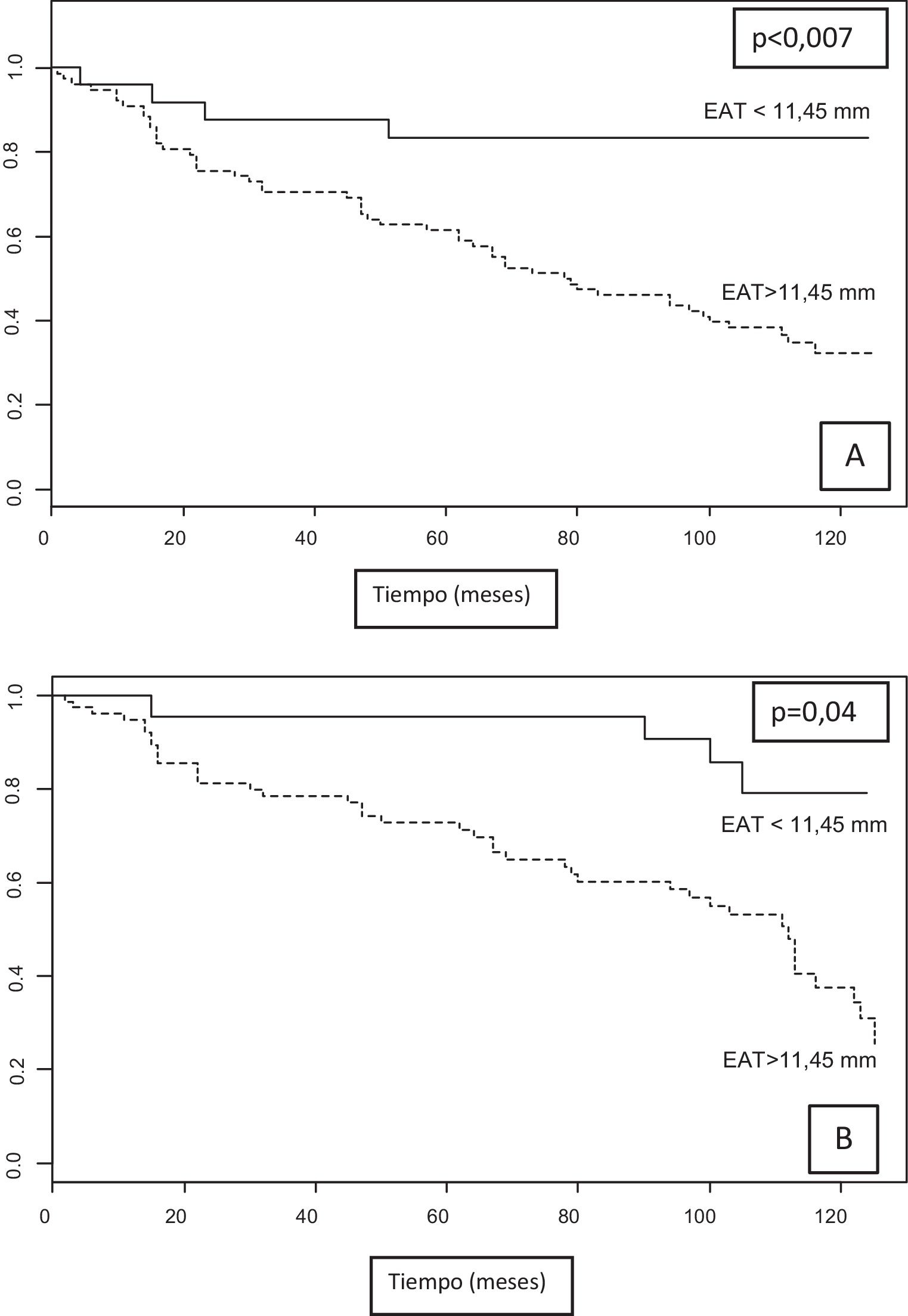
Durante un periodo de seguimiento de 112,68 (IC 95% 109,94 -115,42) meses, hubo 56 fallecidos. De estos, 48 pacientes pertenecían al grupo de mayor EAT (> 11,45mm) y 8 pacientes al de menor grasa (< 11,45mm) (χ2 12,25, p=0,001). Según el análisis de KM, los casos con un grosor de EAT > 11,45mm tenían mayor mortalidad, en comparación con aquellos con un grosor inferior.
La supervivencia media de los pacientes con EAT<11,45mm fue de 97,48 meses (IC del 95%, 81,46-113,51) vs. 76,65 meses (IC del 95%, 66,28-91,47) en aquellos con EAT>11,45mm; χ2 7,35, p=0,007 (fig. 3A).
A) Curvas de supervivencia de Kaplan-Meier. Supervivencia libre de eventos fatales según el punto de corte de 11,45mm para EAT. B) Supervivencia media libre de eventos CV no fatales y de mortalidad CV para EAT, según el punto de corte de 11,45mm.
CV: cardiovascular; EAT: tejido de grasa epicárdico.
En relación con la mortalidad por causa CV, de los 20 fallecidos, 16 pacientes tenían un grosor EAT>11,45mm. La supervivencia media para mortalidad CV fue de 109,11 meses (IC del 95%, 95,59-122,64) para aquellos con grosor EAT < 11,45mm y de 104,57 meses (IC del 95%, 94-113,8) para los de EAT>11,45mm (χ2 1,7, p=NS). Hubo un total de 53 eventos CV incidentes que causaron ingreso hospitalario (eventos no fatales); el 52,1% ocurrió en pacientes con un grosor total de EAT>11,45mm vs. 47,9% con EAT < 11,45mm (p=NS).
El análisis de KM para la variable combinada de mortalidad y evento CV fue estadísticamente significativo (χ2 4,25, p=0,039). Mientras que la supervivencia media libre de cualquier evento fue de 105,04 meses (IC del 95%, 91,1-118,97) para un grosor total de EAT<11,45mm en comparación con 88,36 meses (IC del 95%, 84,54-101,57) para un grosor de EAT>11,45mm (fig. 3B).
En el análisis de supervivencia univariado de Cox, la presencia de un grosor EAT>11,45mm se asoció con un aumento del riesgo de mortalidad global, HR 2,28 (IC del 95%, 1,03-5,04), p=0,042, y de mortalidad CV HR 3,01 (IC del 95%, 0,87-10,44), p=0,08.
Mortalidad combinada según score de CaC y EATLa relación positiva encontrada entre el score de CaC y el EAT nos llevó a explorar si ambas variables tenían potencia estadística para el grupo de pacientes que cumplieran los valores de mayor riesgo para ambas: score de CaC>400 UH y EAT>11,45mm. De este modo, y aplicando un análisis univariante de Cox, se observó un incremento de mortalidad total y CV, con valores de HR 2,11 (IC del 95%, 1,18-3,79), p=0,012, y HR 4,4 (IC del 95%, 1,09-17,8), p=0,038, respectivamente.
Así mismo, en el análisis de supervivencia, se obtuvieron valores de supervivencia media libre de eventos CV no fatales y de mortalidad CV (combinado) significativos, χ2=29,16, p<0,001, para el grupo no afectado (score de CaC<400 UH y EAT<11,45mm: 112,41 meses [IC del 95%, 103,68-121,14) en comparación con el grupo de los casos afectados (score de CaC>400 UH y EAT>11,45mm): 76,09 meses (IC del 95%, 64,22-87,95) (material suplementario, anexo, figura 1 suplementaria A).
En el caso de la mortalidad total, esta significación estadística se mantuvo (χ2=18,97 p<0,001), con supervivencias para el grupo no afectado de 96,3 meses (IC del 95%, 84,63-107,97), en comparación con la menor supervivencia del grupo afectado: 69,19 meses (IC del 95%, 57,9-80,49) (material suplementario, anexo, figura 1 sumplemtaria B).
Mortalidad, evento CV y MATEl total de pacientes fallecidos que presentaban un grosor mediastínico superior a 55,6mm alcanzó el 23,08%. Según el análisis de Kaplan-Meier, los pacientes con un grosor total de MAT>55,6mm tuvieron una mayor mortalidad que aquellos con un grosor total inferior (χ2 5,85, p=0,016) (material suplementario, anexo, (figura 2 S-A). No fue así en el caso de mortalidad y eventos CV combinados (material suplementario, anexo, figura 2 suplementaria).
DiscusiónDiversos estudios realizados en población general sugieren una asociación entre el EAT y el síndrome metabólico8,27, la resistencia a la insulina, la adiponectina28 y con parámetros bioquímicos de inflamación6,8,10.
Al igual que en otros estudios, en nuestra serie encontramos que los pacientes con DM y ERC tenían un mayor deposito graso pericárdico en todos los territorios medidos respecto a los pacientes sin DM19,29.
En el análisis univariado, objetivamos una correlación negativa entre el nivel sérico de albúmina y el grosor total de EAT. La hipoalbuminemia es un componente del complejo inflamación-malnutrición, que, a su vez, está implicado en la etiopatogenia de la enfermedad CV y en la calcificación vascular de los pacientes con ERC avanzada y en hemodiálisis, lo que podría indicar una posible asociación entre el EAT y el complejo inflamación-malnutrición en esos pacientes2,30.
Respecto al perfil lipídico, los niveles de triglicéridos podrían estar relacionados con el grosor total de EAT y MAT, no siendo así en el caso del colesterol total. Es importante destacar que en la ERC avanzada y en hemodiálisis existe un perfil lipídico diferente del de la población general. La concentración total de colesterol no es tan importante, ya que influye más su capacidad aterogénica y su densidad31.
El EAT se correlacionó de forma positiva con los niveles de fósforo, el producto fosfo-cálcico y el score de CaC. La calcificación vascular en la ERC avanzada es muy prevalente. Los principales factores patogénicos implicados son el disbalance en el metabolismo fosfo-cálcico y la inflamación crónica. La hiperfosfatemia y el producto fosfo-cálcico elevado se relacionan con un aumento de mortalidad y de la calcificación vascular en pacientes con tratamiento renal sustitutivo2,32. Por otro lado, la CaC es mayor y progresa más rápidamente en pacientes con ERC avanzada y se ha asociado en los últimos años con el desarrollo de eventos y mortalidad CV33,34.
Sin embargo, el MAT no se correlacionó con ningún parámetro bioquímico del metabolismo óseo-mineral y su asociación con el score de CaC fue menos intensa en comparación con el EAT. Este resultado apoyaría la hipótesis de que el MAT se relaciona con componentes del síndrome metabólico5,10 y que el EAT estaría implicado principalmente con el desarrollo de la aterosclerosis y la CaC16,17,28,35. Una posible explicación podría ser la proximidad del EAT con las arterias coronarias, produciéndose un efecto local paracrino inflamatorio sobre el endotelio coronario16,28.
En población general, el EAT se ha asociado con eventos coronarios fatales y no fatales4,36. La cuantificación de EAT podría ser una herramienta predictora de riesgo CV en pacientes con ERC o en hemodiálisis, pero los estudios al respecto son escasos12,20,23. En nuestra serie, aquellos pacientes con mayor grosor total de EAT y MAT tuvieron una mayor mortalidad y una menor supervivencia libre de eventos CV no fatales y mortalidad CV12,23,37. Si bien se necesitarían más estudios prospectivos para valorar si la medición del EAT añade alguna ventaja a la medición del score de CaC como factor predictor de mortalidad, riesgo CV y marcador de CAD.
Nuestro estudio tiene algunas limitaciones. Es un estudio post hoc, por lo que los resultados deben ser considerados como preliminares y no se pueden establecer relaciones causa-efecto. No disponemos de grupo control. El tamaño muestral es relativamente pequeño, por lo que la potencia estadística es limitada y no podemos descartar una asociación del EAT con otros factores de riesgo CV. Por último, nuestro estudio está realizado con pacientes prevalentes en hemodiálisis, y es bien sabido que el tiempo de permanencia en tratamiento renal sustitutivo se asocia a un aumento de mortalidad38. En este sentido, el haber podido incluir una muestra de pacientes incidentes en hemodiálisis habría podido evitar un posible sesgo de selección.
ConclusionesLa inflamación crónica y la calcificación vascular son los principales mecanismos implicados en la elevada morbimortalidad de la ERC, siendo importante la obtención de marcadores que permitan diagnosticar de forma precoz un elevado riesgo CV. La cuantificación de EAT y MAT mediante MSCT podría ser una herramienta pronostica CV adicional al score de CaC en los pacientes con ERC avanzada o hemodiálisis.
FinanciaciónEl presente estudio no ha recibido ninguna subvención, financiación o apoyo financiero. Disponibilidad de datos y materiales. Los conjuntos de datos utilizados y/o analizados durante el presente estudio están disponibles por el autor de correspondencia. Su disponibilidad para terceros se considerará según la legislación vigente, de forma anónima, y bajo solicitudes individuales de investigadores o grupos de trabajo.
Ethics approval and consent to participateThe research has been approved by the local ethics committee, from the ‘Príncipe de Asturias’ University Hospital (date 12/1/2004). All participants have signed a consent form specifically design for current study. La investigación ha sido aprobada por el comité de ética local del Hospital Universitario Príncipe de Asturias (fecha 1 de diciembre de 2004). Todos los participantes han firmado un formulario de consentimiento por escrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Conceptos clave- –
El tejido graso epicárdico es un factor de riesgo cardiovascular emergente.
- –
En población general, el tejido graso epicárdico se ha relacionado con el síndrome metabólico, la diabetes mellitus y la enfermedad arterial coronaria.
- –
El tejido graso epicárdico también podría ser un factor predictor de riesgo cardiovascular y de mortalidad en pacientes con enfermedad renal crónica avanzada.
- –
La cuantificación del tejido graso epicárdico mediante tomografía computarizada sincronizada multicorte podría ser una herramienta pronóstica adicional para estimar el riesgo cardiovascular en esta población.



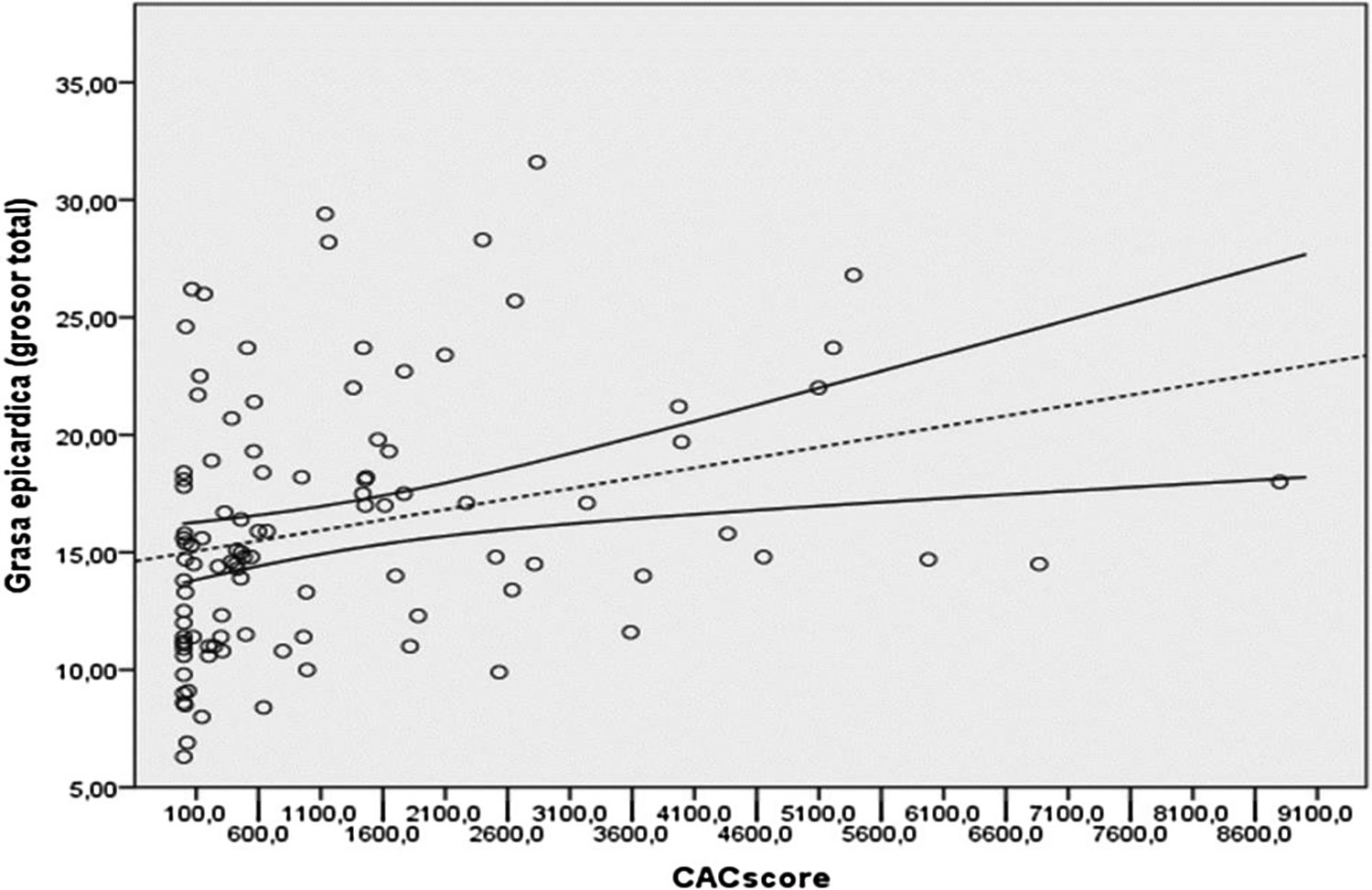
![Correlación lineal entre el EAT y el score de CaC (unidades Hounsfield [UH]), según Spearman, rho=0,39; p<0,001. CaC: calcificación arterial coronaria; EAT: tejido graso epicárdico. Correlación lineal entre el EAT y el score de CaC (unidades Hounsfield [UH]), según Spearman, rho=0,39; p<0,001. CaC: calcificación arterial coronaria; EAT: tejido graso epicárdico.](https://static.elsevier.es/multimedia/02116995/0000004100000002/v2_202105290635/S021169952030179X/v2_202105290635/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)