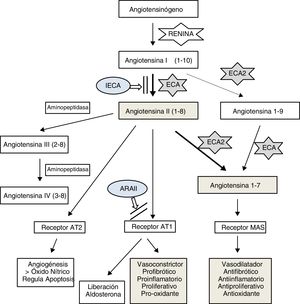
El sistema renina-angiotensina (SRA) es un conocido regulador de la función cardiovascular, implicado en la hipertensión arterial, enfermedad renal, cardíaca, arteriosclerosis, diabetes y patología pulmonar1,2.
Se ha comprobado que el virus SARS-CoV-2, como otros coronavirus, se introduce en las células pulmonares acoplándose a la enzima convertidora de angiotensina II (ECA2)3,4, que forma parte importante del SRA. Esta enzima, expresada en diversos tejidos humanos5, parece tener como función principal mantener el equilibrio entre los efectos vasoconstrictores, proinflamatorios, proliferativos, profibróticos y oxidantes de este sistema y sus antagónicos, mediante la degradación y disminución de la producción de angiotensina II y la formación de angiotensina 1-76–8 (fig. 1). Parece que la principal regulación de la ECA2 sobre la angiotensina II sería la degradación directa, puesto que se ha estimado que este efecto es 400 veces mayor que el que tiene sobre la angiotensina I9.
Esquema del sistema renina-angiotensina. ARAII: antagonista del receptor AT1; AT1: receptor 1 de angiotensina II; AT2: receptor 2 de angiotensina II; ECA: enzima convertidora de angiotensina; ECA2: enzima convertidora de angiotensina II; IECA: inhibidor de la ECA; MAS: receptor de ensamblaje mitocondrial.
En los últimos años se han publicado distintos estudios sobre los posibles efectos beneficiosos que podría tener la ECA2 a nivel cardiovascular, renal y pulmonar10–13, que se han relacionado con su efecto supresor de la angiotensina II. Imai et al.13 observaron que la angiotensina II empeoraba el distress respiratorio en distintos modelos experimentales y que esta mala evolución mejoraba con el bloqueo del receptor 1 de la angiotensina II (AT1). También observaron que la evolución era peor si se producía un descenso en la expresión de ECA2, como sucedía en las infecciones por coronavirus, argumentando que esta evolución desfavorable sería debida en parte a un descenso de la regulación de la angiotensina II por esta enzima.
En esta línea, Gurwitz14 y otros autores15,16 sugieren que los antagonistas del receptor de angiotensina II (ARAII) podrían tener un efecto beneficioso en la evolución pulmonar de la infección por SARS-CoV-2, bien directamente por su capacidad de aumentar los niveles de ECA2, contrarrestando la disminución de niveles producidos por el virus, o bien bloqueando el receptor AT1 e impidiendo así la acción de un posible exceso de angiotensina II, cuyos efectos nocivos a nivel pulmonar han sido descritos en las neumonías por los virus SARS-CoV-215 e influenza A aviar17.
En un estudio experimental en ratas, Ferrario et al.18 encuentran datos discordantes sobre el efecto del inhibidor de la ECA (IECA) lisinopril y el ARAII losartán en la expresión del mRNA del ECA2 y la actividad de esta enzima, observando que ambos aumentan la expresión del mRNA del ECA2, aunque solo el losartán, pero no el lisinopril, aumenta su actividad. Basándose en este estudio y en que los pacientes con mayor riesgo cardiovascular infectados por el virus SARS-CoV-2 parecen tener peor evolución, Sommerstein y Gräni sugieren que el tratamiento con los IECA podría tener un efecto desfavorable en estas circunstancias19. En cambio, en estudios realizados en humanos no se ha encontrado asociación entre la utilización de IECA o ARAII y los niveles de ECA220.
Se podría también interpretar, en la línea de Imai et al.13, que la peor evolución ante la infección por el virus SARS-CoV-2 de los pacientes con más riesgo cardiovascular (hipertensos, diabéticos, ancianos y aquellos con mayor morbilidad cardíaca)21 podría deberse a que tendrían unos niveles más elevados de angiotensina II y que la ECA2 estaría elevada secundariamente a ello para degradarla y reducir así sus efectos nocivos pulmonares. Otro dato que apoyaría la existencia de un exceso de angiotensina II en este proceso es el hecho de que tanto los pacientes con infección por SARS-CoV-2 como los que han sobrevivido a la infección por SARS-CoV tienen mayor incidencia de hipertensión arterial, problemas cardiovasculares y trastornos del metabolismo de la glucosa22.
En esta hipótesis, el bloqueo de la producción de angiotensina II con los IECA podría ser una alternativa para disminuir sus niveles y su potencial inflamatorio a nivel pulmonar y secundariamente la expresión de ECA2, lo que dificultaría la infectividad del virus en las primeras fases de la enfermedad y en los contactos, al disminuir los receptores disponibles para que el virus SARS-CoV-2 pueda entrar en las células. En estudios experimentales se ha observado que ratones knock-out para ECA2 no son infectados por estos virus13. Se ha propuesto también que los IECA podrían alterar en parte la estructura de la enzima por su similitud con la ECA, dificultando también así la adhesión del virus5.
Con respecto a los cuadros clínicos más severos, los datos son más contradictorios, puesto que está descrito que el descenso de la actividad de la ECA2, ocasionada por el virus, podría aumentar la lesión pulmonar, aunque en estas circunstancias el posible beneficio de la ECA2 podría deberse a que aumenta la degradación de la angiotensina II, que estaría elevada por un defecto en su regulación y un aumento de la actividad de la renina estimulado por la hipoxia. Estos cuadros, que afectan a entre un 5 y un 10% de los pacientes con infección por SARS-CoV-2, se caracterizan por una inflamación aguda devastadora con expresión pulmonar predominante (neumonías, hipoxia y distress respiratorio grave) y probablemente están relacionados con diferentes expresiones de interferón, patrones de citoquinas y otros mecanismos moleculares desconocidos, que explicarían las diferentes presentaciones clínicas, independientemente de la edad de los pacientes23.
Es interesante resaltar que hay diferencias interindividuales en la conformación de la ECA y de sus efectores acompañantes. Distintos estudios han mostrado la importancia farmacogenómica de las 3 variantes de sintetasas endoteliales de óxido nítrico (eNOS) sobre las respuestas de la inhibición de la ECA. La variabilidad genética de los genes eNOS o de los genes que contribuyen a su activación podría afectar la respuesta de los IECA. Uno de estos estudios se ha centrado en pacientes hipertensos tratados con el IECA enalapril24.
Los efectos beneficiosos de la inhibición de la ECA a nivel pulmonar se han demostrado en diversos estudios, tanto a nivel experimental —efecto antiinflamatorio del enalapril en un modelo animal de toxicidad pulmonar inducida25 y del perindopril, otro IECA, en la afectación pulmonar secundaria a sepsis26— como clínico, mediante un metaanálisis en el que se observa un efecto protector de los IECA en el riesgo de neumonías27.
El efecto clínico de los IECA y ARAII en pacientes con COVID-19, que precisan ingreso hospitalario, está siendo evaluado en un estudio en marcha en el King's College Hospital and Princess Royal University Hospital de Londres28. En sus resultados preliminares no observan una peor evolución en los pacientes tratados con IECA con respecto a los que no toman estos fármacos, e incluso apuntan a que parecen tener una evolución más favorable. Con respecto a los ARAII, todavía no han podido extraer conclusiones por el escaso número de casos analizado.
Independientemente de otras opciones terapéuticas más específicas: antivirales, bloqueo directo de la ECA2, tratamiento con ECA2 recombinante para intentar saturar la capacidad de unión del virus al mismo, vacunas y otros29,30, la opción propuesta debería ser considerada porque se trata de una terapia muy conocida, accesible y segura, si se administra de forma controlada, que podría ayudarnos a reducir la extensión y los efectos de la infección.
En una primera fase, sería necesario, como comentan otros autores13,18, analizar lo antes posible los datos epidemiológicos disponibles de los pacientes infectados, respecto a su evolución e historial de toma de fármacos antihipertensivos, pero simultáneamente sería conveniente plantear estudios prospectivos aleatorizados en las infecciones iniciales en los que una de las ramas incluya, además del tratamiento considerado más idóneo para cada caso, la asociación de un IECA, con un control clínico estricto de estos pacientes, en la línea de los ya iniciados por otros investigadores.
Es necesario continuar desarrollando la investigación encaminada a mejorar el conocimiento sobre la correlación existente entre los niveles de angiotensina II y la actividad de la ECA2 en distintos tejidos: pulmonar, cardíaco y renal, puesto que parece que el grado de actividad de los componentes del SRA puede variar entre distintos órganos y con respecto a los niveles plasmáticos. Además, deberá aclararse si el posible efecto beneficioso descrito con los niveles más altos de ECA2 se debe a una mayor degradación de la angiotensina II y aumento de angiotensina 1-7 o a una acción a través de otras vías metabólicas.
Consideramos también que es muy importante disponer lo antes posible de resultados de estudios reglados y sistematizados sobre los efectos del bloqueo de la angiotensina II u otros componentes del SRA en la infección por SARS-CoV-2, puesto que la falta de evidencia científica sobre esta cuestión está haciendo que prolifere una gran cantidad de literatura científica con opiniones muy dispares sobre los posibles efectos de los fármacos que interfieren con este sistema, basadas solo en estudios experimentales con muchas limitaciones, como algunos de los ya referidos, y en interpretaciones subjetivas31,32; llegando incluso a proponerse formalmente, creemos que de forma precipitada, actuaciones contrarias al posicionamiento de las sociedades científicas y la Agencia Europea del Medicamento sobre la utilización de estos medicamentos en caso de afectación por COVID-1933.
Conflicto de interesesNinguno.
A la Dr. Sara Lamas-Alvarez por sus interesantes sugerencias y aportaciones para mejorar la redacción y comprensión del manuscrito.