Varón caucásico de 28 años diagnosticado a la edad de 4 meses de una pielonefritis crónica secundaria a reflujo vesicoureteral que requirió tratamiento con hemodiálisis. El paciente fue trasplantado hace 15 años mediante trasplante de donante cadáver previa administración de corticosteroides, micofenolato mofetil, tacrolimus y basiliximab como terapia de inducción inmunosupresora y posteriormente de mantenimiento suprimiendo únicamente el basiliximab. La función del injerto inmediatamente después del trasplante fue adecuada y no se detectó presencia de proteinuria. Un mes después del trasplante desarrolló una diabetes mellitus con requerimiento de insulina. La inmunosupresión se cambió de tacrolimus a ciclosporina A.
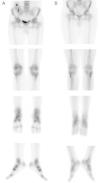
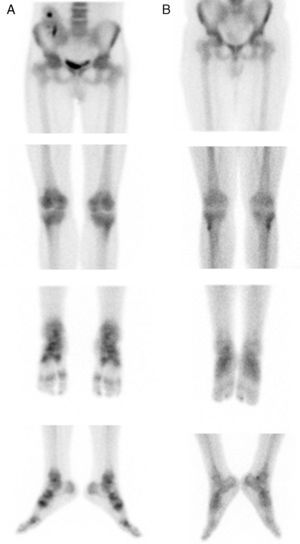
Siete años después, el paciente desarrolló una anemia normocrómica normocítica con cifras de hemoglobina de 9,2mg/dl y hematocrito del 28%. Se inició tratamiento con epoetina beta subcutánea con 10.000UI una vez por semana. Tres meses después, acudió a la consulta por presentar dolores graves bilaterales y asimétricos en tobillos y rodillas con dificultad para la deambulación. No se identificaron antecedentes de traumatismo. El examen clínico reveló signos inflamatorios de tejidos blandos periarticulares en extremidades inferiores. La electromiografía no mostró signos de neuropatía periférica que se pudiese explicar por la diabetes. Las pruebas de laboratorio fueron: creatinina sérica 1,5mg/dl, urea 72mg/dl, proteínas en orina de 24h 854mg, calcio total 9,5mg/dl (niveles de referencia [NR]: 8,5-10,5), fosfato 4,5mg/dl (NR: 2,3-4,3), PTH 95pg/ml (NR: 15-65), fosfatasa alcalina 127 U/l (NR: 90-290), proteína C reactiva 0,1mg (NR:<0,8mg/dl), ácido úrico 7,8mg/dl (NR: 1,9-7,4mg/dl), HbA1c sérico 6,6% (NR: 3,4-5,5%) y ciclosporina A pre-dosis 111ng/ml. La gammagrafía ósea reveló un aumento de la captación de estructuras óseas de forma generalizada sugestivo de la existencia de un patrón metabólico en relación con su hiperparatiroidismo. Además, destacaba una evidente hipercaptación bilateral simétrica de las estructuras osteoarticulares de las caderas, rodillas, tobillos y pies, siendo compatibles con un SDRC que confirmaba la sospecha clínica (fig. 1A).
Los síntomas se resolvieron progresivamente después de la retirada de la epoetina, hasta alcanzar una mejoría completa. Se realizó una gammagrafía ósea de control visualizando una normalización de las alteraciones previamente observadas en las extremidades inferiores (fig. 1B). El rastreo de cuerpo completo seguía mostrando un patrón de captación típico de los pacientes con hiperparatiroidismo, como en este caso (fig. 2).
El SDRC se caracteriza por la presencia de dolor desproporcionado en tiempo o grado con respecto a cualquier trauma u otra lesión conocida, unido a calor e inflamación, en combinación con anomalías sensoriales, autonómicas, tróficas, seudomotoras y vasomotoras. Para realizar el diagnóstico correcto debe aparecer un evento nocivo iniciador o una causa de inmovilización1. En este paciente, el evento inicial fue la inyección subcutánea de EPO. La gammagrafía ósea fue compatible con un SDRC, siendo estos hallazgos claves para la confirmación diagnóstica. Finalmente, la significativa mejoría clínica del paciente tras la retirada de la medicación con EPO sin realizar ninguna otra intervención terapéutica sugiere que se trataba de un SDRC asociado a esta terapia.
La EPO es una glicoproteína que es producida principalmente por fibroblastos intersticiales en la corteza renal peritubular. Los pacientes con enfermedad renal crónica avanzada acaban desarrollando una anemia normocrómica normocítica debido a la síntesis endógena alterada de EPO. Además, la anemia en pacientes con nefropatía diabética suele aparecer de forma muy temprana. La EPO y sus derivados se han usado ampliamente para el tratamiento de la anemia en la enfermedad renal crónica y sus efectos cardioprotectores y neuroprotectores son bien conocidos2,3. Además se ha descrito que la administración de EPO puede proteger contra el desarrollo de la disfunción sensitiva y autonómica del nervio periférico resultante de la diabetes4. En este caso, el paciente era diabético sin polineuropatía conocida y desarrolló un SDRC tras la administración de EPO subcutánea.
Actualmente se ha descrito la aparición de SDRC asociado a fármacos, como los inhibidores de la calcineurina y el sirolimus en los receptores de trasplante, la isoniazida y el fenitoína o fenobarbital5–7. No obstante, no se ha descrito hasta el momento el desarrollo de un SDRC asociado a la terapia con EPO. En este caso, el paciente estaba bajo tratamiento con ciclosporina desde hacía años y aunque no hay una relación temporal entre el inicio de la administración ciclosporina y la aparición del SDRC para explicar los síntomas, sí que podría tratarse de un factor predisponente para desarrollar este síndrome.
En conclusión, este caso muestra la posible relación entre la administración de EPO y la aparición de un SDRC, puesto que la retirada de este tratamiento determinó la resolución clínica completa del paciente. Este caso constituye la primera descripción de un SDRC secundario a la administración de EPO, aunque sería recomendable estudios adicionales que apoyen esta asociación.