La epidemiología de la diabetes mellitus (DM) ha cambiado en los últimos años. La DM ha supuesto una creciente epidemia en las últimas décadas, dando veracidad a las predicciones del World Health Report de 1997 que estimaban un crecimiento progresivo de la enfermedad en los siguientes 20 años1. En 2012, la prevalencia de diabetes en EE. UU. era de un 14% (un 9% de los casos con diagnóstico conocido), pero como dato especialmente destacable y alarmante, existía un 38% de población en situación de prediabetes2. De continuar esta tendencia, uno de cada 3 adultos en EE. UU. será diabético en 20503. El incremento de la prevalencia de DM se ha producido especialmente a expensas de la DM tipo 2 (DM2), debido a cambios en el estilo de vida y a un aumento de la obesidad4. En EE. UU., el coste de la DM en 2012 ascendió a 245.000 millones de dólares, incluyendo la repercusión derivada de la falta de productividad del paciente con complicaciones. Afortunadamente, si bien entre 1990 y 2010 la población diabética en EE. UU. creció un 27%, el porcentaje de complicaciones ligadas a la DM descendió: amputaciones, del 22,6 al 18,8%; insuficiencia renal crónica terminal, del 13,7 al 6,1%; infarto de miocardio, del 3,8 al 1,8%; e ictus, del 3,1 al 1,5%5, probablemente por un mejor diagnóstico y cuidado tanto de la DM como de sus complicaciones.
La globalización de la DM es un problema de salud mundial, con incrementos en la incidencia y la prevalencia que incluyen variantes como la diabetes gestacional y la DM tipo MODY (maturity Onset Diabetes of the Young), es decir, diabetes de la edad madura que se presenta en el joven6,7. En España, el estudio Di@bet.es, realizado en 100 centros con una distribución geográfica amplia, encontró algún trastorno del metabolismo hidrocarbonado en cerca del 30% de la población estudiada8. La prevalencia de DM, ajustada por edad y sexo, fue del 13,8% (IC 95% 12,8-14,7%), existiendo un 6% (IC 95% 5,4-6,7%) de la población que desconocía que era diabética. La repercusión socioeconómica de la DM y sus complicaciones en nuestro país es importante, con un coste global estimado de 2.132€/paciente-año en presencia de complicaciones micro y macrovasculares9. Una reducción de la enfermedad renal crónica (ERC) estadio 5 podría suponer un ahorro de entre 15 y 25 millones de euros en 3 años en Canarias10.
La presencia de albuminuria por encima de los valores considerados como normales y la progresión hacia proteinuria han sido las formas más comunes de expresión clínica de la nefropatía. Sin embargo, en los últimos años se describe con frecuencia creciente la progresión hacia la insuficiencia renal sin desarrollar proteinuria11, lo que ha llevado a postular la existencia de un «fenotipo no proteinúrico»12. Tervaert et al.13 propusieron en 2010 una nueva clasificación histopatológica de las lesiones renales en la DM, insistiendo en el hallazgo de lesiones tubulointersticiales y/o vasculares en ausencia de lesiones glomerulares como forma inicial de afectación renal. Todo ello conduce a un cambio desde el concepto clásico de nefropatía diabética hacia un concepto más genérico de «enfermedad renal diabética» (ERD)4.
Prevención de la enfermedad renal diabética y de la enfermedad cardiovascular en la diabetes mellitusLos estándares actuales de las guías de práctica clínica y de los documentos para la prevención y el manejo de la DM y de la ERD incluyen diversos elementos: el control adecuado de la hiperglucemia y de la presión arterial, la intervención sobre factores de riesgo renal y cardiovascular (CV), un estilo de vida saludable con ejercicio apropiado a la situación de cada paciente, una dieta adecuada en relación con la ingesta de sodio y proteínas, adecuación de hidratos de carbono, abandono del hábito tabáquico, vigilancia lipídica, tratamiento con inhibidores del sistema renina-angiotensina-aldosterona, adecuación de fármacos hipoglucemiantes a la función renal de cada paciente a lo largo de la evolución de la ERD y control coordinado multifactorial y multidisciplinar para evitar la progresión del daño micro y macrovascular14–21.
A pesar de todas estas recomendaciones y estrategias, la ERD sigue siendo la primera causa de ERC avanzada que requerirá tratamiento sustitutivo renal (TSR).
La necesidad de frenar la progresión del daño micro y macrovascular en la DM ha llevado en los últimos años a la realización de estudios multicéntricos incluyendo objetivos vasculares y renales y a la búsqueda de nuevos agentes que han sido estudiados en numerosos ensayos clínicos, así como a la utilización de terapias específicas para intentar frenar la progresión del daño vascular y renal.
Son numerosos los estudios experimentales que después han intentado ser trasladados a la clínica, pero pocos han logrado demostrar un impacto positivo en el manejo cotidiano de la DM y de sus complicaciones.
Nuevos agentes hipoglucemiantes: efectos pleiotrópicos más allá del control glucémicoPese a la pléyade de estudios con nuevos fármacos y la efectividad demostrada por muchos de ellos, sabemos que el control de la glucemia, de la presión arterial y de la proteinuria no es suficiente en muchos de nuestros pacientes con DM y que, a pesar de la administración de los tratamientos descritos previamente, la aparición de ERD o la progresión de la misma no puede ser evitada, frenada o revertida.
Y por ello, la industria farmacéutica y los investigadores tratan continuamente de buscar nuevas alternativas, de tal manera que la investigación de nuevas moléculas es uno de los campos de desarrollo más intensos en los últimos años, como demuestra el creciente número de ensayos clínicos y estudios. Actualmente hay cerca de 40 estudios con nuevas moléculas (www.clinicaltrials.gov). Dado que el análisis de estas nuevas moléculas excedería con mucho la extensión del presente trabajo y los límites aceptados por la revista, nos centraremos en revisar los fármacos más recientes en el manejo de la hiperglucemia y sus efectos ligados a la acción hipoglucemiante o independientes de ella.
- 1.
Algunos agentes hipoglucemiantes han mostrado efectos renoprotectores, independientemente de su acción sobre la glucosa (tablas 1 y 2). Numerosos estudios con agentes agonistas del receptor activado por proliferadores de los perixosomas gamma o tiazolidinendionas han mostrado ser capaces de inducir una disminución de la albuminuria22,23. El análisis post-hoc del estudio PROACTIVE (Prospective Pioglitazone Clinical Trail in Macrovascular Events), que incluyó 5.238 pacientes con DM2 y enfermedad macrovascular, mostró una mayor reducción del filtrado glomerular (FG) en el grupo tratado con pioglitazona que con placebo (diferencia entre grupos 0,8mL/min/1,73m2)24. Un metaanálisis que incluía 15 estudios con tiazolidinendionas (10 con pioglitazona y 10 con rosiglitazona) y un total de 2.860 pacientes encontró reducciones significativas de la albuminuria. Sin embargo, los efectos nocivos CV (aumento en la retención hidrosalina) han limitado el uso de dichos agentes25.
Tabla 1.Algunos estudios piloto y estudios multicéntricos recientes analizados
Estudio/autores/año Moléculas Objetivos Resultados PROACTIVE/Schneider et al.24/2008 Pioglitazona Eventos CV Pacientes con ERC+pioglitazona tuvieron menor riesgo (RR 0,66) de alcanzar objetivo secundario Sarafidis et al.25/2010 Tiazolididendionas Eventos CV, proteinuria Reducción microalbuminuria y proteinuria con tiazolididendionas Hoffmann-La Roche/2013 Aleglitazar
PPAR alfa/gammaEventos CV Suspendido por efectos adversos CV Cooper et al.27/2015 Linagliptina pooled analysis Proteinuria Reducción de 16% albuminuria/creatinina orina RR 16% (HR 0,84) MARLINA/Groop et al.28/2015 Linagliptina Proteinuria Reducción de albuminuria/creatinina orina en 11% de respondedores Tani et al.31/2013 Vildagliptina Proteinuria, FG Reducción cociente albuminuria/creatinina orina 44,6% SAVOR-TIMI/Mosenzon et al.30/2017 Saxagliptina Eventos CV, proteinuria Redución cociente albuminuria/creatinina orina (un año, p<0,0001; 2 años p=0,0143 y final p=0,0158) Fujita et al.32/2014 Alogliptina Proteinuria, FG Reducción cociente albuminuria/creatinina orina en 12 pacientes CARMELINA33/2015 Linagliptina Eventos CV, proteinuria, FG En realización SUSTAIN-6/Marso et al.34/2016 Semaglutida Reducción nefropatía de novo o deterioro de nefropatía previa LEADER/Mann et al.36/2017 Liraglutida Eventos CV Reducción eventos renales (RR 0,78; p=0,003) EMPA-REG/Zinman et al.38/2015 Empagloflozina Eventos CV Reducción muerte CV (38%), hospitalización insuficiencia cardiaca (35%) y muerte global (32%) EMPA-REG Renal/Wanner et al.39/2016 Empagloflozina Proteinuria, FG Reducción empeoramiento nefropatía (12,7%), duplicación creatinina sérica (44%), TSR 55% CANVAS/Neal et al.41/2017 Canagliflozina Eventos CV, proteinuria, FG Reducción progresión albuminuria (RR 0,73) y objetivo 1 y combinado TSR/muerte 40%. Aumento riesgo amputaciones (RR 1,9) CREDENCE/Rizvi et al.43/2016 Canagliflozina Eventos CV y renales En realización Kohan et al.44/2014 Dapagliflozina Proteinuria, FG No diferencias en FG con dosis 2,5, 5 y 10mg/d vs. placebo. Efectos adversos renales similares a placebo CVD-REAL Nordic/Persson et al.45/2018 Dapagliflozina Eventos CV Reducción eventos CV (RR 0,79), insuficiencia cardiaca (RR 0,62) o muerte (RR 0,44) DECLARE-TIMI58 Group/2013 Eventos CV, mortalidad Dapagliflozina En realización CV: cardiovascular; ERC: enfermedad renal crónica; FG: filtrado glomerular; HR: hazard ratio; PPAR: receptores activados por proliferadores de perixosomas; RR: riesgo relativo; TSR: tratamiento sustitutivo renal.
Tabla 2.Morbimortalidad cardiovascular y eventos renales con algunos nuevos agentes hipoglucemiantes
Morbimortalidad con nuevos antidiabéticos MACE Mortalidad CV SAVOR Saxagliptina EXAMINE Alogliptina TECOS Sitagliptina ELIXA Lixisenatida LEADER Liraglutida ↓ RR 13% ↓ RR 22% SUSTAIN-6 Semaglutida ↓ RR 26% EMPA-REG Empagliflozina ↓ RR 14% ↓ RR 38% Eventos renales con nuevos antidiabéticos Progresión MAB Duplicación creatinina sérica Inicio TSR LEADER ↓ RR 22% SUSTAIN-6a ↓ RR 14% EMPA-REG ↓ RR 14% ↓ RR 14% ↓ RR 14% CV: cardiovascular; MAB: microalbuminuria; MACE: episodio cardiovascular mayor; RR: riesgo relativo; TSR: tratamiento sustitutivo renal.
Aleglitazar es un agente con doble efecto PPAR α y δ, con efectos antiinflamatorios, que además mejora el perfil lipídico y la glucemia. El ensayo clínico que pretendía mostrar dichos efectos, así como una posible reducción de la proteinuria, se suspendió prematuramente debido también a los efectos adversos CV, similares a los mostrados en estudios anteriores por las tiazolidinendionas26.
- 2.
La introducción de los inhibidores de dipeptidil-peptidasa 4 (iDPP-4) ha supuesto una revolución en el manejo de la hiperglucemia en la DM, por el efecto «incretina» de estos fármacos. DPP-4 es el enzima que regula la degradación del glucagon-like peptide 1 (GLP-1, «péptido similar al glucagón tipo 1»), una incretina liberada en el intestino en respuesta a la ingesta para estimular a la insulina y suprimir la producción de glucagón. Numerosos estudios han intentado mostrar los efectos beneficiosos vasculares y renales de dichos agentes hipoglucemiantes (vildagliptina, sitagliptina, saxagliptina, alogliptina, linagliptina y teneligliptina). No es el objetivo de esta exposición analizar los muy variables resultados y solamente nos referiremos a algunos de ellos.
Un análisis conjunto de 4 estudios en fase 3 que incluían 217 pacientes con DM2 y nefropatía diabética, tratados previamente con bloqueadores del sistema renina-angiotensina-aldosterona, mostró efectos beneficiosos de linagliptina (único iDPP-4 junto con teneligliptina que no requiere ajuste de dosis en la insuficiencia renal), reduciendo en un 32% la proteinuria, independientemente del efecto sobre la HbA1c27.
Posteriormente, el estudio MARLINA (Microalbuminuria and Renal Efficacy with Linagliptin)28 ha intentado mostrar la eficacia con dosis única de 5mg/día de linagliptina en pacientes con DM2 y nefropatía. Linagliptina fue solo capaz de frenar la albuminuria en el grupo de pacientes llamados «respondedores» (11,5% de los pacientes), pero no en el global de los pacientes tratados con el fármaco29.
El estudio SAVOR-TIMI, en el que se incluyeron 16.493 pacientes con DM2, mostró reducción de la albuminuria solo en un 11,8% de los pacientes que recibieron saxagliptina y de los que había disponibilidad de datos del cociente albúmina/creatinina en orina30. El estudio de Tani et al.31 con vildagliptina mostró reducción significativa de la albuminuria en pacientes con DM2, pero solo incluía 47 pacientes. El estudio de Fujita et al., con un diseño cruzado de sitagliptina/alogliptina, mostró una reducción de la albuminuria en el grupo tratado con alogliptina, pero solo incluía 12 pacientes32.
Hay en realización diversos estudios sobre los efectos CV y renales de los iDPP-4. Los posibles beneficios en protección vascular y renal en pacientes con DM2, nefropatía y elevado riesgo CV están siendo evaluados en el estudio CARMELINA, con linagliptina33. El ensayo clínico ha finalizado el seguimiento y se esperan los resultados no antes de octubre de 2018.
- 3.
La introducción de otros fármacos con efecto incretina, los agonistas del receptor del GLP-1 (exenatida, liraglutida, lixisenatida, albiglutida, semaglutida, dulaglitida y otros), ha supuesto también un cambio importante en las posibilidades del manejo de la hiperglucemia. También numerosos estudios están en marcha para evaluar los posibles beneficios vasculares y renales de estos fármacos.
El estudio SUSTAIN 6 (Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes) ha incluido 3.297 pacientes con DM2, aleatorizados para recibir tratamiento estándar o semaglutida 0,5 o 1mg/semana subcutáneo, durante 104 semanas. De los 1.649 tratados con semaglutida, 108 (6,6%) alcanzaron el objetivo primario compuesto (muerte CV: infarto de miocardio no fatal, accidente cerebrovascular no fatal), por 146 de 1.649 incluidos en el grupo estándar (8,9%), RR 0,74, p<0,001. Los autores concluyeron que semaglutida disminuyó significativamente el riesgo CV en pacientes con DM2 y elevado riesgo CV. El estudio mostró también que el porcentaje de empeoramiento de la nefropatía preexistente fue menor en el grupo de pacientes tratado con semaglutida34,35.
Se acaban de publicar los resultados del estudio LEADER (Liraglutide and Renal Outcomes in type 2 DM). En dicho estudio se han aleatorizado 9.340 pacientes, que recibieron liraglutida en dosis subcutánea semanal vs. placebo, añadido a tratamiento convencional, con un seguimiento de 3,84 años. El número de eventos observados del objetivo combinado renal fue menor en el grupo tratado con liraglutida que en el grupo placebo (268 de 4.668 pacientes vs. 337 de 4.672; RR 0,78; p=0,003). Se detectó proteinuria persistente en un menor número de pacientes que recibieron liraglutida (161 vs. 215 pacientes, RR 0,74, p=0,004). Estos resultados muestran un menor porcentaje de desarrollo y progresión del daño renal en pacientes con DM2 tratados con liraglutida añadida al tratamiento convencional36.
Más recientemente se han publicado los resultados del estudio EXSCEL (Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes). En dicho estudio se aleatorizaron 14.752 pacientes con DM2 para recibir exenatida de liberación prolongada, 2mg en inyección subcutánea semanal, vs. placebo, añadidos a tratamiento convencional. El seguimiento medio fue de 3,2 años. Un 11,4% de los pacientes (n=839) alcanzaron un objetivo principal compuesto de muerte de causa CV, infarto de miocardio no fatal o accidente cerebrovascular no fatal vs. 12,2% (905 pacientes) en el grupo placebo (RR 0,91, p<0,001 para no inferioridad) 37.
Tratamiento con inhibidores del cotransportador sodio-glucosa tipo 2Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) constituyen una de las novedades terapéuticas más prometedoras en el manejo de la DM introducidas recientemente.
Los diversos receptores SLGT están distribuidos de forma amplia pero con variaciones entre los diversos órganos, estando los SGLT2 principalmente localizados en el riñón. A nivel renal, a través de los túbulos, se reabsorbe prácticamente la totalidad de la glucosa filtrada a nivel glomerular. Los iSGLT2 actúan en los túbulos proximales renales impidiendo la reabsorción tubular de glucosa y favoreciendo la eliminación de la misma por la orina.
En el momento actual disponemos de la posibilidad de utilizar canagliflozina, dapagliflozina y empagliflozina, aunque otros iSGLT2 están en desarrollo (tabla 3).
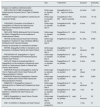
Ensayos clínicos y estudios con inhibidores del cotransportador sodio-glucosa tipo 2 en realización
| Tipo | Tratamiento | Duración | Pacientes, n | |
|---|---|---|---|---|
| Ensayos con objetivos cardiovasculares | ||||
| EMPA-REG OUTCOME (Empagliflozin Cardiovascular Outcome Event in Type 2 Diabetes Mellitus) | Doble ciego vs. placebo fase 3 | Empagliflozina 10 o 25mg/d vs. Placebo | 4,6 años | 7.020 |
| CANVAS Program (Canagliflozin Cardiovascular Asessment Study) | Doble ciego vs. placebo fase 3 | Canagliflozina 100 o 300mg/d vs. placebo | 3,6 años | 10.142 |
| CREDENCE (Evaluation of the Effects of Canagliflozin on Renal and Cardiovascular Outcomes in Participants with Diabetic Nephropathy) | Doble ciego vs. placebo fase 3 | Canagliflozina100mg/d vs. placebo | 4 años | 3.627 |
| DECLARE-TIMI 58 (MulticenterTrial to Evaluate the Effect of Dapagliflozin on the Incidence of Cardiovascular Events) | Doble ciego vs. placebo fase 3 | Dapagliflozina 10mg/d vs. placebo | 6 años | 17.276 |
| VERTIS (Cardiovascular Outcomes Following Ertugliflozin Treatment in Type 2 Diabetes Mellitus Participants with Vascular Disease) | Doble ciego vs. placebo fase 3 | Ertugliflozina vs. placebo | 6,1 años | 8.000 |
| Ensayos en pacientes con insuficiencia cardiaca | ||||
| DEFINE (Dapagliflozin Effect on Symptoms and Biomarkers in Diabetes Patients with Heart Failure) | Doble ciego vs. placebo fase 4 | Dapagliflozina 10mg/d vs. placebo | 12 semanas | 250 |
| PRESERVED HF (Dapagliflozin in Type 2 Diabetes or Prediabetes and Preserved Ejection Fraction Heart Failure) | Doble ciego vs. placebo fase 4 | Dapagliflozina 10mg/d vs. placebo | 12 semanas | 320 |
| DAPA-HF (Study to Evaluate the Effect of Dapagliflozin on the Incidence of Worsening Heart Failure or Cardiovascular Death in Patients with Chronic Heart Failure) | Doble ciego vs. placebo fase 3 | Dapagliflozina 10mg/d vs. placebo | 3 años | 4.500 |
| EMPEROR-Preserved (Empagliflozin Outcome Trial in Patients with Chronic Heart Failure with Preserved Ejection Fraction) | Doble ciego vs. placebo fase 3 | Empagliflozina 10mg/d vs. placebo | 38 meses | 4.126 |
| EMPEROR-Reduced (Empagliflozin Outcome Trial in Patients with Chronic Heart Failure with Reduced Ejection Fraction) | Doble ciego vs. placebo fase 3 | Empagliflozina 10mg/d vs. placebo | 38 m | 2.850 |
| EMBRACE-F (Empagliflozin Impact on Hemodynamics in Patients with Diabetes and Heart Failure) | Doble ciego vs. placebo fase 4 | Empagliflozina 10mg/d vs. placebo | 12 semanas | 60 |
| REFORM (Study and Effectiveness of SGLT-2 Inhibitors in Patients with Heart Failure and Diabetes) | Doble ciego vs. placebo fase 4 | Dapagliflozina 10mg/d vs. placebo | 1 año | 56 |
| EMPA (Empagliflozin in Heart Failure: Diuretic and Cardio-Renal Effects) | Doble ciego vs. placebo fase 2 | Empagliflozina 10mg/d vs. placebo | 2 semanas | 50 |
| SGLT-2 (Inhibition in Diabetes and Heart Failure) | Cohorte prospectiva | iSGLT2 | 1 mes | 31 |
iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2.
Modificada de Lytvyn et al.47.
El estudio EMPA-REG37 incluyó 7.028 pacientes con DM2, de los que 2.345 recibieron empagliflozina 10mg/día, 2.348 recibieron empagliflozina 25mg/día y 2.333 constituyeron el grupo placebo. La variable principal fue un combinado de muerte de causa CV, infarto de miocardio no mortal y accidente cerebrovascular no mortal. La variable secundaria fue un compuesto de la variable principal más hospitalización.
El estudio mostró una disminución significativa de episodios en el análisis conjunto de empagliflozina (490 en 4.687 pacientes, 10,5%) frente a placebo (282 en 2.333, 12,1%), RR 0,86, p<0,001 para no inferioridad y p=0,04 para superioridad. Cuando se analizaron los 2 grupos de 10 y 25mg por separado, no existieron diferencias significativas, siendo la RR de 0,85 para el grupo tratado con 10mg/día y de 0,86 para el grupo de 25mg/día.
El objetivo secundario se alcanzó en 599 de 4.687 pacientes (12,8%) en el grupo conjunto de empagliflozina y en 333 de 2.333 pacientes (14,3%) en el grupo placebo, RR 0,62, p<0,001. Tras la publicación de los resultados del estudio EMPA-REG, se analizaron los resultados del estudio EMPA-REG Renal38, focalizados sobre los efectos renales del tratamiento con empagliflozina a dosis de 10 o 25mg/día en los 7.028 pacientes con DM2 y grados diversos de enfermedad renal. Los resultados finales han mostrado que empagliflozina, tanto a dosis de 10 como de 25mg/día, se asoció a una reducción significativa de los objetivos renales: progresión de micro a macroalbuminuria (proteinuria), reducción del riesgo de un objetivo compuesto de duplicación de creatinina sérica-inicio de TSR-muerte del paciente. Los resultados del estudio evidencian efectos beneficiosos CV más allá de la propia acción sobre la hiperglucemia, y esperamos resultados de nuevos estudios en marcha para corroborar si ese efecto es «de clase» y se produce con otros iSLGT2, o es más específico de empagliflozina.
Con posterioridad se han dado a conocer los resultados de los efectos de empagliflozina en el mismo estudio EMPA-REG referidos a los pacientes con enfermedad CV establecida y ERC (FG<60mL/min/1,73m2). Dichos resultados han mostrado una disminución del RR de mortalidad (0,71) del 29% para todas las categorías de FG y de excreción urinaria de albúmina, incluidos los pacientes con FG<60mL/min/1,73m239,40.
Muy recientemente hemos conocido los resultados del programa CANVAS con canagliflozina. El programa CANVAS integra los datos de 2 ensayos clínicos que han incluido 10.142 pacientes con DM2 y elevado riesgo CV. Los participantes en cada estudio fueron aleatorizados para recibir tratamiento con canagliflozina 100 o 300mg/día por vía oral, o placebo. El seguimiento medio fue de 188,2 semanas. El objetivo principal fue un compuesto de muerte CV, infarto de miocardio no fatal o accidente cerebrovascular no fatal. La edad media de los paciente fue de 63,3 años y la duración media de la DM fue de 13,5 años. El 65,6% de los pacientes tenían historia previa de enfermedad CV. El objetivo principal se alcanzó en 26,9 vs. 31,5 de participantes por 1.000 pacientes-año, RR 0,86, p<0,001 para no inferioridad, p=0,02 para superioridad. Los resultados renales no mostraron significación estadística, pero sí un posible beneficio de canagliflozina sobre la progresión de la albuminuria (RR 0,73) y la reducción del 40% en un objetivo compuesto de FG-necesidad de TSR-muerte de causa renal (RR 0,60; IC 95% 0,47 a 0,77). Desafortunadamente, los resultados mostraron también un incremento en el riesgo de amputaciones distales (6,3 vs. 3,4 participantes por 1.000 pacientes-año, RR 1,97, IC 95% 1,41 a 2,75). No obstante, falta información para poder explicar la causa de dicho hallazgo, aunque en el análisis multivariante los factores de riesgo para presentar amputaciones fueron el antecedente de amputaciones previas (HR 20,9 [14,2-30,8]), enfermedad vascular periférica (HR 3,1 [2,2-4,5]), sexo varón (HR 2,4 [1,6-3,5]), neuropatía autonómica (HR 2,1 [1,4-2,6]), HbA1c>8% (HR 1,9 [1,4-2,6]), tratamiento con canagliflozina (HR 1,8 [1,3-2,5]) y presencia de enfermedad CV (HR 1,5 [1,0-2,3]).
Los autores han concluido que canagliflozina disminuye el riesgo de episodios CV, aunque con un mayor riesgo de amputaciones distales41. Está pendiente la publicación de los efectos renales y CV a largo plazo42,43 del estudio CREDENCE (A Randomized, Double-blind, Placebo-controlled, Parallel-group, Two-arm, Multicenter Study to Assess the Efficacy of Canagliflozin on End Stage Kidney Disease and Vascular Death in Subjects with Type 2 Diabetes Mellitus and Nephropathy). Este estudio es el primer ensayo con iSGLT2 que incluye un end-point primario renal (inicio de TSR, duplicación de la creatinina sérica y muerte renal o CV). Incluye pacientes con albuminuria>300mg/g y FG estimado entre 30 y 90mL/min/1,73m2.
Los efectos renales y CV de dapagliflozina también están siendo estudiados en numerosos ensayos y estudios. Kohan et al. han publicado un metaanálisis de 12 estudios incluyendo 4.545 pacientes con DM2 con una duración superior a 24 semanas. Se han reportado descensos transitorios del FG, sin cambios tras 108 semanas de seguimiento y con escasos efectos adversos44.
Muy recientemente hemos conocido los resultados del estudio CVD-REAL World Nordic. Se trata de un análisis global realizado a través de los registros nacionales de Dinamarca, Noruega y Suecia, dividiendo a los pacientes en 2 grupos: los tratados de novo con dapagliflozina (n=10.227) y los tratados con iDPP-4 (n=30.681), con una edad media de 62 años y un 23% con antecedentes de enfermedad CV. Dapagliflozina se asoció con un menor riesgo de episodios CV mayores (RR 0,79), insuficiencia cardiaca (RR 0,62) o mortalidad de cualquier causa (RR 0,44) en comparación con los iDPP-4. No se especifican objetivos renales en este análisis45.
Igualmente, estamos pendientes de la publicación de los resultados del estudio DECLARE (DECLARE-TIMI58), que evalúa la incidencia de efectos CV, mortalidad CV, infarto de miocardio o accidente cerebrovascular, en pacientes con DM2 tratados con dapagliflozina 10mg/día en pacientes con DM246.
En la tabla 2 resumimos la morbimortalidad y los eventos renales con nuevos agentes hipoglucemiantes. En la tabla 3 se resumen los ensayos clínicos y estudios en marcha con iSGLT2, modificada de Lytvyn et al.47.
Si tomamos conjuntamente los resultados hasta ahora disponibles de los estudios con agonistas GLP-1 y los iSGLT2 podríamos pensar que ambos pueden reducir la incidencia de ERD. Sin embargo, persisten limitaciones importantes: deben diseñarse estudios con objetivos principales específicamente «renales». En segundo lugar, los resultados en cuanto a nefroprotección con agonistas GLP-1, aunque prometedores, son limitados, por lo que es una cuestión abierta, que debe ser respondida en futuros ensayos y estudios. Los nefrólogos hemos de adquirir experiencia en su manejo. Deben aclararse los posibles «efectos de clase» de ambos tipos de fármacos. Igualmente, deben dilucidarse los posibles beneficios CV y renales en la población general con DM y no solo en los grupos de elevado riesgo CV incluidos en los estudios hasta ahora realizados. Finalmente, la barrera del elevado coste de los fármacos habrá de ser balanceada con los posibles beneficios obtenidos.
ConclusionesLa DM continúa siendo la causa más frecuente de ERC avanzada en nuestro medio, a pesar de la estabilización en su frecuencia como causa de nefropatía en estadio 5 en los últimos años.
Estamos convencidos de que los resultados obtenidos con los fármacos aquí descritos y otros que irán apareciendo progresivamente nos ayudarán a manejar de forma más adecuada al paciente con DM y a encarar con mayores probabilidades de éxito el futuro en la prevención y el tratamiento de la enfermedad vascular y renal en la DM.
Creemos que estas nuevas moléculas, manejadas de forma precoz y adecuada a la función renal, van a contribuir a disminuir la incidencia y la prevalencia de la ERD, junto con la aplicación de otros estándares clásicos bien conocidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.