Sr. Director:
INTRODUCCIÓN
La insuficiencia renal es una frecuente y grave complicación del mieloma múltiple (MM), que conduce a un aumento significativo en la morbimortalidad del paciente1, siendo el riñón de mieloma la entidad más frecuente encontrada en este tipo de pacientes. La depuración extracorpórea de cadenas ligeras se considera un tratamiento coadyuvante a la quimioterapia para disminuir el riesgo de insuficiencia renal crónica avanzada y necesidad de tratamiento renal sustitutivo crónico, disminuyendo también, a su vez, la mortalidad global2.
CASO CLÍNICO
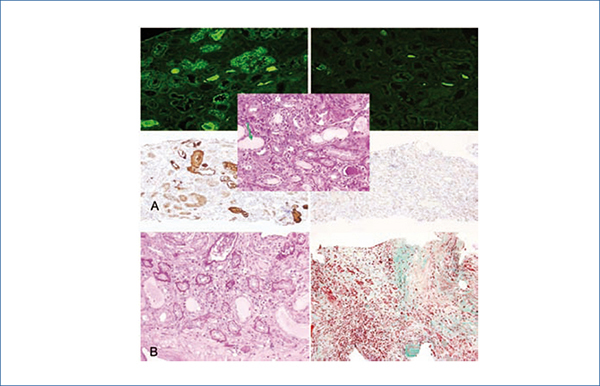
Paciente de 46 años sin antecedentes de interés, acude a Urgencias por dolor en teste izquierdo irradiado a flanco ipsilateral, sin fiebre ni síndrome miccional acompañante. Exploración física anodina, salvo hipertensión arterial. Eco renal y testículo-prostática sin hallazgos. Se aprecia deterioro de la función renal rápidamente progresivo (creatinina 9,79 mg/dl, 4,85 g/24 proteinuria sin sedimento activo) y anemización progresiva (Hb 8,1 g/dl, volumen corpuscular medio 88 fl, hemoglobina corpuscular media 31,1, concentración de hemoglobina corpuscular media 35,4). Estudio inmunológico (anticuerpos antinucleares, anticuerpos anticitoplasma de neutrófilo, anti-MBG, antiestreptolisina, factor reumatoide, C3-4), serología viral y marcadores tumorales, normales. Proteinograma-inmunofijación con banda monoclonal inmunoglobulina (Ig)A-kappa. IgG 317, IgA 1446, IgM 15 mg/dl, cadena ligera libre (CLL, nefelometría Free-Lite®) kappa 4090 ng/ml, lambda 1. Ácido úrico 10,8, LDH 269, calcio 10,2, albúmina 3,3, B2 microglobulina 23 340. Perfil hepático, lipídico y resto de hemograma, normal. Se diagnostica anatomopatológicamente nefropatía por cilindros de cadenas ligeras kappa (CLL-K) (figura 1 A) y MM IgA-kappa estadio IIIB de Durie Salmon, iniciándose tratamiento con bortezomib-dexametasona, junto a terapia depurativa renal con filtro de alto cut-off Theralite® a días alternos.
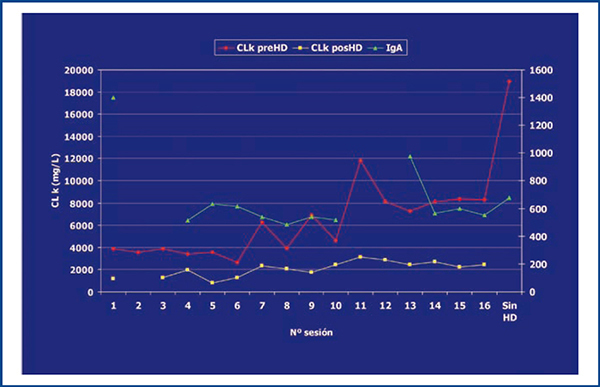
Durante los dos meses siguientes, la cifra sérica de IgA desciende progresiva y significativamente, no así la de CLL-K prediálisis (figura 2), pero se decide en sesión clínica multidisciplinaria continuar con el tratamiento establecido según protocolo de Hematología y rebiopsiar el riñón para valorar la continuación de la terapia depuradora. En la rebiopsia se observan lesiones tubulointersticiales crónicas de intensidad leve-moderada (figura 1 B), prescribiéndose 6 ciclos más de diálisis de alto cut-off.
A los tres meses del diagnóstico, tras 4 ciclos de quimioterapia, se decreta ineficacia de bortezomib, sustituyéndose por lenalidomida ajustada a función renal. Debido a motivos económicos, se imposibilita la continuación de la terapia depuradora de CLL (habiendo recibido un total de 18 sesiones), permaneciendo el paciente en terapia renal sustitutiva con diálisis convencional de alto flujo. Se confirma eficacia de lenalidomida (Task Force, SWOG y EMBT), bajo la cual está el paciente a los tres años del diagnóstico, además del tratamiento renal sustitutivo.
DISCUSIÓN
El fallo renal en el MM se presenta en el 12-20 % de los casos, condicionando la permanencia en diálisis una supervivencia media inferior al año3. La nefropatía por cilindros es la causa más frecuente de fracaso renal, resultando la determinación sanguínea de CLL una gran arma diagnóstica4.El tratamiento quimioterápico es la base de la mejoría pronóstica de estos pacientes en la última década, disminuyendo la síntesis de la cadena ligera y así su depósito en el túbulo renal, responsable último de la nefropatía. Por otro lado, técnicas de depuración extracorpórea que eliminan cadenas ligeras y, por ende, el contacto de estas con el túbulo renal se han estado ensayando durante décadas como terapia coadyuvante, sin resultado exitoso en la recuperación de la función renal5. Hutchison et al.2 han mejorado estos resultados con una técnica de hemodiálisis larga de 8 horas con filtros de alto poro, éxito condicionado a la precocidad del tratamiento6.
En este caso, el tratamiento quimioterápico de primera línea no fue eficaz, haciéndose inútil la depuración extracorpórea. La monitorización de las CLL-kappa, que no la de IgA, que descendió considerablemente desde el inicio del tratamiento, parecía indicar este fracaso terapéutico en todo momento, y es que la corta vida media de las cadenas ligeras hace que su monitorización permita detectar cambios en la masa tumoral más precozmente que la de la Ig entera7. Así, se observa cómo, después de cada ciclo, la cantidad de CLL descendía significativamente, ascendiendo a cantidades similares en la siguiente determinación a las 48 horas, lo que significa que el filtro depurador estaba realizando su trabajo, pero no así el tratamiento inhibidor de la síntesis, es decir, la quimioterapia. La contradicción en los niveles de IgA frente a CLL-K y la no inclusión de esta monitorización de CLL en los protocolos de respuesta retrasó el replanteamiento terapéutico del paciente, impidiendo con ello la recuperación de la nefropatía. Pues, ¿por qué no pensar que un mismo clon de células B puede secretar distintas cantidades de Ig entera que de cadena ligera? Mead et al. encontraron una pobre correlación entre los niveles de Ig entera y CLL en los mielomas mixtos8. Esa, o la existencia de distintos clones de linfocitos B segregando IgA unos y cadena kappa otros, es la explicación fisiopatológica que atribuimos a este caso. Por ello, opinamos que, aunque los niveles de IgA reflejaran una buena respuesta al tratamiento, los de CLL-K eran los que estaban indicando lo contrario, y acertando.
Hasta el momento, la monitorización de CLL no está incluida en los protocolos hematológicos habituales de respuesta a tratamiento, de manera que en la mayoría de los centros solo se tiene en cuenta la Ig entera a la hora de evaluar dicha respuesta. Debido a la larga vida media de la Ig, su monitorización es mensual y la valoración de la respuesta no se realiza antes del cuarto ciclo de quimioterapia, esto es, entre el tercer y cuarto mes tras el diagnóstico. La alegación hematológica ante la sugerencia de adelantar la evaluación referida es que un retraso en el diagnóstico de ineficacia terapéutica de 4-6 semanas no afecta realmente al desenlace final, en lo que a la respuesta medular se refiere8. Como nefrólogos, insistimos en que la diferencia estriba cuando existe nefropatía por cadenas ligeras, casos en los que la precocidad diagnóstico-terapéutica sí es vital: podemos curar tardíamente la discrasia celular medular, pero no así las células del túbulo renal, como lo demuestra la segunda biopsia realizada en nuestro caso.
Afortunadamente, cada vez son más los trabajos que abogan por la importancia pronóstica de las CLL9 y la inclusión de su monitorización en estos protocolos, pudiendo hasta ahorrarse la rebiopsia de médula7-11.
CONCLUSIÓN
La precocidad de tratamiento quimioterápico y depurador de cadenas ligeras es fundamental para su eficacia en el riñón de mieloma. La monitorización de las cadenas libres en sangre ayuda a valorar la respuesta terapéutica. Una buena coordinación entre Nefrología y Hematología es esencial para la eficacia terapéutica en estos pacientes.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Biopsias renales
Figura 2. Monitorización de cadenas ligeras kappa e inmunoglobulina A.