El cisplatino (cis-diaminodicloroplatino(II), CDDP) es un fármaco antineoplásico usado en el tratamiento de muchos tipos de cáncer en órganos sólidos, incluyendo cáncer de cabeza y cuello, pulmón, testículo, ovario y mama1.
Estudios clínicos han demostrado que aproximadamente un tercio de los pacientes que usan este antineoplásico experimentan lesiones renales agudas posteriores al tratamiento con CDDP, presentando una reducción en la tasa de filtración glomerular, aumento del nitrógeno ureico y creatinina en sangre, así como desequilibrio electrolítico2.
Aunque los daños por CDDP incluyen ototoxicidad, gastrotoxicidad, mielosupresión y reacciones alérgicas, la nefrotoxicidad es el principal efecto limitante de este antineoplásico; y a pesar de que se le atribuyen distintos efectos nocivos a nivel renal, el más común de todos es la insuficiencia renal aguda (IRA)1.
La IRA se produce en aproximadamente uno de cada 5 adultos y en uno de cada 3 niños hospitalizados con enfermedad aguda, incrementando su incidencia y presentando una mortalidad inaceptablemente alta. El aumento de la gravedad se correlaciona con el aumento de la mortalidad, la cual ocurre principalmente en pacientes que requieren terapia de reemplazo renal3.
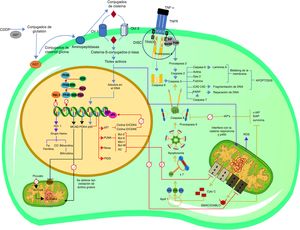
En esta revisión, se describen los eventos moleculares por los cuales el CDDP tiene su acción nefrotóxica al alterar la expresión de diversos genes que participan en el metabolismo y al activar diferentes vías de señalización apoptóticas (fig. 1), resaltando las principales dianas celulares de este antineoplásico y su uso para el planteamiento de posibles tratamientos para la IRA causada por CDDP.
Esquema explicativo de las vías apoptóticas y alteraciones en la expresión génica en la nefrotoxicidad inducida por cisplatino (CDDP).
Proceso por el cual el CDDP entra en la célula y forma aductos con el DNA, provocando la expresión de p53, así como la vía extrínseca de la apoptosis y la activación de la procaspasa 2. Eventos apoptóticos moleculares que se desencadenan por la activación de p53, así como los cambios en la actividad transcripcional de PPAR y su coactivador PGC-1. Vía intrínseca o mitocondrial de la apoptosis hasta la activación de la caspasa 3. Alteraciones transcripcionales en genes diana de PPAR; disminución en la expresión de MCAD y aumento de la expresión de PDK4. Interacciones del CDDP que desencadenan la sobreexpresión de HO-1 por el aumento de ROS.Ac-CoA: acetyl-coenzyme A; AIP: apoptosis inhibitor protein; Apaf 1: apoptosis protease-activating factor-1; C Krebs: Krebs cycle; CAD: caspase-activated deoxyribonuclease; CARD: caspase recruitment domain; CDDP: cisplatino; CO: oxide carbon; Ctr1: copper transporter 1; DD: death domain; DED: death effector domain; DISC: death-inducing signaling complex; E2F: E2-factor; GAS-2: growth arrest specific protein 2; GGT: gamma glutamyl transpeptidase; GST: glutathione-S-transferase; HO-1: heme oxygenase 1; ICAD: inhibitor of caspase-activated deoxyribonuclease; MCAD: medium chain acyl dehydrogenase; OCT2: organic cation transporter 2; PARP: poly(ADP-ribose) polymerase; PDH: pyruvate dehydrogenase; PDK4: pyruvate dehydrogenase kinase isozyme 4; PGC-1: PPAR-gamma-coactivator-1; PGI2: prostacyclin; PIDD: p53-induced protein with a death domain; PPAR: peroxisome proliferator-activated receptor; pRb: retinoblastoma protein; PUMA: p53 upregulated modulator of apoptosis; RAIDD: RIP-associated Ich-1/Ced-3-homologue protein with a death domain; ROS: reactive oxygen species; RXR-α: retinoid X receptor; SMAC/DIABLO: second mitochondria-derived activator of caspase/direct inhibitor of apoptosis-binding protein with low pI; TNF-α: tumor necrosis factor alpha; TNFR: TNF receptor; TRADD: tumor necrosis factor receptor type 1-associated death domain.
Después de la administración de CDDP, dos terceras partes se unen a proteínas plasmáticas como glutatión, metionina, cisteína, albúmina y nucleótidos de forma rápida e irreversible, formando complejos de CDDP inactivos. La tercera parte restante es excretada por filtración glomerular y secreción tubular mediante transporte activo mediado por OCT2 (organic cation transporter 2) y por el transportador de extracción para múltiples fármacos y toxinas4.
Sin embargo, se ha reportado que una hora después de la administración de CDDP, la cantidad de este antineoplásico en plasma no cambia, es decir, su eliminación por vía renal es escasa. La vida media del CDDP en el riñón es larga, va desde las 100 hasta las 300h, debido a que la distribución del fármaco en las células epiteliales renales es mediante una unión covalente con los complejos proteicos CDDP-proteína, los cuales no pueden ser eliminados, contribuyendo así a la nefrotoxicidad en un largo periodo de tiempo. De hecho, estudios in vivo han mostrado que los daños histológicos y bioquímicos son más evidentes 5 días posteriores a la administración del CDDP5-7.
Afinidad de las células renales al cisplatinoLa nefrotoxicidad del CDDP ha sido atribuida a sus altas concentraciones en los riñones y en el sistema de transporte renal. Durante el proceso de excreción, los niveles en sangre de CDDP generalmente no son tóxicos, sin embargo, los niveles de CDDP en las células túbulo-epiteliales pueden ser hasta 5 veces mayores que en la sangre, alcanzando niveles tóxicos en los riñones. Las altas concentraciones de CDDP en los riñones favorecen su difusión pasiva, siendo este el principal mecanismo por el cual el CDDP entra y se acumula intracelularmente. Sin embargo, recientemente se ha reportado que el sistema de transporte activo asociado con la nefrotoxicidad está relacionado con los transportadores de membrana OCT2 y Ctr1 (copper transporter 1)8.
OCT2 es altamente expresado en el segmento S3 de los túbulos proximales, donde se localiza el efecto nefrotóxico del CDDP9, mientras que Ctr1 se expresa en gran medida en el riñón adulto y la proteína se localiza en la membrana basolateral del túbulo proximal, siendo un transportador de cobre que también es capaz de mediar la captación de CDDP en células de mamíferos1. Además de la transportación facilitada por OCT2 en la membrana basolateral del túbulo proximal, el 60% del CDDP es recuperado mediante el sistema de lisosomas, indicando que el ciclo vesicular juega un papel crucial en la acumulación de CDDP en las células túbulo-epiteliales. Así mismo, como se mencionó previamente, las células epiteliales del túbulo proximal acumulan hasta 5 veces más CDDP, haciendo esta región más susceptible que el asa de Henle, la cual también presenta alteraciones5,10,11.
En relación con esto, el estudio de Kishore et al. revela que el CDDP provoca una disminución significativa en la expresión de la aquaporina 1 (AQP1), la cual se expresa en la rama descendente del asa de Henle, produciendo una disminución de la tasa de absorción de agua, generando poliuria12. Además, existe evidencia de que el asa de Henle puede ser afectada en sus funciones por un desequilibrio en la homeostasis del magnesio, o bien por la reducción de transportadores que se expresan en su membrana13.
Aunado a estos mecanismos de eliminación y acumulación del CDDP en el riñón, este antineoplásico forma conjugados de glutatión en la circulación mediados por la GST (glutathione-S-transferase), dando pie a la formación de una potente toxina. Una vez dentro de la célula del túbulo proximal, los conjugados de cisteína se metabolizan adicionalmente por acción de la cisteína-S-conjugado beta-liasa a tioles altamente reactivos1.
Con todo lo anterior, se puede inferir que los túbulos contorneados proximales son el sitio principal de daño por CDDP, debido a los altos niveles de expresión de enzimas implicadas en su metabolismo1 y por la expresión de factores de transcripción que regulan el metabolismo energético del riñón14, de tal manera que existe una afectación morfológica más severa a nivel del túbulo contorneado proximal que en el asa de Henle.
Mecanismos de nefrotoxicidad del cisplatinoLa fisiopatología de la IRA inducida por CDDP es compleja, ya que, como se ha mencionado con anterioridad, están involucrados diversos mecanismos como el daño nuclear y mitocondrial, la activación de vías de señalización de apoptosis, la generación de especies reactivas de oxígeno (ROS, reactive oxigen species) y la estimulación de la inflamación7,15.
El CDDP está formado por un ion de platino unido a 2 iones cloruro y 2 moléculas de amonio. La citotoxicidad del CDDP está relacionada con los metabolitos acuosos reactivos, los cuales se forman dependiendo de la concentración de iones cloruro. La concentración intracelular de cloro es de 20mM, la cual es menor que la concentración sanguínea (100mM), por lo que el CDDP permanece sin alteraciones en el torrente sanguíneo, pero se hidroliza en el ambiente intracelular, reemplazando los iones cloro por moléculas de agua generando un electrófilo cargado positivamente. Por lo tanto, el CDDP en su forma acuosa produce [Pt(NH3)2Cl(OH2)]+ y [Pt(NH3)2(OH2)2]2+8. El átomo de platino forma enlaces covalentes con las posiciones N7 de las bases de purina para conformar enlaces cruzados intracatenarios, principalmente 1,2 o 1,3, y un número menor de enlaces cruzados intercatenarios, deteniendo la replicación y transcripción, el ciclo celular y, eventualmente, generando apoptosis en células con un índice de proliferación elevado, por lo cual las células con un índice bajo de proliferación están relativamente protegidas de este daño; sin embargo, las células del túbulo proximal son una excepción, dañándose por el CDDP8,16,17.
La apoptosis inducida por el daño al DNA es mediada por el gen supresor de tumores p53. En humanos adultos, las células de los túbulos proximales no se dividen, por lo que la formación de aductos con el DNA no juega un papel relevante en la nefrotoxicidad del CDDP. Sin embargo, se ha planteado que el DNA mitocondrial, u otros objetivos mitocondriales, son quizás más importantes que el daño al DNA nuclear en la muerte celular inducida por CDDP8. Para generar estos efectos, el CDDP se hidroliza produciendo un metabolito cargado positivamente que se acumula preferentemente dentro de las mitocondrias cargadas negativamente. Por lo tanto, la sensibilidad de las células al CDDP parece estar en correlación con la densidad mitocondrial y el potencial de la membrana mitocondrial. Esta observación puede explicar la particular sensibilidad del túbulo proximal renal a la toxicidad del CDDP, ya que este segmento presenta una de las más altas densidades de mitocondrias en el riñón1.
Por otro lado, el daño oxidativo y los eventos inflamatorios inducidos por el CDDP también pueden explicar los efectos nefrotóxicos en otros componentes celulares. Varios estudios indican que la nefrotoxicidad del CDDP está asociada con la generación de ROS8, disminuyendo los mecanismos antioxidantes5. Esta generación de ROS amplifica la muerte celular mediada por el ligando de Fas (FasL)/Fas. Esta vía de apoptosis es considerada una de las vías involucradas en el daño renal, donde el receptor de Fas y su ligando traduce señales apoptóticas mediante la activación de los efectores caspasa 3 y 8. Sin embargo, estudios recientes sugieren que el CDDP no aumenta los niveles de FasL soluble en sangre, solo en el tejido renal y la liberación de FasL de membrana, mecanismos aún desconocidos. Sin embargo, las ROS aumentan la actividad de las metaloproteinasas, las cuales podrían contribuir al rompimiento de FasL de membrana formando FasL soluble18,19.
Adicionalmente, la administración de CDDP incrementa los niveles del factor de necrosis tumoral α (TNF-α), óxido nítrico, moléculas de adhesión y células T CD4+, induciendo un incremento de hasta 6 veces más de citocinas inflamatorias como interleucina 1-β, interleucina 18 e interleucina 6, generando inflamación y, por lo tanto, el daño renal5.
Finalmente, otro de los mecanismos que pueden contribuir a la nefrotoxicidad provocada por CDDP es la inhibición en la síntesis de compuestos energéticos mitocondriales. Los ácidos grasos son la principal fuente de energía para el túbulo proximal y el sitio primario de la lesión renal inducida por CDDP. Se sabe que el CDDP es capaz de inhibir la oxidación de ácidos grasos en el riñón de ratón y en células del túbulo proximal en cultivo mediante una reducción en la expresión de genes implicados en la utilización de ácidos grasos celulares mediada por PPAR-α (peroxisome proliferator-activated receptor)14.
El papel de PPAR-α (peroxisome proliferator-activated receptor) en la nefrotoxicidad del cisplatinoLos PPARs son receptores de hormonas nucleares, es decir, proteínas intracelulares dependientes de ligandos que estimulan la transcripción de genes específicos uniéndose a secuencias de DNA específicas. Cuando se activan por la unión a un ligando, sus factores de transcripción afectan el desarrollo y el metabolismo. Existen 3 subtipos de PPAR, productos de los distintos genes, comúnmente designados como PPAR-α, PPAR-γ y PPAR-β/δ, o simplemente δ20.
De forma particular, PPAR-α está implicado en la regulación del metabolismo renal y en el mantenimiento del equilibrio entre la producción y el gasto de energía, dado su alto nivel de expresión en los túbulos proximales renales20. PPAR-α se une como heterodímero con RXR-α (retinoid X receptor) a una secuencia de DNA específica, denominada PPRE (PPAR response element), situado río arriba de genes diana que están implicados principalmente en la oxidación de ácidos grasos21.
Los PPRE consisten en una secuencia consenso de hexanucleótidos AGGTCA espaciados por un único nucleótido. Los ligandos agonistas para PPAR pueden promover la asociación física del heterodímero PPAR-RXR con el DNA, sin embargo, la unión de PPAR con el DNA se puede producir en estado basal22.
En contraste con otros pares de receptores nucleares RXR, los heterodímeros de PPAR-RXR son «permisivos», lo que significa que pueden ser activados por un ligando selectivo de RXR o un ligando de PPAR. La unión del ligando conduce a la disociación de las proteínas correpresoras y a la asociación de proteínas coactivadoras, que pueden reclutar o tener una histona desacetilasa intrínseca y actividad de histona acetiltransferasa, respectivamente, necesarias para el ensamblaje del complejo de iniciación de la transcripción22.
Por lo tanto, PPAR-α forma un heterodímero con RXR. En ausencia de ligandos, el dímero puede reclutar un correpresor, inhibiendo la transcripción mediada por PPAR-α de genes diana; sin embargo, la presencia de un agonista o un activador, tal como la prostaciclina (PGI2), desencadena el reclutamiento de un complejo coactivador que induce la actividad transcripcional de PPAR-α sobre sus genes diana. Esto conduce a un aumento en el catabolismo de ácidos grasos y la producción de adenosin trifosfato (ATP), y también contribuye a disminuir los niveles de productos de peroxidación de ácidos grasos citotóxicos y, por consiguiente, promueve la viabilidad celular e inhibe la muerte celular del epitelio renal20.
Genes diana de PPAR-α (peroxisome proliferator-activated receptor)Entre estos genes se encuentra el que codifica para MCAD (medium chain acyl dehydrogenase), un homotetrámero que cataliza el paso inicial de la vía de la β-oxidación de ácidos grasos mitocondriales de 4 a 12 carbonos. Este paso consiste en la deshidratación del acil-CoA en las posiciones C2 y C3. Como resultado, se obtiene un derivado insaturado delta-enoil-CoA con un doble enlace en posición trans. Los 2 átomos de hidrógeno son transferidos por la MCAD, que contiene flavín adenín dinucleótido (FAD), a la flavoproteína transferidora de electrones (ETF). Esta a su vez los transfiere a la ubiquinona (coenzima Q), un componente de la cadena respiratoria. De esta forma, la degradación de ácidos grasos continúa en una serie de reacciones de oxidación hasta formar ácidos grasos de 2 carbonos23.
En un estudio publicado en el 2004 por Li et al., se demostró que el CDDP provoca una reducción significativa de los niveles de mRNA y de la actividad enzimática de la MCAD en riñones de ratones adultos; sin embargo, al utilizar el ligando WY para PPAR-α, disminuyó la IRA inducida por CDDP impidiendo la reducción de los niveles de mRNA y aumentando la actividad enzimática de MCAD, lo que demuestra que la actividad de PPAR-α mediada por ligando contribuye positivamente a la restauración de la función renal y a la transcripción de genes involucrados en el metabolismo de ácidos grasos14.
Una de las posibles explicaciones, ante la reducción de los niveles de mRNA de MCAD por la nefrotoxicidad inducida por CDDP, es que este antineoplásico es capaz de inhibir la expresión de PGC-1 (PPAR-gamma-coactivator-1) en el túbulo proximal y en la rama ascendente del asa de Henle en el riñón de ratón. PGC-1 es el coactivador de PPAR-α de mayor importancia en el riñón; estudios de hibridación in situ han demostrado la expresión de PGC-1 en estos 2 segmentos de la nefrona, los cuales también expresan altos niveles de PPAR-α y enzimas implicadas en la oxidación de ácidos grasos21. Por lo tanto, la inhibición en la expresión de PGC-1 significaría una reducción de la actividad transcripcional de PPAR-α y, a su vez, la disminución en los niveles de mRNA de genes diana como MCAD. Sin embargo, este mecanismo de regulación transcripcional no explica satisfactoriamente los cambios en los niveles de expresión de otros genes que participan en procesos metabólicos de importancia para el riñón como es la glucólisis. Acerca de esto, Li et al. determinaron que el CDDP es capaz de aumentar la síntesis de mRNA y de la proteína de la PDK4 (pyruvate dehydrogenase kinase isozyme 4) en ratones, lo que representa una disminución en la oxidación de hidratos de carbono, y que el uso del ligando WY para PPAR-α reestablece los niveles basales de mRNA de PPAR-α14. Sorprendentemente, en otros estudios realizados en células musculares de ratones knockout para el gen de PPAR-α, el aumento de PGC-1 indujo la activación en la expresión del gen PDK4, demostrando que la expresión de este gen se puede dar también de forma independiente de PPAR24, de tal manera que no existe un consenso en el mecanismo de regulación de genes implicados en el metabolismo de la glucosa, como PDK4, al menos no en cuanto al papel que PGC-1 y PPAR-α tienen en la transcripción de estos genes.
Hemo oxigenasa-1 como respuesta al daño nefrotóxico del cisplatinoComo se mencionó anteriormente, uno de los agentes causantes de las enfermedades renales, como la IRA, son las ROS. Es bien sabido que el riñón es especialmente vulnerable a los radicales libres, debido a que es uno de los sitios prominentes para los procesos oxidativos25. El CDDP puede inducir la generación de diversas ROS mediante la inactivación del sistema antioxidante celular, interrupción de la cadena respiratoria mitocondrial, interacción con el citocromo P450 microsómico, amplificación de la muerte celular mediada por el FasL o el aumento de las metaloproteinasas18,19,26.
Se ha comprobado en estudios recientes que, en estados elevados de estrés oxidativo, se induce la expresión de la enzima hemo oxigenasa-1 (HO-1) como una respuesta protectora de las células expuestas a una diversa gama de factores tóxicos25.
La HO-1 es la enzima que cataliza el paso limitante de la velocidad de degradación del grupo hemo; sus productos son monóxido de carbono, hierro y biliverdina. En una reacción posterior, la biliverdina reductasa (EC. 1.3.1.24) produce bilirrubina a partir de biliverdina27.
Aunque los procesos celulares subyacentes a la inducción de HO-1 son complejos y estrictamente regulados, un denominador común a la mayoría de estos estímulos es un cambio significativo en la redox celular25. Estudios previos han demostrado que, en la nefropatía tóxica inducida por CDDP en un modelo de estrés oxidativo agudo que no depende directamente de la administración de proteínas hemo al riñón, la HO-1 eleva sus niveles en los túbulos renales 6h posteriores a la administración de CDDP28. Así mismo, Shiraishi et al., en el 2000, demostraron que ratones transgénicos deficientes en HO-1 (−/−) desarrollan insuficiencia renal más rápido con una lesión renal significativamente mayor en comparación con ratones de tipo salvaje (+/+) tratados con CDDP25.
p53, un mediador importante en la muerte celular inducida por cisplatinoComo se mencionó anteriormente, uno de los objetivos celulares del CDDP es el DNA nuclear, y es la interacción de este antineoplásico con el material genético lo que hace que sus mecanismos por los cuales induce nefrotoxicidad sean tan complejos e impliquen múltiples moléculas y vías de señalización.
Entre las moléculas de interés, p53 ha ganado atención en los últimos años como un potente inductor de apoptosis en la nefrotoxicidad provocada por CDDP. El gen supresor de tumores p53 induce la detención del ciclo celular o la apoptosis en respuesta al daño al DNA, activación de oncogenes e hipoxia.
Existe una vasta información recogida en múltiples investigaciones, que presentan evidencia acerca de la participación de esta proteína en los mecanismos de muerte celular que se desencadenan por la acción del CDDP. Una de estas investigaciones fue la realizada por Cummings y Schnellmann en el 2002, donde se demostró, por inmunofluorescencia, el aumento en la expresión nuclear de p53 en células del túbulo proximal de conejo 4h después del tratamiento con CDDP29.
Otro estudio que confirma la participación de p53 en la nefrotoxicidad del CDDP utilizando modelos in vitro es el de Jiang et al. en el 200430, quienes en cultivos de células tubulares proximales de rata demostraron que p53 se fosforila rápidamente y se regula positivamente después del tratamiento con CDDP, antes del inicio de la apoptosis celular. La activación de p53 no fue inhibida ni por carbobenzoxi-Val-Ala-Asp fluorometilcetona, ni por Bcl-2 (B cell lynphoma 2), aunque ambos suprimieron la apoptosis celular inducida por CDDP, indicando que la activación de p53 no era consecuencia de la muerte celular. La pifitrina-α, por otro lado, bloqueó la activación de p53 y, a su vez, atenuó la activación de caspasas y la apoptosis. Los resultados sugirieron que la activación de p53 puede ser una señal temprana para la apoptosis de células tubulares renales inducida por CDDP. Así mismo, la apoptosis inducida por CDDP fue inhibida en un ratón con una mutación puntual en el sitio de unión al DNA para p53, demostrando que los efectos proapoptóticos de p53 en respuesta al CDDP dependen en gran medida de su actividad transcripcional hacia genes diana.
Tres años después, Wei et al. demostraron por inmunoanálisis un aumento de la proteína p53 en muestras de corteza y médula renal después del tratamiento con CDDP en ratones C57BL/631. El aumento de esta proteína se evidenció a partir del día 2 y se intensificó al día 3. Paralelamente a la acumulación de p53, había fosforilación de p53 que fue acompañada por el desarrollo de IRA. Este análisis por inmunofluorescencia evidenció la acumulación de p53 y su fosforilación principalmente en el núcleo de la célula cortical renal. En este mismo estudio, se demostró también que la nefrotoxicidad inducida por CDDP disminuyó considerablemente en ratones deficientes para el gen p53; comparando con animales de la cepa salvaje, los ratones deficientes en p53 mostraron una mejor función renal, menos daño tisular y menos células apoptóticas.
Especies reactivas de oxígeno y p53 en la inducción de apoptosis mediada por cisplatinoEstudios experimentales demuestran que los radicales libres a partir del estrés oxidativo inducen la nefrotoxicidad de este fármaco; estos radicales libres afectan la reabsorción de agua, sodio y glucosa en el túbulo proximal. Un estudio que nos permite ampliar esta vía apoptótica es el de Ju et al. en el 2014, donde demuestran en células mesangiales de rata que el tratamiento con CDDP deriva en la activación de p53, así como en un incremento de los niveles de ROS intracelulares. Sorprendentemente, 2 antioxidantes bien conocidos (N-acetilcisteína y dimetil-tiourea) redujeron significativamente la apoptosis inducida por CDDP, lo que sugiere que la producción de ROS, junto con la activación de p53, están implicadas en la inducción de apoptosis por CDDP32.
Teniendo en cuenta que tanto las ROS como p53 participaron en la inducción de apoptosis mediada por CDDP, podemos inferir interacciones entre ambas. Típicamente se ha establecido durante mucho tiempo que las ROS actúan como mediadoras de la apoptosis inducida por p53, sin embargo, evidencia reciente ha revelado que las ROS también pueden actuar como una señal río arriba que desencadena la activación de p53. Esto sugiere que existe una retroalimentación positiva entre p53 y las ROS, aunado a que los efectos tóxicos del CDDP derivan en una inactivación del glutatión y antioxidantes relacionados32, generando que se modifique el estado redox celular no solo por estos mecanismos, sino también por su interacción con proteínas de la cadena respiratoria mitocondrial como p450, que se refirió anteriormente26.
Adicionalmente, es de gran importancia mencionar las moléculas por las cuales p53 puede desencadenar sus efectos apoptóticos y, particularmente, los estudios que han demostrado dichos efectos en la nefrotoxicidad provocada por CDDP.
Regulación transcripcional de p53 en la nefrotoxicidad inducida por cisplatinoEs bien sabido que existen diversos genes que contienen promotores con sitios de unión a p53; estos genes pueden sufrir una activación transcripcional, o en caso contrario, ser reprimidos. En estos genes, se encuentran algunos con actividad apoptótica a través de diversas vías de señalización, y se ha demostrado que varios de estos son regulados por p53 durante la nefrotoxicidad inducida por CDDP.
PUMA (p53 upregulated modulator of apoptosis)Las proteínas de la familia Bcl-2 son reguladoras clave de la apoptosis, las cuales están evolutivamente conservadas. PUMA (p53 upregulated modulator of apoptosis) es uno de los miembros de esta familia de proteínas, que pertenece a su vez a una subfamilia de proteínas proapoptóticas que tienen dominio BH3 only, que corresponde a una α-hélice anfipática que se une directamente a las proteínas de la familia Bcl-2 antiapoptóticas. Hasta ahora, la actividad de PUMA parece estar controlada exclusivamente por transcripción, mientras que otras proteínas BH3 solo se activan a menudo a través de múltiples mecanismos, incluyendo modificaciones postraduccionales. En respuesta a estrés genotóxico, como daño al DNA, PUMA es transactivado por p53. Junto con otra proteína BH3 only, Noxa, que en la mayoría de los casos tiene una función menor, PUMA representa prácticamente toda la actividad proapoptótica de p5333.
Esta transactivación ocurre a las pocas horas de haber ocurrido un daño del DNA, e inicia con el reclutamiento de p53 por los 2 elementos de respuesta a p53 en el promotor PUMA. Los estudios de orientación génica han indicado que tanto p53 como los sitios de unión a p53 en el promotor PUMA son indispensables para la inducción de PUMA por daño al DNA. La unión de p53 al promotor PUMA facilita las modificaciones de las histonas centrales, tales como la acetilación de las histonas H3 y H4, lo que conduce a la apertura de la estructura de la cromatina y la activación de la transcripción33.
Al igual que otras proteínas BH3, PUMA sirve como una molécula de señalización que transduce señales de muerte a las mitocondrias donde actúa a través de múltiples miembros de la familia Bcl-2 para inducir disfunción mitocondrial y activación de caspasas. PUMA actúa principalmente para activar indirectamente a Bax y/o Bak mediante la inhibición de proteínas miembros de la familia Bcl-2 antiapoptóticas, incluyendo a Bcl-2, Bcl-XL, Mcl-1, Bcl-w y A1. También se ha sugerido que PUMA puede desencadenar la apoptosis mediante la activación directa de Bax, o a través del p53 citoplásmico en algunas células33.
En cuanto a la nefrotoxicidad inducida por CDDP, se ha demostrado que PUMA-α, pero no otras isoformas, es notablemente inducido por CDDP tanto en modelos in vitro de células tubulares proximales cultivadas como in vivo en riñones de ratón. Esta inducción fue dependiente de p53, debido a que cuando se usaba el inhibidor farmacológico de p53, pifitrina-α, no se dio la expresión de PUMA-α y lo mismo ocurrió en ratones knockout para p53. Así mismo, se demostró que PUMA-α se acumuló en las mitocondrias después de su inducción, donde interactuó con Bcl-xL para liberar moléculas proapoptóticas como Bax. Como consecuencia, Bax se activó para permeabilizar la membrana mitocondrial y liberar el citocromo C, dando lugar a la activación de caspasas y permitir la apoptosis. De este modo, tanto a partir de experimentos in vitro como in vivo, estos resultados han sugerido la implicación de PUMA-α en la apoptosis de células renales mediada por p53 durante la nefrotoxicidad del CDDP34.
PIDD (p53-induced protein with a death domain)La función de PIDD (p53-induced protein with a death domain) está sumamente controlada por diversos mecanismos diferentes, permitiendo que se genere una variedad de diferentes fragmentos con funciones específicas. Los niveles de expresión de PIDD se regulan a nivel transcripcional y mediante splicing alternativo, mientras que su función se regula adicionalmente mediante escisión autoproteolítica, así como a través de interacciones intra- e intermoleculares con proteínas. La expresión de PIDD puede ser inducida por p53 o por inhibición del inhibidor de la proteína de apoptosis BRUCE. Sin embargo, aún a nivel basal, no se pudo encontrar correlación entre el estado de p53 de una célula y los niveles de expresión de PIDD, mostrando que al menos la expresión basal de PIDD es independiente de p5335.
A nivel postraduccional, se generan diferentes fragmentos activos de PIDD con funciones específicas: PIDD-C es el fragmento que participa en las funciones de supervivencia y reparación (activación de TLS y NF-κB), mientras que PIDD-CC se une a RAIDD (RIP-associated Ich-1/Ced-3-homologue protein with a death domain) e inicia la activación de caspasa 2, quedando así activado y formando un complejo de aproximadamente 700kDa, denominado el PIDDosoma35.
Un estudio en cultivos de células tubulares proximales demostró que PIDD es capaz de mediar la apoptosis inducida por CDDP36. En estas células, la inducción de PIDD fue llevada a cabo por CDDP, y atenuada por pifitrina-α y RNA pequeño interferente de p53, lo que sugiere un mecanismo dependiente de p53. Después de la inducción de PIDD, se dio la activación de la caspasa 2, lo que condujo a la liberación mitocondrial de AIF (apoptosis inducing factor), dando como resultado condensación de la cromatina, degradación del DNA nuclear y apoptosis de las células tubulares.
CaspasasSon una familia de cisteína proteasas que se encuentran como moléculas precursoras inactivas (procaspasas), que al recibir una señal apoptogénica (como TNF-α) sufren un rompimiento proteolítico y dan lugar a 2 subunidades que constituyen la enzima activa (caspasas). Las procaspasas constan de un prodominio N-terminal y 2 subunidades, una grande p20 y otra pequeña p10. A la fecha, las caspasas más estudiadas son la 1, 2, 3, 4, 5, 6, 7, 8, 9 y 10. Tomando en cuenta la estructura primaria determinada por resonancia magnética nuclear y cristalografía de rayos X, se pueden agrupar en 2 clases: pertenecen a la clase I las procaspasas que tienen un prodominio N-terminal grande, como las procaspasas 1, 2, 8, 9 y 10. En las procaspasas de clase II el prodominio N-terminal es pequeño o carecen de él; pertenecen a esta clase las procaspasas 3, 6 y 737.
Los prodominios de las procaspasas de clase I contienen dominios de interacción proteína-proteína que propician la formación de complejos homodiméricos. Estos complejos están compuestos por tetrámeros de 2 subunidades grandes y 2 pequeñas que favorecen su rompimiento autoproteolítico en sitios específicos de residuos de ácido aspártico (D). Todas estas moléculas constan de 6 α-hélices anfipáticas y antiparalelas las cuales se encuentran altamente empaquetadas formando un centro hidrofóbico, originando interacciones hidrofóbicas entre los DEDs (death effector domains) e interacciones electrostáticas entre los CARDs (caspase recruitment domains). La autoactivación de las caspasas de clase I las dirige al citoplasma para activar a las procaspasas de clase II, que no tienen la capacidad de autoproteolizarse y, durante su activación, forman complejos heterodiméricos que favorecen su rompimiento proteolítico. En estas condiciones, las caspasas activas inician los mecanismos apoptóticos hidrolizando a las diversas proteínas del citoesqueleto, nucleares, proteínas que intervienen en la división celular, en el control del ciclo celular, reparación, replicación y transcripción del DNA37.
Existen 2 cascadas principales para la ejecución de la apoptosis. La primera de ellas se lleva a cabo en la membrana celular, y depende de la acción de los denominados factores de muerte que actúan a través de receptores, desencadenando la formación de un DISC (death-inducing signaling complex). Este DISC genera una señal que recluta caspasas iniciadoras en la membrana de la célula. Una variación de esta cascada es la privación de los factores de crecimiento, que también genera señales a partir de la membrana hacia la mitocondria. La segunda cascada involucra a la mitocondria, organelo clave para la integración de señales intra- y extracelulares para la apoptosis37. Esta vía de activación tiene lugar con la dimerización de Bax y/o Bak, lo que permite la salida de moléculas proapoptóticas tales como SMAC/DIABLO (second mitochondria-derived activator of caspase/direct inhibitor of apoptosis-binding protein with low pI) o de Cyto C (mitochondrial cytochrome c), que a través de su interacción con Apaf 1 (apoptotic protease activating factor 1), desplaza a CARD situándose en medio de los 2 dominios WD40 de Apaf 1, activándolo y dando inicio a la formación del apoptosoma constituido por 7 moléculas de Apaf 1 activado. Esto, a su vez, facilita la activación de la procaspasa 9, que activa a la procaspasa 3.
En cuanto a la regulación transcripcional de las caspasas por p53, se ha descubierto que las caspasas 1, 6, 7 y 10 cuentan con elementos de unión específicos a p53 en sus regiones promotoras, y pueden ser activadas por p53 de una forma dependiente de la transcripción33.
Por otro lado, Yang et al., en el 2007, propusieron la transactivación dependiente de p53 de las caspasas 6 y 7 en la nefrotoxicidad por CDDP, demostrando que por la unión específica a secuencias en el DNA se producía la sobreexpresión de p53 inducida por CDDP, y esto, a su vez, aumentaba los niveles de expresión de las caspasas 6 y 7, así como sus actividades en células tubulares renales y de la corteza renal, mientras que la inhibición de p53 con el uso de pifitrina-α bloqueaba la activación de ambas caspasas en las células tubulares, anulando la apoptosis inducida por CDDP, el daño en el tejido y la disfunción renal38.
La activación de las distintas caspasas ejecutoras de apoptosis, como las caspasas 3, 6 y 7, pueden escindir posteriormente distintos objetivos celulares como proteínas, tales como PARP (poly(ADP-ribose) polymerase), la cual está implicada en la reparación del DNA; laminina A y fodrina, que son componentes esenciales del esqueleto nuclear y el esqueleto citosólico, respectivamente; CAD (caspase-activated deoxyribonuclease), la cual es un tipo de endonucleasa constitutiva dependiente de magnesio que puede ser activada por las caspasas, jugando un papel importante en la degradación del DNA en la apoptosis de los mamíferos. En las células normales, CAD reside en el núcleo formando un complejo con su inhibidor específico, ICAD; y finalmente, GAS-2 (growth arrest specific protein 2), que se escinde durante la apoptosis y la forma escindida induce reordenaciones dramáticas del citoesqueleto de actina39.
p21p21Waf1/Cip1/Sdi1 es el primer inhibidor identificado de los complejos ciclina/CDK, los cuales regulan las transiciones entre las diferentes fases del ciclo celular; pertenece a la familia Cip/Kip. Además de regular el ciclo celular, las proteínas Cip/Kip juegan un papel importante en la apoptosis, regulación transcripcional, migración celular y dinámica del citoesqueleto. Una compleja red de fosforilación modula las funciones de las proteínas Cip/Kip alterando su localización subcelular, interacciones proteína-proteína y estabilidad40.
La progresión del ciclo de división celular está regulada por las actividades coordinadas de los complejos ciclina/CDK. Una forma de regulación de estos complejos ciclina-CDK es mediante su unión a inhibidores de CDK (CKI). En los metazoarios, se han definido 2 familias de genes CKI; la familia de genes INK4, donde se encuentran p16INK4a, p15INK4b, p18INK4c y p19INK4d, los cuales se unen a CDK4 y CDK6 e inhiben sus actividades de quinasa al interferir con su asociación con ciclinas de tipo D. Por el contrario, los CKI de la familia Cip/Kip se unen a las subunidades ciclina y CDK, y pueden modular las actividades de los complejos de las ciclinas D, E, A y B con CDK. Los miembros de la familia Cip/Kip son p21Cip1/Waf1/Sdi1 (p21 codificados por cdkn1a), p27Kip1 (p27, cdkn1b) y p57Kip2 (p57, cdkn1c), los cuales comparten un dominio N-terminal conservado, que media la unión a ciclinas y CDK40.
Por otro lado, es bien sabido que p21 es un objetivo transcripcional importante de p53 fosforilado, y se encarga de la detención del ciclo celular inducida por daño al DNA en G1 principalmente. Además, inhibe al complejo de la ciclina D con CDK4 y CDK6, por lo que pRb (retinoblastoma protein) no puede ser fosforilada, quedándose unida al factor de transcripción E2F, el cual queda bloqueado de esta forma23. Sin embargo, interesantemente, el rol de p21 no se limita a la progresión del ciclo celular, encontrándose implicado en los mecanismos de apoptosis provocados por la nefrotoxicidad del CDDP.
Megyesi et al., en 1996, reportaron que el mRNA de p21 es rápidamente sintetizado hasta altos niveles en riñón de ratones, después de provocar IRA con CDDP41. Esto se realizó con ratones knockout para p53, demostrando que la activación del gen p21 era a través de una vía independiente de p53. Así mismo, en 1998, Megyesi et al. realizaron otro estudio en ratones homocigóticos para una deleción en el gen p21. Después de la administración de CDDP, en comparación con la cepa salvaje, encontraron que los ratones knockout p21 mostraron un inicio más rápido de los signos fisiológicos de IRA, desarrollando un daño morfológico más grave y con una mayor mortalidad42.
Duración en la inducción del proceso apoptóticoComo se mencionó previamente, Wei et al. demostraron mediante inmunodetección la expresión significativa de p53 hasta el día 3 después del tratamiento con CDDP en ratones C57BL/631. Así mismo, otros estudios han reportado que la expresión de las caspasas 3 y 6 en células apoptóticas en cultivo se mantiene hasta 7 días después de la inducción de la apoptosis que, si bien esta no fue inducida con CDDP, se demuestra una tendencia del proceso apoptótico a extenderse más allá de una semana43.
Con relación a esto, vale la pena destacar el trabajo de Eads et al. en el 2016, donde se evaluó la farmacocinética del CDDP en pacientes con cáncer esofágico y daño renal, reportando que este antineoplásico en su forma activa puede ser detectado en plasma hasta 20 días después de su administración y, si bien esta población de estudio tiene una tasa de filtración glomerular disminuida, al comparar los valores de aclaramiento plasmático de platino ultrafiltrable (platino que no está unido a ninguna macromolécula) de estos pacientes con pacientes sanos, se puede apreciar que no varían significativamente44.
El hecho de encontrar evidencia que sustenta que el proceso apoptótico puede mantenerse varios días después de los eventos que dan inicio a este tipo de muerte celular, y que la tasa de aclaramiento plasmático de este antineoplásico es tal que permite que circule varios días por el organismo, explica que se sigan observando datos sugestivos de apoptosis a nivel tubular renal días o semanas después del ingreso de CDDP en el organismo. Al respecto, Liu y Chertow, en el 2010, reportaron que el cisplatino y el carboplatino, al igual que los aminoglucósidos, se acumulan en las células del túbulo proximal provocando IRA después de 7-10 días de exposición13.
Si bien se sabe que el CDDP se mantiene hasta por 3 semanas en el torrente sanguíneo, y la expresión de moléculas relacionadas con el proceso apoptótico tiene una vida media de poco más de una semana, no se ha realizado ningún estudio que correlacione directamente los niveles de CDDP con moléculas implicadas en procesos de muerte celular.
Estrategias renoprotectoras contra los efectos del cisplatinoComo ha sido expuesto en este artículo, existe copiosa información bibliográfica que demuestra los distintos efectos del CDDP en el riñón a nivel molecular, la cual es el fundamento para la búsqueda de nuevos posibles tratamientos, e incluso, estrategias renoprotectoras que disminuyan los efectos secundarios de los antineoplásicos en pacientes oncológicos.
Entre los genes analizados en este artículo se encuentra el factor de transcripción PPAR, acerca del cual muchos estudios han demostrado que la disminución en los niveles de expresión y actividad transcripcional de PPAR-α está relacionada con el desarrollo de IRA causada por CDDP, y que los ligandos de PPAR-α, como WY14643, reestablecen la estructura y función normales del riñón14. En otros estudios se demostró que la PGI2 puede actuar como un inductor de PPAR-α, potenciando la translocación de PPAR-α en el núcleo y la unión al factor de transcripción inflamatorio NFκB, inhibiendo así la apoptosis inducida por TNF-α en células epiteliales renales45. Incluso existe evidencia a nivel clínico, y en experimentos con roedores, que sugiere efectos benéficos por la activación de PPAR-α en nefropatía diabética46.
Por otro lado, como se mencionó anteriormente, la expresión de HO-1 está relacionada con el aumento de ROS provocado por el estrés oxidativo inducido por CDDP. Estudios in vitro en células de túbulos proximales renales de humanos demuestran que la hemina, un inductor de HO-1, atenuó significativamente la apoptosis y necrosis inducida por CDDP, mientras que la inhibición de la actividad de la enzima HO-1 revirtió el efecto citoprotector25. Con este dato, se pueden diseñar posibles estrategias para la expresión génica dirigida a HO-1, así como el desarrollo de nuevos inductores fisiológicamente relevantes del gen HO-1 endógeno como una modalidad terapéutica y preventiva en entornos de alto riesgo de IRA.
Así mismo, dados los efectos de p53 sobre muchos genes que desencadenan los eventos apoptóticos en las células, se han diseñado distintos inhibidores farmacológicos para p53, tales como pitfirina-α, que ha demostrado ser un potente inhibidor de esta proteína30,33,36,38, o el α-2-(2-imino-4,5,6,7-tetrahidrobenzotiazol-3-il)-1-p-toliletano (PFT)29. Y aunque si bien la inhibición de p53 ha dado resultados benéficos en modelos de insuficiencia renal, también existen inhibidores de otros genes como PUMA, tales como la proteína ABT-737, que contiene un sitio de unión al dominio BH3 de las proteínas proapoptóticas de la familia Bcl-2, con lo que logra unirse a ellas en sus surcos hidrofóbicos de superficie, neutralizándolas47. Y dado que PUMA representa prácticamente toda la actividad proapoptótica de p53, es preferible usar inhibidores contra esta proteína, ya que algunos inhibidores para p53 suelen presentar toxicidades adversas33. Sin embargo, se están desarrollando oligodesoxinucleótidos antisentido, los cuales contienen elementos enhancers que, al penetrar a las células, se unen al DNA en sitios específicos de unión a proteínas y de esa forma interfieren con la transcripción genética in vitro e in vivo, lo cual representa una poderosa herramienta de manipulación génica, que puede ser dirigida a los diferentes órganos para silenciar genes específicos (E2F, p53, p21, entre otros) y evitar los efectos secundarios de la quimioterapia o prevenir la progresión de enfermedades como la insuficiencia renal.
Finalmente, también es recomendable seguir investigando los efectos nefrotóxicos por CDDP en el asa de Henle, una vez que se ha descrito que sus funciones pueden afectarse por el desequilibrio en la homeostasis del magnesio, o bien por la reducción de transportadores que se expresan en su membrana. Así mismo, se requiere profundizar en la investigación sobre cómo el FasL soluble puede contribuir en el proceso inflamatorio local, ya sea proapoptótico o antiapoptótico.
ConclusiónEl CDDP es un antineoplásico que actúa en distintos niveles moleculares, siendo capaz de activar tanto vías apoptóticas como detener procesos metabólicos importantes para el desarrollo celular. El mecanismo de acción más importante radica en su interacción con el DNA, formando aductos que alteran la transcripción de genes que participan en diversos procesos celulares.
Una propuesta para intentar disminuir los efectos secundarios de los compuestos derivados del platino consiste en contemplar la adición de una molécula al átomo de platino, que permita al antineoplásico interferir de forma específica con una vía de señalización al unirse a una proteína en especial, y que sus efectos ya no radiquen solamente en la formación de aductos en el DNA.
Existe aún mucho por investigar, y los mecanismos moleculares exactos por los cuales las enfermedades deterioran el organismo siguen siendo un enigma, por lo que conocer el papel de ciertas moléculas clave en las vías de señalización más importantes representa el reto a seguir en el desarrollo de tratamientos cada vez más específicos y efectivos.
Conflicto de interesesLos autores no tienen conflictos de interés que declarar.