Antecedentes: Los pacientes con enfermedad renal crónica (ERC) tienen con frecuencia patología cardíaca asociada. La coincidencia de ambos procesos puede potenciar la inflamación, aumentando los requerimientos de eritropoyetina (EPO) y empeorando la supervivencia. Objetivos: Conocer la prevalencia de patología cardíaca, su influencia en la dosis de EPO y la de ambos factores sobre la mortalidad en pacientes con ERC 4-5 no-D (no diálisis). Métodos: 134 pacientes (68% con EPO al inicio y el 72,3% a lo largo del seguimiento) seguidos durante 36 meses. Para evaluar la respuesta a la EPO se utilizó su índice de resistencia a la eritropoyetina (IRE): dosis de EPO semanal/peso/hemoglobina (Hb); el IRE se estimó basalmente y durante el período de los seis meses precedentes a la finalización del estudio. Resultados: 39 pacientes (29,1%), antecedentes de cardiopatía; 22 (16,4%), episodios de insuficiencia cardíaca (IC). El IRE fue superior en los pacientes con antecedentes de cardiopatía, con IC y en los tratados con inhibidores de la enzima convertidora de angiotensina/antagonistas de los receptores de angiotensina II; en el análisis multivariante (IRE como variable dependiente) compusieron el modelo final: ferritina, Hb, función renal y episodios de IC. Durante el período de seguimiento, 39 pacientes fallecieron. La supervivencia (Kaplan-Meier) a los 36 meses fue inferior en los pacientes con un IRE superior a la mediana (2,6 UI semana/kg/g de Hb en 100 ml) (p = 0,002), los que habían sufrido episodios de IC (p = 0,001) y los que tenían antecedentes de cardiopatía (p < 0,001). Conclusiones: Los pacientes con antecedentes cardiológicos en general y de IC en particular tienen un IRE aumentado. Tanto la presencia de estos antecedentes como un mayor IRE se asocian a la disminución de la supervivencia, pudiendo considerarse el IRE como marcador de riesgo de muerte a corto-medio plazo.
Introduction: Patients with chronic kidney disease (CKD) frequently suffer from heart disease as well. The combination of the two processes can exacerbate inflammation, resulting in increases in both resistance to erythropoietin (EPO) and mortality. Objectives: The aim of this study was to determine the prevalence of heart disease in a representative group of non-dialysis patients with stage 4-5 CKD, and the influence of that entity on EPO requirements and on mortality during a period of 36 months. Methods: 134 patients (68% on EPO at the beginning, increasing to 72.3% during follow-up) were monitored for 36 months. To evaluate the dose-response effect of EPO therapy, we used the erythropoietin resistance index (ERI) calculated as the weekly weight-adjusted dose of EPO divided by the haemoglobin level. The ERI was determined both initially and during the last six months before the end of the study. Results: 39 patients (29.1%) had history of heart disease; 22 (16.4%) had suffered from heart failure (HF). The ERI was higher in patients with a history of heart disease or HF and those treated with drugs acting on the renin-angiotensin system (ACE inhibitors or ARBs). Using ERI as the dependent variable in the multivariate analysis, the variables that composed the final model were ferritin, haemoglobin, glomerular filtration rate and history of HF. The 36 month mortality rate (n=39 patients) was higher in the group having ERI above the median (2.6IU/week/kg/gram of haemoglobin in 100ml) (P=.002), and in the groups with heart disease (P=.001) or HF (P=.001) according to the Kaplan-Meier survival analysis. Conclusions: Patients with history of heart disease or HF have a higher ERI, and all of these characteristics are associated with lower survival. ERI can be considered a marker for risk of death in the short to-medium term.
INTRODUCCIÓN
El principal factor causante de la anemia asociada a la enfermedad renal crónica (ERC) es la disminución (absoluta y relativa) de la síntesis de eritropoyetina (EPO). En un 10% de los pacientes con ERC se describe que existe una respuesta inadecuada al tratamiento con EPO exógena1. La anemia también es frecuente en los pacientes con enfermedades cardiológicas en general y con insuficiencia cardíaca (IC) en particular2, siendo la forma más frecuente la anemia asociada a trastornos crónicos3, donde se comprueba un déficit relativo de EPO —resistencia a la EPO endógena— junto con un bloqueo de la utilización de Fe provocados, en gran parte, por un aumento de citocinas4. En los procesos inflamatorios suele producirse un incremento de hepcidina que impide la liberación de Fe por parte de las células intestinales y las del sistema reticuloendotelial. La inflamación es un factor importante en la IC y en la ERC. En esta última, el aumento de hepcidina está favorecido por la disminución de su excreción renal5. En ambas situaciones, ERC e IC, la disminución de la disponibilidad de Fe es un factor que actúa potenciando la anemia.
En los pacientes en los que coinciden simultáneamente los dos procesos —síndrome renocardíaco crónico IV y V según la clasificación de Ronco6—, es de esperar que la resistencia a la EPO ocurra con más frecuencia, precisando la administración de dosis mayores para mantener niveles de hemoglobina (Hb) similares, como se ha objetivado en estudios previos realizados en pacientes en hemodiálisis con antecedentes de IC7.
La finalidad de este estudio es doble: a) examinar la prevalencia de enfermedades cardiológicas en general y de episodios de IC en particular, y su influencia sobre la dosis de EPO utilizada en una muestra representativa de nuestros pacientes con ERC en estadios 4-5; b) estudiar prospectivamente, en esta población de ERC, la influencia de la patología cardíaca preexistente y de las necesidades de EPO sobre su supervivencia después de tres años de observación.
MATERIAL Y MÉTODOS
Estudio transversal (para el análisis de la prevalencia) y longitudinal (para el análisis de la supervivencia) en el que se incluyeron todos los pacientes atendidos de forma consecutiva en la Unidad de Enfermedad Renal Crónica Avanzada (ERCA) desde primeros de enero a finales de febrero de 2008. El período de observación terminó el 28 de febrero de 2011 e incluyó la situación del paciente al completarse dicho período (continúa en seguimiento en consulta, diálisis, trasplante o fallecido). Para el estudio global de la prevalencia de alteraciones cardiológicas y de supervivencia, no se excluyó a ningún paciente. Se reclutaron 134 pacientes, que representaban el 16% de los 824 atendidos en dicha Unidad a lo largo de 2008. Un paciente era portador del virus de la hepatitis B y otro del virus de la hepatitis C. Para el análisis basal del subgrupo de los que recibían tratamiento con EPO (n = 91) se excluyeron dos pacientes por presentar procesos asociados de gravedad (cirrosis hepática con hipertensión portal avanzada en un caso, y proceso infeccioso crónico asociado a una fístula entero-cutánea tras radioterapia en el otro) que precisaban una dosis de EPO superior a 20.000 U/semana, quedando para el estudio basal 89 pacientes. Adicionalmente, seis pacientes que no estaban en tratamiento con EPO en el momento de su inclusión en el estudio lo iniciaron o reiniciaron a lo largo de los tres años de seguimiento, por lo que el estudio de supervivencia con relación a la dosis de EPO estaba constituido por 97 pacientes. En resumen, 89 pacientes participaron en el estudio basal y 97 formaron parte del estudio de supervivencia según las dosis de EPO.
Se recogieron de su historia clínica los datos demográficos y antropométricos, presión arterial media, etiología de la ERC, antecedentes cardiológicos, que incluía cardiopatía isquémica (infarto agudo de miocardio o angina diagnosticada y seguida por Cardiología), valvulopatías en grado grave o arritmia (fibrilación auricular en todos los casos) y antecedentes de episodios de IC, definidos como crisis de fallo ventricular izquierdo, manifestado como disnea de origen cardíaco que requirió tratamiento hospitalario y considerado o diagnosticado así en los antecedentes que constaban en la historia clínica del paciente. Asimismo, se recogieron los datos sobre tratamiento con inhibidores de la enzima convertidora de angiotensina/antagonistas de los receptores de angiotensina II (IECA/ARA II), fecha de fallecimiento y causa del mismo cuando era conocida. Durante el tiempo de seguimiento del estudio fallecieron 39 pacientes (33 en consulta y 6 tras pasar a diálisis).
Todos los pacientes en tratamiento utilizaron EPO beta (eritropoyetina beta) por vía subcutánea. Para la medida de los requerimientos de EPO se utilizó el índice de resistencia a la eritropoyetina (IRE): unidades de EPO semanal/peso en kg/Hb en g en 100 ml. En el caso de pacientes que pasaron a diálisis o fallecieron dentro del primer año de seguimiento, se ha utilizado para el análisis de la supervivencia el valor del IRE basal (al inicio del estudio). En el caso de pacientes que iniciaron diálisis o fallecieron después del primer año, se ha utilizado el IRE medio: media aritmética del IRE basal y el IRE final, que se refiere al calculado con los datos recogidos del período correspondiente a los 6 meses previos a producirse el fallecimiento, la entrada en diálisis o el final del período de observación. Así, en el estudio de supervivencia, el IRE medio en unos casos corresponde al IRE basal y en el resto a la media del IRE basal y el IRE final.
Las determinaciones analizadas fueron las siguientes: proteína C reactiva (PCR), homocisteína, hemograma, depósitos de Fe, función renal medida mediante el aclaramiento de creatinina con orina de 24 horas y la estimada con la ecuación de Cockcroft-Gault normalizados a la superficie corporal (calculada por la fórmula de Mosteller), ácido úrico, metabolismo Ca-P, hormona paratiroidea y proteinuria. Como indicador de comorbilidad se empleó el índice de Charlson.
El análisis estadístico se efectuó con el paquete estadístico IBM SPSS 18. En el estudio descriptivo de la población se utilizaron las frecuencias absolutas y relativas para las variables categóricas; las variables cuantitativas se representaron mediante la media y la desviación típica en la población total, mientras que para los subgrupos de estudio se empleó la mediana, el percentil 25 y el percentil 75, al no seguir una distribución normal. Para la comparación de grupos, según su IRE fuera mayor o inferior a la mediana, se utilizó el test de la U de Mann-Withney con las variables cuantitativas, y el de la χ2 para las cualitativas. Para estudiar las correlaciones de las dosis de EPO con las distintas variables, se empleó el coeficiente de correlación de Spearman. Las variables que influían en el IRE se analizaron mediante análisis de regresión lineal por pasos sucesivos hacia delante, utilizando el IRE como variable dependiente. El estudio de la supervivencia se efectuó mediante las curvas de Kaplan-Mayer (log-rank).
RESULTADOS
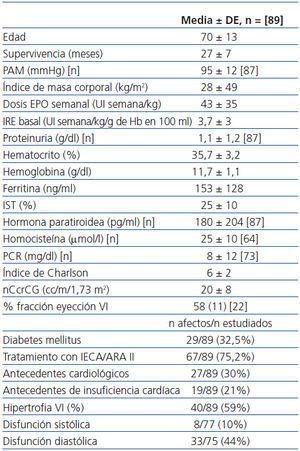
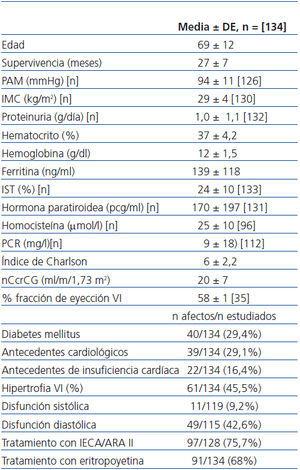
De los 134 pacientes estudiados (51% mujeres/49% hombres), la causa de la ERC fue la siguiente: 36%, nefropatía vascular; 27%, nefropatía diabética; 10%, nefropatía túbulo intersticial de etiología diversa; 10%, causa no filiada; 8%, glomerulopatía crónica diagnosticada mediante biopsia renal; 4%, poliquistosis renal; 5%, enfermedades sistémicas (lupus eritematoso sistémico, artritis reumatoide, síndrome de Sjögren, síndrome hemolítico urémico atípico). Estaban en tratamiento con EPO al inicio del período de observación 91 pacientes (68%) y 97 a lo largo del seguimiento (72,3%). El 96% padecía hipertensión arterial y, de éstos, un 75,7% estaba en tratamiento con IECA/ARA II. Existían antecedentes cardiológicos en 39 pacientes (29,1%) y 22 pacientes (16,4%) tenían antecedentes de episodios de IC. Según los datos ecocardiográficos, 61 pacientes (45,5%) presentaban hipertrofia ventricular izquierda; 49 (42,6%), disfunción diastólica, y 11 (9,2%), disfunción sistólica. En la tabla 1 se recogen estos y otros datos de interés del grupo completo.
Subgrupo de pacientes con eritropoyetina
Los datos basales de este subgrupo de 89 pacientes tratados con EPO al inicio del estudio (tras excluir a los dos pacientes ya mencionados), de los que un 56% eran mujeres y un 43% hombres, se reflejan en la tabla 2.
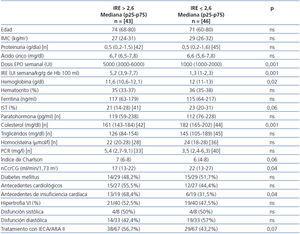
Al comparar a los pacientes, según su IRE basal fuera superior o inferior a la mediana (2,6 U/kg/g en 100 ml) (tabla 3), encontramos diferencias significativas en los niveles de colesterol (p < 0,001), función renal estimada según la ecuación de Cockcroft-Gault normalizada a superficie corporal 1,73 m2 (p = 0,04) y Hb (p = 0,007). El IST e índice de Charlson rozaron la significación (p = 0,06 en ambos casos).
Al comparar las diferentes variables cualitativas, el porcentaje de pacientes con antecedentes de IC fue superior en el grupo con IRE superior a la mediana (p = 0,04). No existieron diferencias significativas entre sexos, porcentaje de diabetes mellitus, antecedentes cardiológicos en general, alteraciones ecocardiográficas ni en el porcentaje de pacientes con tratamiento con IECA/ARA II. No obstante, los pacientes en tratamiento con IECA/ARA II tienen un IRE basal superior al grupo sin este tratamiento: mediana 2,3 (p25-75: 1,1-4,9) vs. 3,6 (p25-75: 2,5-7) U/kg/g de Hb (p = 0,01).
Se encontró una correlación significativa del IRE basal, positiva con los niveles de P (r = 0,246; p = 0,02) y negativa con Ccr (r = –0,373; p < 0,001), Hb (r = –0,323; p = 0,002), Hematocrito (r = –0,216; p = 0,04), colesterol (r = –0,442; p < 0,001) y triglicéridos (r = –0,200; p < 0,03).
El análisis multivariante se efectuó mediante regresión lineal por pasos sucesivos hacia delante, utilizando las diversas variables que se relacionan de forma tradicional con la dosis de EPO (medida por el IRE basal): índice de comorbilidad de Charlson, Hb, ferritina, índice de saturación de la transferrina, función renal estimada mediante la ecuación de Cockcroft-Gault normalizada a superficie corporal, antecedentes de IC (se analizó como ausencia de antecedentes de IC) y antecedentes cardiológicos en general, diabetes mellitus y sexo. De dichas variables: ferritina, Hb, función renal y la ausencia de antecedentes de IC fueron las variables que compusieron el modelo final (tabla 4).
Evolución a los 36 meses
A lo largo de los 36 meses de seguimiento del estudio, del total de 134 pacientes, 31 (23%) iniciaron diálisis, 4 fueron trasplantados de forma anticipada (3%) y 66 (49%) continuaban en la Unidad de ERCA. Han fallecido 39 pacientes (29%): 33 durante su seguimiento en la consulta de ERCA, 6 tras iniciar tratamiento sustitutivo y ninguno de los trasplantados. La causa de muerte en el conjunto de los 39 pacientes fue la siguiente: cardiovascular, 18 (46%); infección, 7 (18%); neoplasia, 6 (15%); otras, 2 (5%) (un paciente por cirrosis y otro por hemorragia digestiva); en 6 (15%) no se conoció la causa (se produjo en el domicilio o en otro centro hospitalario o no se pudo contactar telefónicamente con la familia o ésta la desconocía).
Para analizar la supervivencia a los tres años con relación a la dosis de EPO, medida como IRE medio (97 pacientes, media: 3,3 ± 2,5 U/kg/g de Hb; rango: 0,5-13,1 U/kg/g de Hb; mediana: 2,6 U/kg/g de Hb), como ya se mencionó en el apartado «Material y métodos», se consideró el conjunto de los pacientes que estaban en tratamiento con EPO en el momento de la inclusión y los otros seis que a lo largo del período de observación comenzaron tratamiento con EPO; en total, 97 pacientes.
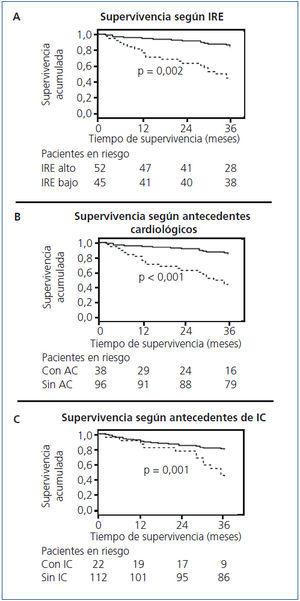
Mediante el estudio de supervivencia de Kaplan-Meier, se observó que los pacientes con un IRE medio superior a la mediana (2,6 U/kg/g de Hb) tenían una supervivencia inferior (log-rank p = 0,002) (figura 1). Asimismo, los pacientes con antecedentes de episodios de IC también tenían una supervivencia inferior: log-rank p = 0,001 (figura 2) y los pacientes con antecedentes cardiológicos en general con log-rank p < 0,001 (figura 3).
Pacientes no tratados con eritropoyetina
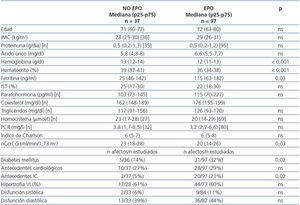
Se compararon distintas variables cuantitativas y cualitativas entre los grupos de pacientes tratados (97 pacientes) y no tratados nunca con EPO (37 pacientes) durante los tres años que duró el período de observación o previamente al mismo. Se apreciaron diferencias estadísticamente significativas en el nivel de Hb, Hto (ambos superiores en los pacientes sin EPO), ferritina (inferior en los pacientes sin EPO) y función renal (mayor en los pacientes sin EPO). Asimismo, los pacientes sin EPO tenían antecedentes de IC y Diabetes Mellitus (DM) en porcentajes inferiores a los pacientes que recibían EPO. Los resultados se muestran en la tabla 5.
No hubo diferencias estadísticamente significativas en la supervivencia de los pacientes que habían sido tratados con EPO con los no tratados mediante estudio de supervivencia de Kaplan-Meier (log-rank p = 0,1).
DISCUSIÓN
Este estudio señala que en una muestra representativa de la población de pacientes con ERC, estadios 4-5 no-D (no diálisis), atendida habitualmente en nuestra Unidad de ERCA, existe una alta comorbilidad —índice de Charlson de 6— y una alta prevalencia de enfermedades cardiológicas. La representatividad viene dada por el hecho de que la muestra está constituida por pacientes atendidos consecutivamente, sin ningún tipo de selección. La edad aumenta la aterosclerosis, de la cual la ERC puede ser una manifestación más, sumándose a las de otras localizaciones (cardíaca, cerebral, arterial periférica). El envejecimiento de la población, por la mejoría de la expectativa de vida, incrementa el tiempo de exposición al riesgo de presentar ERC y es la causa de su aumento preocupante a nivel mundial8,9.
Para valorar la respuesta a la EPO se ha utilizado el IRE, ya empleado en estudios previos10,11. Este índice relaciona la dosis empleada por kg de peso con la cifra de Hb alcanzada; la existencia de valores elevados indica que existen mecanismos que frenan la respuesta eritrocitaria. Tiene también una utilidad pronóstica, ya que el aumento de la resistencia a la EPO se asocia a un mayor riesgo de muerte en pacientes en hemodiálisis7,12. En nuestro estudio también se confirma su utilidad en la ERCA no sometida a diálisis, ya que el porcentaje de pacientes con un IRE superior a la mediana (2,6 U/kg/g de Hb) era mayor dentro de los fallecidos, tendencia que se confirma con el análisis de supervivencia. En un trabajo reciente13, realizado con los datos del estudio TREAT14, efectuado en pacientes diabéticos con ERC 3-4, se utiliza, para valorar la respuesta a la darbepoetina, el porcentaje de modificación de Hb tras las dos primeras dosis, observándose un aumento de la mortalidad y de la incidencia de eventos cardiovasculares en los pacientes del cuartil más bajo de la respuesta de la Hb a la darbepoetina.
Nuestro estudio pone de manifiesto que los pacientes con antecedentes de IC tienen mayores necesidades de EPO. Este hecho se confirma con el análisis multivariante, en un modelo compuesto por el antecedente de IC, los parámetros de función renal, la Hb y los depósitos de Fe, lo que a nuestro juicio fortalece la relación del IRE con la IC en nuestro grupo de pacientes. La resistencia a la acción de la EPO en pacientes con IC ya ha sido observada en pacientes en hemodiálisis7. Esto se explicaría porque la coexistencia de ambas enfermedades condiciona una situación de inflamación de bajo grado, con aumento de la producción de citocinas inflamatorias (IL-1, IL-6, TNF, interferón, etc.), que inducen apoptosis de los progenitores eritroides y, al estimular la producción de hepcidina, disminuyen la disponibilidad del Fe4.
Cuando analizamos y comparamos diversos aspectos de los pacientes con y sin EPO, resalta que los pacientes sin EPO tienen menos incidencia de IC y de DM, así como mayor Hb. Sin embargo, este perfil de paciente, teóricamente más saludable, no se traduce en una diferencia en la supervivencia, al menos en nuestro grupo. No se descarta que en una muestra más numerosa los pacientes que no precisen EPO muestren mayor supervivencia que los tratados con EPO.
Aunque el nivel de PCR, considerado un parámetro de inflamación, fue más elevado en los pacientes con mayor IRE basal, la diferencia no fue significativa, hecho que bien pudiera explicarse por la dispersión tan extensa de los valores recogidos, siendo el valor de la mediana de PCR en los pacientes con IRE mayor claramente superior al del grupo con IRE más bajo. En el estudio referido anteriormente13, realizado con los datos del estudio TREAT de pacientes diabéticos con ERC estadios 3-4, también se observan unos niveles de PCR más elevados en los pacientes con menor respuesta a las dos primeras dosis de darbepoetina. Asimismo, esta relación de la respuesta a la EPO y la inflamación también se ha observado con los niveles de EPO endógena. En un reciente trabajo se ha analizado el nivel de EPO endógena de pacientes con DM y ERC (Ccr medio 50 cc/min) con diversos parámetros y su influencia en la mortalidad tras 7 años de seguimiento. En dicho estudio se pone de manifiesto el mayor nivel de EPO endógena en los pacientes con mayor nivel de PCR y antecedentes de patología cardiovascular, así como la mayor mortalidad en este grupo de pacientes15.
Los niveles de homocisteína suelen estar elevados en la insuficiencia renal, al disminuir su eliminación urinaria16,17. Aunque su aumento se ha asociado con un mayor riesgo vascular, no hemos encontrado diferencias significativas en los pacientes con mayor IRE, posiblemente debido a que el factor que más influye en sus niveles séricos sea la función renal, similar en ambos grupos.
El IRE basal se correlacionó de forma negativa con la función renal (también en la regresión lineal), como era de esperar, dado que la síntesis de EPO endógena es principalmente renal, dependiente de la masa crítica renal funcionante1. En un estudio realizado en pacientes con ERC 3-4, en el que se valoró la respuesta a EPO cuando su dosis era inferior a 100 U/kg/semana, no se encontró, sin embargo, esta relación inversa entre la dosis de EPO y la función renal18. Esto podría explicarse porque sus pacientes presentan un filtrado glomerular (25-60 ml/minuto) más elevado que el de los nuestros. A estos niveles de función renal, posiblemente otros factores (edad, Hb previa, depósitos de Fe, tratamiento IECA, índice de masa corporal, proteinuria) tuvieron más influencia en la respuesta a la EPO.
En nuestro estudio, el tratamiento con inhibidores del sistema renina-angiotensina ha demostrado que influye en el IRE, que es mayor en los pacientes con estos fármacos. Este efecto se ha descrito previamente tanto en pacientes con EPO, precisando dosis más altas, como en los que desarrollan anemia tras la introducción de IECA o ARA II19. Si bien el mecanismo subyacente no se conoce con exactitud, se sabe que la angiotensina II regula los niveles circulantes de EPO tanto en individuos normales como en pacientes con ERC, y que la activación del SRA aumenta los niveles de EPO, por lo que el empleo de los inhibidores del sistema renina-angiotensina disminuirá los niveles endógenos de EPO, empeorará la anemia y aumentará los requerimientos de EPO exógena20.
El nivel de colesterol sérico se correlacionó inversamente con el IRE basal. En pacientes en hemodiálisis está descrita esta relación21, y se ha explicado porque los niveles bajos de colesterol son un marcador de la existencia de malnutricióninflamación, lo que justificaría una menor supervivencia de estos pacientes, al contrario de lo que sucede en la población sin ERC. Igual ocurre con la obesidad en pacientes en hemodiálisis (no se ha encontrado de manera uniforme en los pacientes en diálisis peritoneal), donde no aumenta el riesgo cardiovascular, al contrario que en la población general, formando parte de la conocida como «epidemiología inversa», descrita en el estudio DOPPS22.
A la hora de valorar la relación de las dosis de EPO, IRE y nivel de Hb en los pacientes con ERC e IC, es importante señalar la complejidad del tratamiento con EPO en esta situación, cada vez más frecuente, ya que el nivel de Hb puede bajar y subir de forma «no real» en relación con la intensidad del tratamiento diurético y la coexistencia de edemas (hemoconcentración y hemodilución). Debido a estas circunstancias, pueden introducirse cambios en las dosis de EPO sin que se haya modificado la masa real de glóbulos rojos, por lo que el nefrólogo debe ajustar la dosis de EPO en estos pacientes teniendo siempre en mente la influencia de los cambios de volumen plasmático en la concentración de Hb23-25.
Dentro de las limitaciones del estudio, podemos considerar, en primer lugar, que se trata de un número pequeño de pacientes, pero, por otro lado, aporta la ventaja de la homogeneidad, al pertenecer a una sola consulta, un solo observador y ser atendidos de forma consecutiva, con los mismos criterios terapéuticos, disminuyendo los sesgos de población y observador. Para compensar el sesgo que supondría relacionar el IRE basal con la evolución a lo largo de los tres años de seguimiento, se ha recogido una segunda medida del IRE (en los 6 meses anteriores al éxitus, la entrada en diálisis o el final del período de observación en los pacientes que siguen en consulta) y se ha utilizado el IRE medio al estudiar la supervivencia. Con esto consolidamos la relación del IRE con la evolución observada. Con todo, este trabajo y sus conclusiones tienen las limitaciones de todos los análisis de supervivencia, como la baja tasa de eventos en alguno de los grupos, que impide calcular la mediana de supervivencia, riesgo dependiente del tiempo, etc.
A favor de la utilidad del estudio está la aportación que supone ante la escasez de trabajos en los que se analice la evolución de los pacientes con ERCA (ERC 3-4 no-D) en relación con la morbilidad cardiológica, de gran prevalencia y que, posiblemente, dado el perfil de la población y la tendencia de la misma, va a ir en aumento.
Si bien algunos hallazgos de los estudios con pacientes en diálisis pueden ser superponibles a los que acontecen en los estadios previos de ERC, existen diferencias muy notables. El IRE y las dosis de EPO/kg en la ERC 4-5 no-D son muy inferiores a los existentes en hemodiálisis. Así, en el trabajo de López Gómez7, estudio multicéntrico español en pacientes durante el primer año de inclusión en hemodiálisis, la media del IRE era de 10,2 ± 7,3 U/kg/g de Hb, mientras que en nuestro estudio ha sido de 3,7 ± 3 U/kg/g de Hb, casi una tercera parte. Posiblemente, la mayor función renal de nuestros pacientes y la ausencia de la influencia negativa de la hemodiálisis juegan un papel fundamental en esta diferencia, ya que la comorbilidad (índice de Charlson), el porcentaje de alteraciones cardíacas y la edad son muy similares.
En conjunto, el perfil del paciente con ERC e IRE elevado es el siguiente: antecedentes cardiológicos en general o episodios de IC en particular, mayor índice Charlson y ferritina, así como niveles más reducidos de función renal, Hb y colesterol.
En resumen, este estudio muestra que existe una alta prevalencia de patología cardíaca en los pacientes de la consulta de ERCA. La coexistencia de ERC e IC aumenta las necesidades de EPO, tanto de forma absoluta como con relación a la Hb, expresado con el índice de resistencia. Asimismo, tanto los antecedentes cardiológicos y episodios de IC como un alto IRE parecen asociarse a una menor supervivencia, pudiendo considerarse como marcadores de riesgo de muerte a corto-medio plazo. Un IRE elevado puede ser un marcador de los pacientes en los que hay que aumentar la intensidad diagnóstica y terapéutica.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 2. Características de los pacientes (subgrupo con eritropoyetina)
Tabla 5. Pacientes con tratamiento con eritropoyetina y sin él
Tabla 3. Índice de resistencia a la eritropoyetina (IRE) > o <= 2,6 UI semana/kg/gHb en 100 ml
Tabla 4. Regresión lineal por pasos sucesivos hacia delante
Figura 1. Análisis de supervivencia
Tabla 1. Características de los pacientes (grupo completo)