Introducción: La enfermedad cardiovascular es la principal causa de muerte en los pacientes con enfermedad renal crónica. La hipertrofia ventricular izquierda (HVI) es la manifestación más frecuente y está relacionada con la hipertensión arterial y la hiperhidratación. El objetivo del presente trabajo es estratificar a los pacientes en diálisis según el estado de hidratación y valorar las posibles alteraciones ecocardiográficas en los distintos grupos. Métodos: Realizamos un estudio transversal de 117 pacientes, 65 en hemodiálisis (HD) y 52 en diálisis peritoneal (DP). Las exploraciones realizadas fueron: bioimpedancia multifrecuencia con el sistema BCM-Body Composition Monitor de Freesenius, ecocardiografía transtorácica y analítica de sangre. Definimos hiperhidratación cuando el cociente volumen extracelular-volumen corporal total (ECW/TBW) normalizado para edad y sexo es > 2,5% de la desviación estándar. Resultados: Los pacientes en HD están pre-HD (67,1%) más hiperhidratados de forma significativa que los de DP (46,1%), presentando casi la mitad de la población hiperhidratada hipertensión arterial; tras la sesión de HD se consigue un mejor control del estado de hidratación (26,1%). Los pacientes en DP presentan con más frecuencia cifras de tensión arterial alta y/o llevan tratamiento antihipertensivo (DP 76,9 vs. HD 49,2%). La HVI es más frecuente en los pacientes en HD e hiperhidratados, siendo la más prevalente la HVI excéntrica. Los pacientes hiperhidratados presentan cifras superiores, de forma significativa, del IVAI (volumen de aurícula izquierda indexada por superficie corporal, la IMVI (masa ventricular izquierda indexada) y el cociente sobrehidratación-agua extracelular. Conclusiones: La bioimpedancia es una técnica que nos permite detectar un gran número de pacientes hiperhidratados. Al estudiar las alteraciones ecocardiográficas en los pacientes en diálisis encontramos una alta correlación entre el estado de hidratación por ECW/TBW normalizado para edad y sexo, y el IVAI e IMVI.
Introduction: Cardiovascular disease is the main cause of death in Chronic Kidney Disease patients. Left ventricular hypertrophy is the most common manifestation and it is linked to arterial hypertension and overhydration. The goal of this paper is to stratify dialyzed patients according to hydration status and to make an evaluation about the possible echocardiography alterations of the different groups. Methods: a transversal study was carried out with 117 patients: 65 were on hemodialysis and 52 on peritoneal dialysis. We performed the following tests: multifrequency bioimpedance with the BCM-Body Composition Freesenius’ Monitor system, transthoracic echocardiography, and blood tests. If ECW/TBW (extracellular water vs total body water) normalization ratio for age and gender was > 2.5% SD, the patient was considered overhydrated. Results: HD patients are significantly overhydrated before HD (67.1%) compared to DP patients (46.1%), and almost half of the overhydrated population presents arterial hypertension. However, after an HD session, a better control of the hydration status is reached (26.1%). DP patients frequently present high arterial pressure and/or are under antihypertensive treatment (DP 76.9% vs HD 49.2%). Left ventricular hypertrophy is much more common in HD overhydrated patients, eccentric LVH being more prevalent. Overhydrated patients present significantly high values of LAVI, ILVM, OH/ECW. Conclusions: Bioimpedance technique allows for the detection of a large number of overhydrated patients. Echocardiographic alterations in dialyzed patients show a high correlation between the hydration stage by ECW/TBW normalized ratio for age and gender and the LAVI and ILVM.
INTRODUCCIÓN
La principal causa de muerte en los pacientes con enfermedad renal crónica (ERC) es la enfermedad cardiovascular1. Esto es debido a la presencia habitual de factores de riesgo tradicionales como diabetes mellitus, hipertensión arterial (HTA), dislipemia y edad avanzada2 y a la propia enfermedad renal, por el estado habitual de sobrehidratación, cardiomiopatía urémica y daño vascular (aterosclerosis, calcificaciones vasculares y rigidez arterial).
Las principales manifestaciones de enfermedad cardiovascular en estos pacientes son la enfermedad arterial vascular y la miocardiopatía3. La elevada prevalencia de miocardiopatía se debe a la HTA y la arterioesclerosis, que crean sobrecarga de presión, y lleva al desarrollo de la hipertrofia ventricular izquierda (HVI) concéntrica. La anemia, la sobrecarga de líquido y la fístula arteriovenosa crean sobrecarga de volumen, que conduce a dilatación de ventrículo izquierdo con HVI excéntrica4,5,6.
Existen diferentes métodos para valorar el estado de hidratación. La valoración de la vena cava inferior y parámetros bioquímicos como el péptido natriurético B (BNP) son métodos útiles para valorar el estado de hidratación intravascular7, mientras que la bioimpedancia espectroscópica (BIS) valora el estado de hidratación corporal y extracelular8. Esta última es una técnica sencilla, barata, reproducible, no invasiva y de fácil aplicación, que está basada en la resistencia que ofrece el cuerpo humano al paso de una corriente eléctrica alterna. Nos permite valorar no solamente el estado de hidratación, sino también el volumen intracelular, volumen extracelular, cociente extra e intracelular, el volumen de agua total, así como parámetros nutricionales.
El motivo del presente trabajo es estratificar a los pacientes en diálisis según el estado de hidratación y valorar las posibles alteraciones ecocardiográficas en los distintos grupos según la técnica de diálisis.
MÉTODO
Pacientes
Realizamos un estudio transversal y observacional en 117 pacientes, clínicamente estables, pertenecientes al programa de diálisis del Hospital Clínico Universitario de Valencia entre los años 2008-2010. Los pacientes de la Unidad de Hemodiálisis que formaron parte del estudio fueron 65 (41 hombres), y de la Unidad de Diálisis Peritoneal, 52 (28 hombres). Se excluyeron aquellos que presentaban amputación de algún miembro, portadores de marcapasos o prótesis metálica que interfiriera en la realización de la bioimpedancia, así como los que presentaban algún tipo de arritmia o valvulopatía grave. Todos los pacientes firmaron el consentimiento informado y el protocolo del estudio aprobado por el comité de ética de la fundación del hospital.
Medidas
Las exploraciones a los pacientes en hemodiálisis (HD) se realizaban en mitad de la semana, y a los pacientes en peritoneal se realizaban antes del primer recambio de la mañana con el peritoneo vacío.
Para la valoración del estado de hidratación se utilizó la bioimpedancia multifrecuencia con el sistema BCM-Body Composition Monitor de Freesenius, que mide 50 frecuencias distintas desde 5 hasta 1.000 kHz. Esta técnica ha sido validada por técnicas dilucionales consideradas como patrón de oro9, absorbitometría dual de rayos X y pletismografía10, entre otras11,12. Para la medición utilizamos dos parejas de electrodos: uno en posición distal, un inyector y un sensor, dorsalmente sobre la mano (tercera articulación metacarpo-falángica y del carpo, respectivamente) y otro sobre el pie (tercera articulación metatarso-falángica y tibio-tarsiana). La referencia fue el hemisoma derecho; en HD en el hemisoma libre de accesos vasculares. Los pacientes fueron previamente medidos y pesados correctamente. La exploración se realizó en el grupo de HD antes y después de la sesión. Tanto en HD como en diálisis peritoneal (DP) el paciente tuvo que estar antes de realizar la exploración en decúbito supino durante 15-20 minutos, para ayudar a que se produjera la distribución del exceso de líquido y evitar que la presencia de edema falseara los resultados. Tras la sesión de HD también se esperó este tiempo para que se produjera el equilibrio entre los diferentes compartimentos (intravascular-extravascular-celular).
Entre los diferentes parámetros que obtenemos por BIS, elegimos el cociente volumen extracelular-volumen corporal total (ECW/TBW) para valorar el estado de hidratación y el cociente volumen hiperhidratación-volumen extracelular (OH/ECW) para el riesgo de mortalidad.
Los pacientes se clasificaron por el estado de hidratación por medio del ECW/TBW normalizado para edad y sexo por Lindley et al., que se obtiene de la diferencia entre el cociente teórico que debería tener el paciente en condiciones normales y el obtenido por bioimpedancia. Si la diferencia es > 2,5% el paciente está hiperhidratado (HHD), entre > 2,5% y < 2,5% normohidratado (NHD), < 2,5% deshidratado13.
El OH/ECW es un cociente que actualmente se ha definido como un predictor importante e independiente de mortalidad en los pacientes en diálisis14 cuando es mayor de 15%.
Definimos HTA en aquellos pacientes que presentaran cifras de tensión arterial (TA) > 140/80 mmHg y/o llevaran tratamiento antihipertensivo.
El día de la exploración se realizó una analítica de sangre donde se determinó hemoglobina (mg/dl), calcio (mg/l), fósforo(mg/l), paratohormona (pg/ml), proteínas totales (g/dl) y albúmina (g/dl) en cada paciente.
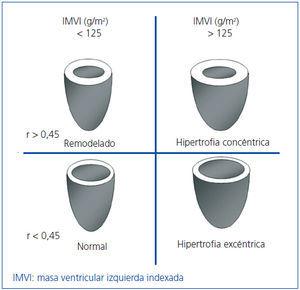
Realizamos la ecocardiografía transtorácica con un transductor multifrecuencia y con el programa doppler tisular (Aloka), antes de realizar la sesión en HD y tras vaciar la cavidad peritoneal en DP. Los registros y mediciones se hicieron siguiendo las recomendaciones de la American Society of Echocardiography (ASE)11,15. La masa ventricular izquierda (MVI) fue calculada usando la fórmula de ASE modificada16,17, que es el método más empleado ya que ha mostrado valores estrechamente relacionados con hallazgos de necropsias: MVI = 0,8 x [1,04 x (DTDVI + GTDS + GTDPP)3 + (DTDVI)3] + 0,6 (DTDVI: diámetro telediastólico de VI; GTDS: grosor telediastólico de septo; GTDPP: gosor telediastólico de pared posterior). La MVI se indexó por superficie corporal (IMVI). Basándonos en los estudios de Devereux et al., el punto de corte para el diagnóstico de HVI por el IMVI fue ≥ 125 g/m2, sin diferenciar por sexo16 (figura 1).
Para clasificar el tipo de HVI calculamos el espesor relativo (ER) con la fórmula: ER = 2 x PP/DTDVI; consideramos un ER normal cuando es < 0,4516.
La valoración de la aurícula izquierda se realizó por la medición del volumen de la aurícula izquierda por el método de Simpson indexado, método de la sumación de discos, donde el volumen de la aurícula izquierda resulta de la sumación individual de todos los discos de la serie. Utilizamos este método por su rapidez y porque correlaciona bien con cualquier método de determinación del volumen de la aurícula izquierda18,19.
Los datos se procesaron con el programa SPSS 15. Los resultados se expresan en media, desviación estándar para los datos con distribución normal; con mediana, rango intercuartil (R Interc) e intervalo de confianza (IC) para las que no presentan distribución normal. Utilizamos comparación de medias con el método de Man-Whitney y T-Student según la distribución de las variables. La regresión lineal se realizó por p-Pearson. Para comparar medias entre dos grupos se realizó con ANOVA para un factor con post doc Bonferroni y Dunnett C según la homogeneidad de las varianzas. Se considera significación estadística p < 0,05. Se realiza un análisis multivariante poniendo como variable dependiente la HVI excéntrica, y como independiente, el resto de las variables del estudio.
RESULTADOS
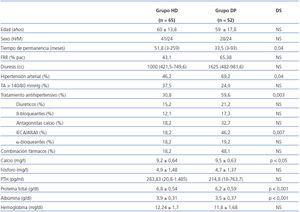
Estudiamos 117 pacientes, 65 pacientes en el grupo de HD y 52 en DP. Las características relevantes demográficas, clínicas y factores de riesgo cardiovascular se especifican en la tabla 1. Destaca que los pacientes que se encuentran en HD tienen una permanencia mayor en la técnica y menor función renal residual (FRR) que los pacientes en DP. A nivel analítico destaca que los pacientes en HD tienen cifras superiores de proteínas totales y albúmina en sangre.
La presencia de HTA es mayor en DP, aunque presentan peor control de cifras en HD. La utilización de fármacos antihipertensivos y su combinación es mayor en los pacientes en DP (59,6% vs. 30,8%). En ambos grupos los fármacos más utilizados son los calcioantagonistas e inhibidores de la enzima conversora de la angiotensina (IECA)/antagonistas de los receptores de angiotensina II (ARAII). Los diuréticos se utilizan con más frecuencia en DP.
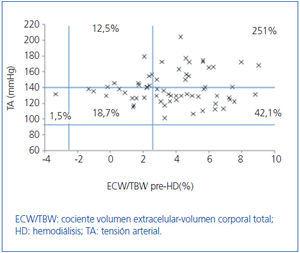
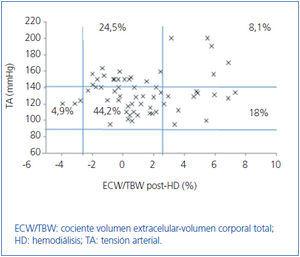
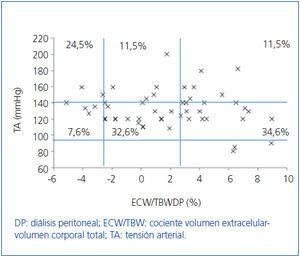
Inicialmente estudiamos en cada grupo de diálisis la relación entre el estado de hidratación y la TA, por medio de ECW/TBW normalizado. Los pacientes en HD antes y después de realizar la sesión presentan el estado de hidratación y las cifras de TA que se especifican en la figura 2 y la figura 3; la distribución de los pacientes en DP se especifica en la figura 4.
En el grupo de HD presentan cifras de TA sistólica (TAS) > 140 mmHg un 37,5%, estando un 25% HHD y 12,5% NHD; el 62,5% están normotensos presentando HHD 42,1% y NHD 18,8%. En el grupo de DP un 24,9% tienen TAS >140, 11,5% HHD y 11,5% NHD; el 74,9% normotensos presentando HHD 34,6% y NHD 32,6%. Observamos en el grupo de HD que tras la sesión se produce un descenso en el número de pacientes HHD (pre-HD 67,1% a 26,1% post-HD), así como un descenso de las cifras de tensión arterial (TAS > 140 37,5% a 32,6%).
Si consideramos en cada grupo de diálisis la presencia de hipertensión (> 140/80 mmHg o tratamiento farmacológico) y el estado de hidratación, observamos en HD HTA 45,45%, de los cuales 30,3% están HHD. Tras la sesión de HD se observa un descenso de pacientes HTA (post-HD 43,4%) y un descenso del número de pacientes HHD (68,1% vs. 27,3%). En DP el 69,2% tiene HTA, de los cuales el 28,8% están HHD. Por tanto, si consideramos las cifras de TA y el tratamiento farmacológico, encontramos también mayor estado de HTA en DP y mayor estado de HHD que los pacientes en post-HD.
La presencia de HHD según ECW/TBW es más frecuente en HD que en DP antes de la sesión de diálisis (pre-HD 67,1 y 46,1% DP), pero tras la sesión de HD se consigue un mejor control del estado de hidratación (post-HD 26,1%).
Al analizar cada grupo de diálisis según el estado de hidratación, en el subgrupo de pacientes HHD en ambas técnicas tienen una permanencia mayor en la técnica (HHD HD 60,9 meses vs. NHD HD 36,5 meses; HHD DP 36,3 meses vs. NHD DP 34,8 meses), presentando diferencia significativa sólo aquéllos en HD. La presencia de FRR es similar en ambas técnicas, aunque menor en el grupo de HHD (FRR HHD HD 34,9% vs. NHD HD 55%; HHD DP 37,5% vs. NHD DP 42,9%).
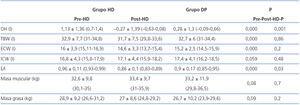
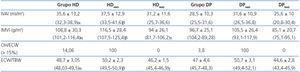
Según los datos obtenidos por BCM, los pacientes en HD tienen significativamente mayor volumen de sobrehidratación (OH) y volumen extracelular/volumen intracelular (E/I) que los de DP (tabla 2).
La segunda fase del estudio consistió en valorar en cada grupo de diálisis, y según el estado de hidratación por ECW/TBW, las características ecocardiográficas y la correlación entre los datos obtenidos por bioimpedancia (tabla 3).
El volumen de aurícula izquierda indexada por superficie corporal (IVAI) y la masa ventricular izquierda indexada (IMVI) son superiores en los pacientes en el grupo de HD y en el subgrupo de HHD de ambas técnicas de forma significativa. El OH/ECW es mayor en los pacientes en HD que en DP de forma significativa (> 15%, 14,06% en HD vs. 3,8% en DP), así como en los pacientes HHD en cada uno de los tipos de diálisis.
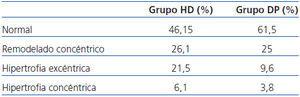
En nuestra población de estudio, si valoramos la geometría del ventrículo izquierdo, observamos la presencia de HVI en un 27,6% del grupo de HD y un 13,4% en DP, la más prevalente en ambos grupos es la excéntrica. Según el estado de hidratación, la presencia de HVI es mayor en el grupo HHD (HD 27,9 vs. DP 20,8%) que en el grupo de NHD (25% vs. 9,5%), siendo la HVI excéntrica la más prevalente (tabla 4 y tabla 5). En el estudio univariable de la HVI excéntrica con todas las variantes, la única que tiene significación es la HVI excéntrica con el estado de hidratación (ECW/TBW normalizado) con una significación p = 0,03 (IC 1,1-11,5).
DISCUSIÓN
La bioimpedancia es una técnica que permite detectar un gran número de pacientes HHD. Es un método de fácil aplicación y podría ser considerado como el patrón de oro de la determinación del estado de hidratación. Se han utilizado diferentes métodos para valorar el estado de hidratación, pero son poco fiables ya que interfieren múltiples factores. La valoración del estado de hidratación por medio de la TA puede verse falseada por el tratamiento antihipertensivo, HTA no dependiente de volumen o presencia de cardiopatías20; la vena cava inferior por la disfunción diastólica indica el volumen intravascular21, etc.; y en los marcadores bioquímicos, como BNP o pro-BNP, pueden interferir la FRR, presencia de cardiopatías22, entre otras.
Encontramos en la literatura que se han utilizado diferentes parámetros para definir el estado de hidratación por bioimpedancia: OH/ECW, ECW/TBW, E/I u OH. Lopot et al. determinan el peso seco óptimo en los pacientes en HD utilizando la desviación entre el ECW/TBW obtenido por bioimpedancia y el obtenido en un grupo control según la edad y sexo; esto se basa en los cambios que se producen en la masa celular (a mayor edad, menor masa celular y por tanto menor volumen intracelular) y el estado de hidratación (a mayor edad y/o sexo femenino, menor volumen intracelular)23. Lindley et al. determinan el peso seco en DP utilizando la diferencia entre el ECW/TBW obtenido por BIS respecto ECW/TBW de un grupo control según la edad y el sexo del paciente13 (definiendo como HHD aquellos que tienen +2,5% de la desviación estándar).
Basándonos en estos principios, nosotros valoramos el estado de hidratación de nuestros pacientes9,24. En el grupo de HD encontramos de forma significativa más pacientes HHD pre-HD (67,1%) que los de DP (46,1%); casi la mitad tiene HTA. Tras la sesión de HD se consigue un mejor control del estado de hidratación (26,1%). Devolder et al. valoran el estado de hidratación por medio de OH/ECW (sobrehidratado OH/ECW > 15%)23, Plum et al. por ECW/TBW25 y Passauer et al. por OH (litros de sobrehidratación > 1,1 l)11 obtienen que en los pacientes en DP es más difícil controlar el estado de hidratación que en post-HD, coincidiendo con nuestros datos.
La distribución corporal del exceso de líquido en los pacientes en diálisis es diferente según el tipo de técnica; por tanto, la repercusión del estado de hidratación en la TA y a nivel cardíaco debe ser diferente. En la literatura el exceso de líquido en los pacientes en DP se encuentra a nivel periférico, en el tejido celular subcutáneo, mientras que en HD se localiza en el torrente circulatorio25. En la HD se produce un aumento del peso corporal en el período interdiálisis (48 horas), por la ingesta de líquido y alimento, y descenso de éste durante la sesión (4 horas) por la ultrafiltración del volumen de agua acumulado y por el transporte convectivo y difusivo de sodio. Se producen cambios bruscos a nivel intravascular, muy lento desde el espacio intersticial por medio del refilling. La ganancia de peso interdiálisis es mayor en aquellos pacientes que no tienen FRR. La técnica de DP se realiza habitualmente de forma continua y el equilibrio entre los diferentes compartimentos se produce de forma constante; la ultrafiltración se produce desde el espacio intersticial.
No hemos de olvidar que la bioimpedancia valora el estado de hidratación intra-extracelular, y no a nivel intravascular. El mayor estado de HHD en HD antes de la sesión se debe la ganancia de peso del período interdiálisis, que se localizará a nivel extracelular e intravascular, dando lugar a un mayor cociente E/I. Tras la sesión de HD se reduce el estado de hidratación por la ultrafiltración del espacio intravascular, y requiere un tiempo para que se equilibren los diferentes compartimentos. En DP observamos un cociente E/I más bajo de forma significativa que en HD (E/I pre-HD 0,96 vs. DP 0,9), debido a un menor volumen extracelular (pre-HD 16 l vs. DP 15,2 l) porque la ultrafiltración en esta técnica se realiza de forma constante. Por tanto, cuando realizamos una bioimpedancia en pacientes de HD, sobre todo después de la sesión, aún no se ha producido el equilibrio entre los distintos compartimentos. Probablemente por esto, los parámetros de hidratación en DP respecto de post-HD puede estar falseados.
En la literatura la prevalencia de HTA en los pacientes en HD es de alrededor del 60%, en el período interdiálisis26, mientras que en DP es superior, 80%27; nuestra prevalencia de HTA es menor. La presencia de cifras de TA alta y/o el tratamiento antihipertensivo es superior en DP (DP 76,9% vs. HD 49,2%), pero tienen mejor control tensional (TA < 140 mmHg, 37,5% HD vs. 24,9% DP), probablemente debido al mayor uso de fármacos antihipertensivos. Los fármacos más utilizados en ambos grupos son los calcioantagonistas e IECA/ARAII.
Los diuréticos se usan más en DP debido a la mayor prevalencia de FRR y esto nos permite aumentar el volumen de diuresis para ajustar el estado de hidratación. La mayor presencia de FRR en DP es debido a que se trata de una técnica continua, con una ultrafiltración constante que impide cambios bruscos de volumen, ayudando a proteger el riñón. Además, los pacientes en HD suelen presentar menor función renal por el mayor uso de nefrotóxicos (aminoglucósidos, contrastes, antiinflamatorios no esteroideos), la bioincompatiblilidad de la membrana de los filtros y/o mayor frecuencia de episodios de hipotensión28,29. Encontramos una correlación inversa del tiempo en diálisis y presencia de FRR en nuestros pacientes, debido a la continua progresión con el tiempo de la enfermedad renal que da lugar al descenso FRR, aunque en la mayoría del estudio el tiempo medio en la técnica es inferior al nuestro.
La mayor frecuencia de HTA en DP puede deberse al mayor estado de hidratación (menor precisión en el ajuste del peso seco, cambios continuos en la membrana peritoneal, etc.). Los pacientes en HD presentan mayor estado de hidratación antes de la sesión de diálisis, pero disminuye tras la sesión, con posterior aumento hasta la próxima sesión, reflejándose estos cambios a nivel tensional. Los pacientes en HD llevan habitualmente menos tratamiento antihipertensivo porque durante la sesión de HD se produce una reducción de volumen a nivel intravascular y éste debe de adaptase. Si el paciente lleva tratamiento antihipertensivo, los mecanismos de compensación y/o adaptación vascular están bloqueados, presentan vasodilatación continua, dando lugar a hipotensiones, con mala tolerancia, e impidiendo alcanzar el peso seco objetivo. Al mismo tiempo se produce el relleno vascular desde el líquido intersticial (refilling), siendo su velocidad distinta según las características del paciente (los pacientes de edad avanzada, diabéticos, con disfunción ventricular o hipertensión pulmonar presentan un refilling muy lento).
La prevalencia de HVI es del 75% de los pacientes en diálisis30,31,32, se desarrolla en los estadios iniciales de la ERC y numerosos estudios han mostrado su aumento en paralelo con la disminución de FG33. La HTA y la hiperhidratación repercuten a nivel cardíaco con el desarrollo de la HVI, entre otros factores de riesgo. Encontramos estudios donde la FRR influye de forma considerable, como el de Wang et al., donde se observa que el 70% de los pacientes con FRR nula presentan alteraciones del modelado ventricular34. El desarrollo de la HVI será diferente según el tipo de sobrecarga: la de líquido o volumen se relaciona con la aparición de HVI excéntrica, mientras que la sobrecarga de presión y la HTA con la HVI, concéntrica. Nosotros encontramos correlación de la HVI excéntrica y el estado de hidratación. Foley y otros autores sugieren que no se produce regresión de la HVI tras iniciar diálisis; es irreversible, debido a la alta mortalidad del paciente35,36. Pero en el último año encontramos en algunos estudios publicados la demostración de que la HVI puede regresar tras años de diálisis. Varias estrategias terapéuticas pueden actuar: el control de la anemia, control del estado de hidratación, uso de antihipertensivos en los pacientes normotensos e hipertensos, uso de la HD diaria o nocturna, prevención y tratamiento de la hiperfosforemia, administración de vitamina D o intervención multifactorial37,38,39. Pero no sólo encontramos regresión en los pacientes en HD, sino también los pacientes en DP40,41.
En nuestro estudio, la prevalencia de HVI es menor (53,5% en HD y 38,4% en DP). La menor presencia de alteraciones cardíacas puede deberse a un aceptable control del estado de hidratación y de la TA, elevada presencia de FRR, así como buen control de cifras de hemoglobina, metabolismo calcio-fósforo, y la utilización de IECA y ARA II. La diferencia encontrada entre ambas técnicas de diálisis se podría explicar por el mayor porcentaje de pacientes con FRR nula en HD31, el menor uso de IECA/ARA II y mayor volumen extracelular. El IVAI refleja el promedio de presiones de llenado aumentadas42, indica la situación funcional del corazón y la sobrecarga; por tanto, el estado de hidratación. Los pacientes en HD tienen un IVAI superior de forma significativa que en DP, así como los pacientes HHD tienen un mayor volumen intravascular y por tanto mayor sobrecarga cardíaca, influyendo en la mayor presencia de HVI.
Por último, analizaremos dos de los marcadores emergentes para la estratificación y monitorización del riesgo cardiovascular en pacientes con ERC, el IVAI y OH/ECW8,14,17,42. Wizemann et al.14 definen el cociente OH/ECW > 15 como factor de riesgo cardiovascular, basándose en el estudio realizado por Wabel et al. donde los pacientes NHD presentan un OH/ECW entre 6,8-15%20. El IVAI es un marcador crónico de la función diastólica, refleja el promedio de las presiones de llenado aumentadas42; se considera el mejor índice de valoración de las presiones de llenado y la situación funcional del corazón, ya que está relacionado con la gravedad y la duración de la disfunción diastólica del ventrículo izquierdo18,19. En nuestro estudio, ambos índices están más elevados en los pacientes en HD, de forma significativa, así como en los pacientes HHD en cada uno de los tipos de diálisis. Por tanto, estar HDD según el cociente normalizado ECW/TBW > 2,5% puede suponer un riesgo elevado cardiovascular.
Con todo esto podemos concluir que la bioimpedancia es una técnica que permite detectar mayor número de pacientes HDD, en ambas técnicas de diálisis. Al estudiar las alteraciones ecocardiográficas en los pacientes en diálisis, encontramos una alta correlación entre el estado de hidratación y el IVAI e IMVI. Sería interesante realizar estudios prospectivos de la población en diálisis para valorar el estado de hidratación y ver si existe regresión en el remodelado cardíaco con el control del estado de hidratación por medio de bioimpedancia.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características de los pacientes en hemodiálisis y diálisis peritoneal
Tabla 3. Parámetros obtenidos por bioimpedancia en los grupos de hemodiálisis y diálisis peritoneal
Tabla 2. Valoración cardíaca y del cociente volumen de sobrehidratación-volumen extracelular según el estado de hidratación en cada grupo de diálisis
Tabla 4. Geometría ventricular izquierda según el tipo de diálisis
Tabla 5. Geometría ventricular izquierda según el estado de hidratación
Figura 1. Patrones de hipertrofia del ventrículo izquierdo
Figura 2. Distribución de los pacientes en hemodiálisis antes de la sesión en función de las cifras de tensión arterial y la diferencia de cociente ECW/TBW
Figura 3. Distribución de los pacientes en hemodiálisis después de la sesión en función de las cifras de tensión arterial y la diferencia de cociente ECW/TBW
Figura 4. Distribución de los pacientes en diálisis peritoneal en función de las cifras de tensión arterial y la diferencia de cociente ECW/TBW