El propósito de este informe de caso es describir la regresión de las calcificaciones vasculares (CV) en una paciente con hiperparatiroidismo secundario (HPTS) tras añadir cinacalcet a su tratamiento. Presentamos un caso clínico de una mujer de 48 años de edad con insuficiencia renal crónica secundaria a nefropatía túbulo-intersticial, tratada con hemodiálisis (HD) de larga duración y sometida a dos trasplantes renales con trasplantectomías. La paciente presentaba HPTS grave causado por la hipertrofia de la glándula paratiroidea; la radiología mostró signos de CV en las arterias radiales e interdigitales y la mamografía, CV lineales múltiples en ambas mamas. Se añadió cinacalcet al tratamiento previo con derivados de la vitamina D y agentes quelantes del fósforo, lo que dio como resultado un buen control del metabolismo mineral. La radiología mostró que las calcificaciones de la arteria interdigital habían desaparecido y que el hueso presentaba un aspecto más estructurado. La mamografía también mostró una regresión de las CV. En conclusión, cinacalcet puede tener potencial para la regresión de las CV en pacientes con HPTS.
The purpose of this case report is to describe the regression of vascular calcifications (VC) in a patient with secondary hyperparathyroidism (SHPT) after having added cinacalcet to her treatment. We present the clinical case of a 48-year-old woman with chronic renal failure secondary to tubulointerstitial disease. She was being treated with long-term haemodialysis (HD) and underwent two kidney transplants with transplantectomies. The patient presented with severe SHPT caused by parathyroid gland hypertrophy. The radiology test showed signs of VC in the radial and interdigital arteries, and VC in a linear arrangement were observed in both breasts on the mammography. Cinacalcet was added to her treatment with vitamin D derivatives and phosphate-binding agents, which resulted in a good control of mineral metabolism. The radiology test showed that the calcification in the interdigital artery had disappeared and that the bone appeared to be more structured. The mammography also showed regression of the VC. To conclude, cinacalcet may have potential for regression of VC in patients with SHPT.
INTRODUCCIÓN
La presencia de calcificaciones vasculares (CV) se ha asociado tradicionalmente con la enfermedad renal crónica (ERC), sin embargo hasta hace pocos años se consideraba un fenómeno pasivo al que se le atribuía poca importancia clínica. En la última década diversos estudios epidemiológicos han identificado la calcificación vascular como un factor pronóstico independiente de mortalidad cardiovascular, tanto en la población general como en la población urémica1-5.
Aunque los mecanismos etiopatogénicos de la CV no se conocen con precisión y son múltiples los factores relacionados con su aparición, las alteraciones del metabolismo mineral son factores claves de este proceso. Hiperfosfatemia, tratamiento con vitamina D, sobredosis de sales de calcio, episodios de hipercalcemia, alteraciones en el remodelado óseo, etc., son causantes directos de la importante carga de CV que sufren los pacientes con problemas renales1-6 .
Hasta ahora, la CV se ha considerado un proceso irreversible, y el esfuerzo del nefrólogo se ha encaminado a enlentecer la progresión de las mismas6,7. Aunque la regresión es improbable, la utilización de las alternativas terapéuticas surgidas en los últimos años y el adecuado control conseguido del hiperparatiroidismo (HPTS) han generado expectativas en este sentido.
La calcificación de la arteria mamaria detectada en la mamografía es una prueba de enfermedad vascular aterosclerótica generalizada, tanto en la población general como en los pacientes diabéticos. La mamografía es una técnica diagnóstica que ofrece una alta sensibilidad para la caracterización de calcificaciones, incluidas las CV, y puede ser una herramienta potencialmente útil para el diagnóstico de CV en mujeres con ERC8.
CASO CLÍNICO
Presentamos el caso de una mujer de 48 años de edad con insuficiencia renal crónica secundaria a nefropatía túbulo-intersticial. La paciente había recibido tratamiento de sustitución con HD de larga duración y había sido sometida a dos trasplantes renales con trasplantectomías: el primero fue debido a un rechazo humoral agudo y el segundo debido a un rechazo humoral y vascular agudo. Retomó el tratamiento de hemodiálisis en marzo de 2005.
Los valores séricos de la hormona paratiroidea intacta (iPTH) fueron altos de forma intermitente. Previamente, la paciente había sido tratada con calcitriol durante períodos cortos de tiempo, ya que la administración provocó hipercalcemia e hiperfosfatemia.
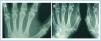
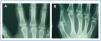
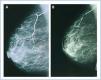
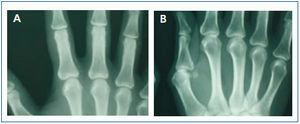
En enero de 2006, presentó HPTS grave (con niveles más elevados de iPTH que los presentados en los meses anteriores). La ecografía paratiroidea reveló una imagen seudonodular hiperecogénica en la zona posteromedial del lóbulo tiroideo izquierdo, que era compatible con una hipertrofia de la glándula paratiroidea. Una serie radiológica mostró signos de hiperparatiroidismo en los huesos de ambas manos y muñecas y CV en las arterias radiales e interdigitales. En la mamografía se observaron múltiples CV lineales en ambas mamas (figura 1A, figura 2A, figura 3A y figura 4A; imágenes de las manos y de las glándulas mamarias en 2006).
La paciente fue tratada únicamente con carbonato cálcico. Posteriormente, se añadieron a la pauta calcitriol oral y sevelamer (800 mg con las comidas principales), un agente quelante del fosfato (P), y se redujo la dosis de carbonato cálcico. La figura 5 muestra los niveles de Ca, P y iPTH sérica. La hiperfosforemia se logró controlar tras dos meses de tratamiento, y el nivel del producto Ca-P fue adecuado, pero los niveles de iPTH aumentaron hasta los 734 pg/ml, por lo que se cambió el tratamiento. Se sustituyó el calcitriol oral por 30 mg de cinacalcet oral una vez al día y alfacalcidol intravenoso (2 µg) inmediatamente después de la hemodiálisis. Las dosis de carbonato cálcico y sevelamer no se modificaron.
Dos meses después, la dosis del calcimimético se redujo debido a los niveles de hipocalcemia (7,6 mg/dl). Se mantuvo el tratamiento con vitamina D intravenosa y carbonato cálcico, y se cambió el calcio del dializado de 2,5 a 3 mEq/l.
Durante los seis meses siguientes, los niveles de todos los parámetros se mantuvieron dentro del intervalo recomendado por las directrices KDOQI. En noviembre de 2006 se observaron una supresión excesiva de la iPTH (138 pg/ml) y una hipercalcemia potencial (9,4 mg/dl), por lo que se suspendió el tratamiento con carbonato cálcico y alfacalcidol. En enero de 2007 se continuó con el tratamiento con sevelamer (800 mg con las comidas principales) y una dosis semanal mínima de calcimimético (30 mg de cinacalcet los lunes y los viernes), lo que dio como resultado un buen control del metabolismo mineral.
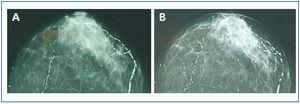
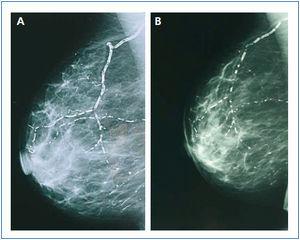
Durante este período, se pudo observar que en la serie radiológica las calcificaciones de la arteria interdigital habían desaparecido y que el hueso presentaba un aspecto más estructurado (figura 1B y figura 2B; imagen de la mano, 2007). También la mamografía mostró una regresión de las CV. Las calcificaciones lineales iniciales fueron sustituidas por calcificaciones irregulares (figura 3B y figura 4B; glándulas mamarias en 2007).
DISCUSIÓN
La enfermedad metabólica ósea asociada con la ERC (EMO-ERC) se define como un trastorno sistémico progresivo y multifactorial, que incluye el conjunto de alteraciones bioquímicas, anomalías óseas y calcificaciones extraesqueléticas anormales que acontecen en los pacientes con ERC. Cada una de estas complicaciones da como resultado importantes consecuencias clínicas que condicionan, a su vez, elevada morbimortalidad en los pacientes urémicos9.
La presencia de CV altera la estructura y la función vascular, siendo éstas las responsables de la aparición de eventos cardiovasculares potencialmente mortales como la cardiopatía isquémica, la insuficiencia cardíaca, los accidentes cerebrovasculares y la enfermedad vascular periférica. Estudios clínicos han mostrado asociación entre la presencia de calcificación en la íntima y/o en la media arterial y mayor riesgo de mortalidad cardiovascular y global1-6.
En consecuencia, en los últimos años, el examen de los pacientes para determinar si presentan CV se ha convertido en parte esencial de la práctica clínica diaria para los nefrólogos. Las directrices KDOQI y las propuestas de KDIGO tienen como objetivo alcanzar un diagnóstico temprano e individualizar los tratamientos para evitar la aparición de aquéllas o atenuar su progresión, ya que la regresión, una vez establecidas, parece poco probable7,9-11 .
Los tratamientos tradicionales para el HPTS y los trastornos minerales (una dieta baja en P, agentes quelantes del P basados en sales de calcio y suplementos de vitamina D) no sólo son insuficientes para la mayoría de los pacientes, sino que a menudo han dado como resultado extensas CV. Las concentraciones elevadas de P, Ca y producto Ca-P predisponen a la aparición de CV e incrementan el riesgo de acontecimientos cardiovasculares adversos1-6,9-11. Por lo tanto, el objetivo del tratamiento debería ser cumplir los criterios de las guías de práctica clínica en la mayor medida de lo posible, minimizando los efectos adversos.
En nuestra paciente, el uso combinado de cinacalcet con vitamina D normalizó los niveles de Ca, P, producto Ca-P y iPTH y se consiguió mantenerlos en los rangos recomendados.
Los diferentes estudios clínicos desarrollados con cinacalcet han puesto de manifiesto su efectividad a la hora de conseguir un adecuado control de las alteraciones bioquímicas asociadas a la EMO-ERC, así como que el tratamiento combinado cinacalcet más vitamina D permite reducir las dosis necesarias de vitamina D disminuyendo, por tanto, sus efectos secundarios12-15. En el caso que presentamos, la combinación de cinacalcet con el tratamiento con vitamina D intravenosa permitió controlar de forma adecuada los niveles de iPTH sin condicionar la aparición de hipercalcemia ni hiperfosforemia. Cuando se administra vitamina D sola, se desarrollan hipercalcemia e hiperfosforemia debido a una mayor absorción intestinal del Ca y el P. En contraste, las concentraciones séricas de Ca y P se reducen con cinacalcet, ya que éste disminuye el flujo desde el hueso como respuesta a las reducciones de la PTH sin una fuente intestinal adicional de mineral16. El uso conjunto de ambos fármacos disminuye los efectos indeseables de la vitamina D al contrarrestarse mutamente e incrementa la inhibición de la secreción de PTH, con lo que se consigue un mejor control de las alteraciones bioquímicas asociadas con la EMO-ERC.
Trabajos experimentales realizados con animales han demostrado que añadir calciomiméticos al tratamiento reduce significativamente la CV en ratas tratadas con calcitriol y paricalcitol, y puede inducir una regresión de la calcificación extraósea. Las ratas urémicas tratadas con calciomiméticos presentan una disminución del grosor de la pared aórtica con un incremento en la expresión de receptores del calcio en la pared de la íntima vascular y atenuanción la presencia de CV17-19. En humanos este efecto protector del cinacalcet sobre las CV también ha sido publicado en casos clínicos de pacientes con ERC e HPTS, como en el caso que nos ocupa20,21.
Los agentes quelantes sin contenido en calcio como sevelamer retrasan el desarrollo de las calcificaciones y mejoran su aspecto, si se comparan con sales cálcicas, y también se han asociado con una reducción de la mortalidad22-24 . Por otra parte, son muchos los estudios que han mostrado que la ingestión de sales de calcio y la consiguiente acumulación de calcio en el cuerpo se asocia con las CV1-6,24. En el caso presentado, se han utilizado ambos quelantes. Es un hecho documentado que el uso de cinacalcet suele asociarse con un incremento en la dosis de carbonato cálcico25,26. Las sales de calcio fueron necesarias en esta paciente para controlar la hipocalcemia que indujo iniciamente el tratamiento con cinacalcet. Se puede observar que en los primeros meses la paciente presentó un balance negativo de calcio, que a nuestro entender podría haber sido determinante en la regresión de las CV en este caso. Por tanto, la pauta terapéutica utilizada en esta paciente, sumando efectos sinérgicos y antagónicos de los fármacos empleados, fue altamente eficaz para controlar el HPT y tuvo como resultado la regresión de las CV.
La regresión es evidente en las imágenes mamográficas, en las que se observa cómo la calcificación lineal fue sustituida por zonas más pequeñas de calcificación parcheada e irregular. En las imágenes se pone de manifiesto la claridad con la que puede observarse la presencia de CV en las mamografías, lo que permite realizar un seguimiento preciso de la evolución de las mismas. Es, por tanto, una técnica útil, económica y accesible para el diagnóstico y el seguimiento de las CV en mujeres con ERC8,27. La presencia de CV en la mamografía se considera un marcador de riesgo cardiovascular en la población general, relacionado con aterosclerosis y diabetes mellitus. Sin embargo, en la población urémica, un estudio recientemente publicado establece la existencia de correlación histológica entre la presencia de CV en la mamografía y la calcificación de la capa media de las arterias28. Mientras que la calcificación intimal se relaciona fundamentalmente con ateromatosis e inflamación, la calcificación arterial medial guarda una mayor relación con la ERC y las alteraciones metabólicas asociadas5. En el caso que presentamos, al tratarse de una mujer joven sin factores de riesgo cardiovascular añadidos, se podría pensar que la calcificación presente en las arterias mamarias estuviera más en relación con la propia ERC y ser de predominio medial. De ser así, se podría justificar la regresión observada de la calcificaciones mamarias al controlar de forma adecuada las alteraciones del EMO-ERC, regresión tan difícil de observar en otros pacientes, en quienes CV intimal y medial confluyen como consecuencia de la interacción de otros muchos factores, lo que hace más difícil conseguir el deseado efecto de la regresión.
En conclusión, este caso demuestra que el uso de un tratamiento adecuado puede dar como resultado una regresión de las CV, y se pone de manifiesto el potencial efecto beneficioso del calciomimético en su regresión.
Figura 1. (A) Imagen radiográfica anteroposterior de la mano izquierda en el año 2006. (B) Imagen radiográfica anteroposterior de la mano izquierda en el año 2007.
Figura 2. (A) Imagen radiográfica anteroposterior de la mano derecha en el año 2006. (B) Imagen radiográfica anteroposterior de la mano derecha en el año 2007.
Figura 3. (A) Imagen radiográfica anteroposterior de la glándula mamaria en el año 2006. (B) Imagen radiográfica anteroposterior de la glándula mamaria en el año 2007.
Figura 4. (A) Imagen radiográfica craneocaudal de la mama en el año 2006. (B) Imagen radiográfica craneocaudal de la mama en el año 2007.
Figura 5. Evolución de los niveles de Ca, P y PTH intacta sérica.