La enfermedad falciforme (EF) es la hemoglobinopatía estructural más frecuente en el mundo. Su afectación renal clínicamente significativa ocurre más frecuentemente en los individuos homocigotos que en los heterocigotos o con hemoglobinopatías mixtas, con la excepción del carcinoma medular renal, que es más frecuente en los portadores del rasgo falciforme. Como en otras manifestaciones de la EF, los fenómenos vasooculsivos son el principal mecanismo etiopatogénico. Sus manifestaciones más frecuentes son la hematuria macroscópica asintomática, las alteraciones funcionales tubulares y la necrosis papilar. Menos frecuentes, pero de peor pronóstico, son la glomerulopatía que conduce a enfermedad renal crónica y el carcinoma medular renal. Debido a la alta tasa de inmigración en España y a una mayor supervivencia de estos pacientes se espera una prevalencia creciente en nuestro país. En 2009, la Asociación Española de Hematología y Hemoterapia elaboró las Guías de manejo de la enfermedad falciforme. Este artículo reproduce el capítulo sobre afectación renal actualizado para su difusión en NEFROLOGÍA.
Patients with sickle cell disease exhibits numerous kidney structural and functional abnormalities, changes that are seen along the entire length of the nephron. Changes are most marked in patients with homozygous sickle cell anemia, but are also seen in those with compound heterozygous states and the sickle cell trait. The renal features of sickle cell disease include some of the most common reasons for referral to nephrologists, such as hematuria, proteinuria, tubular disturbances and chronic kidney disease. Therapy of these conditions requires specialized knowledge of their distinct pathogenic mechanisms. Spanish Haemathology and Hemotherapy Association has recently publicated their Clinical Practice Guidelines of SCD management. Renal chapter is reproduced in this article for Nephrology difussion.
INTRODUCCIÓN
La hemoglobina S (HbS) es la hemoglobinopatía estructural más frecuente y más conocida en el mundo. Es la causante de la enfermedad falciforme (EF), grupo de trastornos que incluyen el estado homocigoto y más grave HbSS y las dobles heterocigocias HbSC y HbS βtalasemia (βº o β+). Cursa con anemia hemolítica crónica y amplia variedad de eventos vasooclusivos y sus consecuencias, vasculopatía proliferativa, así como predisposición a infecciones con importante morbilidad y mortalidad temprana, representa una enfermedad crónica con una importante carga económica y psicosocial. El diagnóstico precoz de la EF permite adoptar medidas preventivas necesarias (profilaxis antibiótica y vacunación) que reducen su morbilidad y mortalidad. La afectación renal en la EF comienza en la infancia, siendo su manifestación más común la hematuria (la primera causa en afroamericanos), la necrosis papilar renal y los defectos de la función tubular, todos ellos desencadenados por fenómenos vasooclusivos. La consecuencia crónica son las glomerulopatías falciformes (albuminuria hasta en un 68% de los adultos con EF) con evolución a insuficiencia renal crónica hasta en un 20% de los pacientes homocigotos1. Ya que la esperanza de vida de los pacientes con EF se ha incrementado en la última década, la prevalencia de ERC secundaria a EF ha aumentado de forma significativa y constituye un factor independiente de mortalidad para estos pacientes2-4. El carcinoma medular renal está asociado al rasgo falciforme (HbAS) y con menor frecuencia a la EF.
Se estima una prevalencia global del gen S en el mundo en 30 millones de personas; afecta especialmente a individuos del África tropical y subtropical, Península Arábiga, India, América Central y EE.UU. Las estimaciones epidemiológicas mundiales cifran en unos 300.000-400.000 los nacimientos anuales afectados de enfermedades hereditarias de la hemoglobina (83% EF, 17% síndromes talasémicos)5-7. En EE.UU. existe una prevalencia de portadores heterocigotos del gen HbS del 8% de la población afroamericana y nacen anualmente 1.500 niños homocigotos. La prevalencia de portadores del gen HbS en la población subsahariana se sitúa entre el 15 y el 30%, con EF en el 2-3% de dicha población, calculándose en torno a 180.000 nacidos anualmente afectados de EF en el África subsahariana6. Las hemoglobinopatías en América son el resultado de migraciones y mestizaje con otros pueblos. El mercado de esclavos africanos tuvo un impacto decisivo en la presencia de hemoglobinas anormales en el Caribe y América tropical, de forma que en Latinoamérica la prevalencia al nacimiento de anemia falciforme es de 0,16‰, y de 6,1-18% la frecuencia de portadores del gen HbS en población de origen africano de países del Caribe.
Desde el año 2000, España ha presentado una de las mayores tasas de inmigración del mundo. Según datos de diciembre de 20108, el 12,2% de los residentes en España son extranjeros, el 44,22% latinoamericanos y el 39% africanos. De ahí el aumento progresivo de la incidencia de hemoglobinopatías en España, junto a la creciente natalidad del colectivo inmigrante, que ya en 2005 superaba el 15% en las Comunidades Autónomas del noreste, centro y este de la península. Según datos del Programa de Prevención de Minusvalías en Recién Nacidos de la Comunidad de Madrid (CAM), que incluye el cribado universal de hemoglobinopatías desde mayo de 2003, se ha observado un aumento progresivo en la prevalencia las mismas, desde un 5,13% en 2004 a un 6,17 en 2005, con una prevalencia global de 5,57% para la serie 2003-2005 (comunicación personal). Sin duda, esto se debe al aumento de inmigración desde países de riesgo recibida en los últimos años y su natalidad en nuestro país (el 74,21% del total de extranjeros nacidos en España son de origen africano, especialmente marroquíes, con el 59,13% de nacidos en España)8.
Ante la escasa experiencia clínica en nuestro país y los recientes avances en el tratamiento de la enfermedad (tratamiento con hidroxiurea [HU], tratamiento de complicaciones de riesgo vital como accidentes cerebrovasculares y síndrome torácico agudo, trasplante de progenitores hemopoyéticos, programas transfusionales y de tratamiento quelante) que mejoran la calidad de vida y prolongan la supervivencia media de los pacientes, el Grupo de Eritropatología de la Sociedad Española de Hematología y Hemoterapia ha tenido la iniciativa de elaborar una guía de tratamiento de la EF que ha sido recientemente publicada9. En este artículo reproducimos el capítulo sobre afectación renal para su difusión en NEFROLOGÍA. En la tabla 1 se resumen las distintas manifestaciones de la EF a nivel renal.
HEMATURIA Y NECROSIS PAPILAR RENAL
Hematuria asintomática
Es la manifestación más frecuente en la EF. Puede ser microscópica o más a menudo macroscópica y autolimitada. Frecuentemente es unilateral, procedente del riñón izquierdo por la mayor longitud de la vena renal izquierda y su localización anatómica que por compresión entre la aorta y la arteria mesentérica superior estaría sometida a una mayor presión venosa con hipoxia relativa en la médula renal que favorece la falciformación. Puede producirse a cualquier edad y se ha descrito sobre todo en el rasgo falciforme (HbAS, mucho más frecuente que la forma homocigota HbSS).
Necrosis papilar renal e infartos renales
Son también una complicación común de la EF, con una prevalencia estimada entre un 30-40% de los pacientes HbSS homocigotos10. Su presentación clínica varía desde hematuria macroscópica asintomática (no siempre presente) hasta un cuadro agudo acompañado de dolor, fiebre e incluso fracaso renal agudo (FRA) obstructivo. Sin embargo, se ha reportado una frecuencia similar de necrosis papilar renal (NPR) en individuos sintomáticos y asintomáticos (65 y 62%, respetivamente)11. A menudo coexiste con infección del tracto urinario (61,5%), por lo que se considera un factor favorecedor o modificador de riesgo.
Anatomía patológica
Los cambios histológicos que suelen estar presentes en la hematuria aislada son relativamente menores y primariamente se produce una congestión medular. Los vasa recta, tras la fase inicial de dilatación y congestión, quedan destruidos dentro de áreas de fibrosis. Las papilas son dependientes de los vasa recta, de forma que tras la destrucción de éstos se producen pequeños infartos focales repetidos de las papilas. La NPR subsiguiente es un proceso focal, y algunos túbulos colectores sobreviven dentro de un área difusa de fibrosis. Los cambios más importantes en la médula renal afectan a la médula interna y a las papilas, cambios todos ellos que resultan en disfunción predominante de los túbulos colectores de las nefronas yuxtamedulares.
Etiopatogenia
La hematuria es probablemente consecuencia de la falciformación en la médula renal combinada con obstrucción vascular y extravasación de hematíes. El ambiente medular es proclive por naturaleza a la falciformación por su presión parcial de O2 de 3540 mmHg, por debajo del umbral de falciformación (45 mmHg), además de su elevada osmolaridad que deshidrata los hematíes concentrando la HbS y de su pH ácido que aumenta la probabilidad de falciformación.
Diagnóstico
La hematuria macroscópica continuada o persistente en un paciente con EF o con rasgo falciforme (HbAS) suele representar una crisis falciforme renal. Sin embargo, deben excluirse otras causas de hematuria tratables más graves, como el carcinoma medular renal. Si existe dolor intenso el diagnóstico diferencial es más amplio, especialmente con crisis renoureteral (por litiasis o papila renal) o infarto renal. La hematuria puede ser asintomática o aparecer dolor lumbar moderado que si es unilateral suele indicar la localización del sangrado.
Para el diagnóstico de NPR es muy importante la sospecha clínica. La ecografía renal es la técnica de elección para su detección y diagnóstico diferencial con la litiasis o el carcinoma medular renal. El hallazgo más precoz de la NPR es una ecogenicidad aumentada de las pirámides medulares (la zona más interna medular), lo que en ausencia de hipercalciuria en un paciente con EF y hematuria sugiere NPR. Posteriormente puede aparecer la calcificación de las pirámides medulares con un patrón típico de sombra «en guirnalda» que rodea la pelvis renal o defecto de ecogenicidad en alguna pirámide por desprendimiento de la papila. La urografía intravenosa que debe evitarse en estos pacientes por el riesgo elevado de nefrotoxicidad por contrastes yodados, demostraba en las series originales de EF un 39% de deformidad calicial del tipo clubbing o abombamiento, no acompañado de cicatrización cortical como la observada en la pielonefritis crónica. En casos dudosos puede recurrirse a la TC helicoidal, que es más sensible que la ecografía para detectar precozmente NPR, así como carcinoma medular renal, siempre utilizando medidas profilácticas para la nefrotoxicidad por contrastes yodados, fundamentalmente expansión de volumen.
Tratamiento
En cuanto a las medidas terapéuticas que deben tomarse, dada la patología generalmente benigna y autolimitada de la hematuria falciforme, es apropiado su tratamiento conservador con reposo en cama para evitar el desprendimiento de los microtrombos.
Es aconsejable mantener una diuresis forzada (objetivo 4 l/1,73 m2 diarios) mediante hidratación, preferiblemente con sueros hipotónicos y el uso de diuréticos tiazídicos o del asa. Esta medida disminuiría la osmolaridad medular y podría aminorar la falciformación en los vasa recta. Además, ayuda a eliminar los coágulos de la vía urinaria. Se debe evitar la expansión de volumen con suero fisiológico, ya que sería inefectiva para disminuir la osmolaridad plasmática y con las transfusiones puede aumentar el riesgo de insuficiencia cardíaca.
La administración combinada con vasopresina es defendida por algunos autores, ya que induciría la hidratación de los hematíes disminuyendo la concentración de HbSS y, por tanto, la falciformación12.
También se recomienda la alcalinización, potencialmente útil para aumentar la afinidad de la Hb por el O2 y reducir la falciformación, además de disminuir la toxicidad tubular de la hemoglobinuria, aunque no ha demostrado su eficacia como medida terapéutica.
El uso de ácido ε-aminocaproico quedaría reservado para aquellos casos en los que las medidas anteriores hubieran fallado y requiere mucha precaución por el riesgo de trombosis.
En casos aislados de hematuria severa, refractaria a las medidas anteriores, podría requerirse la localización arteriográfica y embolización selectiva del segmento renal afectado que obviaría la nefrectomía.
En cualquier caso, el tratamiento de la hematuria debe realizarse como parte del tratamiento general de la EF, principalmente con hidroxiurea (HU), que ha demostrado su eficacia tanto en el niño como en el adulto en la reducción de la incidencia de las crisis con un perfil de seguridad aceptable13. El uso de antioxidantes como el ácido ascórbico podría proteger frente al daño oxidativo de la HU y aumentar su seguridad.
DEFECTOS TUBULARES FUNCIONALES
Alteraciones funcionales de la nefrona distal
1. Hipostenuria.El defecto en la concentración urinaria o hipostenuria es la anomalía tubular más precoz en la EF, así como la más frecuente. La concentración de orina máxima que pueden alcanzar estos pacientes es de 400-450 mOsm/Kg. Esta alteración generalmente no tiene repercusión clínica. En los individuos homocigotos puede aparecer en edad muy temprana y se manifiesta como enuresis y un mayor riesgo de deshidratación que puede sobrevenir en el caso de que coexistan pérdidas extrarrenales o aporte insuficiente si no es posible la ingesta. Puede ser reversible en menores de 10 años de edad con transfusión sanguínea. En edad más avanzada, generalmente a partir de los 15 años, los fenómenos de microtrombosis de los vasa recta condicionan una pérdida progresiva de los mismos, con obliteración y tortuosidad de los restantes, apreciable por técnicas angiográficas y fibrosis de la médula renal. En este caso estaríamos ante una diabetes insípida nefrogénica irreversible cuyas manifestaciones clínicas habituales son nicturia, poliuria y polidipsia.
2. Acidosis tubular distal. La anomalía más incipiente es una acidosis tubular distal incompleta que acompaña a la hipostenuria. La aparición de hiperpotasemia es rara a no ser que concurran circunstancias que afecten a los mecanismos compensatorios renales como la administración concomitante de antiinflamatorios no esteroideos, inhibidores del sistema renina-angiotensina-aldosterona, β-bloqueantes o insuficiencia renal.
Función tubular proximal supranormal
La función del túbulo proximal en la EF está alterada de manera que existe una reabsorción aumentada de sodio y una disminución de su excreción urinaria por lo que la respuesta a los diuréticos del asa está disminuida o abolida. Estas alteraciones podrían ser adaptativas para compensar la incapacidad medular para reabsorber agua y sodio. La reabsorción proximal de fosfato que generalmente acompaña a la reabsorción de sodio está también aumentada, por lo que puede existir hiperfosfatemia, sobre todo en presencia de una sobrecarga de fosfato como en la hemólisis. Ya que la secreción tubular de creatinina (cr) está preservada, la determinación de cr sérica y el aclaramiento de cr (Ccr) sobrestiman el filtrado glomerular (FG). Se han observado diferencias de hasta un 30% en la estimación de FG mediante aclaramiento de inulina y Ccr en estos casos.
La secreción de ácido úrico está aumentada posiblemente como mecanismo adaptativo a un aumento en su generación condicionado por la hemólisis, por lo que suele coexistir con niveles séricos elevados y riesgo de gota úrica. También está descrito un incremento en la reabsorción de β2-microglobulina con el consiguiente aumento en sus niveles séricos.
Etiopatogenia
Para concentrar la orina es necesario un tubo colector intacto en proximidad estrecha con los vasa recta medulares. Las nefronas yuxtamedulares son las más implicadas en los mecanismos de concentración urinaria, ya que sus túbulos colectores llegan a las zonas más profundas de la médula renal. Si el sodio reabsorbido no puede ser lavado por la circulación de los vasa recta esta reabsorción se ve afectada. Ya que la falciformación, como hemos explicado anteriormente, se produce inicialmente en los vasa recta donde el medio es altamente hipertónico, ácido y con hipoxia relativa, la obliteración de éstos altera los mecanismos de contracorriente medulares impidiendo la reabsorción de agua libre y conduce a la congestión medular.
Sin embargo, la capacidad de dilución urinaria se mantiene intacta, así como la secreción de ADH por la preservación de la porción superficial de las asas de Henle de las nefronas corticales, irrigadas por los capilares peritubulares.
La excreción de ácido requiere un gradiente de protones desde el ápex celular tubular a la luz y se lleva a cabo en el tubo colector. Aunque se desconoce el mecanismo etiopatogénico exacto de la acidosis tubular renal distal que puede verse en los pacientes con EF, se cree que el daño de la vascularización medular renal y la hipoxia secundaria puede afectar al aporte energético suficiente para mantener el gradiente electroquímico y de hidrogeniones en los túbulos colectores. Ya que el daño protagonista en la EF ocurre en el segmento más profundo del asa de Henle es muy raro que exista un defecto severo de la acidificación urinaria en la EF y por eso la acidosis es incompleta. Sin embargo, pueden verse trastornos en la acidificación y excreción de potasio tras la administración de inhibidores de la enzima de conversión de la angiotensina (IECA), betabloqueantes o diuréticos ahorradores de potasio, o bien cuando existe insuficiencia renal.
En cuanto a la función tubular proximal supranormal, el mecanismo etiopatogénico apuntado por algunos autores14 sería la liberación de prostaglandinas estimulada por la isquemia en la médula renal. Se ha observado un efecto inhibidor en la reabsorción proximal de sodio por la indometacina mayor en pacientes con EF que en pacientes sin EF15. La inhibición de prostaglandinas reestablece a la normalidad la reabsorción proximal de sodio incrementada en la EF que es responsable de la disminución en la respuesta natriurética a los diuréticos del asa observada en estos pacientes. Por otra parte, los niveles aumentados de prostaciclinas y protaglandina E2 encontrados en pacientes con EF13 podrían mediar, al menos en parte, la secreción de renina plasmática y de síntesis de aldosterona (se han encontrado niveles de renina plasmática elevados en pacientes con EF)16, aunque la tendencia a hiperpotasemia es fundamentalmente independiente de aldosterona.
Diagnóstico
Los pacientes con EF e hipostenuria alcanzan una osmolaridad máxima urinaria 400-450 mOsm/kg tras 8-10 h de sed en comparación con 900-1.200 mOsm/kg en sujetos normales. Además, no responde a vasopresina.
La acidosis tubular renal distal incompleta se pondría de manifiesto tras sobrecarga con cloruro amónico que conseguiría una acidificación urinaria disminuida (pH 5,8 frente a 5,1) en sujetos normales a pesar de una excreción de amonio normal. La acidez titulable por tanto está reducida en estos sujetos.
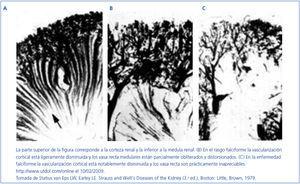
La afectación y desestruturación de los vasa recta tanto en el rasgo falciforme como más severo en la EF puede evidenciarse mediante técnicas angiográficas (figura 1).
Tratamiento
La mayoría de los defectos tubulares en los pacientes con EF no requieren medidas terapeúticas adicionales al tratamiento sintomático en circunstancias patológicas precipitadoras bien de deshidratación o por el contrario de sobrecarga de volumen según la alteración funcional predominante.
Es aconsejable por tanto establecer medidas preventivas en estos casos así como tener precaución con el uso de fármacos favorecedores de hiperpotasemia como los betabloqueantes, inhibidores de la ciclooxigenasa 2, o inhibidores del sistema renina-angiotensina-aldosterona y evitar nefrotóxicos especialmente en aquellos pacientes con hipostenuria.
GLOMERULOPATÍA FALCIFORME
Los pacientes con EF pueden desarrollar proteinuria e insuficiencia renal que progresa a enfermedad renal crónica (ERC) terminal. La afectación renal responsable es una glomerulopatía cuyo marcador inicial es la albuminuria. Su prevalencia aumenta con la edad, de forma que entre los 3 y 20 años se ha descrito albuminuria en un 21,3%17 a un 2818 de los casos, de los cuales un 10,5% progresan a proteinuria en un tiempo de seguimiento de 20 meses que en la mayoría de los casos (72%) conduce con el paso de los años a insuficiencia renal, aunque estas series son retrospectivas. Según un estudio transversal realizado a 90 niños, la prehipertensión e hipertensión, así como el grado de anemia, se asocian de forma independiente con la presencia de albuminuria19. Se necesitan estudios prospectivos que determinen la relación causal de estos hallazgos, así como el beneficio potencial de su tratamiento sobre el desarrollo de albuminuria.
En un estudio prospectivo reciente en 300 adultos entre 20 y 70 años de edad1 se ha encontrado una prevalencia de albuminuria de un 68% (26% proteinuria) en individuos homocigotos frente a un 32% (10% proteinuria) en heterocigotos. En esta misma serie, un 21% de los pacientes presentaban insuficiencia renal mediante estimación por fórmula de Cockroft-Gault. Sin embargo, hay que tener en cuenta que en este tipo de afectación glomerular la cr sérica e incluso la estimación de FG partiendo de su valor, parámetro para estadificar la ERC según la clasificación vigente20, no serían útiles en la EF hasta fases avanzadas de enfermedad (FG <30-40 ml/min/1,73 m2)21, ya que la secreción tubular de cr se mantiene intacta con FG afectado, como hemos explicado anteriormente. Cuando aparece la albuminuria en los pacientes con EF existe una disminución significativa del coeficiente de ultrafiltración glomerular comparado con pacientes con EF sin albuminuria, incluso en aquellos con FG preservado, indicando que la albuminuria es un marcador muy sensible de daño glomerular establecido en la EF y no como ocurre en otras nefropatías como por ejemplo en la diabetes tipo 2. Por esta razón algunos autores15 han recomendado la determinación plasmática de cistatina C como mejor aproximación al FG que las derivadas de la cr sérica, aunque se necesitan estudios más amplios que lo confirmen.
Aunque la proteinuria puede alcanzar rango nefrótico su incremento es gradual con la edad y por tanto su curso clínico es diferente a la instauración brusca de síndrome nefrótico de la glomeruloesclerosis segmentaria y focal (GESF) idiopática o la glomerulonefritis de cambios mínimos.
La proteinuria se asocia a mayor anemia, hemólisis y reticulocitosis22 y también se ha relacionado con la incidencia de crisis dolorosas, colelitiasis, síndrome torácico agudo y accidente vascular cerebral (ACVA). Es más prevalente con cuatro genes α-globina intactos, y menos entre los α-talasémicos, con prevalencias del 40% en adultos HbSS sin α-talasemia y de sólo el 13% en los adultos HbSS con α-talasemia. Además, la tensión arterial (TA) media es superior con cuatro genes α-globina intactos que en los α-talasémicos23.
La prevalencia de hipertensión arterial (HTA) en la ERC de la EF es notablemente menor que en otras causas de ERC17, lo que se comenta posteriormente.
Anatomía patológica
Existen cuatro tipos de glomerulopatía descritos en la EF, la GESF, la glomerulonefritis membranoproliferativa (GNMP), la glomerulopatía específica de la EF (GEF) y la microangiopatía trombótica (MAT)24. Independientemente de la lesión glomerular encontrada, en todas las biopsias renales de pacientes con EF los glomérulos se encuentran hipertrofiados, con capilares distendidos por los eritrocitos falciformes, lo que se describe como GEF, también encontrada en sujetos con EF sin evidencia clínica de ERC. Un hallazgo casi universal son los depósitos de hemosiderina en las células tubulares. La glomerulopatía más frecuente es la GESF24,25, que se ha referido en un 39 % de las biopsias renales realizadas a 18 pacientes con EF y proteinuria y/o insuficiencia renal, hasta ahora la serie más amplia recientemente publicada24. De acuerdo con la clasificación de Columbia pueden verse la formas NOS, tip, perihiliar o colapsante, así como formas mixtas24. Frecuentemente existe fibrosis intersticial con atrofia tubular adyacente a los glomérulos esclerosados. Ya que afecta preferentemente a los glomérulos yuxtamedulares que están vascularizados por los vasa recta, suele acompañarse de fibrosis medular prominente. Tanto la inmunofluorescencia como la microscopia electrónica evidencian la ausencia de depósitos inmunes. En una menor proporción de casos se encuentra esclerosis glomerular global26. También se han descrito infartos corticales focales.
El segundo tipo en frecuencia es la GNMP, que fue la primera afectación glomerular reportada originalmente en la EF. Aunque se ha asociado a nefropatía por VHC y VIH, ninguno de los cinco casos descritos en la serie de Maigne, et al.24 puede ser atribuible a esta asociación. La inmnofluorescencia indirecta puede demostrar depósitos inmunes predominantes en la pared capilar de IgG, IgM,IgA, C3 y C1q. En la mayoría de los casos existe fibrosis intersticial.
Lesiones características de MAT son evidentes en un 17% de los casos acompañados de algún grado de fibrosis intersticial.24
Etiopatogenia
Se cree que el mecanismo inicial para el desarrollo de glomerulopatía sería la hiperfiltración o aumento de FG, común en los pacientes con EF, especialmente en niños14. Además, el flujo plasmático renal está aumentado incluso más que el FG, por lo que la fracción de filtración está disminuida en el paciente con EF en comparación con sujetos normales15. Una explicación para este hallazgo sería que el aumento del flujo plasmático cortical causado por el efecto vasodilatador de las prostaglandinas podría disminuir la eficacia de la difusión por la velocidad del flujo aumentada (la inhibición de las prostaglandinas restablece a la normalidad el flujo plasmático renal y la fracción de filtración). Sin embargo, la hiperfiltración en la EF no sólo se asocia con cambios hemodinámicos sino que la permeabilidad glomerular y el coeficiente de filtración glomerular (Kf) también están aumentados27. Se especula que el incremento en el tráfico transglomerular de macromoléculas asociado con los defectos en la barrera podocitaria condicionados por la hipertrofia glomerular podrían desempeñar un papel en la etiopatogenia de la glomeruloesclerosis asociada a la EF27, de forma similar a lo que ocurre en la diabetes mellitus no insulinodependiente28.
La hipertrofia glomerular que es un hallazgo constante en la EF, al menos en parte podría ser secundaria a la anemia crónica (concordante con una menor prevalencia de daño renal en pacientes con otros tipos de EF menos anémicos como HbSC). Sin embargo, la proteinuira no es universal en la EF ni se relaciona con el número ni severidad de las crisis, por lo que otros factores deben estar implicados.
La hiperfiltración, la hipertrofia glomerular y la GESF no son necesariamente secuenciales ni causales. Algún mecanismo común podría actuar en las tres condiciones como factores de crecimiento y citokinas inflamatorias. La GESF podría ser la causa y no consecuencia de la fibrosis intersticial que podría obstruir las arteriolas eferentes incrementando la presión intraglomerular, resultando en esclerosis glomerular.
Ya hemos comentado el papel protector de la α-talasemia frente al desarrollo de glomerulopatía falciforme, más prevalente con cuatro genes a-globina intactos, no relacionado con el grado de anemia. Se apunta la mejor reología y disminución de la adhesividad eritrocitaria asociada que supondrían menor efecto lesivo sobre el endotelio y, por ende, menor daño orgánico1.
Otros genes podrían estar implicados en el desarrollo de ERC en la EF. Recientemente se ha demostrado que el haplotipo del gen MYH9 se asocia a ERC por estar involucrado en la disfunción podocitaria debido a defectos en la estructura de la miosina IIA29. Este gen se da con frecuencias muy elevadas (>60%) en afroamericanos y subsaharianos, poblaciones en las que además es particularmente frecuente la EF. A día de hoy, en la bibliografía científica no existe evidencia de que se haya investigado el papel que desempeñan las mutaciones del gen MYH9 como moduladoras de la expresión fenotípica de la EF. En un estudio recientemente publicado sobre moduladores genéticos de la severidad de la EF realizado a 1.265 pacientes del Cooperative Study of Sickle Cell Disease no se menciona el gen MYH930.
Diagnóstico
Los pacientes con EF deben ser considerados como pacientes de riesgo de ERC y en ellos determinar periódicamente (mínimo una vez al año) la ratio albúmina/cr en orina (RACu) para su deteccción en la edad infantil, por ejemplo a partir de los 7 años, particularmente en los pacientes con EF más grave.
Es recomendable determinar preferiblemente en primera orina de la mañana. En los casos en los que el RACu es positivo confirmar con una segunda determinación. Los criterios de positividad para albuminuria (RACu >30 mg/g) y proteinuria (RACu >300 mg/g) son los vigentes para ERC18.
En los casos de albuminuria positiva recomendamos determinación de cistatina C plasmática o la medición de FG mediante estudios isotópicos (99Tm-DTPA, 125I-iotalamato) para valorar el FG. La estimación de éste mediante fórmulas recomendada por guías internacionales para cribado de ERC no es recomendable en la EF hasta que existe una afectación importante del FG <35-40 ml/min/1,73 m2.
Debe testarse la seropositividad para virus de la hepatitis y VIH por la elevada prevalencia en pacientes con EF y su asociación con glomerulopatías.
Debe plantearse biopsia renal en casos de síndrome nefrótico de rápida instauración o enfermedad renal rápidamente progresiva.
Tratamiento
Se recomienda seguir la evolución de los pacientes con albuminuria y tratar al menos a los enfermos con proteinuria, por su mayor probabilidad de deterioro de la función renal. La nefropatía falciforme, al igual que otras glomerulopatías proteinúricas, probablemente es modificable con medidas que frenan su progresión, esto es, bloqueantes del sistema renina-angiotensina-aldosterona. Existe más evidencia con los IECA, que han demostrado reducir la proteinuria en adultos y en niños con EF16,26. El uso de estos fármacos conlleva más riesgo de hiperpotasemia en los pacientes con EF debido a la hemólisis, por lo que estarían especialmente recomendadas las medidas preventivas y la monitorización de los niveles de potasio e incluso la suspensión del tratamiento en las crisis hemolíticas26.
Es posible que la HU o el tratamiento transfusional tengan cierto papel protector, especialmente por la importancia de la anemia y la hemólisis como factores de riesgo de enfermedad renal. Se ha señalado que el tratamiento con HU en niños previene el desarrollo de proteinuria e incluso disminuye la tasa de albuminuria16. El fármaco mejora la anemia y la reología eritrocitaria, disminuye la leucocitosis y modula la expresión de moléculas de adhesión. El uso combinado de IECA y HU puede prevenir la progresión de la microalbuminuria a proteinuria franca31, si bien su efecto sobre la prevención de insuficiencia renal no ha sido evaluado.
Steinberg, et al.32 han publicado recientemente los resultados sobre el seguimiento a largo plazo de 299 pacientes incluidos en el Multicenter Study of Hidroxyurea in sickle cell Anemia seguidos durante 17,5 años. Estos autores encuentran una prevalencia global de ERC del 17,4%, desde un 19% en los pacientes que recibieron HU durante un período acumulado inferior a cinco años a un 5% en los tratados con HU 15 años o más. Dada la seguridad y disminución de la mortalidad observada en los grupos de tratamiento prolongado con HU señalan que la ERC podría constituir uno de los criterios expandidos para la indicación de tratamiento con HU en pacientes con EF sin eventos vasooclusivos frecuentes32.
FRACASO RENAL AGUDO
El fracaso renal agudo (FRA) no es raro en la EF, se ha estimado que un 10% de los pacientes que requieren ingreso hospitalario duplican al menos la cifra de cr sérica y puede deberse a distintas etiologías que a menudo coexisten. El factor precipitante más frecuente es la depleción de volumen. El uso de AINE probablemente es responsable al menos en parte de muchos episodios de fracaso renal agudo por inhibir los mecanismos compensadores renales mediados por prostaglandinas ya comentados. Suele asociarse con infecciones, rabdomiólisis y anemización (promedio de Hb 6,4 g/d frente a Hb 8,7 g/dl de los enfermos sin elevación aguda de la cifra de cr). La mayoría de los pacientes sobreviven y recuperan la función renal33.
La incidencia de FRA durante las crisis agudas vasooclusivas es baja (4,3%) y parece relacionarse con la severidad de las mismas, un 13,6% en el síndrome torácico agudo severo. Parece estar limitado a pacientes con hipertensión pulmonar (HTP) por lo que se sugiere que la congestión venosa podría estar implicada como fenómeno patogénico34. En el caso de que exista fallo agudo de al menos dos sistemas mayores (riñón, corazón, pulmón, etc.) durante una crisis aguda vasooclusiva dolorosa se trataría de un fracaso multiorgánico. En estos casos puede estar indicado el intercambio de hematíes de forma individualizada según se establece en las guías americanas sobre aféresis terapéutica35.
Puede producirse un FRA obstructivo por necrosis papilar o hematuria macroscópica.
En sujetos con rasgo falciforme (HbAS) se ha descrito FRA asociado a rabdomiólisis y coagulación intravascular diseminada tras un entrenamiento militar riguroso.
HIPERTENSIÓN ARTERIAL
Los pacientes con enfermedad falciforme tienen niveles de tensión arterial (TA) menor que controles afroamericanos sanos ajustando por edad, no así los sujetos con rasgo falciforme que presentan cifras de TA similares17. Se ha estimado una prevalencia de HTA menor que en la población general (2-6% frente al 28%, respectivamente).
Los mecanismos etiopatogénicos potenciales son la obstrucción de los vasa recta y la isquemia reiterada en la médula renal, implicados en la hipostenuria, así como el menor índice de masa corporal y la menor rigidez arterial descritos en estos pacientes. Existen estudios recientes que sugieren disfunción endotelial y vasculopatía sistémica asociada con reducción de la biodisponibilidad del óxido nítrico en los pacientes con EF. Incluso dentro del rango de TA normal la aparición de ACVA36 se ha asociado con cifras de TA sistólica de 120-139 mmHg o diastólica de 70-89 mmHg, lo que definiría la categoría de HTA sistémica relativa en pacientes con EF, asociada también con mayor riesgo de HTP y disfunción renal37.
La asociación entre HTP y cifras más elevadas de TA en los adultos con EF apoya la posibilidad de un mecanismo fisiopatológico común a ambos problemas. Además, la HTA contribuye a la disfunción diastólica del ventrículo izquierdo, que ha demostrado ser un factor predictivo independiente de muerte en los pacientes con EF. Incluso aumentos leves de presión arterial pulmonar son mal tolerados por el paciente con enfermedad falciforme, lo que podría extrapolarse a la HTA.
Por todas estas evidencias, se postula la posible indicación de instaurar tratamiento antihipertensivo en la categoría de prehipertensión36 (TA sistólica 130-139 mmHg o diastólica 80-89 mmHg) o incluso antes en los pacientes con EF debido al riesgo de daño en órganos diana (corazón, pulmón, riñón). Sería una condición a añadir a las seis situaciones que recoge el séptimo informe del la Joint National Committee38 con indicación de tratamiento antihipertensivo en fase de prehipertensión: insuficiencia cardíaca, postinfarto de miocardio, riesgo elevado de enfermedad coronaria, diabetes mellitus, ERC y prevención de la recurrencia de ACVA, aunque se necesitan ensayos clínicos para establecer las guías de tratamiento y objetivos de TA en los pacientes con EF.
Debido a los mecanismos etiopatogénicos apuntados en la ERC de la EF y a extrapolación de otras glomerulopatías, los inhibidores del sistema renina-angiotensina-aldosterona serían de elección en el tratamiento de la pre-HTA en la EF con albuminuria o HTP. En el caso de HTA se mantendría esta recomendación con las medidas para evitar la hiperpotasemia, en especial las referidas a la asociación de varios fármacos retenedores de potasio, ya comentadas anteriormente.
Recomendamos especial precaución en el uso de diuréticos porque la deshidratación puede precipitar las crisis vasooclusivas y debemos recordar, además, la predisposición a ésta por la hipostenuria casi universal en los pacientes con EF.
CARCINOMA MEDULAR RENAL
El carcinoma medular renal es raro, de muy mal pronóstico y descrito casi exclusivamente en la población negra con rasgo falciforme y menos frecuente en la EF. Aparece en la mayoría de los casos antes de los 20 años de edad, con una mayor incidencia en el sexo masculino. Se sugiere una predisposición genética y se distingue del carcinoma de tubo colector por determinados marcadores, incluyendo un factor inducible por hipoxia. La hipoxia medular en la EF puede promover su desarrollo.
Su presentación clínica habitual es hematuria macroscópica, dolor lumbar y masa abdominal y/o síndrome constitucional. Es frecuente la existencia de metástasis en el momento del diagnóstico, por lo que la extirpación del tumor no es curativa. La supervivencia tras el diagnóstico no supera los 6-12 meses.
La aparición de hematuria macroscópica debe alertar su posibilidad diagnóstica en el niño con rasgo falciforme o EF, por lo debe descartarse mediante tomografía computarizada (TC) en estas situaciones.
INFECCIONES URINARIAS
Los pacientes con EF pueden tener afectada la inmunidad humoral debido a los infartos esplénicos, lo que les predispone a infecciones por bacterias encapsuladas, entre ellas las infecciones urinarias (ITU). Debe prestarse especial atención a su aparición en la gestación y ya se ha mencionado que pueden contribuir a la NPR.
Al igual que otras infecciones, las ITU pueden precipitar una crisis falciforme, lo que debe alertar en el niño por la mayor frecuencia de ITU asintomáticas.
ENFERMEDAD RENAL CRÓNICA AVANZADA
La EF constituye menos del 1% de los pacientes que inician TRS en EE.UU.39.
En este trabajo se han revisado las distintas manifestaciones renales de la EF, sus mecanismos fisiopatológicos, factores de riesgo, diagnóstico y tratamiento. Ya se ha comentado la frecuencia de ERC en los pacientes con EF adultos y niños, casi siempre secundaria a glomerulopatía falciforme. En principio, cualquier avance en el tratamiento de la EF que limite la frecuencia y gravedad de la falciformación afectaría beneficiosamente las consecuencias renales de la EF. En este apartado comentaremos las particularidades del tratamiento de la ERC estadios 3b-5 en la EF.
La anemia en la EF con ERC suele ser multifactorial, por disminución de la eritropoyesis y hemólisis, pero también es muy frecuente un componente ferropénico por pérdidas gastrointestinales. Por lo tanto, su tratamiento debe contemplar estos aspectos para instaurar el adecuado.
El tratamiento se basaría en el uso de transfusiones y/o agentes estimuladores de la eritropoyesis solos o en combinación con HU40, aunque la utilidad del tratamiento con agentes estimuladores de la eritropoyesis no está establecida. Tampoco lo está el nivel objetivo de hemoglobina, aunque en general se recomienda no corregir por encima de valores de hemoglobina de 10 g/dl y en la fase de corrección evitar incrementos de hematocrito superiores a un 1-2% semanal, pues niveles superiores de hemoglobina
o una corrección más rápida pueden precipitar crisis vasooclusivas.
La HU es de eliminación renal, por lo que debe ajustarse su dosis en insuficiencia renal.
Diálisis
En un estudio usando datos del registro americano USRDS sobre 397 pacientes incidentes en diálisis con EF41, la mortalidad global a los dos años era similar a la de los pacientes ERC terminal (ERCT) sin EF (33 y 37%, respectivamente). Sin embargo, los pacientes con EF tenían una edad mucho menor al inicio del tratamiento renal sustitutivo (edad media 40 frente a 60 años). Ajustando por edad, los pacientes con EF demostraban una supervivencia menor que los pacientes sin EF, de forma que para una edad media de 35 años la supervivencia en los pacientes ERCT con EF era del 60% a los tres años y del 40% a los 5 años respecto a un 80 y 70% en la población ERCT sin EF, respectivamente.
Trasplante
En un estudio reciente42 se refiere una supervivencia ajustada por edad en trasplante renal al cabo de un año similar de los pacientes e injertos en la EF a la de los pacientes sin EF. Sin embargo, la pérdida de injerto aumenta de forma significativa con el tiempo de seguimiento en los trasplantados con EF respecto a los pacientes sin EF. Scheinman, et al.43 analizaron los datos del USRDS hasta el año 2000. En total 237 pacientes con EF trasplantados con una supervivencia global del 56% respecto a una supervivencia del 14% en 1.419 pacientes con EF en diálisis. Además de los trasplantados, sólo 53 correspondían al período de la era de los anticalcineurínicos, esto es, a partir de 1991 frente a 957 pacientes ERCT con EF en el mismo período. Por ello, pensamos que la mejor opción de tratamiento renal sustitutivo para los pacientes con ERCT es el trasplante renal, aunque se ha descrito una mayor frecuencia de crisis postrasplante en relación con la corrección de la anemia y existe recurrencia de nefropatía falciforme en el injerto incluso a los 3,5 años, aunque la pérdida del mismo por esta causa es rara. Se baraja que la HU podría prevenir la recurrencia.
Debido a la alta tasa de hiperinmunizados en los pacientes con EF los nuevos tratamientos de inmnosupresión podrían ofrecer ventajas en el pronóstico del trasplante renal en la EF.
Los pacientes deben ser informados sobre los potenciales beneficios y complicaciones antes de ser incluidos en lista de trasplante.
RASGO FALCIFORME
La prevalencia de rasgo falciforme (HbAS) es de aproximadamente un 8-10% en la población afroamericana, y hasta de un 2530% en ciertas áreas de África occidental. Existen aproximadamente 30 millones de personas en el mundo (2,5 millones en EE.UU.), heterocigotas para el gen HbS. El rasgo falciforme es un estado de portador benigno sin manifestaciones hematológicas, con parámetros eritroides (morfología, índices corpusculares, reticulocitos) normales. Son individuos sin anemia, sin necesidad de tratamiento o restricciones ocupacionales.
Siendo asintomático en la inmensa mayoría de personas afectadas, son posibles algunas complicaciones clínicas por vasooclusión en caso de fiebre muy alta y/o en condiciones de hipoxia significativa (como en el montañismo a alturas elevadas), ejercicio vigoroso y complicaciones anestésicas. Existe un bajo riesgo de muerte súbita asociada al ejercicio vigoroso, particularmente en altitudes elevadas y complicado con deshidratación y acidosis, circunstancias que pueden desembocar en rabdomiólisis, coagulación intravascular diseminada y fracaso renal.
Puede producirse falciformación espontánea en la papila renal (normalmente con tensión de oxígeno baja) con NPR, de forma que el 5% de los afectados de rasgo falciforme (HbAS) pueden sufrir episodios de hematuria en algún momento de la vida (causa común de hematuria en afroamericanos). La mayoría presentan un deterioro de la capacidad de concentración de la orina, directamente relacionada con el porcentaje de HbS intraeritrocitario. La hipostenuria progresa con los años, y es reversible hasta cierta edad con transfusiones. Pueden aumentar las infecciones urinarias y existe asociación con el carcinoma medular renal.
Las gestantes con rasgo falciforme tienen una mayor incidencia de bacteriuria y pielonefritis, así como de hipertensión asociada al embarazo.
Agradecimientos
Los autores agradecen al Grupo de Eritropatología de la Asociación española de Hematología y Hemoterapia (AEHH) el permiso para la publicación de este artículo que forma parte de la Guía de Manejo de la Enfermedad Falciforme del Grupo, para su difusión en NEFROLOGÍA.
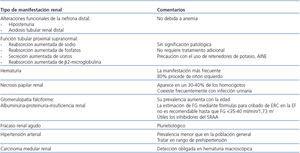
Tabla 1. Manifestaciones renales de la enfermedad falciforme
Figura 1. Arteriografía de un sujeto normal (A), con rasgo falciforme (B) y con enfermedad falciforme (C)