Recomendaciones para el trasplante renal de donante vivo
Más datosEsta guía de recomendaciones para el TR de donante vivo (TRDV) es un documento elaborado con el patrocinio de la Sociedad Española de Nefrología, la Sociedad Española de Trasplantes y la Organización Nacional de Trasplantes que actualiza la calidad de la evidencia disponible para ofrecer el mejor tratamiento de la insuficiencia renal crónica cuando se disponga de un donante vivo potencial. El objetivo principal de esta guía es proporcionar a los profesionales con responsabilidad en los estudios previos del donante vivo y del receptor trasplantado, las mejores herramientas para tomar decisiones en beneficio del donante vivo y del receptor del trasplante.
Además, en el contexto actual del TR, el donante vivo debe recuperar el protagonismo que alcanzó en un pasado reciente. Para ello, las nuevas modalidades de donación HLA y/o ABO incompatible, así como la donación cruzada disponibles en diversos centros con experiencia en TRDV, son oportunidades adicionales para el tratamiento de enfermos renales que tienen un donante incompatible.
Los buenos resultados en supervivencia del paciente y del injerto están ampliando las circunstancias de aceptación de donantes vivos de riñón, incluyendo donantes de mayor edad y otros con algunos condicionantes que incluyen antecedentes o alteraciones límite que, cuando son evaluados con criterios objetivos, pueden aportar un numero adicional de trasplantes.
No se ha obviado en esta guía que el TRDV puede representar algún riesgo para el que dona. Estos problemas que pueden aparecer a corto o largo plazo tienen que ser objeto principal de valoración previa a la donación y presentados al potencial donante para que en ejercicio de su autonomía los asuma o rechace. La experiencia acumulada en los últimos años ha permitido avanzar en el análisis de riesgos para preservar la salud de los donantes, aspecto que debe estar siempre presente en los responsables de programas de TRDV cuando se procede al estudio de idoneidad de un potencial donante.
Finalmente, esta guía ha sido estructurada para facilitar la toma de decisiones con recomendaciones y sugerencias ante incertidumbres derivadas de los resultados en los exhaustivos estudios predonación. Y todo ello, con el objetivo de que el consentimiento informado que debe certificar la calidad de los estudios y la información proporcionada a donante y receptor, alcancen las mayores garantías posibles.
This guide for living donor renal transplantation (LDRT) has been prepared with the sponsorship of the Spanish Society of Nephrology (SEN), the Spanish Transplant Society (SET), and the Spanish National Transplant Organization (ONT). It updates evidence to offer the best chronic renal failure treatment when a potential living donor is available. The core aim of this guide is to supply clinicians who evaluate living donors and transplant recipients with the best decision-making tools, to optimise their outcomes.
Moreover, the role of living donors in the current RT context should recover the level of importance it had until recently. To this end the new forms of incompatible HLA and/or ABO donation, as well as the paired donation which is possible in several hospitals with experience in LDRT, offer additional ways to treat renal patients with an incompatible donor.
Good results in terms of patient and graft survival have expanded the range of circumstances under which living renal donors are accepted. Older donors are now accepted, as are others with factors that affect the decision, such as a borderline clinical history or alterations, which when evaluated may lead to an additional number of transplantations.
This guide does not forget that LDRT may lead to risk for the donor. Pre-donation evaluation has to centre on the problems which may arise over the short or long-term, and these have to be described to the potential donor so that they are able to take them into account. Experience over recent years has led to progress in risk analysis, to protect donors’ health. This aspect always has to be taken into account by LDRT programmes when evaluating potential donors.
Finally, this guide has been designed to aid decision-making, with recommendations and suggestions when uncertainties arise in pre-donation studies. Its overarching aim is to ensure that informed consent is based on high quality studies and information supplied to donors and recipients, offering the strongest possible guarantees.
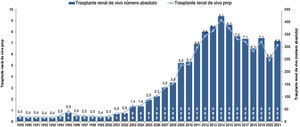
En 2010, la revista Nefrología publicó un suplemento que recogía las «Recomendaciones de la Sociedad Española de Nefrología (SEN) y la Organización Nacional de Trasplantes (ONT) sobre trasplante renal de donante vivo (TRDV)»1. Cuatro años después, nuestro país alcanzó su record con 423 TRDV.
Actualmente, el TRDV es un tratamiento consolidado y la primera opción terapéutica que se debe ofrecer al paciente con enfermedad renal crónica (ERC) avanzada (ERCA), tanto en edad pediátrica como adulta, por sus mejores resultados en supervivencia y calidad de vida.
Por ello, es oportuno actualizar aquel documento de recomendaciones que ha sido de gran utilidad durante una década. Este proyecto se ha realizado con el amparo de la SEN, la ONT y la Sociedad Española de Trasplantes (SET), con el principal objetivo de expandir el TRDV. Incluye todas las posibles variantes de TRDV en función del tipo de donante y sus condiciones: donación cruzada, donación ABO incompatible, donación para receptor hiperinmunizado, donación altruista, donación en cadena, etc. Todos ellos son procedimientos complementarios al trasplante renal (TR) de donante fallecido y que, junto con el TRDV directo, consiguen que la solución del trasplante llegue al mayor número de receptores independientemente de su complejidad.
Varias secciones del documento analizan la seguridad para el donante. El riesgo para la salud de quien dona uno de sus riñones debe ser mínimo, cuidadosamente estudiado, ponderado y presentado al donante para que, sin ninguna presión, decida de forma autónoma. El bienestar del donante es innegociable y por ello las recomendaciones de seguir modelos de vida saludable tras la donación y controles médicos de por vida.
Este documento no es una guía al estilo de las publicadas en Reino Unido2, Norteamérica3 o Europa4. Hemos buscado un híbrido entre revisión, actualización y guía de práctica clínica, en la que el profesional encuentre en secciones bien definidas las recomendaciones, cuando las haya, o en su defecto, opiniones de expertos en TRDV cuando la evidencia sea débil o inexistente. Lamentablemente, las recomendaciones en TRDV con elevada calidad de la evidencia (A, B) no son mayoría, por lo que gran número de recomendaciones quedan reflejadas como sugerencias con calidad de evidencia baja o muy baja (C, D), por lo que por sencillez y utilidad decidimos destacar únicamente la calidad de la evidencia5. Además, se han incluido recomendaciones o sugerencias calificadas como sin graduación (SG) ante opiniones de expertos, cuando no se podía disponer de ninguna evidencia o era una disposición legal.
En cualquier caso, este monográfico que actualiza el TRDV, puede ser de gran ayuda para que los profesionales sanitarios con responsabilidades en donación y trasplante encuentren siempre los mejores recursos y ofrezcan soluciones a problemas complejos en su práctica clínica.
La metodología seguida para esta actualización se inició con la identificación de los temas de mayor actualidad en TRDV, incorporando respecto a las recomendaciones publicadas en 2010, todas las novedades que en la última década habían irrumpido con fuerza, caso del TR cruzado; trasplante ABO y HLA incompatible; donante vivo con criterios expandidos y análisis de riesgos para el que dona.
Se distribuyeron las secciones entre los equipos que habían destacado con publicaciones en cada una. Se les pidió realizar una revisión sistemática de la bibliografía con la ayuda de las evidencias ya destacadas en los documentos publicados por la British Transplantation Society (BTS) y Kidney Disease Improving Global Outcomes (KDIGO)2,3, completando con la literatura publicada en los últimos años.
Los tres coordinadores elaboraron, además, una lista de tópicos mínimos para cada sección, con la finalidad de que tuvieran máxima actualidad. Mediante un intercambio de correos electrónicos, y tras un examen de cada manuscrito inicial por los coordinadores, se enviaron para revisión a un grupo de editores especiales, constituido por relevantes profesionales del TR en España que adaptaron y consensuaron con los autores los diferentes documentos a su versión final.
Este proceso ha llevado 18 meses y ha tenido que lidiar con las sobrecargas asistenciales derivadas de la pandemia por COVID-19, por lo que vaya por delante nuestro agradecimiento más sincero a todos los autores que han colaborado en la elaboración de este documento.
Sección 1. Situación actual del trasplante renal de donante vivo en España y otros paísesEl TR de donante vivo (TRDV) es la opción terapéutica que ofrece mejores resultados para un paciente con insuficiencia renal avanzada, tanto en términos de supervivencia de paciente e injerto, como en términos de calidad de vida6. Desde que en 1954 se llevara a cabo con éxito el primer TRDV entre humanos7, los avances en inmunosupresión, el desarrollo de técnicas quirúrgicas poco invasivas para la nefrectomía del donante y el consenso en la aproximación al estudio, la selección y el cuidado del donante vivo8 han consolidado este tratamiento como una opción a considerar de forma sistemática en pacientes con insuficiencia renal avanzada2,9.
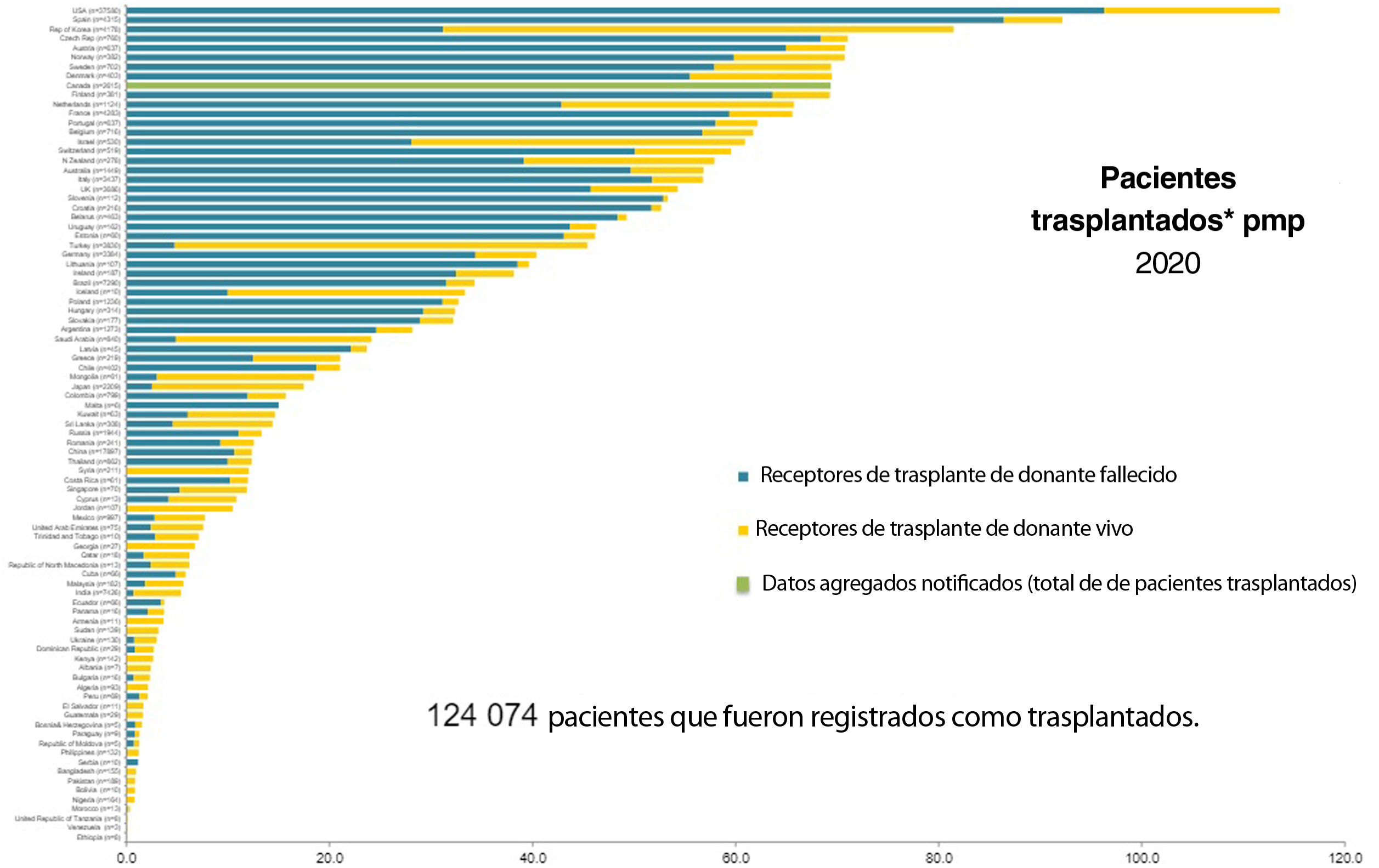
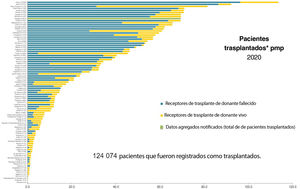
Según datos del Observatorio Global de Donación y Trasplante, en el mundo se realizan cada año cerca de 90.000 trasplantes renales, de los que aproximadamente el 40% proceden de donante vivo10. La figura 1 muestra la actividad de trasplante renal (TR) por países en 2018, diferenciado los procedimientos de donante fallecido y de donante vivo. Al comparar la actividad trasplantadora, se observa que aquellos países con un índice de desarrollo humano (HDI) más bajo desarrollan su programa de TR fundamentalmente a expensas del donante vivo, aunque sus tasas por millón de población (en adelante, pmp) son menores que las de países con un HDI más alto, países que llevan a cabo tanto TR de donante fallecido como de donante vivo11. No obstante, también se observan importantes diferencias en la actividad de TRDV pmp entre países pertenecientes a realidades socioeconómicas similares, como es el caso de los países de la Unión Europea.
En España, un país con una elevada tasa de donación de fallecido y una actividad de TR que supera los 3.000 procedimientos anuales, el TRDV también se ha consolidado como una opción de tratamiento por los beneficios que aporta, tanto a los pacientes como al sistema de trasplantes en su conjunto, con un bajo riesgo para el donante. En este capítulo revisamos las bases que justifican el programa de TRDV en nuestro país, abordamos aspectos relativos a la protección del donante, describimos la situación del programa en España y resumimos los retos que nuestro sistema ha de abordar en este ámbito.
La necesidad del TR de donante vivoEl programa de TRDV se presenta como una necesidad por diferentes motivos. En primer lugar, por los beneficios que ofrece este tratamiento al receptor, en comparación con los conseguidos con el TR de donante fallecido. Por otro lado, el TRDV es necesario para el progreso hacia la autosuficiencia en trasplante ante la dificultad de cubrir adecuadamente las necesidades de TR de nuestra población en un contexto en el que asistimos a un cambio progresivo en el perfil del donante fallecido. Finalmente, la apuesta por este programa se fundamenta en una mejora sustancial en la seguridad del procedimiento para el donante.
Resultados del TR de donante vivoEl TRDV se asocia con mejores resultados a largo plazo que el TR de donante fallecido, independientemente de la relación genética entre donante y receptor6,12 o de si se trata de un primer o un segundo trasplante13. Los datos del Registro Europeo de Tratamiento Sustitutivo Renal (ERA-EDTA) muestran que la supervivencia del injerto renal (ajustada por edad, sexo y causa de enfermedad renal primaria) a los cinco años es del 86,7% para los receptores de donante vivo vs. 81,4% para los de donante fallecido, y la supervivencia del paciente a los cinco años (ajustada por edad, sexo y causa de enfermedad renal primaria) es del 94,6 y 92,1%, respectivamente14. Los datos del registro americano ofrecen resultados muy similares a los del europeo15.
Se han barajado diferentes motivos para justificar los mejores resultados obtenidos con el TRDV, como es el buen estado de salud basal del donante vivo, con menos patología asociada que la observada en el donante fallecido1. Sin embargo, al comparar los resultados del TR de donante fallecido con los del donante vivo estándar en pacientes de similares características, no se observan diferencias significativas en la supervivencia a medio plazo, ni en la incidencia de rechazo agudo, aunque sí en el retraso en la función del injerto16. Estas diferencias a favor de la donación de vivo sí son significativas, al comparar de manera global los resultados del TRDV con los de donante fallecido, sin diferenciar por tipo de donante fallecido (muerte encefálica o asistolia y criterios estándar o expandidos)6,13,17.
Por otro lado, el TRDV se lleva a cabo con más frecuencia que el de fallecido antes de que el paciente inicie tratamiento sustitutivo renal con diálisis18. Conviene destacar que el tiempo en diálisis y la comorbilidad asociada se han identificado de manera reiterada como factores negativamente relacionados, tanto con la supervivencia del injerto trasplantado como con la del paciente, con independencia de la etiología de la insuficiencia renal crónica19,20.
Por tanto, con base en la evidencia actual, los mejores resultados del TRDV vienen determinados fundamentalmente por las características y grado de comorbilidad del receptor que se trasplanta, el tiempo que tarda en trasplantarse y el perfil de su donante.
Cambio en el perfil del donante fallecido y lista de esperaEn los últimos 20 años, España ha vivido cambios fundamentales en las normativas de seguridad vial y laboral y ha experimentado una mejora continua en la atención sanitaria. Todo ello ha propiciado un afortunado descenso en la mortalidad de la población, pero también un descenso progresivo del potencial de donación en muerte encefálica21 .
Nuestro sistema, a través de la red de coordinación de trasplantes y los equipos médicos y quirúrgicos, se ha adaptado a este nuevo escenario y ha conseguido aumentar su actividad de trasplante, si bien a expensas de un cambio sustancial en el perfil de los donantes.
Los cambios acontecidos en los cuidados del paciente crítico al final de la vida se han continuado del desarrollo sin precedentes de programas de donación en asistolia controladaeeeeeee16,22. Se ha normalizado también el trasplante exitoso de órganos de donantes fallecidos de edad avanzada y muy avanzada, como adaptación a un potencial donante envejecido y con comorbilidades asociadas. La puesta en marcha de proyectos como el de donante de riesgo no estándar23,24 y la elaboración de guías clínicas25–28 para realizar una adecuada valoración del riesgo-beneficio de trasplantar órganos de donantes con diferentes patologías, han permitido ampliar de manera progresiva el grado de aceptación y utilización subsiguiente de órganos procedentes de donantes de mayor complejidad.
En este contexto, España ha alcanzado la cifra de TR más elevada de su historia y la más alta del mundo, con 72,8 trasplantes pmp en el año 201929. Sin embargo, y a pesar de que la lista de espera para trasplante es menor año tras año, a final de 2019 fue de 3.933 pacientes, por lo que aún estamos lejos de alcanzar la autosuficiencia. Abundando en el efecto negativo del tiempo en diálisis en la supervivencia postrasplante, nos encontramos con que solo un 5% de los pacientes con ERCA se trasplantan antes de iniciar tratamiento con diálisis30.
El hecho de que el incremento de donantes fallecidos se haya producido a expensas de donantes cada vez más añosos, incluyendo los donantes en asistolia controlada, determina una probabilidad reducida de que los pacientes jóvenes con insuficiencia renal avanzada se trasplanten en un corto plazo de tiempo. Es este segmento de la población el que puede beneficiarse de manera más evidente de la donación renal de vivo, si bien este tratamiento es adecuado para pacientes en cualquier franja de edad.
Conviene destacar que el reducido número de donantes jóvenes también afecta a la disponibilidad de otros órganos, como el páncreas. De manera muy resumida, por el riñón joven asociado al páncreas compite el paciente diabético y el receptor joven con los problemas ya mencionados para encontrar un donante apropiado en términos de edad, especialmente si se trata de un paciente hiperinmunizado. El TRDV puede ayudar a solventar esta situación ofreciendo la posibilidad de realizar de manera aislada el trasplante de páncreas.
La mejora en la seguridad del donante vivoAunque se constate el beneficio del TRDV para los pacientes, este tratamiento no podría llevarse a cabo sin la condición sine qua non de garantizar la seguridad del donante. Por este motivo, la presente guía clínica se desarrolla en cada uno de sus apartados teniendo en cuenta las posibles consecuencias para el donante y su calidad de vida posterior.
La estandarización del estudio y cuidado del donante vivo1,31, así como la utilización de técnicas de nefrectomía cada vez menos invasivas32, tienen como objetivo primordial la protección de la salud1,8,9 de los donantes.
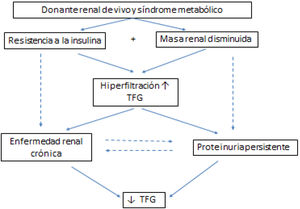
La realización de una nefrectomía en una persona sana no es inocua, si bien es cierto que el riesgo de mortalidad inmediata asociada a la donación renal de vivo se estima en un 0,03% y no ha variado en los últimos 15 años33. La incorporación de la nefrectomía laparoscópica ha supuesto una mejora considerable en el postoperatorio inmediato del donante, con un más rápido restablecimiento y reincorporación a la vida social y laboral. A largo plazo, la probabilidad de desarrollar una enfermedad renal avanzada por el donante renal de vivo, si bien es inferior a la descrita en la población general (que tiene comorbilidad), es superior a dicha probabilidad si el donante no se hubiera sometido a la nefrectomía34–37. La edad, la raza negra, la obesidad y las enfermedades familiares genéticas han demostrado ser factores de riesgo en la evolución de los donantes a largo plazo. Deben, por tanto, tenerse en cuenta en la valoración de riesgos de un donante, en la información que se facilita tanto a donante como a receptor y en el cuidado del donante tras el procedimiento9.
La protección del donanteUn programa de TRDV ha de sustentarse en el pilar fundamental que representa la protección integral del donante vivo de órganos. Los principios básicos en los que se sustenta esta protección se recogen en diferentes documentos legales internacionales: Principios Rectores de la Organización Mundial de la Salud sobre Trasplante de Células, Tejidos y Órganos Humanos, Convenio del Consejo de Europa relativo a los Derechos Humanos y la Biomedicina, así como su Protocolo Adicional sobre el Trasplante de Órganos y Tejidos de origen Humano, y Directiva 2010/53/UE del Parlamento Europeo y del Consejo, de 7 de julio de 2010, sobre normas de Calidad y Seguridad de los Órganos Humanos destinados al trasplante38–40. En España, estos principios se recogen en la Ley 30/1979, de 27 de octubre, sobre extracción y trasplante de órganos, y en el Real Decreto 1723/2012, de 28 de diciembre, por el que se regulan las Actividades de Obtención, Utilización Clínica y Coordinación Territorial de los Órganos Humanos destinados al Trasplante y se establecen Requisitos de Calidad y Seguridad41. A este marco legislativo nacional e internacional se añaden estándares profesionales nacionales1, como los representados por esta guía, e internacionales, destacando las guías KDIGO 9.
La protección del donante vivo comienza con una adecuada evaluación y selección del potencial donante desde una perspectiva médica y psicosocial8. Es necesario un estudio exhaustivo y estandarizado del potencial donante con el objetivo de valorar el riesgo que la donación conlleva para su estado de salud –así como para el potencial receptor del órgano donado–. La evaluación de riesgos incluye aspectos relativos a la salud física, pero también psicosocial, que permitan identificar contraindicaciones absolutas o relativas a la donación.
El sistema sanitario adquiere una responsabilidad con respecto a la persona que dona un órgano en vida, por las complicaciones que pueda desarrollar a corto, medio y largo plazo. Es por ello obligatorio asegurar una atención médica continuada en el tiempo al donante vivo y proporcionarle los oportunos cuidados orientados a preservar la función renal residual (en el caso de donación renal) y tratar eventuales complicaciones derivadas de la donación. En el espacio de la Unión Europea, existe la obligación adicional de registrar información sobre cada donante vivo en registros nacionales diseñados para conocer las características clínicas y demográficas basales de los donantes y su curso evolutivo, incluyendo las complicaciones desarrolladas en relación con el proceso de donación. A este registro de información se suma la notificación obligatoria, por parte del profesional sanitario, de eventos adversos (incidentes en la donación que ponen en riesgo al donante vivo, aunque no le hayan generado ningún daño) y reacciones adversas (incidentes que hayan generado un daño al donante vivo) al Sistema Nacional de Biovigilancia42.
Un pilar básico en la evaluación del donante vivo es el de determinar la validez del consentimiento a la donación. El consentimiento válido ha de ser libre, informado y expresado de forma explícita. En la valoración del donante vivo es fundamental dirimir los motivos que hay detrás de una donación y valorar la legitimidad de la relación entre el potencial donante y el receptor. La información sobre el proceso ha de ser amplia, proporcionarse de manera estructurada y comprensible, ofreciendo la posibilidad de no continuar con el proceso en cualquier momento y sin necesidad de explicación alguna. En la determinación de la validez del consentimiento tiene un papel fundamental la participación del denominado living donor advocate en terminología anglosajona, un profesional independiente de quien vaya a realizar la extracción y el implante del órgano que vela por la íntegra protección de la persona. En nuestro país, este papel es ejercido mediante la intervención de un profesional médico independiente, a la que se suma la participación del Comité de Ética del centro, y la comparecencia del potencial donante frente al Juez de Primera Instancia. Este sistema de tres filtros que prevé nuestra legislación es probablemente uno de los más garantistas del mundo. En el proceso de valoración, la identificación de situaciones sospechosas de trata de personas con fines de extracción de órganos o de mediación de un beneficio económico o comparable ha de determinar no solo la interrupción del procedimiento de donación, sino la notificación del caso a las autoridades competentes, a efectos de activar la investigación y la persecución de posibles delitos.
La protección del donante vivo también implica la eliminación de desincentivos a la donación de órganos en vida, lo que incluye el reembolso de los gastos en los que haya incurrido el donante y su compensación por el lucro cesante en relación con la evaluación, la intervención quirúrgica y posterior recuperación. La protección ante eventuales despidos por parte del empleador por faltas ocasionadas por realización de pruebas diagnósticas o por el propio acto de donación es otro ejemplo de medidas a desarrollar.
Evolución del TR de donante vivo en España y comparativa con otros paísesA pesar del gran consenso internacional a favor del TRDV, en España no se generalizó este tratamiento hasta los primeros años del siglo XXI, en parte debido al éxito del modelo español en donación y trasplante43, y en parte por la reticencia de los profesionales a realizar una nefrectomía a una persona sana44,45.
Tras el consenso alcanzado en el Foro de Ámsterdam, el posicionamiento internacional en materia de protección del donante, y los buenos resultados obtenidos con este tratamiento en grandes registros internacionales8,33,46,47, el TRDV comenzó a promoverse en España desde diferentes ámbitos (equipos de trasplante, sociedades científicas, asociaciones de pacientes, coordinaciones autonómicas de trasplantes y ONT)48. Se llevaron a cabo acciones dirigidas a mejorar el conocimiento acerca de esta opción terapéutica entre pacientes y familiares acerca de esta opción terapéutica: los beneficios que ofrece al paciente, el tipo de estudio a realizar en el donante y las posibles consecuencias de la donación para el mismo1. También se han realizado importantes esfuerzos en la formación de los profesionales implicados en esta actividad.
Para conocer las posibles consecuencias de la donación de vivo en España, ha sido fundamental la puesta en marcha de un registro nacional, que incluye información sobre las principales características clínicas y epidemiológicas de los donantes de un riñón en vida, la técnica utilizada para la realización de la nefrectomía, su índice de complicaciones y las posibles implicaciones clínicas de la donación renal a corto, mediano y largo plazo. El registro funciona desde el año 2010 y gracias al compromiso de administraciones y profesionales, cuenta con información del 96% de los donantes renales vivos, lo que permite extraer conclusiones fiables y lo convierte en una herramienta de apoyo para la valoración de riesgos de los donantes y en la información que se facilita acerca del procedimiento.
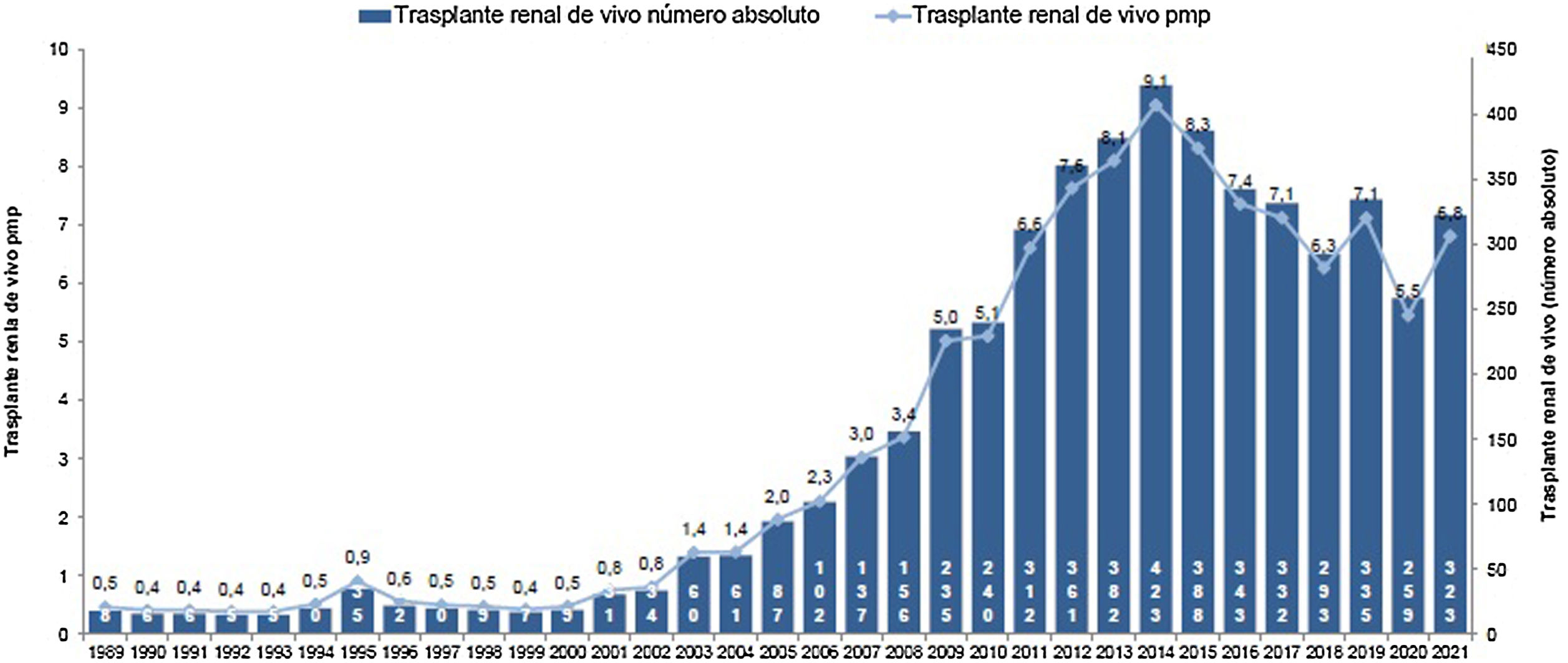
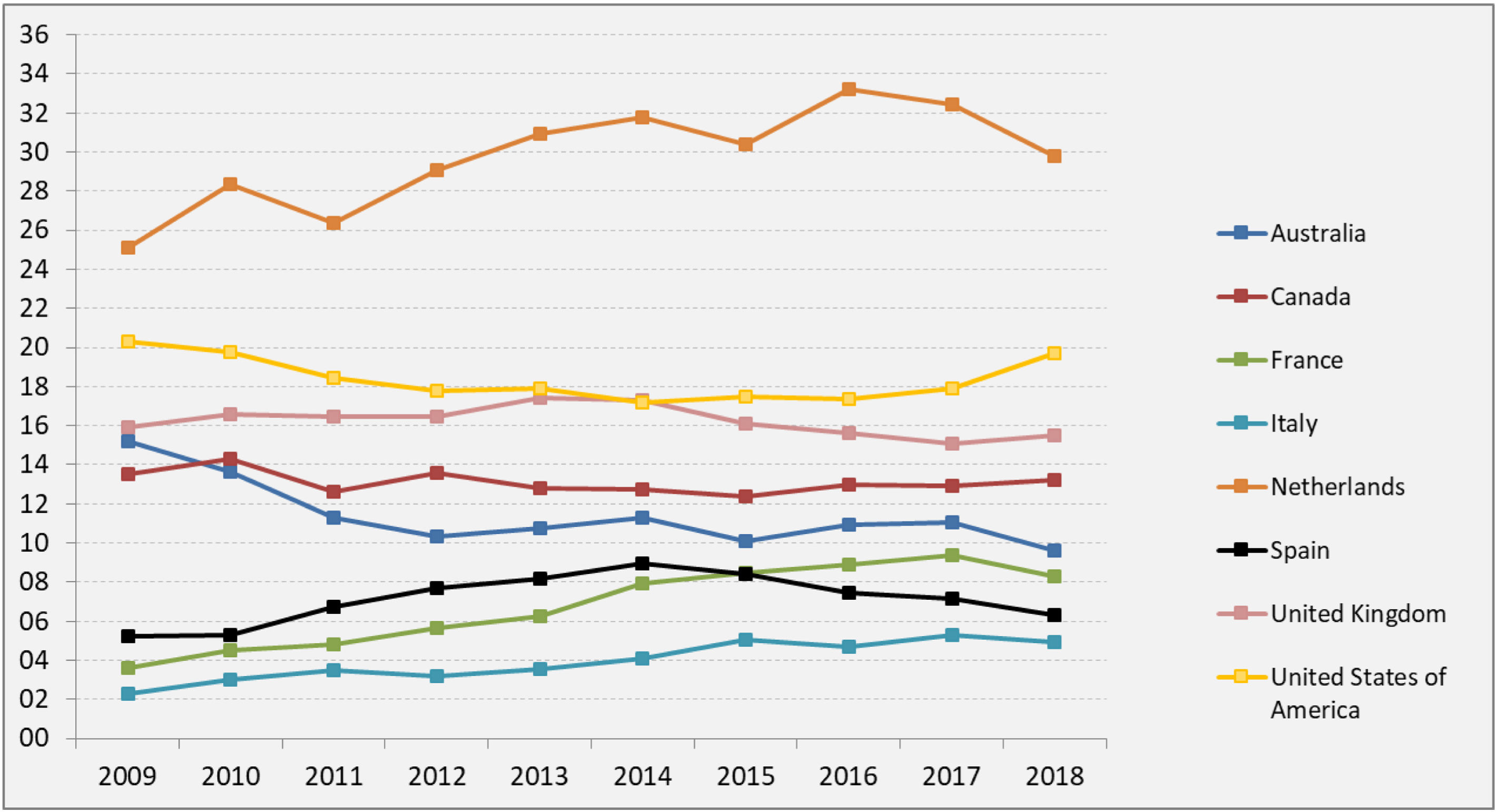
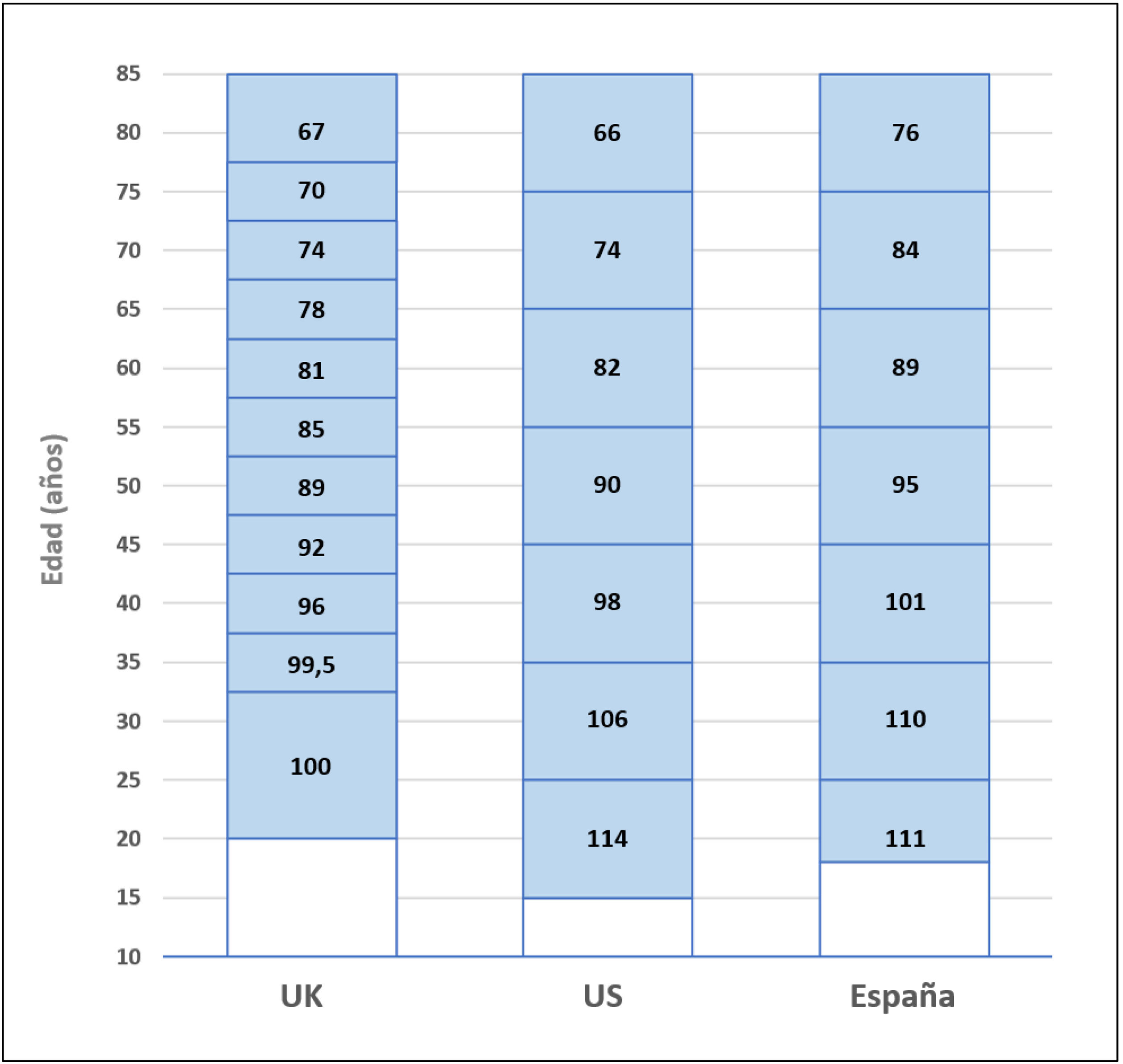
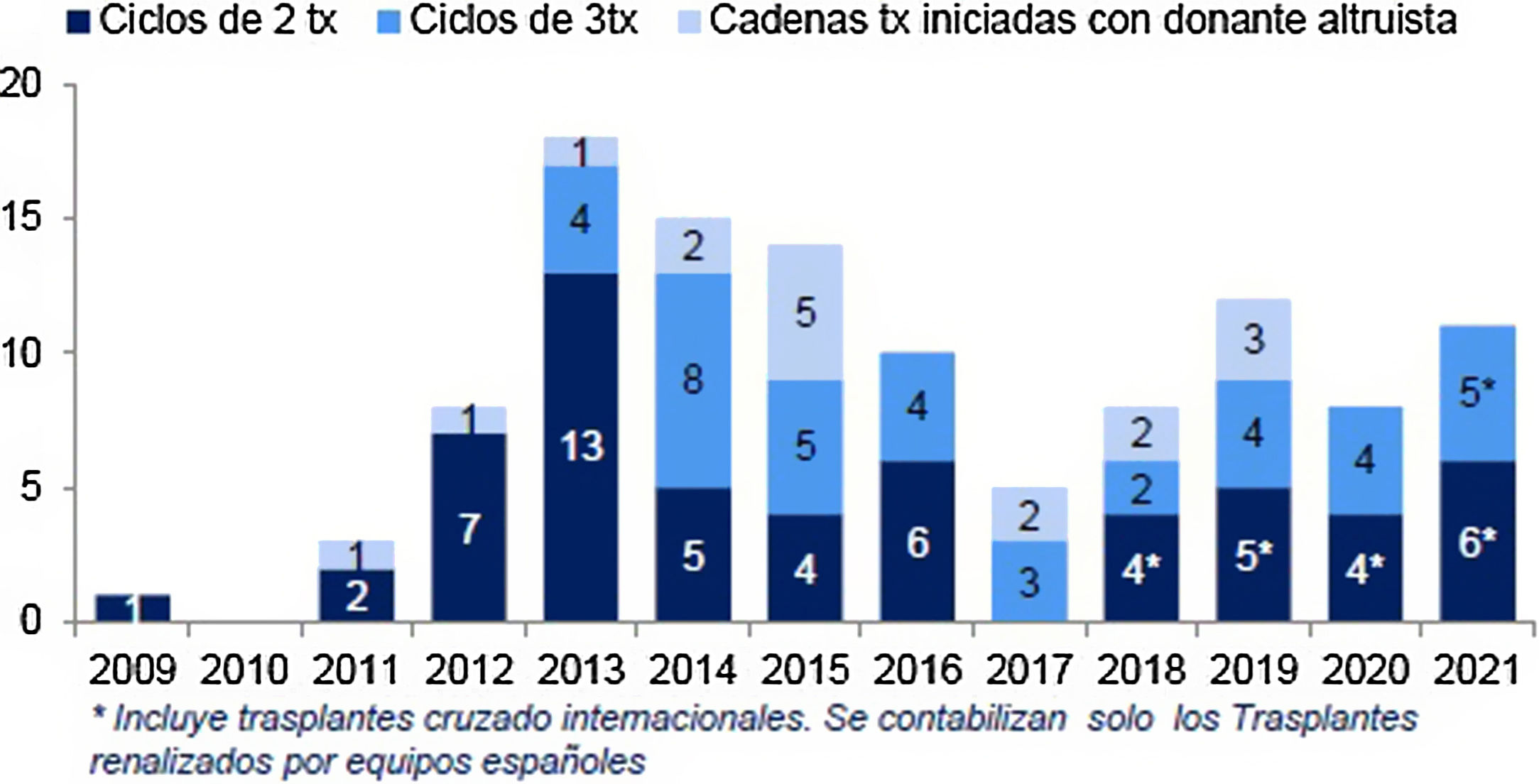
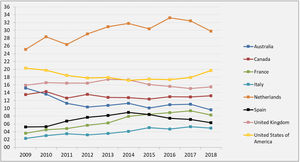
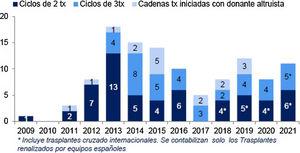
El resultado de las medidas puestas en marcha ha impulsado la aparición de nuevos programas de TRDV y un aumento en la actividad de los programas existentes, pasándose de realizar 61 TRDV en 12 centros en el año 2004, a superar la cifra de 300 procedimientos en 33 centros acreditados para su realización en 2019, lo que supone una actividad de 7,1 pmp29 (fig. 2). Siendo esta una buena noticia, es importante reflejar que, a pesar del aumento de actividad, aún estamos lejos de conseguir el objetivo de evitar la entrada en diálisis a muchos pacientes. Al comparar la actividad de TRDV en los últimos años con la de otros países de nuestro entorno o de un marco sociodemográfico y económico similar al nuestro, observamos una tasa de actividad inferior a la de países nórdicos, Países Bajos, Reino Unido, EE. UU. o Canadá49. En EE. UU. llama la atención un discreto descenso en los últimos años, que ha sido motivo de análisis por parte del sistema americano y que presenta una tendencia ascendente actual (fig. 3).
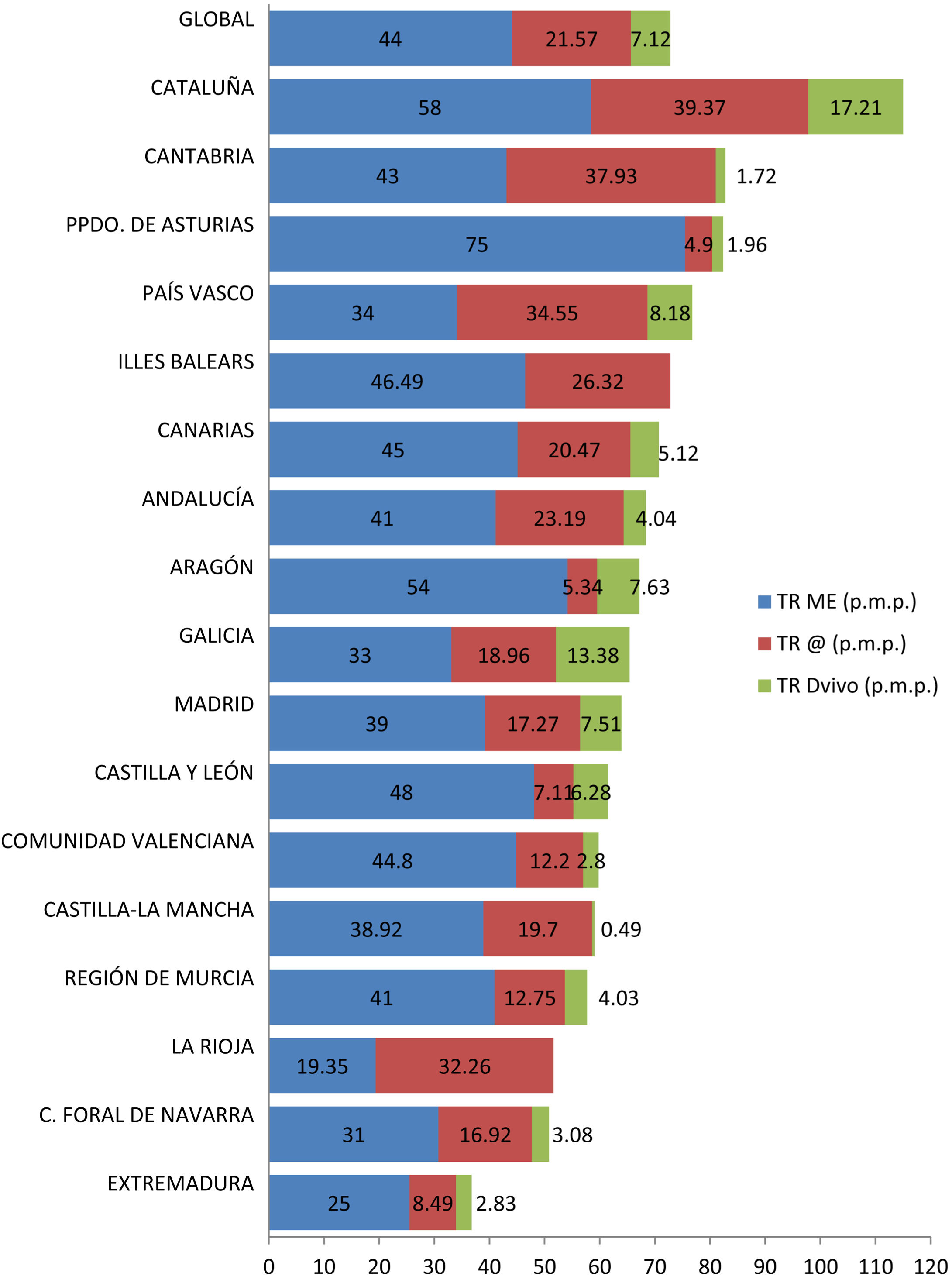
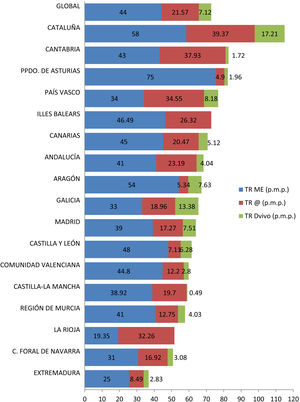
Además, el crecimiento en la actividad trasplantadora no se ha producido de manera homogénea en España. Existen importantes diferencias en el número de procedimientos de TRDV pmp realizados en las diferentes Comunidades Autónomas, lo que se traduce en un acceso desigual a esta opción terapéutica (fig. 4). Varias de las comunidades con mayor tasa de TRDV pmp también tienen cifras elevadas de TR de donante fallecido pmp. La actividad de TRDV de Cataluña y Galicia es similar a la registrada en un país tan activo en este ámbito como es Reino Unido49.
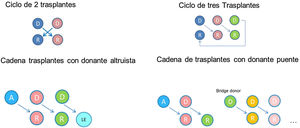
Adaptación del programa de TR de donante vivo a las nuevas necesidadesEl TRDV estándar es el que se lleva a cabo entre un donante y un receptor compatibles por grupo sanguíneo y HLA. De hecho, una de las ventajas que ofrece la donación de vivo frente a la de fallecido es que, al realizarse con frecuencia entre familiares consanguíneos, la probabilidad de que donante y receptor compartan un mayor número de antígenos es mayor. Sin embargo, este hecho no ha impedido la realización de TRDV entre personas no genéticamente relacionadas, con excelentes resultados50, favoreciendo su expansión al trasplante entre esposos, amigos y personas no relacionadas, como ocurre en los programas de donación renal cruzada y altruista51.
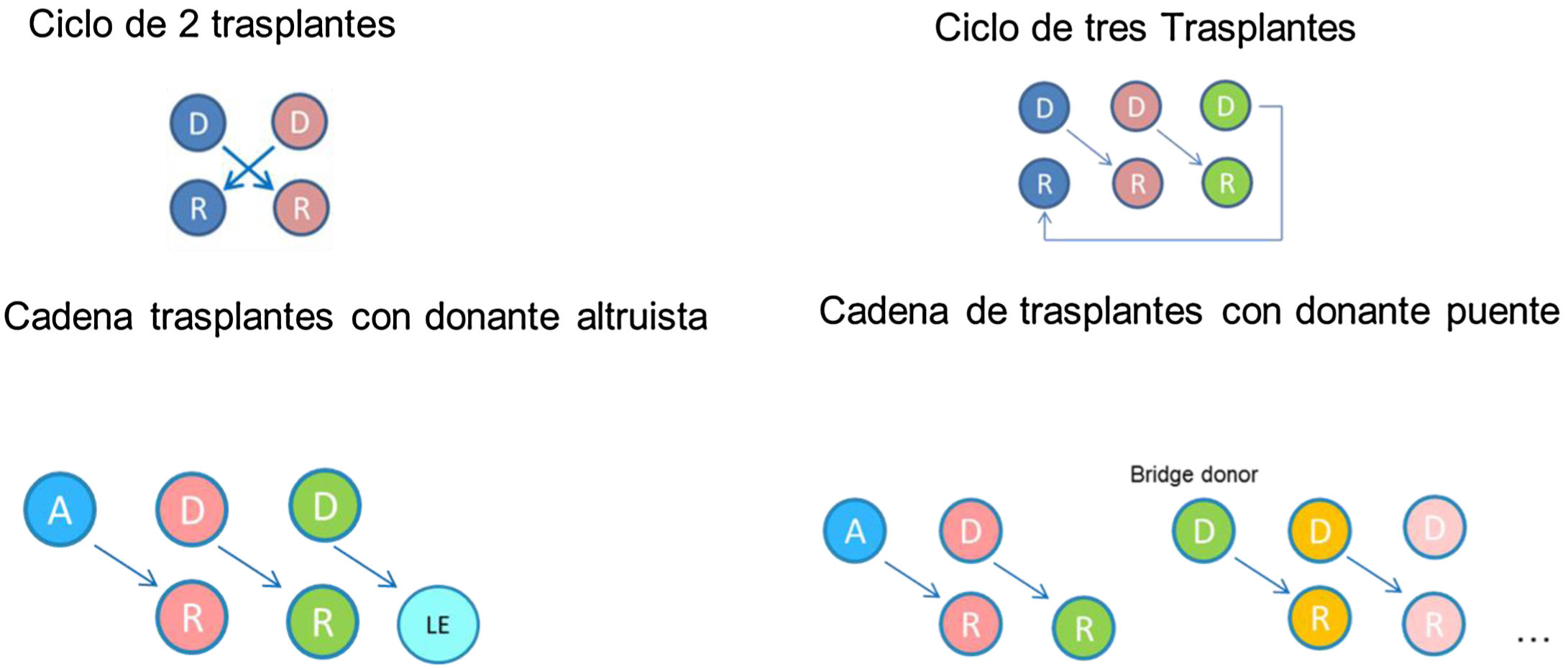
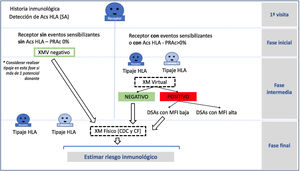
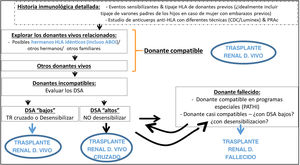
El incremento en la actividad de donación de vivo ha llevado parejo un aumento en el número de donantes que inician estudios, en los que se detecta una incompatibilidad con su receptor. De hecho, entre un 30 y un 40% de los potenciales donantes que se estudian son incompatibles con su receptor, ya sea por incompatibilidad de grupo sanguíneo con presencia de hemaglutininas contra el grupo sanguíneo del donante o por la detección, en el receptor, de anticuerpos específicos frente al HLA de su donante. Para solventar la incompatibilidad se han llevado a diferentes estrategias: las basadas en la desensibilización del receptor, que permiten realizar trasplantes directos incompatibles (ya sea ABO o HLA incompatibles)52–54 y las que se fundamentan en el intercambio de donantes entre un pool de parejas incompatibles, denominados trasplantes no directos o cruzados51,55,56. Ambas estrategias se llevan a cabo en España desde hace más de 10 años y han permitido realizar TRDV a alrededor de 50 pacientes al año29 que, de otro modo, habrían permanecido en lista de espera de un donante fallecido.
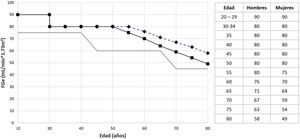
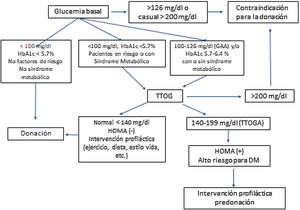
La adaptación el programa de TRDV no se basa solo en la superación de la incompatibilidad, sino en la ampliación de criterios de aceptación de un donante, tanto en la evaluación de factores de riesgo cardiovascular, como en la edad de donantes y receptores. Respecto a los primeros, y siempre teniendo en cuenta la protección del donante como principal objetivo, en los últimos años se ha producido un incremento en la aceptación de donantes con hipertensión arterial (HTA) controlada farmacológicamente y obesidad (definida como índice de masa corporal [IMC] ≥ 30 kg/m2) (Secciones 5, 7 y 8), que suponen en España un 10 y un 16% de los donantes vivos renales, respectivamente57.
Respecto a la edad, según datos del Registro Español de Enfermos Renales (REER), la mortalidad anual postrasplante es inferior a la de aquellos pacientes que permanecen en diálisis en cualquier grupo de edad30, por lo que el TRDV es una excelente opción también para el grupo de pacientes más añosos. De hecho, en España, el 16% de los receptores de TRDV son mayores de 60 años, así como el 21% de los donantes, con buena evolución posdonación57.
Optimización del programa de TR de donante vivoLos avances del programa nacional de TRDV en los últimos años han permitido su mejora progresiva, tanto en términos cuantitativos con un aumento del número de trasplantes efectuados, como cualitativos con un mejor conocimiento del proceso y sus resultados, una información más sistemática sobre esta opción terapéutica y una superación de obstáculos técnicos para la realización de este tipo de trasplantes. Sin embargo, todavía son diversos los retos pendientes de abordar, reflejados en la Estrategia Nacional en Donación y Trasplante de Órganos para los años 2018-202258.
La insuficiente actividad y las diferencias entre centros y Comunidades Autónomas en cuanto a TRDV obligan a una estrategia de identificación y difusión de buenas prácticas en la organización y el desarrollo de los procesos de información, evaluación y selección (inmunológica, nefrológica, urológica y psicosocial) del donante vivo, así como del procedimiento quirúrgico, el cuidado y el seguimiento del donante. En este sentido, la ONT, la SEN y la SET han liderado un proyecto de benchmarking del que derivarán recomendaciones específicas a adoptar por parte de los centros y los profesionals sanitarios a efectos de mejorar áreas críticas del proceso de TRDV. Es importante protocolizar en consulta de ERCA la provisión de información sobre la opción del TRDV, identificar una figura responsable de coordinar la actividad de TRDV en hospitales acreditados y desarrollar acciones de formación ad hoc dirigidas a equipos implicados y a profesionales con capacidad de indicación de este tratamiento sustitutivo renal.
Es necesario mejorar en cuanto a medidas de protección del donante vivo en nuestro país, incluyendo aquellas orientadas al ámbito sociolaboral, lo que exige reformas legislativas que ya se están abordando. La introducción de mejoras técnicas en los programas nacionales de TR cruzado, donación altruista y trasplante de donante incompatible también permitirá aumentar el número de pacientes que pueden beneficiarse de la opción del TRDV con adecuados resultados postrasplante.
Finalmente, la necesidad de llegar al profesional de manera eficaz es uno de los motivos por los que la SEN, SET y ONT han decidido desarrollar el presente documento de recomendaciones sobre TRDV.
Sección 2. Normativa para el TR de donante vivo en España- •
El TRDV está regulado en España por la Ley de trasplantes 30/1979 y desarrollada mediante el Real Decreto 1723/2012 (Calidad de la evidencia: SG).
- •
Nuestra legislación permite la donación de un órgano de donante vivo si es compatible con la vida y la función del órgano puede ser compensada por el organismo de forma segura (SG).
- •
Esta donación requiere la ausencia de condicionante económico, psicológico o social, y que el destino del órgano sea su trasplante a una persona determinada (SG).
- •
La normativa cita la posibilidad de donación entre personas relacionadas genéticamente, por parentesco o por amistad íntima, pero no excluye la donación entre personas no vinculadas siempre que se realice de forma voluntaria, altruista y desinteresada (SG).
- •
El donante ha de ser una persona mayor de edad civil, con plenas facultades mentales y adecuado estado de salud, lo que se acredita mediante el pertinente certificado médico emitido por facultativo ajeno al proceso de donación, y deberá ser plenamente informado de las consecuencias de su decisión (SG).
- •
El donante debe otorgar su consentimiento de forma expresa, libre y consciente ante el juez, pero antes de este trámite ya habrá firmado un documento de consentimiento informado en el ámbito sanitario en el que reconocerá haber sido informado de los posibles riesgos para su persona y de las ventajas que se esperan del implante al receptor del órgano (SG).
- •
Los centros que realizan el TRDV deben estar autorizados tanto para la extracción como para el trasplante de dicho órgano, lo que requiere reunir los requisitos exigidos para la autorización de centros de obtención y trasplante de donante cadáver, debiendo elaborarse protocolos marco para garantizar la calidad y seguridad del procedimiento (SG).
- •
El incumplimiento de los requisitos previstos en la normativa de trasplantes puede dar lugar a responsabilidad administrativa por la comisión de infracción (SG).
- •
En los casos de extracción de órganos sin el consentimiento libre, informado y expreso del donante vivo, o cuando medie retribución de cualquier clase, se incurrirá en delito de tráfico de órganos y se exigirá responsabilidad penal (SG).
Han transcurrido más de 40 años desde la publicación de la Ley 30/79 sobre extracción y trasplante de órganos, sin que la misma haya experimentado más que una modificación. Se trata de la operada por la Ley 26/2011, de 1 de agosto, de adaptación normativa a la Convención Internacional sobre los derechos de las personas con discapacidad, que añade una letra e) al artículo 4 en materia de información y prestación de consentimiento por persona con discapacidad.
Pese al transcurso del tiempo, esta norma continúa siendo un instrumento válido y seguro para regular la materia que constituye su objeto, dotando al sistema de un alto grado de fiabilidad. Las implicaciones éticas y jurídicas derivadas de la donación de órganos de donante vivo son incuestionables. Nos encontramos ante personas sanas a las que se les practica una intervención corporal que no está indicada para mejorar su salud, sino la de otra persona que sí se encuentra enferma. Dicha intervención supone al donante la pérdida de un órgano principal, menoscabo que el ordenamiento jurídico admite en función del consentimiento y del beneficio que se espera en el receptor. Pero esta excepción al régimen general de punición de las lesiones graves queda condicionada al cumplimiento estricto de los requisitos para garantizar que el consentimiento se presta libre y desinteresadamente tras recibirse una exhaustiva información sobre los riesgos y beneficios.
El articulado de la ley establece los principios por los que ha de regirse la actividad y distingue dos diferentes regímenes jurídicos, según se trate de donación de órganos procedentes de donante vivo o de donante cadáver. La regulación pormenorizada de cada concreto régimen se remite a la normativa reglamentaria de desarrollo, complementándose con la que regula la extracción y utilización de tejidos humanos.
Como principio básico se proclama el de gratuidad, prohibiéndose expresamente la percepción de compensación económica por el donante, derivada de la donación de órganos, y vedándose igualmente la posibilidad de exigir precio o contraprestación alguna al receptor. Esta declaración se entiende sin perjuicio de adoptar las medidas necesarias para que la donación no sea en ningún caso gravosa para el donante. Pueden así compensarse los perjuicios económicos que se hayan ocasionado al donante como consecuencia del proceso de donación sin que se vulnere el principio de gratuidad.
El segundo principio enuncia el propósito que ha de guiar toda la actividad objeto de regulación: la extracción y trasplante de órganos únicamente podrá realizarse con una finalidad terapéutica, quedando fuera de este campo finalidades tales como la investigación u otras igualmente lícitas.
Como se ha indicado, el régimen legal que se diseña es diferente, según nos encontremos ante donante vivo o ante donante cadáver.
En el supuesto de donante vivo, la ley exige el cumplimiento de una serie de requisitos tendentes a garantizar la validez del consentimiento que ha de prestar el donante tras recibir la necesaria información. Son los siguientes:
- a)
Que el donante sea mayor de edad. El Real Decreto-ley 9/2014, de 4 de julio, por el que se establecen las normas de calidad y seguridad para la donación, la obtención, la evaluación, el procesamiento, la preservación, el almacenamiento y la distribución de células y tejidos humanos y se aprueban las normas de coordinación y funcionamiento para su uso en humanos, permite la obtención de células y tejidos de personas menores de edad o incapaces para el caso de residuos quirúrgicos o de progenitores hematopoyéticos, o de otros tejidos o grupos celulares reproducibles cuya indicación terapéutica sea o pueda ser vital para el receptor. En estos supuestos, el consentimiento será otorgado por quien ostente la representación legal (artículo 7.1).
- b)
Que se encuentre en el ejercicio de plenas facultades mentales. Que haya sido previamente informado de las consecuencias –de orden somático, psíquico y psicológico– de su decisión, así como de las eventuales repercusiones que la donación pueda tener sobre su vida personal, familiar y profesional. Respecto de células y tejidos, la norma exige que se lleve a cabo una entrevista personal con el donante durante la cual se ha de completar un cuestionario estructurado. Según dispone el artículo 7.1 del Real Decreto-ley 9/2014, de 4 de julio, la información que debe proporcionarse al donante por el médico que haya de realizar la extracción o por el que sea responsable de esta, debe cubrir el objetivo y la naturaleza de la obtención de las células y tejidos; sus consecuencias y riesgos; las pruebas analíticas que se han de realizar; el registro y protección de los datos; y los fines terapéuticos. Asimismo, se informará al donante de las medidas de protección aplicables al mismo y de los beneficios que con el uso del tejido o grupo celular extraído se espera que haya de conseguir el receptor. En el supuesto de «uso antólogo eventual» de la célula o tejido, el contenido de la información facilitada deberá incluir además: i) la indicación de que las células y tejidos así obtenidos estarán a disposición para su uso alogénico en otros pacientes en el caso de existir indicación terapéutica; ii) la información actual, veraz y completa sobre el estado de los conocimientos científicos respecto de los usos terapéuticos o de investigación; iii) las condiciones de procesamiento y almacenamiento en los establecimientos autorizados; y iiii) cualquier otra cuestión relacionada con la utilidad terapéutica de la obtención de células y tejidos sin indicación médica establecida en el momento de la obtención e inicio de la preservación. Igualmente, se le informará de los beneficios que se esperan conseguir en el receptor mediante el trasplante del órgano donado.
- c)
Que el donante otorgue su consentimiento de forma expresa, libre y consciente.
- d)
Si el donante fuese una persona con discapacidad que cumpla los requisitos previstos en los apartados anteriores, la información y el consentimiento deberán efectuarse en formatos adecuados, siguiendo las reglas marcadas por el principio del diseño para todos, de manera que le resulten accesibles y comprensibles a su tipo de discapacidad.
- e)
Que el destino del órgano extraído sea su trasplante a persona determinada con el propósito de mejorar sustancialmente su esperanza o condiciones de vida.
- f)
Que se garantice el anonimato del receptor.
Concluye la regulación legal enumerando los requisitos que deben concurrir para que el responsable del trasplante de su conformidad al mismo, apreciados todos ellos desde la perspectiva del receptor. La exigencia de este requisito se matiza en la regulación reglamentaria –RD 1723/2012– al disponer su artículo 5 que esta limitación no es aplicable a los directamente interesados en el trasplante de órganos de donante vivo entre personas relacionadas genéticamente, por parentesco o por amistad íntima:
- a)
Que sea plenamente consciente del tipo de intervención que va a efectuarse, conociendo los posibles riesgos y las previsibles ventajas que, tanto física como psíquicamente, puedan derivarse del trasplante.
- b)
Que sea informado de que se han efectuado en los casos precisos los necesarios estudios inmunológicos de histocompatibilidad u otros que sean procedentes, entre donante y futuro receptor, efectuados por un laboratorio acreditado por el Ministerio de Sanidad, Política Social e Igualdad.
- c)
Que dicha información se proporcione utilizando formatos adecuados, siguiendo las reglas marcadas por el principio del diseño para todos, de manera que resulten accesibles y comprensibles a las personas con discapacidad.
- d)
Que exprese por escrito u otro medio adecuado a su discapacidad, su consentimiento para la realización del trasplante cuando se trate de un adulto jurídicamente responsable de sus actos, o por sus representantes legales, padres o tutores, si estuviera incapacitado o en caso de menores de edad. En el caso de que el receptor sea una persona con discapacidad, deberán tenerse en cuenta las circunstancias personales del individuo, su capacidad para tomar dicha decisión en concreto y contemplarse la prestación de apoyo para la toma de estas decisiones. Tratándose de personas con discapacidad con necesidades de apoyo para la toma de decisiones, se estará a la libre determinación de la persona una vez haya dispuesto de los apoyos y asistencias adecuados a sus concretas circunstancias.
El receptor es un paciente y por ello esta regulación debe ser completada con lo dispuesto por la ley 41/2002 reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. Debe entenderse que el menor de edad al que se refiere el artículo 6 de la ley es el menor de 16 años. Sobre la mayoría de edad requerida para ser donante de órganos y para ser receptor trataremos en el epígrafe correspondiente al consentimiento.
Real Decreto 1723/2012, de 28 de diciembre por el que se regulan las actividades de obtención y utilización clínica de órganos humanos y coordinación territorial de los órganos humanos destinados al trasplante y se establecen requisitos de calidad y seguridad.Esta norma sustituye al Real Decreto 2070/1999, de 30 de diciembre, que estuvo en vigor desde que derogó el de 22 de febrero de 1980, norma que desarrolló por primera vez la Ley 30/79. A lo largo de su existencia, la ley ha contado con estos tres desarrollos reglamentarios, siendo especialmente relevante la modificación producida en el año 1999 en el ámbito propio de la donación de órganos de donante cadáver. Las reformas reglamentarias no han alterado el régimen de donación de órganos de donante vivo, pero ello no significa que nuevas modalidades de donación, como la donación no vinculada, queden fuera del ámbito de cobertura de la normativa vigente
El Real Decreto vigente incorpora al ordenamiento jurídico español la Directiva 2010/53/UE del Parlamento Europeo y del Consejo, de 7 de julio de 2010, sobre normas de calidad y seguridad de los órganos humanos destinados al trasplante. La directiva determina los requisitos mínimos que deben aplicarse a la donación, evaluación, caracterización, obtención, preservación, transporte y trasplante de órganos humanos, con el fin de garantizar altos niveles de calidad y seguridad de dichos órganos. Exige, asimismo, requisitos de trazabilidad y el desarrollo de un sistema para la notificación y gestión de eventos y reacciones adversas graves, estableciendo los datos mínimos que deben recabarse para la evaluación de donantes y órganos.
Entre sus fundamentos éticos destacan los relacionados con la voluntariedad y la gratuidad, el consentimiento, la protección del donante vivo y la protección de datos personales. También introduce por primera vez un catálogo de infracciones administrativas por incumplimiento de la normativa sobre extracción y trasplante de órganos.
Observando los requisitos y principios establecidos en la Directiva, el RD 1723/2012 exige para las actividades relacionadas con la obtención y utilización clínica de órganos humanos requisitos de calidad y seguridad, todo ello con el fin de garantizar un alto nivel de protección de la salud humana y reducir en lo posible la pérdida de los órganos disponibles.
La finalidad de dichas actividades ha de ser, como ordena la Ley 30/79, terapéutica, es decir, deben guiarse por el único propósito de favorecer la salud o las condiciones de vida del receptor, sin perjuicio de las investigaciones que adicionalmente puedan realizarse. Igualmente se exige, en el ejercicio de estas actividades, respeto a los derechos fundamentales de la persona y respeto a los postulados éticos que se aplican a la práctica clínica y a la investigación biomédica.
Los principios en que se inspira la regulación contenida en Real Decreto encuentran su fundamento en la propia Ley 30/79 que desarrolla, en la Directiva 2010/53/UE que traspone, y en la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales. Se enumeran a continuación:
- Confidencialidad: Este principio impide divulgar informaciones que permitan la identificación del donante y del receptor. De esta regla se exceptúan aquellos casos en que un individuo, de forma pública, libre y voluntaria, se identifique como donante o como receptor. Aun cuando dicho extremo ocurra, se deberá respetar el principio de que ni los donantes ni sus familiares podrán conocer la identidad del receptor o la de sus familiares y viceversa.
Con carácter general, se evitará cualquier difusión de información que pueda relacionar directamente la obtención y el ulterior trasplante, pero esta limitación no es aplicable a los directamente interesados en el trasplante de órganos de donante vivo entre personas relacionadas genéticamente, por parentesco o por amistad íntima. Fuera de estos casos, aun tratándose de donación de órganos de donante vivo, deberá respetarse el principio de confidencialidad.
El respeto a este principio no impide la adopción de medidas preventivas cuando se sospeche la existencia de riesgos para la salud individual o colectiva.
- Protección de datos personales: La información relativa a donantes y receptores de órganos humanos será recogida, tratada y custodiada en la más estricta confidencialidad, conforme a lo dispuesto en la legislación sobre protección de datos, en la ley General de Sanidad y en la Ley 41/2002, de 14 de noviembre, reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica.
El responsable del tratamiento habrá de adoptar las medidas técnicas y organizativas precisas para garantizar la seguridad de esta categoría especial de datos, evitando su alteración, pérdida, tratamiento o acceso no autorizado. Tanto el responsable como el encargado del tratamiento están obligados a guardar secreto profesional, aunque finalice su relación laboral. Las infracciones en esta materia podrán ser sancionada por la Agencia Española de Protección de Datos, sin perjuicio de la responsabilidad penal en que pudiera incurrirse (artículos 197 y 198 del Código Penal).
Según dispone el artículo 9 de la Ley Orgánica 3/2018 de Protección de Datos Personales y garantía de los derechos digitales, por remisión al artículo 9.2 del Reglamento (UE) 2016/679, podrá ser amparado el tratamiento de datos en el ámbito de la salud cuando así lo exija la gestión de los sistemas y servicios de asistencia sanitaria y social, pública y privada, o la ejecución de un contrato de seguro del que el afectado sea parte.
- Limitación de la promoción y publicidad: La promoción de la actividad de donación de órganos ha de realizarse con carácter general, señalando su carácter altruista, voluntario y desinteresado. No podrá hacerse publicidad de la donación de órganos en beneficio de personas concretas o de centros sanitarios, instituciones, fundaciones o empresas determinadas.
Se prohíbe expresamente la publicidad engañosa que induzca a error sobre la obtención y utilización clínica de órganos humanos.
Sin perjuicio de lo anterior, las autoridades competentes promoverán la información y educación de la población en materia de donación y trasplante, de los beneficios que proporcionan a las personas que los necesitan, así como de las condiciones, requisitos y garantías que suponen.
- Gratuidad: No puede percibirse gratificación o compensación económica alguna por la donación, por el donante ni por cualquier otra persona física o jurídica. Tampoco se exigirá al receptor precio alguno por el órgano trasplantado, ni cabe ofrecer o entregar beneficios pecuniarios o de cualquier otro tipo en relación con la asignación de uno o varios órganos para trasplante, así como solicitarlos o aceptarlos. Y se prohíbe cualquier publicidad sobre la necesidad de un órgano o sobre su disponibilidad, ofreciendo o buscando algún tipo de gratificación o remuneración.
El Real Decreto reproduce la excepción por compensación de pérdidas económicas cuando indica que la realización de los procedimientos médicos relacionados con la obtención no será, en ningún caso, gravosa para el donante vivo. No se impide a los donantes vivos el resarcimiento de los gastos y la disminución de ingresos directamente relacionados con la donación. Ahora bien, cuando dicha restitución resulte procedente, habrá de efectuarse necesariamente a través de los mecanismos que se puedan prever a tal efecto por las administraciones competentes.
- -
Equidad: La selección y acceso a posibles receptores ha de sujetarse a criterios de equidad garantizando la igualdad de oportunidades ante el tratamiento.
- -
Adopción de las medidas de seguridad y calidad necesarias con el fin de reducir las pérdidas de órganos, minimizar los posibles riesgos, tratar de asegurar las máximas posibilidades de éxito del trasplante y mejorar la eficiencia del proceso de obtención y trasplante de órganos.
En cuanto a la concreta regulación de este tipo de donación, se regula en el artículo 8 de forma coherente con la regulación contenida en la ley 30/79, pero con un desarrollo más completo. Los requisitos a los que se sujeta la donación de vivo son los siguientes:
- 1.
La extracción debe realizarse de un órgano o parte de él cuya obtención sea compatible con la vida y cuya función pueda ser compensada por el organismo del donante de forma adecuada y suficientemente segura.
- 2.
No podrá procederse a la extracción de órganos de menores de edad aún con el consentimiento de sus padres o tutores.
- 3.
Tampoco podrá procederse a la extracción –o en su caso utilización– de órganos de donantes vivos cuando:
- -
Por cualquier circunstancia pudiera considerarse que en la obtención del consentimiento ha mediado condicionamiento económico o de otro tipo, social o psicológico.
- -
Existan sospechas de que se altera el libre consentimiento del donante.
- -
No se esperan suficientes posibilidades de éxito del trasplante.
- 4.
El derecho de información ha de extenderse a la forma de proceder prevista ante la contingencia de que una vez se hubiera extraído el órgano, no fuera posible su trasplante en el receptor al que iba destinado. Toda la información habrá de facilitarse al donante en formatos adecuados, de manera que resulte accesible y comprensible a las personas con discapacidad.
- 5.
Será preceptiva la emisión de informe por el Comité de Ética del hospital trasplantador.
La acreditación del estado de salud y facultades mentales del donante es un requisito exigido por la Ley 30/79. El Real Decreto dispone al respecto que deberá realizarse por médico distinto del que vaya a efectuar la extracción, previa la correspondiente información. Dicha información abarcará necesariamente los siguientes aspectos: a) riesgos inherentes a la intervención; b) consecuencias previsibles de orden somático o psicológico; c) repercusiones que pueda suponer en su vida personal, familiar o profesional; y d) beneficios que se esperan del trasplante y los riesgos potenciales para el receptor. Igualmente debe trasladarse al donante vivo la importancia que reviste la transmisión de sus antecedentes personales y será informado de que se le proporcionará asistencia sanitaria para su restablecimiento y se facilitará su seguimiento clínico en relación con la obtención del órgano.
Los anteriores extremos se acreditarán mediante un certificado médico que hará referencia al estado de salud, a la información facilitada y a la respuesta y motivaciones libremente expresadas por el donante y, en su caso, a cualquier indicio de presión externa al mismo. El certificado incluirá la relación nominal de otros profesionales que puedan haber colaborado en tales tareas con el médico que certifica.
Centros autorizados. Competencias autonómicasEl artículo 10 del Real Decreto enumera los requisitos generales que han de cumplir los centros de obtención de órganos de donante vivo, previa autorización por la autoridad competente de la comunidad autónoma:
- 1)
Estar autorizado como centro de obtención de órganos procedentes de donantes fallecidos y como centro de trasplante del órgano para el que se solicita la autorización de obtención de donante vivo. Artículo 11.2 RD 1723/2012.2.
Para poder ser autorizados, los centros de obtención de órganos de donantes fallecidos deberán reunir, al menos, los siguientes requisitos:
- a)
Disponer de una organización y un régimen de funcionamiento que permita asegurar la realización de la obtención de forma satisfactoria.
- b)
Disponer de una unidad de coordinación hospitalaria de trasplantes, dotada del personal y los medios adecuados.
- c)
Garantizar la disponibilidad del personal médico cualificado y los medios técnicos que permitan comprobar la muerte.
- d)
Garantizar la disponibilidad de personal médico y de enfermería debidamente cualificado, así como de los servicios sanitarios y medios técnicos suficientes para la correcta selección, evaluación, caracterización y mantenimiento del donante.
- e)
Garantizar la disponibilidad de los servicios sanitarios adecuados, incluyendo laboratorios y técnicas de imagen, para la realización de aquellas determinaciones que se consideren en cada momento necesarias y que permitan una adecuada evaluación clínica del donante. Estos servicios contarán con personal cualificado y con instalaciones y equipos apropiados.
- f)
Garantizar la disponibilidad de las instalaciones y materiales necesarios para la correcta realización de las obtenciones, de conformidad con los estándares aceptados en esta materia y con las mejores prácticas médicas.
- g)
Disponer de programas marco, con el fin de garantizar la calidad y la seguridad de todo el proceso.
- h)
Disponer de un registro de acceso restringido y confidencial, con sus correspondientes claves alfanuméricas, donde se recogerán los datos necesarios que permitan garantizar la trazabilidad, así como vincular la trazabilidad de los tejidos y células obtenidos de los donantes.
- i)
Disponer de un archivo de sueros del donante durante un periodo mínimo de diez años, al objeto de hacer, si son necesarios, controles biológicos.
- j)
Garantizar la disponibilidad del personal, instalaciones y servicios adecuados para la restauración del cuerpo de la persona fallecida, una vez realizada la obtención.
- k)
Cumplir con los requisitos establecidos en materia de confidencialidad y protección de datos personales, promoción y publicidad y gratuidad de las donaciones.
- l)
Disponer de suficiente personal médico y de enfermería con cualificación y acreditada experiencia para la correcta evaluación y selección del donante y la realización de la obtención.
- 2)
Disponer de las instalaciones y materiales necesarios para la correcta realización de las obtenciones, de conformidad con los estándares aceptados en esta materia y con las mejores prácticas médicas.
- 3)
Disponer de los servicios sanitarios, incluyendo laboratorios y técnicas de imagen, necesarios para garantizar el adecuado estudio preoperatorio del donante y el correcto tratamiento de las eventuales complicaciones que puedan surgir en el mismo. Estos servicios sanitarios contarán con personal cualificado y con instalaciones y equipos apropiados.
- 4)
Disponer de protocolos que aseguren la adecuada evaluación y selección del donante, la transmisión de información relativa al donante y al receptor cuando la obtención y el trasplante no se efectúen en el mismo centro, el proceso de la obtención y el seguimiento postoperatorio inmediato y a largo plazo, así como otros protocolos o programas marco con el fin de garantizar la calidad y la seguridad de todo el proceso.
- 5)
Disponer de un registro de acceso restringido y confidencial, con sus correspondientes claves alfanuméricas, donde se recogerán los datos necesarios que permitan garantizar la trazabilidad.
- 6)
Garantizar el registro de la información relativa a los donantes vivos y su seguimiento clínico, de acuerdo con lo establecido en el artículo 31, sin perjuicio de las disposiciones sobre protección de datos personales y secreto estadístico. El artículo 31, de sistemas de información, establece:
- i.
Sin menoscabo de los convenios que pudieran establecerse con las asociaciones profesionales y científicas pertinentes ni de los sistemas que pudieran implementar las comunidades autónomas a tales efectos, y en cooperación con las mismas, será función de la Organización Nacional de Trasplantes desarrollar y mantener los sistemas de información estatal en los que se registren y custodien los datos relativos a: a) Los donantes y los órganos y su caracterización. b) La trazabilidad de los órganos desde la donación hasta el trasplante o la desestimación y viceversa. c) Las características y los movimientos de los pacientes incluidos en lista de espera para trasplante. d) Las características y datos de seguimiento de los pacientes trasplantados. e) Las características y datos de seguimiento de los donantes vivos. f) La notificación y las medidas de gestión de los eventos y reacciones adversas graves.
- ii.
Para cada uno de los apartados anteriores, la Organización Nacional de Trasplantes definirá, en cooperación con las comunidades autónomas, los datos mínimos que habrán de proporcionarse al sistema estatal para todo donante, órgano, paciente en lista de espera o receptor.
- 7)
Cumplir con los requisitos establecidos en materia de confidencialidad y protección de datos personales, promoción y publicidad y gratuidad de las donaciones.
En cuanto al procedimiento para obtener la autorización sanitaria de la correspondiente comunidad autónoma, así como para su renovación y extinción, sin perjuicio de la normativa específica de cada una de ellas, se ajustará a lo consignado en el artículo 11 del RD 1723/2012 sobre autorización a los centros de obtención de órganos de donantes fallecidos. La autorización deberá contener, como mínimo: a) La actividad para la que se autoriza al centro. b) El nombre del o de los responsables del proceso de obtención. c) Su duración, según el periodo de vigencia que determine la autoridad competente.
Al término del periodo de vigencia de la autorización se podrá proceder a su renovación previa constatación de que persisten las condiciones que dieron lugar a su concesión. En ningún caso se entenderá prorrogada automáticamente.
Cualquier tipo de modificación sustancial que se produzca en las condiciones, estructura, responsables o funcionamiento del centro deberá ser notificada a la autoridad competente y podrá dar lugar a la revisión de la autorización sanitaria, e incluso a su extinción, aun cuando no hubiera vencido el periodo de vigencia.
La autorización determinará la persona a quien, además del responsable de la unidad médica en que haya de realizarse el trasplante, corresponde dar la conformidad para cada intervención, y podrá ser revocada o suspendida como consecuencia de las actuaciones de inspección y control por parte de las autoridades competentes.
Por lo que se refiere a los centros de trasplante de órganos, el artículo 19 del Real Decreto exige, además de los requisitos generales establecidos para los centros de obtención, los requisitos específicos mínimos que figuran en el anexo II. Para la realización de cualquier trasplante de órganos de donante vivo será imprescindible que el centro esté autorizado para el trasplante del órgano correspondiente de donante fallecido y demuestre experiencia acreditada en su realización. El artículo 18 RD 1723/2012 dice en su apartado 1 que el trasplante de órganos humanos solo podrá realizarse en aquellos centros sanitarios que dispongan de autorización específica de la autoridad competente de la correspondiente comunidad autónoma. Y en su apartado 2 que, para poder ser autorizados, los centros trasplantadores de órganos humanos deberán reunir al menos los siguientes requisitos generales:
- a)
Estar autorizado como centro de obtención de órganos de donantes fallecidos y acreditar una actividad suficiente como para garantizar la viabilidad y calidad del programa de trasplante.
- b)
Disponer de una organización sanitaria y un régimen de funcionamiento adecuado para realizar la intervención que se solicita.
- c)
Disponer de la unidad médica y quirúrgica correspondiente con el personal sanitario suficiente y con demostrada experiencia en el tipo de trasplante del que se trate.
- d)
Garantizar la disponibilidad de facultativos especialistas con experiencia probada en el diagnóstico y tratamiento de las complicaciones del trasplante a desarrollar.
- e)
Disponer de una unidad de coordinación hospitalaria de trasplantes.
- f)
Disponer de las instalaciones y materiales necesarios para la adecuada realización del proceso de trasplante, tanto en el preoperatorio, como en la intervención y en el postoperatorio, de conformidad con los estándares aceptados en esta materia y con las mejores prácticas médicas.
- g)
Disponer de los servicios sanitarios, incluyendo laboratorios y técnicas de imagen, necesarios para garantizar la realización del trasplante, el seguimiento clínico adecuado del receptor y el correcto tratamiento de las eventuales complicaciones que la práctica de este trasplante precise. Estos servicios sanitarios contarán con personal cualificado y con instalaciones y equipos apropiados.
- h)
Disponer de un servicio de anatomía patológica con los medios técnicos y humanos necesarios para el estudio de complicaciones asociadas al trasplante y poder realizar los posibles estudios post mortem.
- i)
Disponer de un laboratorio de microbiología donde se puedan efectuar los controles de las complicaciones infecciosas que presenten los pacientes.
- j)
Garantizar la disponibilidad de un laboratorio de inmunología y una unidad de histocompatibilidad con los medios técnicos y humanos necesarios para garantizar la correcta realización de los estudios inmunológicos necesarios para la monitorización pre y postrasplante.
- k)
Disponer de una comisión de trasplante y de aquellos protocolos que aseguren la adecuada selección de los receptores, el proceso de trasplante y el seguimiento postoperatorio inmediato y a largo plazo, y que garanticen la calidad y la seguridad de todo el procedimiento terapéutico, así como de aquellos otros protocolos de calidad y seguridad.
- l)
Disponer de un registro, de acceso restringido y confidencial, con sus correspondientes claves alfanuméricas, donde constarán los trasplantes realizados con los datos precisos para garantizar la trazabilidad.
- m)
Garantizar el registro de la información que permita evaluar la actividad de los trasplantes realizados en el centro, así como los resultados obtenidos, de acuerdo con lo establecido en el artículo 31 y sin perjuicio de las disposiciones sobre protección de datos personales y secreto estadístico.
- n)
Adecuar en todo momento la actuación y los medios de las unidades médicas implicadas en los diferentes tipos de trasplante a los progresos científicos, siguiendo protocolos diagnósticos y terapéuticos actualizados.
- o)
Cumplir con los requisitos establecidos en materia de confidencialidad y protección de datos personales, promoción y publicidad y gratuidad de las donaciones.
El procedimiento para obtener la autorización de la comunidad autónoma correspondiente se inicia con una la solicitud que deberá contener, al menos los siguientes datos: a) El tipo de trasplante a realizar. b) La relación de médicos responsables del equipo de trasplante, así como la documentación que acredite su cualificación, y c) una memoria con la descripción detallada de los medios humanos y materiales y los protocolos de que dispone el centro, de acuerdo con los requisitos exigidos para realizar la actividad correspondiente.
Sin perjuicio de la normativa específica de cada comunidad autónoma, la autorización deberá contener, como mínimo: a) El tipo de trasplante para el que se autoriza el centro. b) El nombre del o de los responsables del equipo de trasplante, y c) su duración, según el periodo de vigencia que determine la autoridad competente.
Será función de cada comunidad autónoma la inspección o supervisión a intervalos regulares de las unidades de coordinación de trasplantes, los centros de obtención y los centros de trasplante. A este fin, las unidades y centros deberán proporcionar toda la información en la forma y modo en que sea solicitada en relación con la actividad para la que hayan sido autorizados.
Consentimiento informado. Donantes excepcionales: menores «competentes» y adultos «incompetentes»Consentimiento informado de donanteTanto la Ley 30/79 como el Real Decreto 1723/2012 exigen, para dotar de validez al consentimiento del donante, la concurrencia de un doble requisito: biológico y psicológico.
En cuanto al primero, la ley alude a que el donante sea mayor de edad, previsión que confirma el Real Decreto cuando prohíbe la extracción de órganos de menores de edad, aun con el consentimiento de sus padres o tutores. Puede surgir duda sobre el límite que ha de aplicarse para determinar la mayoría o minoría de edad, pues la Ley 41/2002 en su artículo 9.4 excepciona del consentimiento por representación a los mayores de 16 años que no tengan su capacidad modificada judicialmente, salvo que no sean capaces intelectual ni emocionalmente de comprender el alcance de la intervención que se propone realizar. La denominada mayoría de edad sanitaria –mayoría de edad para consentir cualquier actuación en el ámbito de la salud– ha quedado establecida en 16 años.
No es esta, sin embargo, la mayoría de edad a que se refiere la normativa sobre extracción y trasplante de órganos cuando regula la validez del consentimiento prestado por el donante vivo. Dicha mayoría de edad coincide con la denominada mayoría de edad civil, que la Constitución ha fijado, en su artículo 12, en los 18 años. Del mismo modo, el Código Civil dispone en su artículo 315 que la mayor edad comienza a los 18 años cumplidos, debiéndose computar a estos efectos completo el día del nacimiento, y en el artículo 322 que el mayor de edad es capaz para todos los actos de la vida civil «salvo las excepciones establecidas en casos especiales por este Código».
La mayoría de edad sanitaria general –16 años– no se considera suficiente por el legislador para tomar decisiones como la del otorgamiento de instrucciones previas, tal y como dispone el artículo 11 de la ley 41/2002, que igualmente exige la mayoría de edad para emitir tales voluntades anticipadas. Tampoco una decisión que afecta a la salud e integridad física de una persona sana puede adoptarse si no se constata que se ha llegado a una edad biológica en la que cabe presumir una madurez suficiente para tomar decisiones relevantes. En este sentido se pronuncia de manera inequívoca el artículo 156 del Código Penal cuando otorga al consentimiento del donante, válida, libre, consciente y expresamente emitido, la virtualidad de eximir de responsabilidad penal a los facultativos que le extraen un órgano en los supuestos de trasplante de órganos efectuado con arreglo a lo dispuesto en la ley. Pero se exceptúan los supuestos en que el consentimiento se haya obtenido viciadamente, o mediante precio o recompensa, o cuando el otorgante sea menor de edad o carezca absolutamente de aptitud para prestarlo, en cuyo caso no será válido el prestado por éstos ni por sus representantes legales. Es decir, el Código Penal solo entiende que no merece reproche penal la extracción de órganos de donante vivo cuando este, siendo mayor de edad, ha prestado consentimiento a la extracción de forma válida, libre, consciente y expresa. En otro caso, aun habiéndose prestado consentimiento para la extracción, los facultativos incurrirían en el delito tipificado en el artículo 149 del Código Penal que castiga –con la pena de prisión de seis a 12 años– a quien causa a otro, por cualquier medio o procedimiento, la pérdida o la inutilidad de un órgano principal.
El requisito psicológico se aborda por la Ley 30/79 exigiendo que el donante se encuentre en el ejercicio de plenas facultades mentales, lo que debe acreditarse mediante el correspondiente certificado médico. Y prohíbe la posibilidad de donar a las personas afectadas por una deficiencia psíquica o enfermedad mental o que por cualquier otra causa no puedan prestar consentimiento válidamente.
Esta disposición no debe entenderse matizada por la modificación legal introducida en la Ley 30/79 por Ley 26/2011, de 1 de agosto, de adaptación normativa a la Convención Internacional sobre los derechos de las Personas con Discapacidad. La citada modificación permite ser donante a una persona con discapacidad, pero siempre que cumpla los requisitos de mayoría de edad y pleno ejercicio de facultades mentales. En tales casos la información deberá facilitarse al donante en formatos adecuados, de manera que le resulten accesibles y comprensibles a su tipo de discapacidad.
La prestación del consentimiento siempre es posterior a la información que ha de recibir el donante, siguiéndose así la regla general propia de todo consentimiento informado. Sin embargo, la información que ha de proporcionarse al donante vivo es mucho más extensa que la requerida para cualquier otro acto sanitario, precisamente porque se trata de una persona sana a la que no se le va a realizar una intervención en su beneficio. La información sobre los riesgos de todo tipo, y la de los beneficios que se esperan en el receptor, ha de ser exhaustiva. A este respecto el RD 1723/2012 dispone que la información abarcará necesariamente los siguientes extremos: a) riesgos inherentes a la intervención, b) consecuencias previsibles de orden somático o psicológico, c) repercusiones que pueda suponer en su vida personal, familiar o profesional, y d) beneficios que se esperan del trasplante y los riesgos potenciales para el receptor. Igualmente debe trasladarse al donante vivo la importancia que reviste la transmisión de sus antecedentes personales y será informado de que se le proporcionará asistencia sanitaria para su restablecimiento y se facilitará su seguimiento clínico en relación con la obtención del órgano. En el certificado médico acreditativo del estado de salud del donante habrá de hacerse referencia, además, a la información facilitada al mismo y a la respuesta y motivaciones libremente expresadas por aquel y, en su caso, a la presencia de cualquier indicio de presión externa al mismo.
El consentimiento prestado por el donante en el ámbito sanitario deberá ser ratificado por el mismo ante la autoridad judicial. A ello nos referiremos en el epígrafe correspondiente.
Consentimiento informado de receptorAl consentimiento del receptor se refiere la Ley 30/79 en su artículo sexto, estableciendo unos requisitos que no difieren de cualquier otro consentimiento informado en el ámbito de la sanidad. Solamente se especifica el tipo de información que debe proporcionarse en función de la naturaleza de la intervención que se pretende realizar.
La regulación del consentimiento informado del receptor en la ley de extracción y trasplante de órganos ha de entenderse modificada por la ley de autonomía del paciente. Así lo dispone expresamente el artículo 17 del RD 1723/2012 cuando afirma que el trasplante de órganos humanos solo se podrá efectuar en centros autorizados para ello, con el consentimiento previo y escrito del receptor o sus representantes legales, conforme prevé el artículo 9 de la Ley 41/2002, de 14 de noviembre. Previamente habrá de suministrarse información sobre los riesgos y beneficios que la intervención supone, así como de los estudios que sean técnicamente apropiados al tipo de trasplante del que se trate en cada caso.
Donantes excepcionales: menores «competentes» y adultos «incompetentes»Los términos «competencia» o «incompetencia» referidos a la capacidad de las personas para consentir un acto sanitario no son propiamente conceptos jurídicos. Veamos qué conceptos jurídicos se refieren a la capacidad de las personas.
La capacidad jurídica o capacidad de derecho supone la aptitud de un sujeto para la plena tenencia y goce de derechos. Es un atributo de la personalidad, en abstracto es igual para todos, y basta la existencia de la persona para afirmar su existencia (Artículo 30 Código Civil: La personalidad se adquiere en el momento del nacimiento con vida, una vez producido el entero desprendimiento del seno materno).
La denominada capacidad de ejercicio o capacidad de obrar es la aptitud del sujeto para el ejercicio de los derechos. Dada su naturaleza es contingente y variable: no existe en todas las personas, ni se da en ellas en el mismo grado pues requiere de inteligencia y voluntad. Por ello la ley unas veces la niega y otras la limita.
La definición de «competencia» en el ámbito sanitario implica el reconocimiento de aptitudes psicológicas para tomar determinadas decisiones. Este concepto debe ser completado con el de «capacidad de discernimiento», que supone la aptitud psicológica necesaria para tomar «aquí y ahora» una decisión responsable.
Los especiales requisitos y exigencias que la ley impone al consentimiento prestado por el donante vivo impiden de forma absoluta que un menor de edad de 18 años «competente» pueda ser donante y también que pueda serlo un mayor de esa edad «incompetente» que por cualquier otra causa no puedan prestar consentimiento válidamente.
Régimen de sanciones por compraventa de órganos. Detección y denuncia de ilegalidades cometidas fuera de EspañaRégimen de sanciones por compraventa de órganosCatálogo de infracciones administrativasLa compraventa de órganos es un delito grave, pero la tipificación de tal conducta como delito no resulta incompatible con la existencia de un derecho administrativo sancionador. El derecho penal actúa en este ámbito en una función de sobreprotección de los bienes jurídicos que el derecho administrativo también tutela.
El Real Decreto incorpora en su artículo 33 un catálogo de infracciones, dotando a la norma del imprescindible elemento de la coerción como mecanismo que prevé consecuencias para el caso de incumplimiento de lo dispuesto en la misma. Las infracciones se definen por remisión a lo dispuesto, no solo en el Real Decreto, sino, también, a las previsiones contenidas en la Ley 14/1986, de 25 de abril, general de sanidad y la Ley 33/2011, de 4 de octubre, General de Salud Pública, ello además de lo previsto por la legislación sobre protección de datos de carácter personal (Ley Orgánica 3/2018 de Protección de Datos Personales y garantía de los derechos digitales).
El Real Decreto clasifica las infracciones en función de su gravedad, distinguiendo entre muy graves, graves y leves.
Son infracciones muy graves:
- 1.
La realización de cualquier actividad regulada en el Real Decreto sin respetar el principio de confidencialidad, siempre que éste sea exigible.
- 2.
La realización de cualquier actividad regulada en el Real Decreto sin respetar los principios de voluntariedad, altruismo, ausencia de ánimo de lucro o gratuidad.
- 3.
La publicidad sobre la necesidad o la disponibilidad de un órgano, ofreciendo o solicitando algún tipo de gratificación o remuneración.
- 4.
La obtención de órganos de donante vivo en ausencia de cumplimiento de cualquiera de los requisitos previos establecidos en el Real Decreto, en particular los relativos a la mayoría de edad, facultades mentales, estado de salud y consentimiento.
- 5.
La obtención de órganos de donante fallecido en ausencia cualquiera de los requisitos previos establecidos en el Real Decreto, en particular los relativos a la investigación sobre la voluntad del fallecido respecto a la donación de órganos y el diagnóstico y la certificación de la muerte.
- 6.
La obtención o el trasplante de órganos en un centro que no disponga de la preceptiva autorización de la autoridad competente.
- 7.
El incumplimiento de los requisitos de trazabilidad.
- 8.
La entrada o salida de órganos en España sin la preceptiva autorización, de acuerdo con lo establecido en el artículo 15.
- 9.
La obstrucción o el impedimento de la labor inspectora.
Como puede observarse, cualquier actividad de compra o venta de órganos de donante vivo incidiría en la tipicidad de las conductas descritas en los números 2, 4 y 5, ello sin perjuicio de su tipificación penal. El artículo 34 del Real Decreto prevé a este respecto que en los supuestos en que las infracciones pudieran ser constitutivas de delito, se pasará el tanto de culpa a la jurisdicción competente y se abstendrá de seguir el procedimiento sancionador mientras la autoridad judicial no dicte resolución firme que ponga fin al procedimiento. Y de no haberse estimado la existencia de delito, se continuará el expediente sancionador tomando como base los hechos que los Tribunales hayan considerado probados.
Sanciones y procedimiento sancionadorLa sanción prevista para todo tipo de infracciones es pecuniaria. Así se dispone en el artículo 33 del Real Decreto que remite, para determinar la graduación de su cuantía, a lo establecido por el artículo 58 de la Ley 33/2011, de 4 de octubre, y por el artículo 36 de la Ley 14/1986, de 25 de abril. El art. 58 Ley 33/2011, dice:
- 1.
La comisión de infracciones en materia de salud pública dará lugar a la imposición de las siguientes sanciones, sin perjuicio de las que puedan establecer las comunidades autónomas y Entidades locales en el ámbito de sus competencias: a) En el caso de infracción muy grave: multa de 60.001 hasta 600.000 euros, pudiendo rebasar esta cuantía hasta alcanzar el quíntuplo del valor de mercado de los productos o servicios objeto de la infracción. b) En el caso de las infracciones graves: multa de 3.001 hasta 60.000 euros. c) En el supuesto de las infracciones leves: multa de hasta 3.000 euros. Estas cantidades podrán ser actualizadas por el Gobierno reglamentariamente.
- 2.
Sin perjuicio de la sanción económica que pudiera corresponder, en los supuestos de infracciones muy graves, se podrá acordar por la autoridad competente el cierre temporal de los establecimientos o servicios por un plazo máximo de cinco años.
En cuanto al procedimiento sancionador será el previsto en el artículo 60 de la Ley 33/2011, de 4 de octubre, que remite a lo dispuesto por la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas. La incoación, tramitación y resolución de los expedientes sancionadores corresponderá a la administración competente por razón del territorio y la materia, sin perjuicio de las responsabilidades penales, civiles o de otro tipo que pudieran concurrir.
I) Tipificación de la compraventa de órganos. Artículo 156 bis del Código Penal
El artículo 156 bis del Código Penal (introducido por la Ley Orgánica 5/2010, y reformado por Ley Orgánica 1/2019, de 20 de febrero, por la que se modifica la Ley Orgánica 10/1995, de 23 de noviembre, del Código Penal, para transponer Directivas de la Unión Europea en los ámbitos financiero y de terrorismo, y abordar cuestiones de índole internacional) castiga a los que de cualquier modo promovieren, favorecieren, facilitaren, publicitaren o ejecutaren el tráfico de órganos humanos, señalando diferente pena, según que se trate de órgano procedente de donante vivo o de donante cadáver, siendo mayor en el primer caso.
Con esta tipificación se pretende dar respuesta al fenómeno cada vez más extendido de la compraventa de órganos humanos y al llamamiento de diversos foros internacionales a abordar su punición. Ya en el año 2004 la Organización Mundial de la Salud declaró que la venta de órganos era contraria a la Declaración Universal de Derechos Humanos, exhortando a los médicos a que no realizasen trasplantes si tenían sospechas de que el órgano había sido objeto de una transacción. En la cumbre internacional sobre turismo de trasplantes y tráfico de órganos celebrada en mayo de 2008, representantes de 78 países consensuaron la denominada «Declaración de Estambul», en donde se deja constancia de que dichas prácticas violan los principios de igualdad, justicia y respeto a la dignidad humana debiendo ser erradicadas. Y, aunque nuestro Código Penal ya contemplaba estas conductas en el delito de lesiones –artículo 156, interpretado a sensu contrario–, se consideró necesario dar un tratamiento diferenciado a dichas actividades tipificándolas expresamente.
Incorpora el legislador una interpretación auténtica sobre qué debe entenderse por tráfico de órganos humanos ajenos, incluyéndose en la definición la extracción u obtención ilícita de los mismos. Se tiene por tal:
- 1.
La que se haya realizado sin el consentimiento libre, informado y expreso del donante vivo en la forma y con los requisitos previstos legalmente.
- 2.
Aquella en la que, a cambio de la extracción u obtención, en provecho propio o ajeno, se solicitare o recibiere por el donante o un tercero, por sí o por persona interpuesta, dádiva o retribución de cualquier clase o se aceptare ofrecimiento o promesa. No se entenderá por dádiva o retribución el resarcimiento de los gastos o pérdida de ingresos derivados de la donación.
- 3.
Igualmente se sanciona penalmente a quienes, en provecho propio o ajeno: a) solicitaren o recibieren, por sí o por persona interpuesta, dádiva o retribución de cualquier clase, o aceptaren ofrecimiento o promesa por proponer o captar a un donante o a un receptor de órganos; b) ofrecieren o entregaren, por sí o por persona interpuesta, dádiva o retribución de cualquier clase a personal facultativo, funcionario público o particular con ocasión del ejercicio de su profesión o cargo en clínicas, establecimientos o consultorios, públicos o privados, con el fin de que se lleve a cabo o se facilite la extracción u obtención ilícitas o la implantación de órganos ilícitamente extraídos. Igualmente se castigan las denominadas resoluciones manifestadas por cuanto la provocación, la conspiración y la proposición para cometer este delito se sancionará con la pena inferior en uno a dos grados.
La tipificación de las conductas delictivas se extiende al receptor del órgano que consintiera la realización del trasplante conociendo su origen ilícito. La sanción penal al receptor resulta difícil de imaginar en un plano teórico porque, muy probablemente, alegará la concurrencia de un estado de necesidad exculpante cuando el trasplante resulte necesario para mantener su vida. Ello ha de entenderse sin perjuicio de que su conducta pudiera ser considerada cooperación necesaria al tráfico ilegal de órganos humanos ajenos, en el eventual supuesto de que concurriesen los requisitos necesarios para ello.
En cualquier caso, la atribución al juzgador de la facultad de imponer pena atenuada por una menor reprochabilidad de la conducta del receptor debido a su situación parece excluir la causa de disculpa que pudiera alegarse.
Los contornos del bien jurídico protegido por esta figura delictiva han sido perfilados por la sentencia de la Sala 2.ª del Tribunal Supremo de 27 de octubre de 2017. Entiende el Tribunal Supremo que el delito de tráfico de órganos no trata solo de proteger la salud o la integridad física de las personas, sino que el objeto de protección va más allá; destinado a proteger la integridad física, desde luego, pero también las condiciones de dignidad de las personas, evitando que las mismas por sus condicionamientos económicos puedan ser cosificadas, tratadas como un objeto detentador de órganos que, por su bilateralidad o por su no principalidad, pueden ser objeto de tráfico. Añade además que «el propio sistema nacional de trasplantes establece un sistema nacional altruista y solidario para la obtención y distribución de órganos para su trasplante a enfermos que lo necesiten».
No existe, por tanto, justificación alguna para lograr el acceso a órganos humanos por vías distintas de las previstas por el sistema nacional de trasplantes, tortuosos caminos siempre conducentes a supuestos de tráfico de órganos que atentan contra la dignidad de personas vulnerables. Que puedan existir ofrecimientos de vías supuestamente legítimas para obtener órganos fuera del sistema nacional de trasplantes no releva de responsabilidad a quien acude a aquellas, sabedor de que si no puede acceder a un órgano en España, ello se debe al permanente desequilibrio entre la oferta y demanda de órganos o a criterios médicos que desaconsejan el trasplante en caso de disponibilidad de órgano.
II) Detección y denuncia de ilegalidades cometidas fuera de España.
La credibilidad que genera el sistema nacional de trasplantes como parte integrante del sistema nacional de salud no se reduce por el hecho de que una persona se haya procurado el acceso a un órgano por vías ilícitas, señaladamente en un país extranjero. Quien así actúa no lo hace por pensar que el sistema español es ineficaz, sino porque prefiere acudir a mecanismos que le pueden procurar de manera más rápida el acceso a un órgano, aunque el procedimiento seguido sea ilegal, afecte a la dignidad y salud de personas vulnerables y sea menos seguro para el receptor.
La confianza en el sistema nacional de salud se mantiene en estos casos, y ello se traduce en la demanda de tratamiento en nuestro país una vez se ha producido el implante. En estas situaciones cabe plantearse, primero, si debe de prestarse asistencia sanitaria a quien ha vulnerado la ley para procurarse un órgano fuera de las vías establecidas y, segundo, si el facultativo debe reportar a alguna autoridad sanitaria o denunciar ante la autoridad judicial o fiscal por sospecha de delito de tráfico de órganos humanos.
Respecto de lo primero, es obligación de todo facultativo prestar la debida asistencia sanitaria a un paciente que se encuentra en la descrita situación. Esta obligación quedará condicionada a que la asistencia sanitaria requerida se halle incluida en la cartera de servicios del centro sanitario y a que se disponga de los medios adecuados para prestarla. Si los medios fueran escasos, siempre cabría priorizar la asistencia a quien ha accedido al trasplante de un órgano por las vías legales, porque, seguramente, el pronóstico de supervivencia del injerto será mayor. Desde una perspectiva sancionadora penal, solamente se incurrirá en el delito de denegación de asistencia sanitaria (artículo 196 del Código Penal) cuando de dicha denegación se derive riesgo grave para la salud de las personas.
En cuanto a la obligación de denunciar, la misma viene impuesta por el artículo 262 de la Ley de Enjuiciamiento Criminal que, pese al evidente anacronismo de su redacción, continúa vigente. Según este precepto, tienen obligación de formular denuncia ante el ministerio fiscal o el tribunal competente «los que por razón de sus cargos, profesiones u oficios tuvieren noticia de algún delito público». El anacronismo queda claramente de manifiesto tras la lectura del párrafo segundo, del siguiente tenor literal: «si la omisión en dar parte fuere de un Profesor en Medicina, Cirugía o Farmacia y tuviese relación con el ejercicio de sus actividades profesionales, la multa no podrá ser inferior a 125 pesetas ni superior a 250», añadiendo que «si el que hubiese incurrido en la omisión fuere empleado público, se pondrá además en conocimiento de su superior inmediato para los efectos a que hubiere lugar en el orden administrativo».
No existe duda sobre la vigencia de la obligación de denunciar, pero si dicha obligación se incumpliera, no se incurriría por el facultativo en la conducta tipificada en el artículo 408 del Código Penal. Este precepto castiga a la autoridad o funcionario que, faltando a la obligación de su cargo, dejare intencionadamente de promover la persecución de los delitos de que tenga noticia o de sus responsables. Pero el ámbito subjetivo del delito no puede extenderse al personal facultativo porque no es funcionario público afectado por la obligación de promover la persecución de un delito. El delito no consiste en rigor en no dar noticia a un órgano judicial de la supuesta comisión de un delito, sino en dejar de perseguirlo; omitir la investigación necesaria.
La obligación de comunicar a la administración sanitaria la sospecha fundada de la comisión de un delito de tráfico de órganos no cede ante un supuesto ejercicio del derecho al secreto profesional. En efecto, el secreto profesional no queda afectado por el hecho de trasladar a la autoridad la sospecha fundada sobre la comisión de un delito. El conocimiento del supuesto hecho ilícito se obtiene de la mera observación o exploración física del paciente y no es información sobre un proceso patológico sujeta al deber de confidencialidad.
Sobre el modo de llevar a efecto la denuncia, el procedimiento más adecuado será el de reportar a la autoridad sanitaria competente que se ha prestado asistencia a una persona con un injerto cuyo implante no ha seguido las vías legalmente previstas, es decir, la vía del sistema nacional de trasplante. La autoridad sanitaria será la que, directamente o a través de sus servicios jurídicos, formule la oportuna denuncia ante el ministerio fiscal o ante el juez de instrucción.
Debe tenerse en cuenta que a la dificultad de perseguir al receptor de un órgano procedente de tráfico cuando alegue encontrarse amparado por un estado de necesidad –ya hemos dicho que ordinariamente no será apreciable–, se añade la de perseguir en España un delito cometido en el extranjero cuando el tráfico de órganos no se encuentra tipificado como delito en el país de comisión. El principio general de atribución de jurisdicción a los tribunales españoles es el de territorialidad (Artículo 23.1 de la Ley Orgánica del Poder Judicial), si bien como excepción existen algunos supuestos en que los tribunales españoles extienden su jurisdicción a delitos cometidos en el extranjero, bien por españoles, bien por españoles o extranjeros. Estas excepciones (principios de personalidad y de protección de intereses) requieren por lo común, salvo que un tratado internacional exima de este requisito, que el hecho cometido sea punible en el lugar de ejecución. Por ello, en ausencia de tratado, si la conducta considerada delictiva en España ha tenido lugar en un país que no tipifica como delito el tráfico de órganos, los tribunales españoles no podrán perseguirla. Y nada habría que perseguir en el país de comisión porque la conducta en cuestión no se considera delictiva.
Documentación y su custodiaEl artículo 32 del real decreto regula los sistemas de información que han de implementarse para el registro y custodia de determinados datos. Son los relativos a: a) los donantes, los órganos y su caracterización; b) la trazabilidad de los órganos desde la donación hasta el trasplante o la desestimación y viceversa; c) las características y los movimientos de los pacientes incluidos en lista de espera para trasplante; d) las características y datos de seguimiento de los pacientes trasplantados; e) las características y datos de seguimiento de los donantes vivos y f) la notificación y las medidas de gestión de los eventos y reacciones adversas graves.
Se atribuye la Organización Nacional de Trasplantes la función de desarrollar y mantener los sistemas de información estatal en los que se registren y custodien los datos referidos, en cooperación con las comunidades autónomas y sin menoscabo de los sistemas que pudieran desarrollar estas y de los convenios que pudieran establecerse con las asociaciones profesionales y científicas pertinentes.
La Organización Nacional de Trasplantes definirá, en cooperación con las comunidades autónomas, los datos mínimos que habrán de proporcionarse al sistema estatal para todo donante, órgano, paciente en lista de espera o receptor. Los sistemas de información estatal que habrán de permitir la realización de análisis estadísticos periódicos, recibirán el suministro de los datos desde los centros de obtención o los centros de trasplante, según corresponda, bien directamente o bien a través de los sistemas autonómicos disponibles. La Organización Nacional de Trasplantes definirá, en cooperación con las comunidades autónomas, los procedimientos que permitan la integración estatal de la información.
Con los datos incluidos en los sistemas, y sin perjuicio de otros informes que puedan llevarse a cabo, la Organización Nacional de Trasplantes elaborará informes anuales de la actividad desarrollada por los centros de obtención y de trasplante de todo el territorio nacional, incluyendo los datos agregados de donantes vivos y fallecidos, así como el número y tipo de órganos obtenidos y trasplantados o desestimados. Estos informes en ningún caso contendrán datos personales de donantes o de receptores y se difundirán a la red de coordinación de trasplantes y a los equipos trasplantadores, siendo accesibles al público.
Además de permitirse una explotación general de los datos, los sistemas de información estatal se podrán también utilizar como sistemas de información autonómica u hospitalaria en lo que respecta a sus propios datos, cuando la comunidad autónoma o el hospital correspondiente así lo requieran.
El acceso a cualquiera de los datos contenidos en los sistemas de información quedará restringido a las personas autorizadas en los centros, en las unidades de coordinación autonómica o en la Organización Nacional de Trasplantes, y todos los sistemas, a nivel hospitalario, autonómico o estatal cumplirán con lo establecido en la normativa vigente sobre protección de datos personales, confidencialidad y secreto estadístico.
Programa de trasplante cruzado y donación altruista. Confidencialidad en donaciones no directasLa donación cruzadaEl desequilibrio entre necesidad y disponibilidad de órganos para trasplante explica las iniciativas de la administración sanitaria tendentes a aumentar el número de potenciales donantes, tanto fallecidos como vivos. La donación de vivo entre personas no emparentadas o afectivamente vinculadas es una de estas iniciativas. Pero plantea los siguientes interrogantes: si reúne los caracteres de voluntaria, altruista y desinteresada, y si, admitido que cumple con aquellos requisitos, tiene o no cobertura en nuestro sistema legal a falta de una previsión expresa.
La Organización Mundial de la Salud en Resolución WHA 63.22, de 21 mayo del 2010 estableció los principios rectores sobre trasplante de órganos, disponiendo el principio Rector 3 en el que se establece que en la donación de órganos de donante vivo, los donantes han de estar relacionados con los receptores genética, legal o emocionalmente. En nuestro país, el artículo 5 del RD 1723/2012 hace referencia, para excluir a donante y receptor de la regla general de confidencialidad, a personas relacionadas genéticamente, por parentesco o por amistad íntima. Este último concepto es equiparable a la vinculación emocional referida por la Organización Mundial de la Salud, sin que quepa excluir la donación entre receptores unidos por vínculos emocionales diferentes de la amistad íntima. Tampoco cabe rechazar la donación entre personas no vinculadas porque la mención a dicha relación se efectúa en el real decreto a los solos efectos de introducir una excepción a la obligación de confidencialidad respecto de las identidades de donante y receptor.
Como hemos advertido, la donación a desconocidos puede infundir sospechas sobre la existencia de cualquier tipo de remuneración al donante, que se ve privado de uno de sus órganos con el único propósito de mejorar sustancialmente la esperanza o condiciones de vida de alguien totalmente desconocido para él. Debe tenerse en cuenta que el altruismo se define como la diligencia en procurar el bien ajeno aun a costa del propio, que es precisamente la actitud que guía al donante de órganos en el TR de donante vivo. Para confirmar el propósito altruista del donante y superar toda sospecha de finalidades espurias en el proceso de donación, se intensifican las tareas de indagación tendentes a confirmar la verdadera voluntad de mejorar la salud o condiciones de vida del receptor como principal motivación de la donación. Este objetivo se alcanza mediante la emisión de los correspondientes informes psicosociales que se efectúan sobre el donante con el objetivo de acreditar sus verdaderas motivaciones, aportando datos sobre su situación laboral, económica y familiar.
Pero, en el supuesto de donación cruzada, es precisamente el interés en favorecer a una persona con la que se tiene algún tipo de relación afectiva el motivo por el cual se mantiene la voluntad de donar, aunque el receptor sea finalmente un desconocido para el donante. Consiente en ceder uno de sus órganos porque sabe que otra persona dona en favor de su allegado y ese segundo donante también es consciente de que manteniendo su voluntad de donación logrará el fin que se había propuesto inicialmente. Ambos donantes conocen que las personas en cuyo favor querían donar recibirán un órgano si mantienen la voluntad de donar a un desconocido.
Conviene aclarar que no nos encontramos ante un condicionante a la donación, lo que sería rechazable por expresa prohibición legal, sino ante la existencia de una condición jurídicamente válida que puede enunciarse de la siguiente forma: «dono porque donas» (condición). Y no «dono para que dones» (condicionante).
El objetivo que se pretende lograr desde una perspectiva de política sanitaria resulta igualmente tutelado por la ley, pues se trata de superar el constante desequilibrio entre el número de pacientes en lista de espera de riñón y el de donantes.
La validez jurídica de esta donación exige constatar, además del resto de los requisitos propios de la donación de vivo (mayoría de edad, capacidad, información, etc.) que un primer donante, dispuesto a hacerlo en favor de un allegado suyo, mantenga su voluntad de realizar esta acción en beneficio del allegado de un segundo donante, y que ese segundo donante dispuesto a donar a favor de una persona vinculada con él, mantenga su voluntad de hacerlo en beneficio del allegado de ese primer donante. Y que el motivo de no procederse a la donación de órganos de cada uno de esos donantes en favor de la persona vinculada con ellos es la existencia de incompatibilidad entre los respectivos receptores, situación que no se da con los receptores desconocidos.
La donación renal cruzada se configura como una donación simultánea en la que se parte de una previa voluntad favorable a la donación con la finalidad de mejorar la salud y condiciones de vida de un receptor concreto y determinado. Siendo esto así, ante la incompatibilidad entre donante y receptor vinculados, se mantiene la voluntad de donar a un desconocido porque otro donante cede su órgano al allegado del primer donante que es a quien este quiere favorecer. Se estructura todo el proceso mediante un intercambio de voluntades favorables a la donación previamente acreditadas, resultando favorecidos aquellos que no podían recibir un órgano de las personas vinculadas con los mismos pese a que dichos allegados estaban dispuestos a donar y así ya lo habían decidido.
Como hemos indicado anteriormente, esta modalidad de donación tiene plena acogida en nuestra legislación, amparo legal que se extiende al caso de no darse incompatibilidad para el trasplante entre el donante y el receptor afectivamente vinculados y pretender lograrse un beneficio real asociado al procedimiento de TR cruzado (por ejemplo, ganar edad). La finalidad terapéutica pretendida, guiada por un mejor resultado esperado del trasplante justificaría la elección del TR cruzado como procedimiento terapéutico adecuado a seguir en tal situación.
La donación puramente altruistaLa figura de quien dona a una persona totalmente desconocida sin otra finalidad que la de mejorar la salud o las condiciones de vida de ese receptor no vinculado, cumple mejor que ningún otro con la exigencia legal de que la donación sea voluntaria, altruista y desinteresada.
El problema que puede surgir con este tipo de donaciones es el mismo que el abordado al tratar de la donación cruzada, a saber, que exista sospecha de motivación no altruista encubierta, principalmente de contenido económico, que impida dar validez al consentimiento otorgado. Con independencia de que la conducta de transacción sobre órganos propios no se incluye en la tipificación contenida en el artículo 156 bis del Código Penal (que entiende por tráfico de órganos la extracción u obtención ilícita de órganos humanos ajenos), aunque sí podría entenderse tipificada la conducta del receptor si mediara precio, lo cierto es que una cesión de órganos de esta naturaleza nunca podría ser aceptada por el sistema nacional de trasplantes.
Los procedimientos que puedan establecerse para garantizar la efectiva motivación altruista del donante (informes psicosociales, cuestionarios estructurados, indagación sobre circunstancias laborales, económicas, personales y familiares, etc.) habrán de ser consentidos por el mismo como parte del proceso de donación, y su resultado presentado ante el juez de primera instancia con la finalidad de que pueda valorar si el consentimiento que, ante dicha autoridad, prestará el donante se encuentra ausente de condicionamiento económico, social, psicológico o de otro tipo. En esto no cambia la situación respecto de ningún otro supuesto de donación de órganos de donante vivo, sin perjuicio de que el examen judicial del consentimiento en este caso puede requerir de un soporte probatorio más amplio.
Debe valorarse la posibilidad legal de admitir donaciones de donante vivo a una lista de espera de receptores, aunque reduce de forma considerable, si no lo elimina, el riesgo de que exista una remuneración oculta tras la voluntad de donar. Obviamente, el beneficiario de tal donación sería desconocido para el donante y ello impediría cualquier tipo de transacción económica entre ambos. Mayor problema surgiría en aquellos supuestos en los que, con la finalidad de procurar las mayores posibilidades de éxito del trasplante, la selección del receptor se redujese a un determinando grupo de receptores con determinadas características (edad, situación clínica, etc). En estos casos, parece que podría haber una indicación que señalaría desde el inicio a un posible receptor o a un número reducido de ellos, debiendo, por tanto, extremarse al máximo las cautelas para garantizar que la motivación del donante sea puramente altruista y desinteresada. Siendo así, llegaríamos a la misma conclusión ya avanzada respecto de la donación renal cruzada.
Confidencialidad en donaciones no directasEl artículo 5.2 del Real Decreto establece como regla general de confidencialidad que ni los donantes ni sus familiares pueden conocer la identidad del receptor o la de sus familiares y viceversa, debiendo evitarse la difusión de cualquier información que pueda relacionar directamente la obtención y el ulterior trasplante. Sin embargo y por razones derivadas de la propia técnica del trasplante de órganos de donante vivo, se exceptúan de esta regla general «los directamente interesados en el trasplante de órganos de donante vivo entre personas relacionadas genéticamente, por parentesco o por amistad íntima». La donación no vinculada constituye, por tanto, una excepción a la excepción, quedando así sujeta a la regla general de confidencialidad.
Con el objetivo de preservar la confidencialidad de las parejas en este proceso, el Protocolo Nacional de donación renal cruzada prevé la creación en la Organización Nacional de Trasplantes de un registro de parejas donante-receptor incluidas en el Programa Nacional de Donación Renal Cruzada. El registro cumple con los requisitos de la legislación sobre protección de datos de carácter personal y tiene entre sus funciones proporcionar a cada miembro de la pareja un número identificativo único, que se utilizará para preservar el anonimato entre parejas en la comparecencia ante el juez de primera instancia. De este modo, en este último documento, no figurará información que permita identificar al receptor (ni a los miembros de la otra pareja con la que se va a realizar el intercambio) por parte de terceros, sino su número identificativo del registro de donación renal cruzada. El coordinador de trasplantes del hospital donde se va a realizar la intervención en cada caso entregará al juez una hoja informativa facilitada por la Organización Nacional de Trasplantes donde se acredite las identidades de las dos parejas donante-receptor y su correspondencia con el número identificativo.
Comparecencia ante el juezLa Ley 30/79 remite al desarrollo reglamentario tanto la regulación de la prestación del consentimiento por parte del donante como la determinación de la autoridad ante la que el mismo debe otorgarse. Desde el Real Decreto 426/1980, de 22 de febrero, y hasta la entrada en vigor del RD 1723/2012, la normativa sectorial disponía que el consentimiento se otorgase ante un juez, en concreto, el encargado del Registro Civil. La Disposición adicional segunda de la Ley 20/2011, de 21 de julio, del Registro Civil, al abordar el régimen jurídico de los encargados de la Oficina Central del Registro Civil y de las Oficinas Generales del Registro Civil, preveía que las plazas de encargados del Registro Civil se proveyeran entre funcionarios de carrera del Subgrupo A1 que tuvieran la licenciatura en Derecho o la titulación universitaria que la sustituya, y entre secretarios judiciales (hoy letrados de la administración de justicia). Es decir, el legislador ordenaba la desjudicialización del Registro Civil, convirtiéndolo en un órgano administrativo que ya no estaría a cargo de ningún juez. En atención a la referida previsión legal, el RD 1723/2012 quiso mantener la misma línea de los reglamentos anteriores, decidiendo que la autoridad ante la que el donante prestase su consentimiento seguiría siendo una autoridad judicial. Pero, ante la previsión legal de desjudicializar los registros civiles, el real decreto atribuyó la competencia al juez de primera instancia, en sintonía, también, con el proyecto de Ley de Jurisdicción Voluntaria que se encontraba en tramitación en ese momento y que ya está en vigor (Ley 15/2015, de 2 de julio, de la Jurisdicción Voluntaria).
El informe emitido por el Consejo General del Poder Judicial al proyecto de Real Decreto 1723/2012 estima adecuado el mantenimiento de la intervención judicial en la donación de vivo, pues deja constancia de que la reforma introducida no es «de menor entidad, ni una cuestión baladí, en tanto, la modificación legal que ha desjudicializado el Registro Civil conlleva, por lo que atañe a efectos de este informe, la desaparición de la garantía jurisdiccional de derechos, en este caso, de la libertad de prestación del consentimiento por el donante vivo y el conocimiento por el mismo de la trascendencia y repercusiones de su decisión (en definitiva, de que dispone de la información necesaria para prestar libremente consentimiento), que otorgaba la intervención del Juez titular del Registro Civil, y que no puede suplir el funcionario Encargado del Registro Civil, según el modelo establecido en la Ley 20/2011».
Lo cierto es que los registros civiles no se han desjudicializado. El Real Decreto-ley 16/2020, de 28 de abril, de medidas procesales y organizativas para hacer frente al COVID-19 en el ámbito de la Administración de Justicia, modifica la disposición final décima de la Ley 20/2011, de 21 de julio, del Registro Civil, y dispone que la misma entrará en vigor el 30 de abril de 2021.
En todo caso, la competencia para la prestación del consentimiento queda ya definitivamente atribuida al juez de primera instancia, titular del juzgado de igual denominación, que existe en cada partido judicial con jurisdicción en todo su territorio y sede en la capital de aquel, al que corresponde el conocimiento de los procedimientos en materia civil atribuidos por las leyes, entre otros, los procedimientos de jurisdicción voluntaria.
En cuanto al procedimiento que debe seguirse para la obtención de órganos de donante vivo, se requerirá la presentación, ante el juzgado de primera instancia de la localidad donde ha de realizarse la extracción o el trasplante, a elección del promotor del expediente, una solicitud del donante o comunicación del director del centro sanitario en el que vaya a efectuarse, o de la persona en quien delegue, en la que se expresarán las circunstancias personales y familiares del donante, el objeto de la donación, el centro sanitario en donde ha de efectuarse la extracción, la identidad del médico responsable del trasplante y se acompañará del certificado médico sobre la salud mental y física del donante.
El donante deberá otorgar su consentimiento expreso ante el juez durante la comparecencia a celebrar en el expediente de jurisdicción voluntaria (que requieren la intervención de un órgano jurisdiccional para la tutela de derechos e intereses, sin que exista controversia o conflicto que deba sustanciarse en un proceso contencioso) que se tramite, tras las explicaciones del médico que ha de efectuar la extracción y en presencia del médico que acredita el estado de salud física y mental del donante, el médico responsable del trasplante y la persona a la que corresponda dar la conformidad para la intervención, conforme al documento de autorización para la extracción de órganos concedida.
El documento de cesión del órgano donde se manifiesta la conformidad del donante será extendido por el juez y firmado por el donante, el médico que ha de ejecutar la extracción y los demás asistentes. Si alguno de los anteriores dudara de que el consentimiento para la obtención se hubiese otorgado de forma expresa, libre, consciente y desinteresada, podrá oponerse eficazmente a la donación. Se facilitará copia de dicho documento de cesión al donante. En ningún caso podrá efectuarse la obtención de órganos sin la firma previa de este documento.
Con el fin de confirmar que el consentimiento del donante es firme, el legislador establece un plazo mínimo de 24 horas entre la firma del documento de cesión del órgano y la extracción, pudiendo el donante revocar su consentimiento en cualquier momento antes de la intervención sin sujeción a formalidad alguna. Dicha revocación no podrá dar lugar a ningún tipo de indemnización.
En todo caso, y con carácter previo a la presentación de solicitud de comparecencia ante el juzgado de primera instancia, el potencial donante habrá suscrito un documento de consentimiento informado en el que declara haber sido informado suficientemente y con la debida antelación de los procedimientos a los que será sometido, así como de sus riesgos, posibles complicaciones, beneficios esperables y alternativas, con posibilidad de haber formulado todas las preguntas que ha creído oportunas y haciendo constar que se le han aclarado todas las dudas.
La Ley de la Jurisdicción Voluntaria 15/2015, del 2 de julio, considera la prestación del consentimiento a la donación de órganos por donante vivo como uno de los actos en que ha de intervenir un juez para la efectiva tutela de los derechos e intereses en materia de derecho civil. La publicación de esta norma, más allá de establecer el procedimiento judicial a seguir para formalizar el consentimiento a la donación, no modifica el régimen jurídico diseñado por el Real Decreto 1723/2012.
Son los artículos 78, 79 y 80 (Capítulo X bajo la rúbrica «De la extracción de órganos de donantes vivos») de esta ley los dedicados a regular esta materia, siempre tomando en consideración que la intervención judicial tiene por único objeto constatar que el consentimiento del donante es libre, voluntario, desinteresado y que cumple los demás requisitos Ley 30/79 y normativa de desarrollo.
La solicitud, dice la ley, habrá de presentarse ante el órgano judicial por el donante o mediante comunicación con el director del centro, en la que se harán constar las circunstancias personales y familiares del donante, el objeto de la donación, el centro sanitario en donde ha de efectuarse la extracción y la identidad del médico responsable del trasplante o extracción, o en el que se delegue. A dicha solicitud o comunicación deberá acompañarse certificado médico sobre la salud mental y física del donante. A la comparecencia que se celebre ante el juez de primera instancia deberán asistir el donante, el médico que ha de efectuar la extracción, el médico firmante del certificado de salud y el médico responsable del trasplante o en quien delegue. Habrá de estar presente igualmente la persona a quien corresponda dar la autorización para la intervención. El juez de primera instancia otorgará el documento de cesión del órgano si considera que el consentimiento prestado expresamente lo ha sido de forma libre, consciente y desinteresada, y que se han cumplido los otros requisitos establecidos por la legislación sobre extracción y trasplante de órganos. Tal y como también se prevé por dicha legislación, la Ley Jurisdicción Voluntaria ordena que se haga constar en el documento de cesión la posibilidad de revocar el consentimiento en cualquier momento previo a la intervención.
Coherencia absoluta entre ambos textos, como no podía ser de otra manera, uno dirigido al ámbito sanitario ordenando su forma de actuar, y otro al juez, indicándole el procedimiento judicial a seguir. La prestación del consentimiento ante la autoridad judicial dota a la donación de órganos de donante vivo de una doble garantía. Por un lado, el consentimiento se ha de otorgar ante una autoridad externa e independiente del sistema público de sanidad. Por otro, el hecho de que el documento de cesión del órgano sea emitido por un juez, proporciona mayor seguridad al validarse los controles sobre el consentimiento realizado en el ámbito sanitario.
Sección 3. Aspectos éticos en la donación y TR de donante vivoEl TRDV se considera un procedimiento muy eficaz en el tratamiento de la ERC. Sin embargo, por su naturaleza, exige el cumplimiento de normas legales y éticas que garanticen idoneidad y protección al donante, al tiempo que regulen las actuaciones de quienes intervienen en el procedimiento59.
La ética en donación de órganos es una disciplina dinámica, ya que con cada avance científico aparecerá algún dilema ético que requerirá nuevas y mejores definiciones60. La ética comienza por plantear criterios o pautas de actuación que posteriormente y, en algunos casos, el derecho ordena y eleva a rango de ley, ya que no todos los planteamientos éticos llegan a tener refrendo legal. El derecho tiene, por tanto, carácter coercitivo y la ética que trata de la donación de vivo quedaría dentro de las obligaciones imperfectas, ya que nunca se puede exigir a alguien que done, sino que es una decisión estrictamente personal y nunca ni a nadie se le puede presionar a favor o en contra de la donación61.
La donación de órganos de donante vivo mantiene algunos conflictos éticos. El dilema ético clave radica en que la donación de vivo implica inevitablemente un daño físico y un riesgo potencial para la salud de una persona sana62. En este sentido, cobra especial importancia la autonomía del individuo en su decisión de donar.
El altruismo ha sido el fundamento de la donación de órganos desde sus orígenes y se justifica como un regalo desinteresado sin expectativa de remuneración. El altruismo de la donación puede ser orientado a familiares, amigos o incluso a desconocidos y refuerza la filosofía de la donación voluntaria y gratuita mediante la solidaridad entre donante y receptor63.
La dignidad se asocia con el concepto kantiano de la dignidad inherente o el estatus especial del cuerpo humano, donde dignidad y precio son mutuamente excluyentes. Mantener la dignidad obliga a que los seres humanos se posicionen más allá del precio negociable. Por lo tanto, cualquier forma de pago de partes del cuerpo violaría la dignidad humana, aunque el propio donante no se sienta degradado. La Convención de Oviedo bajo los auspicios del Consejo de Europa64 pidió garantizar dignidad e identidad sin discriminación alguna, junto a derechos y libertades fundamentales en intervenciones de biología y medicina.
Por ello, los profesionales sanitarios que participan en el TRDV deben razonar con elevados estándares éticos. De esta forma, sus decisiones serán acordes con una buena práctica clínica y reflejarán transparencia total ante sanitarios y sociedad65.
La donación de vivo se considera dentro del nivel básico del principio ético de beneficencia y entre los requisitos éticos también se debe examinar que se cumplen los relacionados con autonomía y no maleficencia. Así, beneficencia es la acción que facilita el bienestar de terceros. Se considera ética cuando extrema beneficios y minimiza riesgos. La autonomía es el derecho del individuo a tomar decisiones de forma independiente. Una decisión es autónoma cuando se alcanza libremente y sin coacción. Finalmente, la no maleficencia pone límites a intervenciones que puedan causar perjuicio o daño y vigila que la relación riesgo-beneficio sea correcta.
La Organización Mundial de la Salud ha establecido 11 principios rectores sobre trasplante de células, tejidos y órganos humanos, con la finalidad de proporcionar un marco ordenado, ético y aceptable para la donación y trasplante con fines terapéuticos, la mayoría de ellos se aplican al donante vivo66.
Las consideraciones éticas de mayor trascendencia que se pueden plantear en el estudio de los donantes potenciales para TR de vivo son las que se mencionan en el siguiente apartado.
Análisis de la autonomía del donante- •
La seguridad y bienestar del candidato a donante debe prevalecer sobre el potencial beneficio del receptor, por lo que todos los profesionales que intervengan en el estudio tienen el deber ético de proteger el mejor interés del donante vivo (calidad de la evidencia: SG).
- •
Se recomienda especificar con el donante los requisitos para ser aceptado, la información que desee compartir con el receptor, así como el procedimiento ante resultados inesperados, fueran o no, relevantes para la donación (B).
- •
Se sugiere que los estudios del donante y receptor deberían realizarse por separado, aunque con equipos bien coordinados para garantizar una buena comunicación y sin comprometer la independencia del donante y receptor (C).
- •
Se sugiere proporcionar apoyo profesional y confidencialidad cuando un potencial donante decida no donar y exprese dificultades para comunicar esa decisión al receptor (SG).
La decisión de donar en vida es un acto voluntario que será finalmente evaluado cuando reciba la información completa. No obstante, en la primera reunión con el donante, el profesional que inicie el estudio acreditará su capacidad y motivación que le ha llevado a tomar la decisión de donar uno de sus riñones. Aunque para acreditar la capacidad y estado de salud mental se cuente posteriormente con el informe de profesionales cualificados, esta entrevista debería ser independiente, en ausencia del receptor e incluso de otros familiares. El principal beneficio que la donación aportará al donante es psicológico, asentado en la satisfacción personal de mejorar la salud de una persona enferma mediante la donación altruista. La ausencia de presiones que encubran otras motivaciones debe ser inicialmente evaluada mediante preguntas abiertas del tipo: «¿puede decirme su motivación principal para ser donante?; ¿piensa que si no dona, el paciente puede morir por falta de alternativas?; ¿piensa que su situación personal, financiera o social ha podido influir en la decisión de ser donante?; ¿se ha sentido presionado por alguien para donar?».
En la primera toma de contacto se le informará al posible donante de las alternativas de tratamiento que tiene el receptor, así como de las estimaciones de supervivencia y tiempos de espera. Se le asegurará que iniciar el estudio para ser donante no le compromete a la donación, que podrá abandonar en cualquier momento sin consecuencia alguna.
En situaciones en las que se valore el TRDV como urgente (por ejemplo, paciente hiperinmunizado sin acceso vascular) y el estudio del donante se tenga que completar en poco tiempo, el donante potencial podría estar, en cierto modo, presionado para donar y el consentimiento viciado. Por ello, la donación urgente de vivo se debería contemplar excepcionalmente y buscar otras alternativas con donante fallecido67.
En ocasiones, ante riesgos incrementados por la donación, esta puede ser aceptada siempre que las consecuencias para su salud no lleguen a ser inaceptables y con una completa y verificada información explicitada en el documento de consentimiento. No obstante, puede existir conflicto entre la autonomía del donante que quiere donar y la no maleficencia del equipo médico que quiere protegerle y excluirle. Este dilema puede resolverse atendiendo al nivel de jerarquía, por el que los principios de no maleficencia y justicia serían de nivel 1 (ámbito público), mientras que autonomía y beneficencia serian de nivel 2 (ámbito privado)61. Los principios éticos de ámbito público afectan a todos por igual y tienen preferencia sobre los del ámbito privado que cada uno gestiona según sus ideales y proyecto de vida.
Finalmente, a todos los donantes vivos se les informará, al comienzo del estudio, que en caso de tener alguna dificultad para comunicar la decisión de no donar, recibirán asistencia por parte del equipo de trasplantes para trasmitir esa declaración.
Decisiones en la selección del donante por género- •
Se sugiere a los profesionales sanitarios responsables de la selección del donante minimizar desequilibrios por razón de género, descartando la posible coerción a mujeres para donar (SG).
Los profesionales que intervienen en las decisiones para elegir el mejor donante entre varios posibles deben hacer una reflexión ética para minimizar un posible desequilibrio de género. Numerosos estudios documentan que las mujeres constituyen la mayoría de los donantes vivos de riñón, pero las razones detrás de esta disparidad en las tasas de donación entre hombres y mujeres siguen siendo controvertidas68. Según la ONT69 y el Foro de Amsterdam8, el 65% de los donantes vivos de riñón son mujeres y el 65% de los receptores fueron hombres8. Estas diferencias obligan a una deliberación ética de género antes de seleccionar al donante. En algunas circunstancias, por cultura o presión social, parecería que las mujeres no tienen más remedio que ser las elegidas para donar. De sospecharse este sesgo, los profesionales médicos y psicólogos que valorarán al donante deben descartar la existencia de posible coerción por género.
Análisis del altruismo- •
Se sugiere extremar las precauciones ante determinadas circunstancias o sospechas que puedan esconder acuerdos económicos u otros beneficios espurios, sobre todo en donantes no relacionados (SG).
Esta evaluación resulta más complicada en el caso de donantes genética o legalmente no relacionados. Según estimaciones de la Organización Mundial de la Salud, un 8% de los más de 100.000 trasplantes que cada año se realizan en el mundo se practican con órganos procedentes del tráfico ilegal70. La Declaración de Estambul define la comercialización del trasplante de órganos como «una práctica en la que un órgano es tratado como un producto básico, incluso comprándolo, vendiéndolo o utilizándolo para obtener otro beneficio»71. Salvo en Irán, donde la donación de vivo para receptores no relacionados está pagada y controlada por el Estado, es una práctica universalmente rechazada. Además de tener importantes controversias éticas72, se dice que limita el crecimiento de las donaciones de donantes fallecidos73. En otros países, estos acuerdos son clandestinos y negados, aunque desacuerdos o incumplimientos posteriores sacan a la luz este tipo de actos que explotan a los más necesitados por intermediarios que lucran. Además, corrompen a profesionales y clínicas en países con recursos limitados para investigar y perseguir estas prácticas ilegales. Los profesionales que inician el estudio de donante vivo de riñón tienen que extremar las precauciones ante determinadas circunstancias que puedan esconder pactos económicos u otros beneficios espurios. En donantes no relacionados, sin actividad laboral, inmigrantes, personas en prisión, se comenzará por acreditar en qué se apoya la relación del donante con el receptor, para evaluar después, con la ayuda de un equipo multidisciplinar, la motivación del donante a fin de conformar una decisión. Estos donantes vulnerables deben ser considerados víctimas, ya que su decisión puede estar sometida a coacción, independientemente del prometido beneficio económico o de otro tipo.
Ofrecer o aceptar una recompensa económica a cambio de donar algún órgano es delito y, si se sospecha, debe ser denunciado. Es también inaceptable, desde un punto de vista ético, cuando la recompensa es intangible, porque se socavan principios de dignidad, de justicia e igualdad, posibilitando que enfermos con más recursos consigan mediante estas prácticas, soluciones para su salud inalcanzables para gente común. Internet ha incrementado la facilidad de compraventa de riñones de donante vivo. Aunque están prohibidas, no es difícil encontrar ofertas o peticiones de donación a cambio de contraprestaciones económicas y las autoridades deben perseguir estas prácticas. Internet también ha facilitado la creación de páginas web dedicadas a encontrar donantes vivos no relacionados para trasplante directo. Éticamente es rechazable, salvo que la donación fuera anónima y controlada por los profesionales sanitarios, como en programas de donación cruzada con los donantes altruistas «Buen Samaritano»74. Caso contrario estaríamos convirtiendo estos sitios web en lo que se ha denominado «concursos de belleza» donde los receptores son evaluados en función de su apariencia personal y biografía, variables irrelevantes para la asignación de órganos75.
Acreditacion de la identidad del donante y relación con el receptor- •
Se sugiere, en el caso de donantes no relacionados genéticamente, documentar la relación de parentesco o circunstancias que acrediten la relación donante-receptor para garantizar que la donación cumple legislación y estándares éticos (SG).
Un exhaustivo conocimiento de la identidad del donante y la relación genética o legal con el receptor debería ser prioritario en las fases iniciales del estudio de idoneidad. Los profesionales que participen en el estudio del donante (nefrólogos, urólogos, psicólogos/psiquiatras, enfermeras, trabajadores sociales, coordinadores de trasplantes, etc.) deben indagar en detalle sobre la identidad de cada donante y su relación con el receptor. Para ello, solicitarán toda la documentación que permita corroborar relaciones de parentesco y, en el caso de donantes no relacionados, las circunstancias que verifiquen la intensidad, temporalidad y relación entre donante y receptor, con la finalidad de garantizar que el altruismo es la motivación principal para donar. El protocolo de Derechos Humanos y Biomedicina del Consejo de Europa relativo al Trasplante de Órganos y Tejidos de Origen Humano insta a proteger la dignidad e identidad de donantes y receptores y garantizar sin discriminación, derechos y libertades individuales para alcanzar máximos estándares profesionales y mínimos riesgos76.
Anonimato- •
Mantener el anonimato es obligatorio en España en trasplantes de donante vivo con donación cruzada y donantes altruistas no directos (SG).
Esta regulación no es aplicable en el TRDV directo entre personas relacionadas genéticamente, por parentesco legal o amistad íntima. En España, el anonimato es obligatorio para los TRDV con donación cruzada y en donaciones altruistas no directas (Buen Samaritano) que permiten trasplantes en cadena. Sin embargo, no todos los países en Europa con programas de donación cruzada y donación altruista tienen regulado legalmente el anonimato51.
En un estudio entre 414 donantes y receptores que participaron en trasplante de vivo no directo y cruzado en Alemania y Suecia, donde se exige anonimato para estos programas, el 22% de los donantes y el 31% de receptores expresaron el deseo de conocerse tras el trasplante77. Otros estudios similares coinciden que el deseo de conocer a la otra parte es mayor por parte de los receptores. Aunque donantes y receptores generalmente están satisfechos con el anonimato, consideran que una política estricta sobre el anonimato no es necesaria.
Los expertos en bioética mantienen opiniones divididas a este respecto. Romper el anonimato puede ser germen de presiones psicológicas o económicas hacia el beneficiario de la donación y acabar en conflicto. Serían situaciones poco frecuentes, pero con estrés para donantes y receptores. Además de la obligatoriedad legal en España, mantener el anonimato es una práctica éticamente aceptable, porque potencia el altruismo y previene conductas que pueden perjudicar la percepción social de la donación, tanto de vivo como de donante fallecido.
En ocasiones, algunos donantes piden ser estudiados sin el conocimiento del receptor. No es una buena práctica clínica asumir que todos los receptores aceptan TRDV relacionado, aunque muchos profesionales de la salud o miembros de la familia así lo crean. El principio ético de autonomía para el receptor de TRDV podría ser relevante en casos puntuales, en los que prevalecería su negativa a recibir un determinado riñón de donante vivo.
Procedimiento ante resultados imprevistos- •
Se recomienda especificar con el donante los requisitos para ser aceptado; la información que desea compartir con el receptor, así como el procedimiento ante resultados inesperados, fueran o no, relevantes para la donación (B).
Se comentará con el potencial donante la forma de proceder ante resultados inesperados que identifiquen una relación genética muy improbable. Los análisis de HLA durante la evaluación del donante pueden revelar, por ejemplo, casos de paternidad mal atribuida (0,25-0,50% de todos los donantes vivos) y también, aunque en menor medida, casos de hermanos y niños nacidos de madres adolescentes que crecieron creyendo que otro pariente de la familia era su madre78. El manejo de esta información es controvertido y no hay una respuesta estándar por lo que cada caso deberá ser tratado según sus singularidades.
Del mismo modo, se debería también informar al potencial donante del procedimiento a seguir ante resultados analíticos imprevistos (casos de virus de la inmunodeficiencia humana [VIH] o virus de la hepatitis C [VHC]) cuya positividad pueda tener implicaciones en la salud de terceras personas que tendrán que conocer esta circunstancia para su derivación a especialistas. Respecto al receptor, resultados analíticos antes desconocidos (serología viral, anticuerpos específicos) que pudieran cambiar la supervivencia del órgano trasplantado, tendrían que ser compartidos con el donante.
Análisis de riesgos e información al donante- •
La donación de uno de los riñones con fines de trasplante comporta aceptar un grado de riesgo para la salud del que dona que debe ser mínimo, conocido y aceptado por el donante antes de la extracción (SG).
- •
Se sugiere que la información al potencial donante de los riesgos y beneficios del TRDV sea ofrecida como mínimo en dos fases y en formato oral y escrito (D).
- •
Se recomienda a todos los donantes que deben seguir revisiones médicas de por vida (B).
Desde un punto de vista ético, los profesionales que evalúen a los donantes no pueden obviar que tienen que trabajar a favor de los intereses de los donantes. La nefrectomía de un riñón para trasplante y sus consecuencias para el donante, nunca estarán completamente libres de posibles complicaciones, riesgo que algunos podrían valorar como éticamente inaceptable. Sin embargo, en el TRDV se admite que, para alcanzar el beneficio del trasplante, se puede aceptar también un mínimo o nivel razonable de riesgo para el donante. Por ello, todos los donantes vivos de riñón deben recibir información precisa, y tantas veces como sea necesario, de los riesgos de la cirugía mayor y las limitaciones o cuidados que supone vivir con un único riñón79. Se sugiere que esta información se ofrezca como mínimo en dos fases y en formato oral y escrito80. En la primera fase, se comentarán los riesgos globales comunes a todos los donantes vivos de riñón y en la segunda, cuando ya se han recibido los resultados del estado de salud del donante, se debe complementar con los riesgos específicos para el que dona (ERC, HTA, diabetes mellitus, preeclampsia, etc.) que específicamente se tratan en otros capítulos de esta guía. Las herramientas como «ESRD Risk Tool for Kidney Donor Candidates» pueden facilitar un trabajo objetivo a la hora de evaluar uno de esos riesgos81.
Adicionalmente, los donantes deben aceptar seguir revisiones periódicas tras la nefrectomía para poder detectar precozmente la aparición de factores de riesgo cardiovascular y renal, entre otros, que se puedan controlar con cambios de estilo de vida, recomendaciones dietéticas, farmacológicas o procedimientos quirúrgicos. Los datos de pérdida de seguimiento en España (2010-2017) para los donantes vivos de riñón son del 18 y 13% al cuarto y sexto año, respectivamente69; algunos estudios en otros países detectan porcentajes mucho más elevados82.
El seguimiento posdonación para los donantes vivos de riñón es, además de una obligación ética para proteger su salud, una herramienta imprescindible para verificar, con la mejor metodología científica, los riesgos de la donación a diferentes plazos, con los menores sesgos posibles83. Los registros de seguimiento de las donaciones renales de vivo están incluidos en una directiva del Parlamento Europeo84 e incluidos en nuestra normativa.
Evaluación del donante vivo no residente- •
Los donantes con vínculo genético o emocional, no residentes en el país del receptor, son especialmente vulnerables por lo que requieren una vigilancia extraordinaria que asegure su protección y cuidados posdonación (SG).
- •
Se sugiere no aceptar la donación de donantes no residentes que no puedan tener garantizada tras la donación un seguimiento médico a largo plazo (SG).
El Comité de Ministros del Consejo de Europa, consciente de que muchos países están aceptando donaciones de órganos de donante vivo no residentes con o sin vínculo genético, legal o emocional con el destinatario que llegan legalmente (con visa u otra autorización) al país y desean donar, adoptó una resolución en el 2017 para la selección, evaluación, donación y seguimiento del donante vivo no residente al reconocer que estas personas son especialmente vulnerables por lo que necesitan una vigilancia extraordinaria que asegure su protección y cuidados posdonación85.
Es importante mantener una estrecha cautela para la detección precoz de posibles casos de tráfico de personas con fines de extracción de órganos para trasplante, cuestión que puede ser particularmente difícil de detectar al evaluar y aceptar un donante vivo no residente.
- -
Receptor y donante vivo con residencia fuera de España. El hospital trasplantador debe recibir antes del traslado a España un informe detallado que acredite al receptor y al posible donante como aptos para el trasplante y donación, respectivamente, de acuerdo con los criterios del Foro de Ámsterdam para la donación de vivo. El receptor aportará pruebas claras de parentesco genético o legal. En casos excepcionales, se podrá aceptar otro tipo de relación afectiva si se acredita fehacientemente y siempre dentro del marco legal vigente en España. Si para el desplazamiento se requiere visado, este tendrá una duración no inferior a seis meses. Los informes médicos de idoneidad, consentimiento informado, aprobación por el comité Ético y comparecencia judicial serán cumplimentados según la legislación y se facilitará la traducción cuando proceda. El receptor no tendrá acceso a someterse a un TR de donante fallecido en España. Los gastos derivados del procedimiento serán sufragados por el receptor o subsidiariamente por el país de procedencia.
- -
Receptor con residencia en España y donante vivo no residente. Se aplican todas las salvaguardas anteriores respecto al informe médico del donante que debe ser realizado en el propio país del donante. En el caso concreto del trasplante de vivo, este llevará asociada la atención relacionada con el proceso de la donación, así como sus posibles complicaciones86. Por tanto, se aplica a donantes sin seguridad social o receptores cubiertos por otros regímenes como Mutualidad General de Funcionarios Civiles del Estado (MUFACE).
Los centros autorizados para TRDV deben disponer de un protocolo específico para la aceptación del receptor de donante vivo no residente y proceder a la comunicación previa a la ONT, a través de la coordinación autonómica, de la fecha de las cirugías y cumplimiento del protocolo según el documento «TR de donante vivo en receptores no residentes»85,87.
Firma del consentimiento informado (CI)- •
Se recomienda que el CI incluya los riesgos comunes a todos los donantes, los riesgos particulares para ese donante y ser firmado por este sin la presencia del receptor, familiares o personas que pudieran influir en la decisión (B).
- •
En la firma del CI se confirmará con preguntas abiertas, que el donante ha entendido la información sobre la nefrectomía y sus riesgos, y que su decisión de donar es firme y sin coacción (SG).
- •
Los donantes serán informados de su derecho a retirarse del estudio en cualquier momento, así como del procedimiento a seguir en caso de que, una vez extraído el riñón, no fuera posible su implante en el receptor (SG).
Este es un paso que se debe realizar con fidelidad. La redacción del documento de CI varía ampliamente de un hospital a otro. Podría ser el momento de estandarizar un documento de CI específico nacional, que contemple las peculiaridades de la nefrectomía para TRDV. Deberá facilitarse copia de este al donante y al receptor. Esta iniciativa coincide con opiniones de profesionales trasplantadores en centros de trasplantes de España y de otros países europeos47.
El acto de firma del CI se considerará óptimo cuando se realice en presencia de profesionales que han participado en el estudio del donante y un cirujano del equipo de donación o trasplante. En esta sesión, se comentarán todas las pruebas analíticas, radiológicas, informes de otras especialidades y cualquier otro resultado que pueda influir en la seguridad del donante o en el éxito del trasplante. Será el momento de ofrecer todas las explicaciones adicionales que demande el donante. Antes de las firmas, el equipo médico confirmará, con preguntas abiertas, que el donante ha entendido la información, conoce el proceso de la nefrectomía y los riesgos inherentes y que su decisión es firme y sin coacción alguna. Además, se le informará que en cualquier momento es libre para revocar su consentimiento. Por ello, se aconseja que en este paso no esté presente el receptor.
El documento del CI para el donante incluirá, al menos:
- -
Riesgos del procedimiento quirúrgico (tipo de cirugía, anestesia, transfusiones, infecciones, reintervenciones, mortalidad).
- -
Riesgos derivados de la nefrectomía como posibilidad de aparición ERC, HTA o cardiopatía.
- -
Riesgos personalizados para el donante estudiado, por resultados analíticos límites, enfermedades preexistentes o antecedentes familiares. En mujeres jóvenes con potencialidad de gestación, se indicarán riesgos de HTA gestacional o preeclampsia.
- -
Actuaciones ante la contingencia de que el riñón una vez extraído no pueda ser implantado en el receptor. El donante debe decidir en el momento de firmar el CI, si el riñón se trasplantará a otra persona o se reimplantará en el donante.
- -
Derecho a retirar el CI en cualquier momento antes de la cirugía.
- -
Cuantificación o potencialidad del riesgo de que el riñón no llegue a funcionar en el receptor o pierda su función prematuramente.
- -
Compromiso a seguimiento médico posdonación.
El documento del CI para el receptor incluirá, al menos:
- -
Riesgos del procedimiento quirúrgico (anestesia, transfusiones, infecciones, reintervenciones, mortalidad).
- -
Riesgos por los que el riñón trasplantado no llegue a funcionar (trombosis, rechazo) o deje de funcionar prematuramente.
- -
Efectos adversos de la medicación inmunosupresora.
- -
Riesgos de contraer enfermedades no detectadas en el donante por periodo ventana o imposibilidad diagnóstica.
- -
Recurrencia de enfermedad renal original.
- •
La función del CEA es proteger los derechos de los donantes y, en caso de conflicto, ayudar en la toma de decisiones (SG).
- •
Se sugiere enviar al CEA los informes médicos del estudio del donante y receptor, así como toda la información que se considere relevante para análisis de riesgos y motivación (C).
El RD 1723/2012 contempla la intervención del CEA en la evaluación del donante vivo: «En cualquier caso, para proceder a la obtención, será preceptivo disponer de un informe del Comité de Ética correspondiente». Para ello, los profesionales que han estudiado al donante y al receptor, enviarán una solicitud al CEA para su informe, acompañada de los informes clínicos de donante y receptor en el que conste una detallada historia clínica y las pruebas realizadas para evaluar su estado de salud. Se acompañará de un informe de salud mental del donante y los CI de donante y receptor. La función del CEA es proteger los derechos de los donantes y, en caso de conflicto, ayudar en la toma de decisiones. No es su misión calificar la idoneidad del procedimiento, sino velar porque el donante esté bien informado de las probabilidades de éxito y riesgos que asume. En algunos casos, puede solicitar entrevistar al donante para confirmar el grado de información y ausencia de coacción.
El CEA emitirá un documento sobre la idoneidad de la donación de vivo, o puede solicitar algún informe o consideración adicional en relación con garantías para el donante. Este informe nunca sustituye la responsabilidad de quienes controlan el proceso de donación y trasplante de donante vivo.
Recientemente, se ha implantado en hospitales norteamericanos con programas de TRDV la figura del llamado «defensor independiente del donante». Una persona ajena al equipo trasplantador y no involucrada en el estudio del donante y receptor. Su misión es asegurar que donante y receptor tengan toda la información relevante del proceso de donación, que ha sido bien comprendida, descartando la posibilidad de coacción o comercialismo y abogar por los derechos del donante88. Algún hospital de nuestro país con elevada actividad en TRDV dispone de un profesional ajeno e independiente al equipo de trasplantes que acredita la idoneidad de todo el proceso antes de proceder al TRDV. Sin embargo, para una mayoría de los centros, los autores consideramos que los CEA contemplados en la legislación española cumplen perfectamente esta figura del defensor independiente y, por tanto, no sería necesario implicar a otros profesionales con idéntico objetivo.
Sección 4. La información en la donación renal de vivoEl objetivo principal de la información al potencial donante vivo renal es obtener su consentimiento para la donación. Esta obtención es un proceso, más que un evento. El programa de TR es responsable de establecer que el potencial donante tiene la capacidad para entender la información relevante, que se le transmite la información adecuada referente a los riesgos y beneficios de la donación y a las alternativas terapéuticas del receptor, que entiende esta información y que actúa voluntariamente.
En las guías españolas publicadas en 20101, este bloque referido a la información daba recomendaciones generales y revisaba la literatura disponible hasta esa fecha, centrándose en cuándo y qué información suministrar89. En la presente sección, se recogen las recomendaciones para que el proceso sea adecuado. Son relevantes también en este sentido las secciones 2 (aspectos legales) y 3 (aspectos éticos), así como las secciones 5 al 8 y 17, referidas a riesgos físicos y psicosociales para el donante.
La ausencia de estudios aleatorizados y de revisiones sistemáticas justifica que todas las recomendaciones en este tema sean «sin grado».
Información sobre la modalidad de tratamiento renal sustitutivo- •
La elección de la modalidad de tratamiento renal sustitutivo es un proceso de toma de decisión compartida entre el paciente y el equipo médico (calidad de la evidencia: SG)
- •
A todo paciente al que se considere candidato a recibir un TR, se le debe ofrecer la posibilidad de recibir un riñón de un donante vivo (SG).
- •
A todo paciente al que se considere candidato a recibir un TR, se le debe informar de que la mejor opción es un trasplante anticipado, antes de necesitar tratamiento con diálisis (SG).
El proceso de toma de decisión de la modalidad de tratamiento renal sustitutivo (TRS) entra de lleno en el concepto de decisiones compartidas, al menos entre dos partes: el paciente y el equipo profesional sanitario, nefrólogo y enfermera nefrológica. Los profesionales aportan evidencia científica sobre el diagnóstico, la etiología, el pronóstico y las diferentes opciones terapéuticas, incluyendo el tratamiento conservador, sin diálisis ni TR. El paciente aporta sus valores, sus circunstancias sociales, económicas y familiares, sus preocupaciones y preferencias. Finalmente, ambas partes llegan a un acuerdo sobre las mejores opciones a seguir.
Esta elección de TRS, en el marco de un flujo incontenible de información asociado al derecho cada vez más explícito del paciente a su autonomía para decidir cualquier aspecto que se relacione con su salud, implica el abandono total del modelo paternalista clásico. En el nuevo modelo deliberativo, la decisión la toma el paciente, y el profesional de la salud proporciona una atención respetuosa y sensible a sus preferencias individuales, sus necesidades y valores, y avala la decisión del auténtico protagonista del proceso. En la elección del TRS, este modelo deliberativo es mucho más adecuado que el modelo alternativo, puramente técnico e informativo, en el que el profesional simplemente sirve de asesor. En el modelo deliberativo que esta guía propone, el paciente entra en una relación de confianza con el profesional médico y de enfermería, fruto de ese intercambio activo y bilateral de información para la búsqueda de la mejor decisión compartida. El profesional garantiza la información adecuada, comprensible y de fácil acceso, sobre los tratamientos, sus ventajas y riesgos.
Las mejores decisiones compartidas son las que, sobre una base científica suficiente de efectividad y seguridad, están lo más cerca posible de los valores, preferencias y objetivos del paciente. Las herramientas de ayuda en la toma de decisión son instrumentos que ayudan al paciente a obtener información y respuestas a las preguntas clave sobre qué debe hacer o qué ha de saber para acabar tomando una decisión. El formato puede ser muy diverso: trípticos, hojas informativas, videos, aplicaciones en línea, webs interactivas, etc. La información debe ser de alta calidad y garantizar una presentación entendible y clara, desarrollarse adecuadamente y con efectividad90.91.
Ante un paciente que alcanza la situación de ERC de grado 4, con un filtrado glomerular (FG) estimado (FGe) inferior a 30.mL/min, el primer paso debe ser su valoración como posible candidato/a a TRDV92. Paralelamente a esta opción, la elección de una u otra modalidad de diálisis (peritoneal o hemodiálisis) es necesaria, por si no fuese posible la realización del trasplante en fase anterior a la diálisis. El marco ideal para realizar este proceso de información y de elección de la modalidad de TRS es la consulta de ERC avanzada, en la que, además de este proceso, se llevan a cabo una serie de actividades cada vez mejor estandarizadas y susceptibles de acreditación formal (tabla 1).
Actividad a desarrollar en la unidad de enfermedad renal crónica avanzada en el Hospital del Mar, Barcelona.
| Evaluación global y valoración en primer lugar por enfermería.Proceso de decisión de tratamiento renal sustitutivo (trasplante renal de donante vivo o fallecido, hemodiálisis o diálisis peritoneal).Derivación a la consulta específica que proceda (hemodiálisis o diálisis peritoneal); si el paciente es candidato a trasplante, derivación a consulta específica de trasplante de vivo o de entrada en lista de trasplante de donante fallecido si procede.En los casos de pacientes no candidatos a tratamiento renal sustitutivo, se valorará seguimiento para adecuar medidas de confort y complicaciones, derivación a su centro primario de referencia con informe para paliativos, si procede.Realización de estudio analítico, de comorbilidad, de cribado tumoral, de marcadores virales (VIH, virus B-C), y seguimiento periódico.Vacunación virus B y otros.Encuestas sobre calidad de vida y grado de dependencia.Firma del consentimiento específico de elección de la técnica. |
En el caso de la página web habilitada por el Departament de Salut de la Generalitat de Catalunya, existe un detallado conjunto de herramientas para una decisión compartida para el tratamiento de la ERC avanzada91 (tabla 2). Sea en web o personalmente, deben aportarse comparaciones entre las diversas opciones y sería aconsejable añadir test de preferencias, espacio que permite al paciente hacer una reflexión y utilizar los resultados en la deliberación con el profesional sanitario.
Herramienta de ayuda y material para la toma de decisiones compartidas entre las opciones de tratamiento sustitutivo renal (modificado de eferencia 89)
| ¿Cuáles son las opciones de tratamiento? | |||
|---|---|---|---|
| Trasplante renal | Diálisis peritoneal | Hemodiálisis | |
| ¿En qué consiste? | Se implanta un riñón de un donante fallecido o vivo | La sangre se filtra y limpia a través de una membrana natural en el abdomen | La sangre se filtra y limpia a través de un circuito exterior con una máquina |
| ¿Qué se necesita? | Un buen estado general, sin contraindicaciones médicas o quirúrgicas | Un tubo estrecho y flexible dentro del abdomen | Un acceso en la vena, bien fístula que se hace (pequeña cirugía) o catéter |
| ¿Requiere cirugía? | Sí | Sí, para colocar el catéter | Sí, para hacer la fístula |
| ¿Hace daño? | Molestias en la herida tras la cirugía | No | Los pinchazos en la fístula en cada sesión |
| ¿Dónde se hace? | En el hospital, pero solo en el ingreso, luego revisiones en consulta | En casa o cualquier lugar adecuado y limpio | En el hospital o centro de hemodiálisis |
| ¿Quién lo aplica? | Un cirujano experto | Uno mismo | Un profesional sanitario; a veces uno mismo en domicilio |
| ¿Con qué frecuencia? | Una sola vez si no hay rechazo agudo o crónico. Requiere revisiones de por vida | Cada 3-4 horas durante el día o bien durante 8-10 horas por la noche | Tres veces a la semana cuatro horas en un centro asistencial; flexible en domicilio |
| ¿Comporta restricciones de líquidos y dieta? | Menos que el resto de los tratamientos | Pocas | Sí |
| ¿Tiene efectos secundarios? | Complicaciones de la cirugía y de los tratamientos para evitar el rechazo: infecciones y tumores | Riesgo de infección del orificio del catéter o del abdomen (peritonitis) | Cansancio, riesgo de presión arterial baja tras la sesión, infecciones |
| ¿Qué resultados tiene a largo plazo? | Mejores que los otros tratamientos | Buenos; mejores que la hemodiálisis a corto plazo, pero iguales a largo plazo | Buenos |
| ¿Cuánto tiempo puede funcionar? | La mitad funcionan 10-12 años, unos más y otros menos. Es posible un nuevo trasplante | Varios años | Varios años |
La toma compartida de decisiones garantiza que el paciente tenga más conocimiento, esté mejor informado, tenga mayor conciencia de sus propios valores y una mejor capacidad de percibir riesgos y ventajas y de decidir, sin que empeore su salud93.
Un elemento debatido en la actualidad acerca de la metodología de la decisión de modalidad de TRS es la pertinencia de aplicar métodos cuantitativos para calcular el riesgo de mortalidad o la capacidad de supervivencia con las diversas modalidades. En el contexto anglosajón, este tipo de calculadoras se utiliza con frecuencia, mientras en España su uso no es habitual. Una de las mejor desarrolladas ha sido el iChoose Kidney, que tras su aparición en el programa de trasplante de Emory (Atlanta, EE. UU.)94 y comprobada su utilidad en un ensayo aleatorizado95, se ha validado en Ontario, Canadá96. La calculadora incluye edad, género, raza, tiempo en diálisis y las comorbilidades más importantes. En su validación canadiense, que incluyó 22.520 pacientes en diálisis y 4.505 trasplantados, se pudo predecir la mortalidad a tres años. En un ejemplo que se recoge en la publicación96, una mujer de 70 años, raza negra, con más de un año en diálisis, hipertensa y diabética, tiene un riesgo de mortalidad a tres años del 27% en diálisis y del 11% si se trasplanta. Si el riñón procede de un donante vivo, el riesgo es el 6% y si el donante es fallecido, del 12%.
Aparte de las diversas estrategias que cada centro hospitalario o unidad de ERC avanzada desarrollen para su adecuado proceso de decisión compartida de la modalidad de TRS, existen estrategias concretas desarrolladas para la ayuda de decisión específica en el TRDV (tabla 3)97. Los materiales de ayuda (folletos, videos, material en web, mensajes de texto, calculadoras, etc.) se centran en la educación global en el proceso de la enfermedad renal y el trasplante, más o menos adaptadas al paciente general o a aspectos culturalmente sensibles y abarcan al potencial donante y al potencial receptor. En España, se ha extendido más la estrategia de que cada unidad ha elaborado materiales propios, esencialmente folletos o pequeños libros explicativos que en una serie de apartados van detallando los diversos aspectos relacionados con el proceso de donación, ventajas e inconvenientes, riesgos para el donante y el receptor y resultados esperables. Las preguntas que cualquier material que se aporte al potencial donante renal vivo debería responder, se recogen en la tabla 4. El folleto nunca debe sustituir por completo una conversación todo lo extensa que sea necesario con el potencial donante, en la que este pueda exponer cualquier duda98.
Resumen y breve descripción de las herramientas disponibles de ayuda a la decisión en trasplante renal de donante vivo (TRDV)
| Ayuda a la decisión | Tipo de herramienta | Breve descripción |
|---|---|---|
| Ayudas a la decisión educativas comprensivas | ||
| PREPARED: Patients’ readiness to make decisions about kidney disease | Libro de bolsillo, video, sitio web | Conocimiento. Aspectos económicos. Testimonios en video de pacientes, familiares y profesionales, con preocupaciones |
| La gran pregunta, el gran don | Material impreso | Material para pacientes renales y familiares, y potenciales donantes centrado en el TRDV y su proceso de evaluación |
| Instrumentos específicos o culturalmente sensibles | ||
| Living ACTS: Opciones en trasplante | DVD y libro | Dirigido especialmente a superar barreras de comunicación sobre el TRDV en población afroamericana |
| Infórmate (sobre donación renal de vivo para Latinos) | Sitio web | Información adaptada culturalmente en inglés y español para pacientes y familias |
| Ayudas a la decisión para potenciales receptores | ||
| Tu ruta al trasplante | Mensajes adaptados y personalizados por ordenador | Programa que genera educación personalizada basada en el análisis del receptor concreto, ventajas e inconvenientes ante el TRDV |
| Explora el trasplante @Casa | Mensajes de texto | Material educativo que discute las ventajas del TRDV |
| Mi entrenador de trasplante | Aplicación iOS | Comunica predicciones para el paciente concreto y su supervivencia tras las diversas opciones de tratamiento. Promueve la consideración del TRDV. |
| iChoose Kidney | Aplicación smartphone | Trasplante vs. diálisis |
| Ayudas a la decisión para educación del donante | ||
| Live Donor Champion | En persona | Entrenamiento para un posible representante o «abogado» del potencial donante renal vivo |
| DONOR | Plataforma para el paciente renal que permite compartir sus vivencias. Mediante la contestación a una serie de preguntas, se crea una historia narrada que puede compartirse con facilidad | |
| Calculadora de riesgo de enfermedad renal avanzada para candidatos a donante renal | Sitio web | Proporciona el riesgo de llegar a requerir tratamiento renal sustitutivo tras 15 años de haber donado un riñón |
| Ayudas a la decisión para profesionales y proveedores | ||
| KDPI del donante vivo | Sitio web | Para determinar el riesgo del receptor ante diversos donantes vivos, según sus características, y compararlo con un potencial donante fallecido |
Preguntas que cualquier material que se aporte al potencial donante renal vivo debería responder
| ¿Qué es la enfermedad renal crónica terminal? |
| ¿Qué es la donación en vivo? |
| ¿Quién puede ser donante vivo? |
| ¿Quién no puede ser donante vivo? |
| ¿Qué puede hacer el potencial receptor? |
| ¿Qué riesgos implica la donación en vida para el donante? |
| ¿Qué debemos esperar del trasplante? |
| ¿Qué tipo de evaluación se hará de la pareja donante-receptor? |
| ¿Cuáles son los riesgos para el donante? |
| ¿Cuáles son los riesgos para el receptor? |
Todos los pacientes con ERC deben ser considerados y valorados para el TR, excepto aquellos en los que exista una contraindicación absoluta, porque el TR ofrece una mejor calidad y una mayor esperanza de vida que la diálisis3,4. El paciente que recibe un TR anticipado, bien sea de donante vivo o fallecido, tiene una mejor supervivencia del paciente y del injerto con respecto al que ya comenzó diálisis99. Por ello, el TR anticipado debe ofrecerse a todos los pacientes que tengan la posibilidad de un donante renal vivo. Desde el proceso de decisión en consulta de ERC avanzada se le comentará esta opción al paciente y su familia, adjuntando folletos informativos, y se derivará con una primera visita a consulta pre-trasplante.
Las guías europeas recomiendan que los pacientes con deterioro progresivo de la función renal y un FGe < 15 mL/min/1,73 m2 se valoren para ser incluidos en lista de espera para un TR preventivo o anticipado3,4. Se derivará para iniciar estudio para el TR a aquellos pacientes que se prevea que pueden ser candidatos, cuando su FG sea < 20.mL/min, una vez explorada la posibilidad de TR de donante vivo.
Información básica para que el potencial donante renal otorgue su consentimiento- •
La información que se trasmitirá al donante estará protocolizada e incluirá detalles sobre el proceso de evaluación y aceptación; los riesgos, beneficios y evolución esperable en la salud del donante; alternativas terapéuticas para el receptor; manejo de los datos personales de salud y personal de soporte del donante (SG).
Los programas de TR deben desarrollar el proceso de comunicación de la información relevante a los candidatos a la donación100. Se ha sugerido el uso de checklists estandarizadas para asegurar que se transmite toda la información pertinente101. En EE. UU., la Organ Procurement and Transplantation Network ha desarrollado un listado para asegurar la adecuación del proceso102, además de un documento para el donante potencial en lenguaje comprensible103.
Esta transmisión de información debe hacerse en cada programa de TR en el entorno más favorable en cada caso; los escenarios más frecuentes y aconsejables son la consulta de ERC avanzada, la consulta pretrasplante o la coordinación de trasplante, a los que los pacientes se remiten desde las consultas generales de nefrología o las unidades de diálisis. Es frecuente que, en el marco de la elección de TRS en consulta de nefrología, se establezca la posibilidad de la donación de vivo y esto lleve a una visita específica informativa y de análisis de esta modalidad que dirigen nefrólogos especializados en trasplante. Por tanto, es esencial que los nefrólogos responsables de las consultas de ERC tengan siempre presente la posibilidad de tratar a los pacientes con la mejor modalidad disponible, que es el TR de donante vivo, y si es posible, anticipado a la necesidad de diálisis. El mejor momento para presentar esta posibilidad e indagar la existencia de potenciales donantes es cuando el posible receptor se encuentra en ERC grado 4, con FGe entre 16 y 30 mL/min.
Puede utilizarse material impreso de diversos tipos en el que se sistematice esta información y se facilite la presentación y discusión de los conceptos fundamentales ante el o los potenciales donantes. Desde el principio, el potencial donante debe recibir la información sobre los detalles del proceso de evaluación de una manera didáctica y comprensible. El lenguaje utilizado debe facilitar la comunicación y la comprensión mutua entre el candidato potencial y los profesionales104,105, y el clima en el que ese intercambio se desarrolla debe permitir todo tipo de preguntas y adaptarse a las particularidades del candidato105,106.
La información que se debe transmitir está incluida en muchas guías y declaraciones1,2,104,107,108. Algunas regulaciones requieren un mínimo contenido que debe asegurarse en el proceso de CI107. En la tabla 5 se resume la información que debe transmitirse al potencial donante.
Información que debe transmitirse a un potencial donante renal en el proceso de obtención de su consentimiento (modificado de referencia 91)
| Tipo de información | Información que debe transmitirse al potencial donante |
|---|---|
| Datos de salud personales del potencial donante | La información personal sobre la salud del candidato a donante es confidencialEl programa de trasplante transmitirá información confidencial del potencial donante al receptor con permiso del donante: compatibilidad inmunológica y características médicas relevantes para el futuro del trasplante. |
| Riesgos de hallazgos positivos en la evaluación | Posibles enfermedades que requieran estudio y tratamientoPosibles enfermedades transmisibles que requieran comunicación a las autoridadesPosibles descartes de parentescos familiares previamente asumidos o hallazgos de nuevos parentescos previamente desconocidos |
| Riesgos de la donación | Riesgos físicos médicos y quirúrgicos, psíquicos y sociales de la donación renal, a corto y largo plazo |
| Alternativas de tratamiento en el receptor potencial | Información sobre las técnicas de diálisis y el trasplante renal de donante fallecido, así como los resultados comparativos respecto al trasplante renal de donante vivo. |
| Datos de salud personales del potencial receptor | La información personal sobre la salud del candidato a recibir un trasplante renal es confidencialEl programa de trasplante transmitirá información confidencial del potencial receptor al donante con permiso del donante, solo cuando esos hallazgos sean relevantes en el proceso de toma de decisión de donación. |
| Procesos en la evaluación del potencial donante, la donación y su seguimiento | Es posible que algunos procedimientos requieran consentimiento informado específicoEs necesario insistir en la gratuidad total de la donaciónDebe plantearse la posibilidad de la renuncia a la donación en cualquier fase del proceso.Tras el proceso de evaluación hay dos posibilidades finales que debe decidir el equipo de trasplante y comunicar al candidato: que es adecuado para la donación o que no lo es. En el segundo caso, deben explicarse los motivos al candidato descartado.Debe explicarse todo el proceso de ingreso hospitalario, nefrectomía, postoperatorio, alta hospitalaria y seguimiento posterior a corto y largo plazo.Deben detallarse las ventajas sociales, sanitarias y económicas de la donación, incluida la priorización para trasplante de donante fallecido en caso de desarrollo de enfermedad renal crónica avanzada. |
La preocupación más habitual que el donante renal refiere antes de donar es la posibilidad de padecer insuficiencia renal en el futuro y después de donar, el proceso de recuperación, duración y complicaciones posibles100,109,110.
Los candidatos a donante renal deben saber que la donación solo la podrán hacer una vez en la vida, y deben conocer las alternativas en el tratamiento sustitutivo de la función renal para cualquier potencial receptor. Cuando se detecta incompatibilidad de grupo sanguíneo o por sensibilización HLA, debe informarse al donante sobre las diversas opciones que se pueden plantear, como el TR ABO-incompatible, el TR cruzado111–113 o la desensibilización HLA, que en general suelen requerir un CI específico.
El proceso de evaluación de un potencial donante conlleva riesgos de descubrir patologías y enfermedades previamente ocultas, que incluso requieran proceso diagnóstico y terapéutico. Todos los hallazgos y la conducta a seguir deben compartirse con quien en ese momento deja de ser un candidato a donante renal sin más y pasa a ser un paciente. Uno de esos hallazgos puede ser un posible descarte de parentesco familiar previamente asumido (por ejemplo, paternidad), o bien un nuevo parentesco previamente desconocido78. No existe consenso a la hora de establecer una conducta apropiada en estos casos. Es aconsejable la información precoz de que un suceso como el descrito puede ocurrir. El programa de TR debe establecer el protocolo de información en este caso: cuándo y cómo informar a los interesados78,114–117.
El candidato a donante renal debe recibir información sobre los riesgos quirúrgicos, médicos y psicosociales (secciones 5-7 y 17), incluyendo la necesaria individualización y el inevitable grado de incertidumbre y falta de evidencia en la mayor parte de casos. Por ejemplo, el riesgo de mortalidad a los tres meses de donar se estima en el 0,03%, y no se ha establecido el perfil de donante con riesgo aumentado118–120.
El cirujano que realiza la nefrectomía del donante renal tiene una particular responsabilidad a la hora de asegurar que este entiende los riesgos potenciales a corto y largo plazo. En España, el cirujano suele ser urólogo y lleva a cabo su propio proceso de información centrado en la nefrectomía, habitualmente laparoscópica. El urólogo expone el objetivo de la cirugía, describe la técnica que se utilizará, los riesgos asociados a la misma y, en su caso, obtiene el consentimiento. Por otro lado, el potencial donante debe recibir información acerca de las circunstancias que se pueden presentar al vivir con un único riñón, incluidos riesgos excepcionales como traumatismos severos o problemas médicos infecciosos o litiásicos que pudieran comprometer la función del único riñón existente. A largo plazo, se puede confirmar que la tendencia a pérdida progresiva del FG no es significativa en ningún grupo de edad121, y que la HTA no aumenta en incidencia con el paso de los años122.
Una de las preguntas que plantean las mujeres jóvenes, posibles donantes, es la relativa a la posibilidad de gestación. Se ha descrito un aumento de la HTA gestacional y preeclampsia en donantes renales respecto a sus controles de salud general similar pero no donantes. Sin embargo, estos hallazgos no se asociaron a más complicaciones ni para la madre ni para el feto123. Deberá prestarse especial atención a controles de la presión arterial, ganancia de peso y proteinuria, en general, similares a los que se pueden recomendar a otro tipo de gestantes124.
Aunque podría ser aconsejable el uso de herramientas cuantitativas y transparentes en este proceso de información de riesgo a largo plazo para el potencial donante renal125, existen importantes limitaciones en el uso de este tipo de cálculos y no disponemos de estimadores precisos del riesgo atribuible a la donación renal. Aunque sin una regulación oficial al respecto, debe transmitirse al potencial donante que en el muy infrecuente caso en el que pueda desarrollar una ERC avanzada, sería situado con máxima prioridad en la obtención de un riñón para TR126,127.
Con el mismo énfasis que para los riesgos, el programa de trasplante debe informar al candidato a donante renal de los potenciales beneficios de su donación. La dificultad en la medición de ese beneficio no es muy diferente a la del riesgo al que antes aludíamos128.
Debe informarse al donante acerca de la supervivencia estimada tanto del riñón como del receptor a uno, cinco y 10 años, tanto tras un TRDV, como de un TR de donante fallecido o del tratamiento con las diversas técnicas de diálisis, preferentemente a partir de los resultados del propio programa. Aunque en EE. UU. se requiere que el potencial donante reciba información de supervivencia de riñón y receptor al año del TR107, en España no existe tal obligatoriedad.
El candidato a donante debe saber que cualquier aspecto de su salud no será comunicado al potencial receptor sin su consentimiento expreso129,130. De igual modo, cualquier detalle referido al receptor no será comunicado al donante si no media consentimiento para hacerlo2,107. También debe conocer las implicaciones económicas y sociales de la donación, el impacto que esta pudiera tener en su desempeño laboral y el tiempo de incapacidad laboral transitoria, tanto estándar como si surgieran complicaciones. Por otro lado, debe informarse al donante que es ilegal obtener beneficio material (económico o de otro tipo) como compensación de la donación.
El profesional que informa debe transmitir al donante renal que existe la posibilidad de renuncia a la donación en cualquier fase del proceso, y que sea cual sea la razón, mantendrá todo el soporte del programa de trasplante. Por otro lado, la mayoría de los programas se reserva la decisión de confirmar o descartar a un potencial donante renal, y esa capacidad que tiene el equipo profesional debe informarse en detalle al potencial donante, dando por cumplida la motivación de esa decisión131. En general, se asume que el programa de trasplante que descarta un donante por riesgo inasumible para su salud o la del receptor, debe facilitar una segunda opinión en otros programas, si así lo requiere el potencial donante.
El donante de riñón debe recibir información acerca de los riesgos y beneficios que el receptor de ese riñón va a experimentar, entre otros: 1) que el tratamiento no es definitivo y que es frecuente la pérdida progresiva de la función renal con el paso de los años, sobre todo por desarrollo de formas crónicas de rechazo; 2) que existe la posibilidad, en torno al 5%, de la pérdida precoz del injerto por rechazo agudo, fracaso primario del injerto, trombosis o complicaciones infecciosas. Este aspecto se recoge en más detalle en la tabla 689.
Riesgos potenciales que asume el receptor de un trasplante renal que debería conocer el potencial donante renal en el proceso de la obtención de su consentimiento (modificado de referencia 89)
| El riñón | La cirugía | Los fármacos | Las expectativas no alcanzadas |
|---|---|---|---|
| No llegue nunca a funcionar (5%) | Complicaciones asociadas a la anestesia (< 1%) | Necesidad de fármacos todos los días toda la vida | No se abandona el hospital: revisiones de por vida |
| Funcione mucho menos de lo esperado (10%) | Complicaciones hemorrágicas (3-5%) | Producen efectos secundarios como diabetes, hipertensión | Con frecuencia un trasplante no funciona toda la vida, hay rechazo crónico y vuelta a diálisis (50%) |
| Necesidad de sesiones de diálisis hasta que funcione (25%) | Aparición de fístula urinaria, linfa o sangre alrededor del riñón o infección de la herida (5-8%) | Su toma crónica se asocia a infecciones y tumores malignos | Puede «reproducirse» la enfermedad original en el riñón trasplantado |
| Que haya rechazo u otras situaciones que requieran una biopsia (15%) | Que sea necesario hacer una transfusión de sangre (20%) | Dudas sobre si no hubiera sido mejor quedarse en diálisis |
El punto esencial del proceso es llevar a cabo una adecuada entrevista, en clima de total confianza y franqueza, en ausencia del potencial receptor o sus familiares. Normalmente, la duda persistente y la ambivalencia equivalen a una negativa a donar, y tanto en este caso como en el caso de franca negativa, el programa debe apoyar la decisión y dar soporte al que fue potencial donante y ha decidido finalmente no serlo, de forma respetuosa y confidencial132. Aunque practicada con frecuencia en el pasado, el «medical alibis», o la justificación de la negativa a donar de una persona ante el potencial receptor a través de una razón médica falsa que pudiera justificar esa decisión, es desaconsejable. Parece más adecuado argumentar «este donante no es adecuado» a nivel general, sin especificar una razón falsa133. El programa de trasplante debe ayudar al donante a comunicarlo si así se le requiere. Por otro lado, también se presentan casos en los que un potencial receptor no acepta una donación renal voluntaria, y en este contexto, deben también articularse los procedimientos que minimicen el conflicto y permitan una negativa sin mayor consecuencia.
Aproximación preliminar a la viabilidad de la donación- •
El proceso de estudio del potencial donante renal vivo admite planteamientos muy diversos, dependiendo de las características del donante, premura del estudio, facilidades y tiempos de espera locales para las exploraciones (SG).
- •
El primer paso de «cribado» de un potencial donante renal debe descartar casos inviables con un mínimo de molestias para el donante y de consumo de recursos, por lo que debería incluir: revisión del estudio pretrasplante del receptor; compatibilidad donante-receptor (grupo ABO, prueba cruzada) y evaluación del donante potencial, con analítica básica y estimación del FG (SG).
El proceso de estudio del potencial donante renal vivo admite planteamientos muy diversos, dependiendo de las características del donante, premura del estudio, facilidades y tiempos de espera locales para las exploraciones. Los estudios pueden plantearse todos a la vez desde el principio en casos muy claros, sobre todo si se pretende una resolución rápida. El orden de realización de las exploraciones también debe alterarse según los casos; por ejemplo, en donantes con patologías concretas que requieren aprobación por otros especialistas, no se debería profundizar en el estudio hasta obtenerla.
El primer paso debe ser de «cribado» de un potencial donante renal, en el marco de la consideración inicial de la pareja donante-receptor con exploraciones elementales poco invasivas y de realización inmediata, en la que se califica la donación como posible. Se trata de descartar casos inviables con un mínimo de molestias para el donante y de consumo de recursos. Al mismo tiempo, da un lapso al donante para confirmar su decisión. Para esta primera aproximación no se requiere CI por escrito, sino simplemente la aceptación oral del potencial donante. Sí se requerirá más adelante, cuando se deban realizar exploraciones invasivas y finalmente el consentimiento para la nefrectomía.
Este primer cribado debería incluir tres aspectos fundamentales:
- 1)
Revisión del estudio pretrasplante del receptor: confirmar la indicación del trasplante, estudio pre-trasplante apropiado y completo, y valoración del riesgo y pronóstico.
- 2)
Compatibilidad donante-receptor: determinación o repetición del grupo ABO en banco de sangre, tipaje HLA de donante (y receptor, si no estaba incluido en lista de donante fallecido) y primera prueba cruzada. Permite sentar la posibilidad del trasplante directo si existe compatibilidad ABO y prueba cruzada negativa; en caso contrario, permite ofrecer la opción de un TR cruzado o un procedimiento de desensibilización.
- 3)
Evaluación del donante potencial, con anamnesis y exploración física, analítica básica con creatinina sérica y FGe, glucemia, función hepática, hemograma, hemostasia, serologías VHB, VHC y VIH y microalbuminuria/creatinina y sedimento en orina esporádica.
- •
La información a la sociedad sobre el trasplante de donante vivo debe estimular su promoción (SG).
- •
La atención a los medios de comunicación y la información proactiva deben ser prioritarias (SG).
La evidencia científica a favor del TRDV, especialmente anticipado a la necesidad de diálisis, debe estimular su promoción en los espacios formativos dedicados a los profesionales de la salud de todo tipo, incluyendo profesionales de atención primaria134. Por otro lado, los proveedores de tratamiento con diálisis deben conocer bien las ventajas del trasplante, y en especial el de donante vivo, de modo que puedan educar en ese sentido a los pacientes que tratan.
A nivel de toda la sociedad, debe llegarse a consensos entre todas las organizaciones comunitarias, medios de comunicación, incluso organizaciones religiosas, para promocionar y estimular el TRDV. En este sentido, los avances tecnológicos deben aprovecharse para extender lo más posible las más diversas herramientas educativas y formativas a toda la sociedad. Este esfuerzo educativo debe ser más intenso cuanto menor sea el nivel educativo de las diversas comunidades y regiones, superando inequidades sociales y económicas.
La atención a los medios de comunicación ha constituido desde siempre una prioridad para la ONT, y por extensión, de los coordinadores autonómicos y hospitalarios de trasplante, conscientes de que la información trasmitida a los medios va a repercutir de forma directa en toda la sociedad. Todos los profesionales sanitarios vinculados a la donación y trasplante de órganos deben colaborar de forma permanente con los medios de comunicación, estar disponibles en cualquier momento a sus peticiones y aclarar todas sus dudas, tratando de atajar cuanto antes los posibles efectos nocivos de una noticia mal planteada o contada. Los profesionales sanitarios deben mantener lo que en teoría de la comunicación se denomina, una «comunicación proactiva». Los periodistas agradecen esta actitud, que se traduce en una atención diaria personalizada. La continua publicación de noticias positivas ha contribuido a forjar la buena imagen de los trasplantes en nuestra sociedad, que los considera no solo una técnica habitual, sino, sobre todo, una prestación fundamental de nuestro sistema sanitario. En el imaginario social, los ciudadanos españoles identifican los trasplantes con la vida, percepción que sin duda favorece la donación de órganos en general y la donación de personas vivas en particular. Principios básicos de comunicación como la necesidad de unos mensajes claros, concisos y bien argumentados, la coherencia en los argumentos empleados, la forma de explicar los temas difíciles, el tono de los mensajes y, por descontado, las técnicas más adecuadas de transmitirlos son claves para que el sistema funcione.
Como escribe el exdirector de la ONT, Rafael Matesanz: «Se deben atender siempre las llamadas de los periodistas, vengan de donde vengan y de la mejor manera posible. Y todo ello con la mayor rapidez posible, ya que los periodistas suelen carecer del lujo de poder esperar. De esta forma, vamos a poder prevenir muchos malentendidos que pueden acabar en escándalos y, por otra parte, vamos a tener oportunidad de difundir una imagen positiva del proceso.»135
Bajas laborales, costes económicos, seguros de vida y solicitud de créditos- •
La extracción de un riñón para donarlo debe incluirse como causa específica que justifique la declaración de incapacidad temporal para el trabajo y el consiguiente disfrute de una prestación monetaria de la seguridad social (SG).
- •
Los gastos directos y acreditables en los que incurra el donante por causa de la donación deben ser reembolsados y su asistencia sanitaria garantizada de por vida (SG).
- •
El cambio en las circunstancias de salud que pueda sufrir una persona por su condición de donante no puede implicar penalizaciones en la contratación o renovación de pólizas de seguros ni préstamos de cualquier tipo (SG).
La donación renal conlleva problemas laborales con cierta frecuencia. Los donantes tienen que perder muchos días de trabajo por las pruebas médicas y el posoperatorio. Es posible que incluso pueda perderse el puesto de trabajo al considerarse que este tipo de intervenciones son «voluntarias». La interpretación restrictiva de la Ley General de la Seguridad Social (art. 128) impide el reconocimiento de la incapacidad laboral transitoria con derecho a prestación económica, al considerarse que el donante no está enfermo ni ha sufrido un accidente de trabajo. Por ello, muchos donantes toman vacaciones o permisos no remunerados para este proceso.
Es necesario solucionar esa falta de protección laboral del donante vivo, y la extracción de un órgano para la donación debe incluirse como causa específica que justifique la declaración de incapacidad temporal para el trabajo y el consiguiente disfrute de una prestación monetaria de la seguridad social durante la extracción y posterior recuperación del donante, y que incluya la imposibilidad de que la persona pueda ser despedida durante el proceso de donación. Si bien la actual regulación de la incapacidad temporal ya permite una interpretación en este sentido, es conveniente que la legislación laboral española lo contemple de forma explícita.
Una iniciativa más ambiciosa e incentivadora podría traducirse en una protección social y laboral similar a la que tienen actualmente los padres ante el embarazo y parto, una licencia similar a la licencia maternal o paternal. La medida afectaría a unas 400 personas al año, una cifra muy baja. La solución a este problema estimularía la donación renal entre personas vivas. Los gastos directos y acreditables en los que incurra el donante por causa de la donación deben ser reembolsados y su asistencia sanitaria debe ser garantizada de por vida. No obstante, no debe fijarse ninguna compensación económica, que por otro lado prohíbe la legislación vigente.
El cambio en las circunstancias de salud que pueda sufrir una persona por su condición de donante no puede implicar penalizaciones en la contratación o renovación de pólizas de seguros ni préstamos de cualquier tipo136.
Sección 5. Evaluación, antecedentes y pruebas específicas para el donante vivo de riñónEl estudio del donante de riñón es un proceso complejo en el que intervienen numerosos especialistas. En él debe asegurarse que el donante tiene una salud física y psíquica adecuada, que la donación es consciente, voluntaria y desinteresada, que los riesgos para el donante a corto, medio y largo plazo son muy bajos y que las posibilidades de éxito en el receptor son altas. También debe evitarse la transmisión de enfermedades de donante a receptor, especialmente las de tipo infeccioso y/o neoplásico. En caso de enfermedades hereditarias es muy importante confirmar que el potencial donante no la sufre o porta igual que el receptor. Asimismo, debe asegurarse buena compatibilidad inmunológica entre donante y receptor. Este último tema y el estudio metabólico del donante serán descritos en otros apartados. En este capítulo, se expone cómo debe realizarse el estudio del donante y los principales hallazgos que pueden encontrar en el mismo y que pueden contraindicar la donación.
Analítica general y radiologíaAunque no es homogéneo en todos los centros, la mayoría recomienda un protocolo de estudio similar al siguiente9,101,137,138:
Analítica sanguínea- -
Hemograma, estudio de coagulación, metabolismo del hierro.
- -
Bioquímica (glucosa, HbA1c, urea, creatinina, Filtrado Glomerular Estimado mediante la fórmula Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI), sodio, potasio, calcio, fósforo, ácido úrico, gasometría venosa, bioquímica hepática, proteinograma, colesterol total, HDL-colesterol, LDL-colesterol, triglicéridos, proteína C reactiva).
- -
Serologías:
- -
VIH. Reacción en cadena de la polimerasa (PCR)-VIH antes de la cirugía.
- -
Hepatitis B: VHB-antígeno de superficie (HBsAg), VHBcAc (HBcAc IgM/IgG), VHB-anticuerpo de superficie (HBsAc), PCR-VHB en plasma si HBcAc positivo.
- -
Hepatitis C (ELISA). En algunos casos valorar ARN-VHC.
- -
Citomegalovirus (CMV IgG/IgM).
- -
Epstein-Barr (EBV IgG/IgM).
- -
Toxoplasma.
- -
Sífilis: RPR (reagina plasmática rápida)-FTA.
- -
Coronavirus. Cribado de SARS-CoV-2.
- -
Virus humano T- linfotropic-HTLV I-II.
- -
Prostate-Specific-Antigen (PSA) (hombres > 40 años).
- -
Test de gestación, si procede.
- -
Test de sobrecarga oral de glucosa, si procede.
- -
Elemental, dos veces.
- -
Ratio albúmina/creatinina, ratio proteínas/creatinina
- -
Aclaramiento de creatinina, calciuria y proteinuria en muestra de 24 h
- -
Urocultivo.
A considerar según valoración de riesgo por áreas geografías endémicas:
- -
Tripanosoma cruzi
- -
Strongiloides
- -
Test de diagnóstico rápido de malaria (RDT) detectores de antígenos y determinación de anticuerpos mediante inmunofluorescencia indirecta (IFI) contra la misma
- -
Esquistosomiasis
- -
Coccidiomicosis, histoplasmosis
- -
Ébola
- -
Zika
- -
Virus del Nilo Occidental
- -
Radiografía de tórax (postero-anterior y lateral).
- -
Angio-TAC abdominal. Esta última nos va a informar de posibles alteraciones órgano a órgano, detecta problemas vasculares, litiasis, tumores y facilita una descripción de ambos riñones que va a contribuir de forma definitiva a la selección del riñón a nefrectomizar. Asimismo va a permitir caracterizar el sistema excretor renal. Las anomalías por angio-TAC suelen ser la primera causa de descarte.
- •
Se sugiere incluir en los estudios del donante, pruebas de esfuerzo como el SPECT miocárdico o la RM con dobutamina en caso de ECG o ecocardiograma anormal, mayores de 60 años o suma de factores de riesgo (C).
El estudio cardiovascular tiene por objeto la detección de cardiopatías significativas que constituyan contraindicación por aumento de riesgo del donante: cardiopatía isquémica, insuficiencia cardiaca, valvulopatías, hipertrofia ventricular izquierda o arritmia significativas. Tras finalizar el estudio y convenientemente seleccionados, los donantes no parecen ver aumentado su riesgo cardiovascular tras la donación139.
Junto a la anamnesis detallada, la exploración física, la radiografía de tórax y el ECG, la edad o factores de riesgo de los posibles donantes hace que nos ayudemos de la ecocardiografía (hipertensos, soplos, disnea de esfuerzo, edad avanzada), del Holter (descartar arrtimias) y de las pruebas de esfuerzo como la tomografía computarizada por emisión de fotón único (SPECT) miocárdica o la RM con dobutamina (ECG o ecocardiograma anormal, más de 60 años o suma de factores de riesgo: edad > 45 años en hombres/> 55 años en mujeres, tabaquismo, dislipemia, HTA, antecedentes familiares)137. Si el caso lo requiere, el cardiólogo solicitará otras pruebas al estudio del donante.
Las pruebas de función respiratoria estarían indicadas en caso de enfermedad pulmonar crónica o tabaquismo importante. Existe un riesgo incrementado para el donante en caso de volumen espiratorio forzado en un segundo (FEV1) o capacidad vital forzada (FVC) < 70%, o ratio FEV1/FVC < 65%138.
Valoración de la función renal del donante- •
Se recomienda en el estudio inicial la estimación del FG mediante fórmulas validadas (calidad de la evidencia: B).
- •
Se recomienda que la medición de FG debe ser confirmada mediante marcadores exógenos más precisos, como 125- iothalamato, 51 Cr-EDTA, iohexol o Tc-DTPA, especialmente en pacientes con función renal límite (B).
- •
Se sugiere estudio con 99Tc DTPA cuando exista una diferencia de tamaño entre los dos riñones superior al 10% (C).
- •
El FG medido del donante antes de la donación debe ser suficiente para que, tras la misma, el FG previsible se mantenga dentro de unos valores aceptables para la edad y género correspondiente durante el resto de la vida (B).
- •
Se sugiere que la decisión de aceptar un candidato cuya función renal está por debajo del umbral requerido o que tiene otros factores adicionales de riesgo de progresión a insuficiencia renal crónica, debe ser individualizada (D).
- •
Se sugiere informar y hacer constar en el CI del donante del pequeño incremento del riesgo de sufrir insuficiencia renal crónica a lo largo de su vida (D).
- •
Se recomienda para todos los donantes un seguimiento de por vida, con especial atención a función renal, proteinuria y presión arterial (B).
La función renal del donante no debe evaluarse solo con la creatinina plasmática. Tiene valor limitado cuando aparenta ser normal, aunque si es conocida previamente y es igual o superior a 1,5 mg/dL puede ayudar a descartar la donación. En general, se recomiendan las ecuaciones de estimación del FG estandarizadas a superficie corporal y el aclaramiento de creatinina en orina de 24 horas. Este requiere recogida de orina que debería colectarse en ausencia de fiebre, menstruación, infecciones urinarias y ejercicio físico forzado previo. Asimismo, es importante que la ingesta de proteínas de la dieta sea al menos de 1 g/kg de peso, ya que una dieta baja en proteínas puede disminuir el aclaramiento de creatinina hasta 10 mL/min140. Siempre hay que tener en cuenta la posibilidad de recogida incompleta o excesiva de orina. Para ello, nos ayudamos de la excreción de creatinina (debe quedar dentro del rango 15-25 mg/kg). Debe determinarse en dos ocasiones para minimizar errores.
La estimación del FG mediante fórmulas validadas por los estándares internacionales de referencia se acepta en el estudio inicial y debe repetirse con posterioridad9,137. Las más usadas son Cockroft-Gault, Modified-Diet in Renal Disease (MDRD) y CKD-EPI. Son fórmulas que no están validadas para esta población concreta de donantes vivos de riñón. No obstante, se ha comunicado que el promedio del aclaramiento de creatinina (Cr) y MDRD da una buena aproximación al FG medido por 125-iotamalato141. Actualmente, se piensa que CKD-EPI podría aportar un mejor ajuste al FG medido que otras fórmulas, en pacientes con función normal142.
Las KDIGO y las guías británicas recomiendan la comprobación posterior y evaluación de la función renal con métodos más «exactos» como la medición del FG con marcadores exógenos como 125iothalamato, 51Cr-EDTA, iohexol, 99Tc-DTPA9,137. Estas pruebas cobran mayor importancia, si cabe, en presencia de función renal límite estimada por fórmulas.
Si la medida del FG no es factible, se recomienda al menos la determinación de Cistatina C, determinándose en esos casos el FGe por fórmulas basadas tanto en creatinina como en Cistatina C. No obstante, estas técnicas solo son necesarias en casos con aclaramiento de creatinina cercano al límite. El estudio con 99Tc DTPA se recomienda cuando existe una diferencia de tamaño entre los dos riñones superior al 10%. Tiene la ventaja adicional de estimar la función de los dos riñones por separado137. En caso de detectar anomalías vasculares o urológicas que no contraindiquen la donación, el mejor riñón debe ser preservado para el donante.
Para respaldar estas directrices, la Organ Procurement and Transplantation Network (OPTN) desarrolló una calculadora de FG ubicada en la red para calcular el FG y compararlo con el FG medido143. La herramienta ha sido validada en un estudio de candidatos a donante144, lo cual sugiere que el FG calculado puede ser lo suficientemente preciso para la toma de decisiones sin la necesidad de medirlo directamente. Sin embargo, el uso del FGe forma aislada no está reconocido por la política de OPTN, pero una estrategia de detección con FGe seguida de confirmación con un aclaramiento de creatinina de 24 horas o un FG medido puede ser suficiente y cumplir con las normas establecidas.
El FG medido del donante antes del procedimiento debe ser suficiente para que, tras el mismo, el FG previsible se mantenga dentro de unos valores aceptables para la edad y género correspondiente durante el resto de la vida137. Las guías británicas nos proponen una tabla orientativa al respecto (tabla 7).
En general, FG > 90 mL/min/1’73m2 se consideran óptimos para la donación, recomendándose evaluar individualmente aquéllos comprendidos entre 60-90.mL/min/1’73 m2. En caso de ser inferiores a 60, la donación se considera generalmente contraindicada. La decisión de aceptar un candidato cuya función renal está por debajo del umbral requerido o que tiene otros factores adicionales de riesgo de progresión a la insuficiencia renal crónica, debe individualizarse y basarse en la probabilidad que tiene de desarrollo de insuficiencia renal crónica terminal a lo largo de su expectativa de vida137.
Asimismo, debe tenerse en cuenta la función renal necesaria para el futuro receptor y compararla con la calculada a partir de la función renal del donante a efectos de tomar la decisión de si será suficiente. Esta decisión es muy importante tanto en una donación directa como en la posibilidad de aceptar una donación indirecta.
El donante va a tener un riesgo de insuficiencia renal terminal después de la donación que no va a ser superior al de la población general33. Sin embargo, existirá un pequeño incremento del riesgo de sufrirla a lo largo de su vida35,37. Dicho aspecto debe ser conocido y consentido por el potencial donante9.
Finalmente, cabe añadir que el donante deberá ser seguido durante toda su vida, con especial atención a su función renal, proteinuria y presión arterial8.
Proteinuria- •
Se recomienda a todo donante vivo potencial cuantificar la excreción de proteínas en orina (B).
- •
Se recomienda aceptar como donantes aquellos con excreción albúmina en orina inferior a 30 mg/día o con ratio albúmina/creatinina menor de 30 mg/g. Individualizar los casos entre 30-300 mg/día (30-300 mg/g) y contraindicar aquellos con una albuminuria superior (A).
- •
Se sugiere que el riesgo de ERC y riesgo cardiovascular corren paralelos al incremento de la albuminuria o de la proteinuria (C).
En todo potencial donante vivo debe medirse la excreción de proteínas en orina137. Es preferible determinar la albuminuria del donante antes que la proteinuria total. A pesar de ello, la mayoría de los centros realiza ambas. Se recomienda efectuar una ratio albúmina/creatinina en muestra de orina y confirmarla con una albuminuria total en orina de 24 horas o un cociente albuminuria/creatininuria en orina de 24 horas. Se considera aceptable una excreción de albúmina en orina inferior a 30 mg/día o con ratio albúmina/creatinina menor de 30 mg/g. Es aconsejable individualizar los casos entre 30-300 mg/día (30-300 mg/g) y contraindicar aquellos con una albuminuria superior9. Una alternativa aceptable es la ratio proteínas/creatinina en muestra de orina. En este caso, se recomienda que sea menor de 50 mg/mmol. Los valores que claramente contraindicarían la donación serían una albuminúria > 300 mg/día, ratio albúminuria/creatininuria > 300 mg/g (> 30 mg/mmol), ratio proteinuria/creatininuria > 500 mg/g (50 mg/mmol) o una proteinuria > 500 mg/día9,137,143.
El significado de la albuminuria o proteinuria moderadas (albuminuria/creatininuria 3-30 mg/mmol, proteinuria/creatininuria 15-50 mg/mmol, albuminuria 30-300 mg/día o proteinuria entre 150-500 mg/día) está todavía por determinar en el donante vivo de riñón. Sí sabemos que el riesgo de ERC y el riesgo cardiovascular son paralelos al incremento de la albuminuria o de la proteinuria, por lo que podrían ser una contraindicación relativa a la donación101,137. Con todo, cada centro tiene posiblemente un umbral de aceptación distinto. En EE. UU., una encuesta relativa al umbral de proteinuria en la que los distintos centros marcaban la aceptación o no de un donante vivo de riñón, objetivó que un 37% lo definió como una proteinuria< 150 mg/día y un 44% inferior a 300 mg/día o incluso superior145.
Microhematuria- •
Se recomienda realizar al menos dos determinaciones de hematíes en orina a todos los donantes (B).
- •
Se recomienda profundizar en el estudio de aquellos donantes con microhematuria persistente en dos o más ocasiones (A).
- •
Se recomienda valorar biopsia renal si la microhematuria es de probable origen glomerular para descartar la existencia de glomerulopatías (B).
- •
Se recomienda consulta a especialista en genética ante sospecha de enfermedad renal hereditaria (B).
- •
Se recomienda cistoscopia en pacientes mayores de 40 años con microhematuria de causa desconocida (B).
A todo donante deberían realizársele al menos dos determinaciones de hematíes en orina durante el estudio137. Si el donante presenta una microhematuria persistente, (> 3 hematíes /campo o 5 hematíes x 106/L) en dos o más ocasiones, esta debe estudiarse para determinar la causa (dismorfia eritrocitaria, urocultivo, citología urinaria, cistoscopia, biopsia renal, estudio de litiasis)137. Si es de probable origen glomerular (hematíes dismórficos) se valorará realizar biopsia renal para descartar la existencia de glomerulopatías (nefropatía IgA/IgM, síndrome de Alport, membrana fina), riñón «en esponja» medular y glomeruloesclerosis significativa146. En caso de sospecha de enfermedad renal hereditaria, cabría valorar por el genetista la posibilidad alternativa de realizar un panel de genes de enfermedades hereditarias que podrían llevarnos al diagnóstico sin la necesidad de realizar una biopsia renal147. La patología glomerular contraindica en general la donación, a excepción de la enfermedad de la membrana basal fina101,137. En cualquier caso, la ausencia absoluta de riesgo para desarrollar ERC avanzada en donantes con enfermedad de membrana basal fina no se puede garantizar, por lo que se sugiere que estos donantes tengan una edad superior a los 40 años en el momento de la donación. En caso de no encontrar la causa, en pacientes de más de 40 años sería recomendable realizar una cistoscopia para descartar patología vesical. Posiblemente, los donantes de riñón que presentan microhematuria tienen más riesgo de deterioro progresivo de la función renal148.
La decisión de aceptar el potencial donante dependerá de la causa, reversibilidad y/o riesgo de progresión de esta.
Leucocituria- •
Se sugiere contraindicar la donación ante leucocituria persistente en ausencia de infección urinaria o prostatitis (C).
Se considera contraindicada la donación cuando es persistente en ausencia de infección urinaria o prostatitis. Si no se explica por infección, puede requerirse biopsia renal para descartar nefritis intersticial o pielonefritis crónica (que excluyen donación)3.
Siempre hay que descartar una tuberculosis urinaria, que contraindica la donación, mediante cultivo de micobacterias (al menos tres).
Litiasis renal- •
Se sugiere consultar con especialistas ante la presencia de litiasis o alteraciones metabólicas relacionadas, informando a donante y receptor de los riesgos y seguimiento apropiado (C).
- •
Se sugiere en donantes con litiasis unilateral que sean aceptados, la nefrectomía del riñón afecto, de forma que el donante quede con un riñón libre de litiasis (C).
La existencia de litiasis renal debe descartarse en todo potencial donante renal. La historia clínica (cronología y composición de los cálculos) y la angio-TAC realizadas durante el estudio son importantes para ello9. En caso de antecedentes hay que determinar la causa de la litiasis y realizar un estudio metabólico de orina de 24 horas. La aceptación del donante va a depender de la probabilidad de recurrencia de la litiasis en el riñón residual y de la perfecta comprensión por el donante de los riesgos que la donación implica en este caso. En EE. UU., la mayoría de los centros aceptan un donante con antecedentes de litiasis si en el momento actual no la padece y el estudio metabólico de orina es normal145. Independientemente de la donación o no, el potencial donante con historia de litiasis debe seguir los criterios habituales para evitar la recidiva de la enfermedad litiásica.
La litiasis renal puede considerarse contraindicación absoluta en determinadas situaciones con alto riesgo de recidiva o lesión renal como la nefrocalcinosis, si es bilateral, recurrente o tiene probabilidad de serlo por trastornos relacionados (hipercalciuria, hiperfosfatemia, hipocitraturia, hiperuricemia, hiperuricosuria, cistinuria, hiperoxaluria, acidosis tubular distal, infecciones urinarias recurrentes, sarcoidosis, enfermedad inflamatoria intestinal)138,149. Las anormalidades metabólicas del donante deben ser siempre discutidas con un experto en litiasis, especialmente si no se encuentra una causa metabólica clara de la litiasis 137. En general, se acepta que, en ausencia de una anomalía metabólica importante, los donantes potenciales con una historia limitada de litiasis renal o con una pequeña litiasis actual, pueden ser considerados como potenciales donantes. Es necesaria una buena comunicación de los riesgos a donante y receptor y un seguimiento apropiado del donante a lo largo del tiempo137.
En caso de existir una litiasis unilateral y aceptarse la donación, la nefrectomía debe practicarse en el riñón afecto de la litiasis (intentando extraer el cálculo en dicho acto), de forma que el donante quede con un riñón libre de litiasis137.
Detección de tumores en el donante- •
Se recomienda una historia clínica cuidadosa y exploración física detallada para detectar neoplasias ocultas antes de la donación renal, especialmente cuando la edad es superior a 50 años (B).
- •
Se recomienda aceptar potenciales donantes con un riesgo mínimo de transmisión de tumores de bajo grado (< 1%), después de una cuidadosa evaluación y discusión (B).
- •
Se sugiere que riñones de donantes con tumor renal T1a pueden ser aceptados tras realizar tumorectomía durante la extracción (D).
- •
Se sugiere rechazar la donación en angiomiolipomas bilaterales. En unilaterales mayor de 4 cm se puede extraer el riñón afecto y realizar exéresis tumoral ex vivo. Si son unilaterales y menores de 4 cm no contraindican la donación y si son de menos de 1 cm, el riñón con angiomiolipoma puede quedarse tanto en el donante como en el receptor (C).
Debe descartarse la posibilidad de que un potencial donante renal sea portador de tumores transmisibles al receptor. El estudio debe realizarse según las guías de cada país. La historia clínica cuidadosa y la exploración física detallada son esenciales, especialmente cuando la edad es superior a 50 años137. Deben complementarse con analítica general, Rx de tórax, angio-TAC, tacto rectal y PSA en varones mayores de 50 años, sangre oculta en heces, colonoscopia o cistoscopia si proceden y estudio ginecológico (exploración, citología, ecografía ginecológica, mamografía). También pueden realizarse estudios específicos en función de hallazgos del estudio preliminar o antecedentes personales o familiares; por ejemplo: examen por dermatología si tiene antecedentes familiares de melanoma o número elevado de nevus138.
En general, los donantes con un proceso maligno activo detectado durante el estudio o con antecedentes de este suelen descartarse de la donación150. Esta se desestima si hay diagnóstico previo de cáncer hematológico, gastrointestinal, testicular, melanoma, pulmonar, mamario, renal o urinario con alguna excepción, coriocarcinoma o gammapatía monoclonal9. Solo pueden considerarse potenciales donantes aquellos con un riesgo mínimo de transmisión (< 1%) considerados tumores de bajo grado después de una cuidadosa evaluación y discusión9,137,138 como tumores cutáneos basocelulares, carcinoma in situ de colon o cérvix, riñones portadores de un quiste Bosniak II-III o incluso un tumor renal T1a y tumorectomía151,152.
El estudio radiológico mediante TAC con contraste, ecografía o Resonancia Nuclear Magnética (RNM) permite habitualmente distinguir entre lesiones benignas como el angiomiolipoma y malignas como el carcinoma renal de células claras. Se requiere para ello la colaboración de un radiológo experimentado137.
Los angiomiolipomas bilaterales contraindican la donación. En los unilaterales mayores de 4 cm algunos grupos consideran la donación denominada terapéutica y realizan exéresis del angiomiolipoma durante la nefrectomía de forma ex vivo. En los unilaterales menores de 4 cm, no se suele contraindicar la donación. Si son unilaterales y menores de 1 cm, se considera que el riñón con el angiomiolipoma puede quedarse tanto con el donante como con el receptor137.
Enfermedades renales hereditarias o con componente familiar- •
Se recomienda realizar una historia clínica detallada a todos los potenciales receptores de TR, con especial detalle en lo relativo a antecedentes familiares de enfermedad renal. En enfermedad renal hereditaria, es imprescindible excluirla en el potencial donante (A).
Todos los potenciales receptores de TR deben tener realizada una detallada historia de afectación familiar por enfermedades renales y, cuando sea posible, el diagnóstico de estas. Ello ayudará a detectar riesgos familiares en el potencial donante vivo. Al mismo tiempo, todos los donantes deben ser interrogados sobre antecedentes personales o familiares de enfermedades hereditarias. En el caso de que la enfermedad del receptor se deba a una enfermedad renal hereditaria, es imprescindible excluirla en el donante, realizando exploraciones radiológicas, biopsia renal o estudios genéticos si es necesario9,137,138. Entre las más importantes cabe destacar la poliquistosis renal autosómica dominante. Clásicamente, se han determinado unos criterios para su diagnóstico y para diferenciarla de los quistes simples aislados153. En caso de duda, el diagnóstico genético nos ayudará a tener seguridad de que el donante no va a sufrir la enfermedad en el futuro154. Otras enfermedades hereditarias o con componente familiar a descartar en el donante son el síndrome de Alport, la enfermedad por membrana basal fina, glomerulopatías con mayor afectación familiar (IgA, membranosa, focal y segmentaria, membranoproliferativa), Lupus Eritematoso Sistémico (LES) y el síndrome hemolítico urémico atípico. Aquellos donantes que sean portadores de la misma enfermedad que el receptor no deben ser aceptados como donantes.
Riesgo de transmisión de enfermedades infecciosas155- •
Las pruebas destinadas a detectar infecciones transmisibles deben realizarse a todos los potenciales donantes vivos (B).
- •
Se recomienda ante enfermedad infecciosa potencialmente transmisible, que el equipo médico y el receptor acepten o rechacen la idoneidad de la donación tras información detallada de los riesgos (B).
- •
La positividad del HIV humano o del human T lymphotrophic virus (HTLV) se considera una contraindicación absoluta a la donación de vivo (B).
- •
Se recomienda informar a donante y receptor del riesgo de primoinfección postrasplante en caso de donante CMV + y receptor CMV-, y del riesgo de enfermedad linfoproliferativa en caso de donante EBV + y receptor EBV- (B).
Ya se han descrito anteriormente las pruebas destinadas a detectar infecciones transmisibles que deben realizarse a todos los potenciales donantes vivos156,157. Es recomendable que para las enfermedades de mayor riesgo de infección se efectúen con poca anterioridad al trasplante, de forma que podamos obviar períodos ventana. Especialmente para VIH, VHB y VHC es preferible que estén identificadas en el mes anterior a la donación9. Determinadas infecciones activas o latentes no serán una contraindicación si es posible un tratamiento efectivo del donante. Es importante realizar una correcta anamnesis de los factores de riesgo de enfermedades infecciosas latentes en el donante, con especial hincapié en factores de comportamiento social, adicciones, riesgos profesionales, riesgos geográficos y exposición a animales. Los criterios para aceptar infecciones transmisibles del donante varían país a país26,27 y están cambiando rápidamente en los últimos años. Cuando el donante tenga una enfermedad potencialmente transmisible, el equipo médico y el receptor convenientemente informado tomarán la decisión acerca de si se pueden asumir los riesgos de la transmisión9,137.
Virus de la hepatitis B (VHB)La positividad a HbsAg o presencia de ADN viral en sangre contraindica la donación a pacientes HBsAg negativos. La positividad a HBcAc-IgM, que indica infección reciente, y la positividad aislada a HbcAc obligan a descartar replicación activa por ADN o mutación virales. La positividad a HBcAc-IgG con/sin HbsAc positivo y con ADN viral negativo implica un riesgo muy pequeño de transmisión (aunque no nulo), que hace admisible la donación, pero el receptor debería estar inmunizado de forma natural o por vacunación efectiva9,138 (SG).
Virus de la hepatitis C (VHC)La presencia de anticuerpos contra el VHC ha sido clásicamente una contraindicación a la donación renal, tanto por el riesgo de transmisión al receptor como por el de glomerulopatía en el donante. Desde 2013, se recomienda la determinación del ARN-VHC en el estudio del donante de riñón158. La aparición de los nuevos tratamientos antivíricos directos contra el VHC y su alta efectividad han permitido realizar un cambio de escenario. Por ejemplo, se están trasplantando riñones de donantes fallecidos positivos a receptores negativos que van a recibir seguimiento intensivo de su carga vírica o tratamiento antirretroviral directo y dan su consentimiento159,160. Esta situación podrá extenderse al TRDV con tratamiento previo del donante (SG).
Virus de la inmunodeficiencia humana (VIH)La detección del VIH humano o del HTLV se considera una contraindicación absoluta a la donación de vivo137. Existe, sin embargo, experiencia en Sudáfrica en el trasplante de donantes VIH + a receptores VIH + previo consentimiento informado y con buenos resultados161.
Citomegalovirus (CMV)Tanto donante como receptor deben estar testados serológicamente antes del trasplante para saber su grado de inmunidad ante el CMV. En los programas de donación de vivo, los estados serológicos frente al CMV no contraindican la donación ni son criterio habitual de selección del donante. Sin embargo, deben determinarse para saber si es necesario realizar profilaxis en caso de donante positivo a receptor negativo o en otras situaciones de exceso de inmunosupresión162. Algunas guías contemplan la necesidad de informar al donante y receptor del riesgo postrasplante en caso de donante positivo y receptor negativo137.
Virus de Epstein-Barr (EBV)El estado serológico de donante y receptor frente al EBV debe determinarse antes del trasplante. La presencia de anticuerpos contra el EBV en el donante traduce una infección previa que posiblemente se encuentra en fase latente y puede ser transmitida al receptor. No contraindica la donación, pero cuando el receptor es negativo tiene más riesgo de desarrollar una enfermedad por EBV que puede ir desde una viremia banal, un cuadro de mononucleosis infecciosa o una enfermedad linfoproliferativa postrasplante163. Esta situación se ve más en caso de receptores en edad pediátrica. Las Guías Británicas recomiendan informar de este riesgo cuando el donante es EBV + y el receptor EBV-137.
Otros herpes virusLa necesidad de cribado para herpesvirus 6 y 7 (HHV 6 y 7) (de penetración casi universal) y de herpesvirus 8 (HHV 8) (prevalencia muy variable según zonas) no está bien establecida. El HHV8 puede ser transmitido con el trasplante y se ha relacionado con un mayor riesgo de Sarcoma de Kaposi164,165.
Virus del Nilo OccidentalEs un virus que se ha extendido a determinadas regiones que no eran autóctonas para el mismo. Cabe valorar en donantes provenientes de regiones de riesgo la determinación mediante PCR ya que el estudio serológico es complejo166.
TuberculosisSe calcula que un 30% de la población mundial ha estado infectada por Mycobacterium tuberculosis. Es muy importante constatar en la historia clínica del donante el país de origen y los viajes realizados a países de riesgo137. La mayoría de los centros trasplantadores incluye al menos el PPD en el estudio de donante y receptor de trasplante. Otros solamente lo incluyen si existe una cierta prevalencia de tuberculosis en la población local. Si el PPD es positivo, es necesario descartar tuberculosis (TBC) activa (que sería una contraindicación) mediante la clínica, pruebas de imagen (radiografía o TAC de tórax, urografía iv) y microbiológicas (cultivo de micobacterias en esputo y orina o con un interferon-gamma release assay [IGRA])138,166. La TBC latente no es una contraindicación y se recomienda tratarla antes de la donación (nueve meses de isoniacida o tres meses de rifampicina). Debe considerarse profilaxis postrasplante en el receptor (SG).
SífilisInicialmente, realizamos una RPR a todos los donantes. La positividad por RPR debe completarse mediante pruebas treponémicas. La presencia de sífilis latente no contraindica la donación, pero el donante debe recibir tratamiento apropiado (tres dosis semanales de 2,4 millones de penicilina-benzatina im). Si se considera que existe un riesgo de transmisión al receptor, es preferible administrarle tratamiento profiláctico (2,5 MU de pencilina benzatina dosis única im o doxiciclina 100 mg/día vo durante 14 días o 1 g de azitromicina dosis única vo)167.
Enfermedades infecciosas emergentes. ParásitosLos donantes procedentes o que hayan residido en zonas endémicas para otras infecciones emergentes o con parasitosis endémicas deben ser investigados en ese sentido. Se recomienda el apoyo en consulta con el servicio de enfermedades infecciosas. A destacar, enfermedades como la malaria, la enfermedad de Chagas, la toxoplasmosis, la bilharziasis y la estrongiloidosis. Tras el estudio del donante, la donación puede ser planteada tras un tratamiento efectivo de la enfermedad137,138,168–170. Cuando exista el antecedente de viaje en los 28 días previos a zonas endémicas de virus Zika o de virus Ébola, la donación deberá ser diferida hasta un tiempo prudente que asegure que el donante no ha sido infectado9 (SG).
Infecciones urinariasEl urocultivo debe realizarse en todos los potenciales donantes. Es relativamente frecuente encontrar una bacteriuria asintomática en mujeres. Si el donante es un hombre con bacteriuria o hay antecedentes familiares de infecciones del tracto urinario, es recomendable realizar estudio radiológico (TAC, urografía, cistouretrografía miccional seriada) destinado a descartar lesiones corticales renales u otras anomalías de la vía urinaria y, en ocasiones, incluso una cistoscopia o estudio urodinámico137,138. Las infecciones urinarias bajas en la mujer, incluso recurrentes, no contraindican la donación, pero sí las pielonefritis repetidas. La orina debe ser estéril en el momento de la donación.
Enfermedades por prionesLa donación está contraindicada cuando existan antecedentes personales o familiares de enfermedad de Creutzfeldt-Jakob. No existe actualmente una prueba diagnóstica eficaz. La transmisión a partir de un órgano trasplantado es excepcional. En la de componente familiar puede requerirse el consejo genético. Los factores de riesgo son las transfusiones desde 1980, injertos de duramadre o tratamientos con hormona pituitaria o gonadotrofina137.
SARS-CoV-2La pandemia de 2020 hace imprescindible su cribado en el donante y receptor. Las pautas al respecto evolucionan constantemente, por lo que es aconsejable consultar las recomendaciones de la ONT en cada momento determinado. La transmisión de la enfermedad desde un donante fallecido es excepcional.
Enfermedades hematológicas del donante- •
Se recomienda un exhaustivo estudio del donante en caso de presentar anemia (A).
Muchos centros ya realizan los estudios de hipercoagulabilidad de forma sistemática a todos los donantes. A pesar de todo, se consideran obligatoriamente indicados solo si hay antecedentes trombóticos. El antecedente de tromboembolismo pulmonar o trombosis de venas profundas puede constituir una contraindicación para la donación (NG). En mujeres portadoras de factor V-Leiden estaría indicada la suspensión prequirúrgica de anticonceptivos o del tratamiento hormonal sustitutivo.
En cuanto a la anemia, es imprescindible un exhaustivo estudio antes de la donación137. Lo mismo ocurre cuando se detecta una hemoglobinopatía.
Sección 6. Valoración psicológica del donante vivo de riñónLa donación renal de vivo es un proceso complejo que engloba aspectos éticos, psicológicos, sociales y físicos. Se realiza con la expectativa de que el riesgo para el donante se vea compensado por los beneficios psicosociales (calidad de vida, bienestar social y psicológico, imagen corporal y auto concepto) y la mejora de la salud del receptor171.
Además, el estado de salud física y mental del donante, que debe de ser acreditado y certificado por un médico cualificado, es un requisito legal en España que permite la donación y el trasplante entre personas emocionalmente relacionadas y también entre desconocidos, siempre que se realice de forma altruista y desinteresada172. La ONT ha apostado decididamente por el impulso de la donación de vivo, para lo que se hace necesaria la actualización de los protocolos de estudio del donante vivo, incluyendo los relativos a la evaluación psicológica58,172.
De cara a la valoración psicológica del donante vivo de riñón, se plantea la realización de un protocolo unificado, al margen de la posible clasificación del donante para el mismo, combinando la realización de una entrevista personal y una evaluación psicométrica, facilitando el consentimiento informado y una correcta salud psicológica de los donantes 173,174.
Con relación a la donación renal altruista el protocolo de la ONT, indica que se realizará una evaluación que permita: «a) elaborar toda la complejidad y profundidad que implica la experiencia de la donación altruista; b) realizar una valoración de su salud mental, calidad de vida y situación psicosocial en que vive y c) comprender la motivación subyacente a la donación»58,172. En el caso del donante altruista o buen samaritano, hay que tener en cuenta que la motivación desempeña un papel importante y requerirá una valoración más exhaustiva.
La conveniencia de participación en las evaluaciones de profesionales con conocimientos y experiencia sobre trasplantes, así como la de realizar evaluación y seguimiento de donantes y pacientes trasplantados, apuntan la conveniencia de incluir la figura del psicólogo en los equipos de trasplante multidisciplinares, centrando su actividad en la atención de los pacientes trasplantados, en la evaluación y seguimiento de los donantes y también en el cuidado emocional de los integrantes de los equipos.
La valoración psicológica y social del donante vivo, garantiza un adecuado proceso al tener en cuenta todas las variables que pudieran influir, para favorecer la eficacia y éxito del trasplante, desde la perspectiva del donante.
Los componentes en la entrevista de evaluación psicológica en el donante vivo de riñón se resumen en tabla 8 y son los que se describen en el siguiente apartado.
Componentes de la entrevista de evaluación psicológica en donante vivo de riñón
| Explorar en el donante |
| Información que dispone acerca de la donación y el trasplante |
| Relación con el receptor |
| Comprensión de posibles riesgos y complicaciones del procedimiento |
| Comprobar que es competente y libre de tomar la decisión de forma voluntaria |
| Explorar posibles conductas de riesgo (tatuajes, promiscuidad sexual, adicciones…) |
| Motivación que le lleva a tomar la decisión |
| Expectativas post intervención |
| Entrevista sociodemográfica |
| Apoyo social y familiar |
| Estado de pareja e hijos |
| Nivel académico |
| Actividad laboral y situación económica |
| Antecedentes clínicos (intervenciones terapéuticas, enfermedades y trastornos psicológicos) |
| Creencias religiosas |
| Hábitos saludables |
| Consumo de tabaco, alcohol, drogas u otras sustancias |
| Valoración cognitiva |
| Comprobación capacidades cognitivas que confirmen madurez y capacidad volitiva |
| Valoración emocional |
| Valorar posible afectación emocional que pueda influir en el proceso: |
| - Desórdenes emocionales (ansiedad, depresión, etc.) |
| - Impulsividad |
| - Estresores habituales |
| - Explorar posible ideación suicida (previa o actual) |
| - Existencia o no de abuso sexual (previo o mantenido) |
| Valoración de estrategias de afrontamiento |
| Comprobar estrategias de afrontamiento del donante, si son o no adaptativas y pueden ayudarle en la post-intervención ante posibles complicaciones |
- •
Se sugiere que la evaluación psicológica debe basarse en una entrevista clínica y una valoración psicométrica (calidad de la evidencia: C).
- •
Se sugiere que la evaluación psicológica se realice por psicólogos o por psiquiatras con experiencia clínica, y que estos no participen en el cuidado del receptor (SG).
- •
Se sugiere unificar los contenidos del protocolo de evaluación psicológica independientemente del tipo de donante (SG).
- •
Se sugiere la incorporación de psicólogos a los equipos de trasplante multidisciplinares (SG).
La evaluación psicológica debe incluir la salud mental, además de la comprensión de los riesgos y circunstancias de la donación, el análisis de la relación donante potencial-paciente, la motivación para donar, la decisión de donar y las estrategias de afrontamiento ante la cirugía y posibles complicaciones, entre otras174–178. Existe una gran variedad de métodos y criterios para la evaluación psicológica; en algunos casos, se utilizan criterios formales y, en otros, entrevistas clínicas semiestructuradas173,179,180. Por ello, se sugiere la realización de una entrevista y una valoración psicométrica, que permita disponer de datos suficientes para proceder a la emisión del informe final. La evaluación psicosocial, debería ser efectuada por psicólogos o psiquiatras con experiencia clínica que tengan una cualificación adecuada con conocimientos en salud mental y que no participen en el cuidado del receptor, para reducir conflictos de intereses en la evaluación del candidato a donante. La evaluación psicosocial, debe hacerse en ausencia del receptor, familiares u otras personas que puedan influir en la decisión del donante, independientemente del tipo de relación con el receptor.
Criterios de selección y aceptación donante vivo- •
Se recomienda contraindicar la donación de vivo ante trastornos clínicos o de personalidad graves o en fase aguda, situaciones de estrés, vulnerabilidad o indefensión personal y graves trastornos adictivos (B).
- •
Se recomienda contraindicar la donación en el donante altruista o buen samaritano ante la predisposición exagerada o notable a despertar la admiración de los demás o ser el centro de atención (B).
En general, las principales contraindicaciones psicosociales para la donación en vivo incluirían los problemas psiquiátricos graves o de uso de sustancias, la presencia de estresores financieros importantes que podrían tener un efecto coercitivo en la decisión del donante de donar o empeorar significativamente como resultado de la donación y cualquier complicación médica, evidencia de que el posible donante ha experimentado una presión o coerción indebida de otros para hacerlo, una comprensión o capacidad limitada para comprender los riesgos y beneficios propios del donante o del candidato al trasplante de la donación de riñón y ambivalencia acerca de proceder con la donación172,181.
En el caso del donante altruista, hay que tener en cuenta, además, las siguientes contraindicaciones: a) una visión no realista de que el trasplante está libre de rechazo y fallos; b) la confusión del donante de que si el trasplante falla es porque el personal falla, no el donante; c) compensación monetaria; d) deseo de atención por los medios de comunicación; e) remedio para un problema psicológico u otra enfermedad subyacente; f) deseo del donante por sexo, raza o etnia y g) deseo de conocer al receptor e involucrarse en su vida182.
La entrevista psicológica- •
Se sugiere que la entrevista incluya motivación y expectativas posdonación, aspectos sociodemográficos, antecedentes, valoración cognitiva, valoración emocional y estrategias de afrontamiento, resiliencia y apoyo emocional disponible (SG).
- •
Se recomienda una valoración más exhaustiva del donante altruista o buen samaritano, valorando la motivación como el criterio más importante (B).
En la entrevista psicológica con el posible donante, se deben tener en cuenta todas las áreas que pudieran comprometer de algún modo la intervención, no solo la médica, sino también la social, económico-laboral, emocional, cognitiva y familiar. Debe asegurarse que el donante es conocedor de los posibles daños que pudieran derivarse de la donación174,175. Al inicio de la entrevista, es conveniente averiguar la información de que dispone el donante sobre la donación y si se considera que esta es deficitaria, proporcionar información adicional sobre el procedimiento, posibles riesgos, beneficios, resultados, evolución, etc. Se debe valorar que la donación sea desinteresada y que no busque beneficio económico, publicidad o algún tipo de promoción personal en todos los casos, y especialmente en el donante altruista. Debe quedar claro que la donación es anónima y no se podrán facilitar datos del receptor172. La entrevista debe incluir una lista sobre historia de salud mental, abuso de drogas, que sea capaz de entender los riesgos, apoyo social, motivación y voluntariedad, relación donante receptor, etc.183. En la primera fase de la entrevista, se explorarán factores relativos a la información de que dispone el donante en cuanto al procedimiento, riesgos y posibles complicaciones. Con relación a las expectativas posintervención, hay que explorar si el donante ha valorado la posibilidad de que en un futuro se pudieran presentar en él mismo complicaciones renales susceptibles de comprometer su propia salud a causa de necesitar el órgano donado. Todo lo anterior nos dará información sobre la motivación que le lleva a la donación, que en el caso del donante altruista es de especial importancia.
Posteriormente, se incluirán en la entrevista todos aquellos datos sociodemográficos necesarios en cualquier valoración psicológica y, especialmente, aquellos específicos y necesarios en estos donantes, como son hábitos saludables y posibles consumos de sustancias.
En la valoración cognitiva se evaluará el aspecto intelectivo en cuanto a su propia capacidad y madurez para comprender el significado y posibles consecuencias de sus acciones. Se trata de extremar las precauciones a fin de garantizar que el proceso de emisión del consentimiento sea realmente libre, sin que haya coacciones familiares, profesionales o económicas184.
Respecto a la valoración emocional, se explorará la posible existencia de desórdenes emocionales que estén afectando a su decisión libre de donar, como pueden ser trastornos de ansiedad, depresión o del control de los impulsos, etc. Esta evaluación se confirmará con la valoración psicométrica. Asimismo se tendrá en cuenta si es una decisión madurada, fruto de una adecuada reflexión o, por el contrario, mediada por un acto irreflexivo que pueda ser consecuencia de una acción impulsiva en un momento puntual. Por último, se tendrán en cuenta las estrategias de afrontamiento habituales del donante ya que pueden ser predictoras de un buen ajuste posintervención. En este sentido, se explorará la capacidad del donante en cuanto a resolución práctica de problemas, su capacidad de regulación emocional y cómo gestiona las situaciones estresantes, teniendo en cuenta que la donación de un órgano es una situación vital estresante en sí misma. Pueden considerarse estrategias de afrontamiento adaptativas el afrontamiento activo, la planificación, la contención de la impulsividad, la reinterpretación positiva y la búsqueda de apoyo social. Por el contrario, la negación, evitar centrarse en las propias emociones negativas y las conductas adictivas, se considerarían estrategias desadaptativas y por tanto, predictoras de un peor ajuste posintervención185.
Valoración psicométrica- •
Se sugiere la realización de una evaluación psicométrica que se base en la utilización de una prueba objetiva que permita valorar aspectos clínicos y de personalidad (C).
- •
Se sugiere la utilización del cuestionario MCMI (actualmente en su versión IV) de Millon para proceder a la evaluación psicométrica (SG).
- •
Se sugiere que el evaluador esté familiarizado y tenga experiencia suficiente en el manejo de la prueba (SG).
Al margen de los resultados de la entrevista, siempre es aconsejable no realizar diagnósticos ni tomar decisiones de trascendencia para los pacientes sin apoyarse en datos objetivos que complementen el juicio clínico o la impresión diagnóstica186.
Para ello, proponemos la utilización del Cuestionario MCMI de Millon, tanto por la posibilidad de identificar la presencia de síndromes clínicos graves, como patrones clínicos de la personalidad y patología grave de la misma, facilitando una información y una nomenclatura que se ajusta más a los criterios diagnósticos de la clasificación internacional de enfermedades (CIE) y el Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM), a la que está más habituada el personal sanitario en general187,188. Este cuestionario, ofrece una visión dimensional del contínuo normalidad-anormalidad en psicopatología que lo hace especialmente interesante en la evaluación de un colectivo (el de donantes potenciales) al que, en principio, no se le supone psicopatología alguna189–190 y ha sido utilizado en la valoración de donantes vivos de riñón191,192.
Seguimiento del donante- •
Se sugiere seguimiento del donante vivo desde el punto de vista psicológico, mediante entrevistas especialmente en aquellos en que se detecte la presencia de rasgos de personalidad patológica (SG).
- •
Se sugiere el seguimiento psicológico de los receptores para mejorar supervivencia de órgano y paciente (SG).
De igual manera que se recomienda el seguimiento de los donantes vivos a corto, medio y largo plazo para prevenir o tratar los factores de riesgo que pudieran comprometer su salud en general y en especial su función renal193, también debería de protocolizarse el seguimiento psicológico del receptor ante posibles complicaciones que a nivel psicológico pudieran producirse tras el trasplante. En este sentido, se han evaluado elevados niveles de ansiedad y depresión en el postrasplante inmediato194.
Siguiendo el Protocolo de Donación Renal Altruista de la ONT, sería conveniente que los candidatos aceptados para la donación recibieran desde el inicio de su inclusión en el programa, una adecuada asistencia psicológica que facilite la expresión y gestión emocional de la posible ansiedad y sufrimiento generado en el proceso de donación, con el fin de evitar futuras complicaciones emocionales, previniendo así el desarrollo de trastornos psicológicos desencadenados tras la donación172. Identificar los donantes que potencialmente puedan tener mayor nivel de problemas psicológicos postrasplante puede contribuir a limitar el seguimiento a esos casos192, reduciendo la probabilidad de aparición de complicaciones posteriores195.
Sección 7. Donante vivo de riñón con alteraciones límite: criterios de aceptación y descarteLa experiencia acumulada en miles de donantes a lo largo de las últimas décadas permite evaluar los resultados y prácticas de la donación que se han realizado hasta el momento, estableciendo unas bases sólidas sobre los criterios de aceptación de un donante vivo renal que se relacionan con un resultado favorable posdonación. Sin embargo, cuando tratamos de alcanzar los límites a la donación, nos enfrentamos a experiencias mucho más reducidas, y resultados con mayor variabilidad, lo que obligará a que dichos límites sean, de forma intrínseca, un campo de incertidumbre e investigación, en el que la aparición de nuevos datos puede empujar dicho límite en un sentido u otro.
En la donación, como en casi todos los fenómenos biológicos, el riesgo asociado a una determinada variable no seguirá un patrón discontinuo, sino más bien lo contrario, un patrón continuo de riesgo que suele obligar a una decisión arbitraria para colocar un determinado límite, que será más una zona de transición que una línea nítida.
Limites a la donación según el FG del donante- •
Cualquier donante debe asegurar como mínimo los umbrales de FG ajustados para categorías de edad y sexo (tabla 7). Dichos umbrales son válidos bajo condiciones adecuadas de compensación y preservación de la función renal post donación (calidad de la evidencia: B).
- •
Se recomienda un FG ≥ 90.mL/min/1,73 m2 en donantes <.30 años; y un FG ≥ 80.mL/min/1,73 m2 en donantes de 30 a 45 años. En ambos casos debe confirmarse la ausencia de factores de riesgo adicionales (C).
- •
No se recomienda la utilización de la calculadora de riesgo de Grams et al.125 en candidatos jóvenes debido a que puede conllevar una importante infraestimación del riesgo de ERC terminal (ERCT) (B).
- •
En donantes.> 45 años con FG superior a los mínimos exigidos, pero con otros factores de riesgo, se recomienda estimar el riesgo de ERCT mediante la calculadora de riesgo de Grams et al.125 (C).
- •
Se sugiere no aceptar donantes con FG <.70.mL/min/1,73 m2, excepto en donantes de edades avanzadas y una evaluación rigurosa (C).
Actualmente, se acepta que el FG es el mejor indicador de la función renal, tanto en individuos sanos como en pacientes afectos de ERC. Pese a ello, no existe un claro consenso sobre cuál debe ser el FG de un determinado individuo y cómo debe ajustarse el FG a los cambios que acontecen con la edad. Gran parte de la literatura hasta el momento acepta que el FG medio de un varón joven caucásico es de 125.mL/min/1,73 m2196,197. Sin embargo, los estudios más recientes, basados en gran parte en poblaciones de donantes sanos, muestran cifras inferiores de FG para el mismo individuo medio, en torno a 107.mL/min/1,73 m2198–200 (fig. 5). Del mismo modo, tenemos evidencias de que el FG disminuye de forma fisiológica a partir de cierta edad, aunque el ritmo de descenso y su causa es también materia de intenso debate201–203. El estudio de potenciales donantes sanos ha demostrado que existe una pérdida constante de FG a partir de los 40-45 años, que es aproximadamente de 0,9.mL/min/1,73 m2 por año198,199. Estos datos, procedentes de estudios tanto de población general como de candidatos a la donación, han servido incluso para generar una nueva propuesta para la estimación del FG y de sus intervalos de normalidad como alternativa al estadiaje actual de la ERC propuesto por las guías KDIGO, de modo que la clasificación de la ERC y su estadiaje, basados en umbrales de FG, utilice límites ajustados a la edad del individuo204.
Valores predonación del filtrado glomerular (mL/min/1.73m2) medido (Reino Unido, UK)215 o estimado (España, Estados Unidos, US)200,237 por grupos de edad. Los valores en la población de Reino Unido corresponden a la media de los valores publicados para hombres y mujeres. Los valores mostrados en la población de donantes de Estados Unidos (US) corresponden a los valores representativos para dicha población por grupos de edad. Los valores en población española corresponden a la media en donantes del Registro Español de Trasplante Renal con Donante Vivo 2010-2017.
Estas consideraciones tienen trascendencia en la evaluación de un candidato a la donación y, de hecho, en consonancia con ellas, actualmente coexisten dos diferentes aproximaciones para la evaluación del FG aceptable o límite para la donación. El primero, propuesto por las KDIGO, es consecuente con el concepto de clasificación de la ERC en intervalos de FG independientes de la edad del individuo, y establece para la idoneidad de un donante un FG ≥ 90.mL/min/1,73 m29. El segundo, propuesto por las Guías de la Sociedad Británica de Trasplante (British Transplantation Society, BTS), acepta el concepto de que existe una reducción fisiológica del FG con el envejecimiento y propone umbrales de FG aceptables para la donación basados en los rangos de normalidad definidos para cada intervalo de edad del donante (fig. 6)2. La utilización de una u otra aproximación tiene importantes consecuencias en la clasificación de los candidatos como aptos o no aptos para la donación205.
Gráfico y tabla de valores de filtrado glomerular estimado (FGe) mínimos para aceptar la donación según la edad del candidato para hombres (-•-), mujeres (- -), y ambos sexos (-•-) propuestos por las últimas Guías de la Sociedad Británica de Trasplante2, y su comparación con el umbral límite por grupos de edad propuestos para la definición de enfermedad renal crónica por Delayane et al.203.
En ambos casos se pretende que, tras la donación, el FG resultante no comprometa el pronóstico del donante a lo largo de su esperanza de vida, y mantenga el estado de salud del donante con un nulo o mínimo impacto a largo plazo. Para ello, es necesario conocer el FG esperado en el donante tras la donación, y el umbral de FG a partir del cual se detecta un exceso de morbimortalidad.
Reducción del FG tras la donación renalEl donante pierde aproximadamente el 50% de su masa renal en la donación, pérdida que, en condiciones óptimas, es seguida de un periodo de compensación que consigue que el FG a los 12 meses de la donación alcance aproximadamente el 70% del FG basal (60-75%)206,207. En un análisis reciente con más de 21.000 donantes del registro americano, el FGe a los dos años de la donación fue del 68,7% respecto al FGe predonación, equivalente a un descenso absoluto de 31,2.mL/min/1,73 m2208.
Consecuentemente, dependiendo del FG aceptado predonación, un porcentaje importante de donantes con un FG normal predonación podrían alcanzar FG <.60.mL/min/1,73 m2 posdonación y, por tanto, bajo la actual clasificación de las KDIGO, ser considerados dentro de la categoría de ERC. Pese a que existen serias discrepancias respecto a la trascendencia en los donantes de un FG reducido, diversos estudios han encontrado en el seguimiento de los donantes un incremento de la prevalencia de diversas complicaciones asociadas a la ERC, incluyendo HTA, preeclampsia, hiperuricemia, gota e hiperparatiroidismo122,123,209,210. Más importante aún, varios estudios recientes han demostrado pequeños incrementos en el riesgo a largo plazo de ERC terminal (ERCT) en los donantes35,37.
Respecto a la reducción esperada del FG que acontece con el envejecimiento, largas series de donantes confirman que, en condiciones adecuadas de selección, la pérdida de FG con la edad es incluso inferior en los donantes a la observada en población general sana.
En el seguimiento de los donantes se describe un periodo prolongado de estabilización del FG posdonación, o incluso de compensación positiva, que puede prolongarse durante años211. Este proceso de compensación parece limitado por diversos factores de riesgo como la edad, el sexo masculino o la obesidad212. Varios estudios muestran una menor compensación de FG en donantes añosos en las fases más precoces y también a largo plazo213,214. Esto puede estar relacionado con una diferente capacidad y velocidad en los mecanismos de compensación asociados al envejecimiento. De forma similar, aunque por mecanismos menos obvios, también ha sido descrita una menor velocidad y capacidad de compensación del FG en los donantes que guardan una relación de parentesco con el receptor211,213.
La determinación de la reserva funcional renal predonación no ha demostrado hasta el momento un valor añadido en la predicción del FG posdonación, y por tanto, es una determinación de aplicación limitada al campo de la investigación215.
El FG alcanzado en el receptorEl FG predonación está estrechamente relacionado con FG obtenido en el receptor y es esencial para una adecuada supervivencia del injerto. El FG es de hecho la característica más importante en la predicción de la función renal de receptores de TR de donante vivo216. Además, el desarrollo de ERCT en el donante es un factor de riesgo independiente del FG predonación de pérdida del injerto censurada por muerte en el receptor217. Un estudio sobre 275 receptores de riñones cuyos donantes desarrollaron ERCT, demostró que tenían un aumento de las tasas de pérdida del injerto censurada y de mortalidad respecto a un grupo control de receptores de TRDV, ajustado para todos los factores de confusión relevantes en donante, receptor y trasplante, e independientemente de cual fuese la relación donante receptor218. Este trabajo pone en evidencia la posible existencia de enfermedad renal subclínica predonación, o bien la existencia de factores de predisposición a la ERC que no son detectados en el examen rutinario de evaluación de un donante. Análisis detallados sobre biopsias preimplante en injerto de donante vivo podrían arrojar luz sobre esta cuestión. Una revisión de casi 3.000 parejas de donante y receptor ha demostrado que la presencia de lesiones subclínicas en la biopsia preimplante se asocia, de forma independiente a las variables clínicas de donante y receptor, con la supervivencia del injerto censurada por muerte del paciente219. Otros componentes de la función renal en el donante, además del FG, se han correlacionado con el FG en el receptor220.
El FG final en el receptor será el resultado de variables asociadas al donante y también al emparejamiento donante-receptor. Se han hecho diversos intentos de aunar todas esas variables para desarrollar modelos predictivos, bien de la función renal o de la supervivencia del injerto procedente de un donante vivo221,222. Aún con limitaciones, estos modelos proporcionan una puntuación individualizada para cada donante que es importante como ayuda en la toma de decisiones e incluso para la selección entre diferentes donantes.
Individualización del riesgo de ERC para el donanteLa preocupación respecto a las consecuencias a largo plazo de la donación ha reforzado la idea de centrar la evaluación del donante sobre el riesgo futuro de ERC avanzada. Las recomendaciones KDIGO incluyen la estimación individual del riesgo futuro de ERCT tras la donación como el eje central de un nuevo marco de evaluación del donante9. Este enfoque es diferente al abordaje previo, en el que la donación se acepta o no en función de si el donante cumple con una serie preestablecida de condiciones de salud o función renal, y no de un intento de cuantificación de su riesgo global.
En primer lugar, debe estimarse el riesgo de ERCT en ausencia de donación, ajustado a las características demográficas y clínicas del candidato, incluyendo el FG. Se ha desarrollado una calculadora que permite la estimación del riesgo de ERCT y diálisis a 15 años y a lo largo de la esperanza de vida de un individuo (http://www.transplantmodels.com/esrdrisk/). Dicha calculadora está construida sobre un metaanálisis de varias cohortes de individuos de población general en EE. UU., entre las cuales se seleccionaron casi 5 millones de individuos con bajo perfil de riesgo de ERC, según variables clínicas y analíticas. Se consideraron múltiples variables, siendo finalmente 10 las que resultaron predictivas de dicho riesgo y fueron incluidas en la calculadora125 (tabla 9).
Variables asociadas con el riesgo futuro de ERCT y Hazard Ratio correspondientes237
| Característica | Hazard ratio (IC 95%) |
|---|---|
| Raza (raza negra vs. caucásica) | ND |
| Sexo | ND |
| Edad | ND |
| FGe CKD-EPI <60 mL/min/1.73m2 60-89 mL/min/1.73m2 90-119 mL/min/1.73m2> 120 mL/min/1.73m2 | 6,61 (4,87 – 8,96) 1,63 (1,53 – 1,74) 1,02 (0,85 – 1,23) 0,79 (0,56 – 1,10) |
| Presión arterial sistólica Por incrementos de 20mmHg por encima de 120 mmHg | 1,42 (1,27 – 1,58) |
| Tratamiento antihipertensivo (Sí vs. No) | 1,35 (1,01 – 1,82) |
| DM no dependiente de insulina (Sí vs. No) | 3,01 (1,91 – 4,74) |
| IMC Por incrementos de 5 puntos por encima de> 30 kg/m2 | 1,16 (1,04 – 1,29) |
| Tabaquismo Exfumador Fumador activo | 1,45 (1,23 – 1,71) 1,76 (1,29 – 2,41) |
| Cociente albúmina/Cr en orina (mg/g) Por incrementos de 10 veces desde niveles de 4 mg/g | 2,94 (0,99 – 8,75) |
Cr: creatinina; DM: diabetes mellitus; Fge: filtrado glomerular estimado; IC: intervalo de confianza; IMC: índice de masa corporal; ND: no disponible.
El segundo paso consiste en la estimación del riesgo de ERCT que es atribuible a la donación, y que será añadido al riesgo basal del donante. Este riesgo no está bien definido, y podemos encontrar un rango muy amplio para las estimaciones de este riesgo35,37,125. Las KDIGO sugieren calcular el riesgo final de ERCT tras la donación mediante la multiplicación del riesgo basal por un factor de 3,5 a 5,3, dependiendo del sexo y raza del donante125. Este factor multiplicador es el cociente entre el riesgo esperado de ERCT a 15 años en la población general analizada por Grams et al. estratificada por raza y sexo, y el riesgo observado a 15 años en la serie de más de 96.000 donantes del registro americano35,125.
Hay varias limitaciones en este proceso. En primer lugar, diversas variables quedan fuera de la estimación del riesgo futuro de ERCT en un individuo. Es especialmente importante la ausencia del factor de riesgo que supone la relación existente entre donante y receptor, ya que la carga genética puede tener un peso específico muy relevante en el riesgo global de ERCT del candidato2,37,223,224. En segundo lugar, hemos de tener en cuenta que la atribución del riesgo basal a cada perfil de donante está fuertemente sesgada por el tiempo de seguimiento de las cohortes de población general incluidas en metaanálisis de Grams et al. (tiempo medio de seguimiento de cuatro a16 años), y sobre el que se construyó la calculadora de riesgo125. Por tanto, la incertidumbre en la estimación del riesgo basal de ERCT a largo plazo aumenta de forma considerable en donantes jóvenes, o lo que es lo mismo, el valor predictivo de una evaluación normal en el momento de la donación disminuye a medida que el donante es más joven, y tiene una esperanza de vida más prolongada225.
También afrontamos importantes incertidumbres en cuanto al cálculo de la fracción de riesgo que es atribuible a la donación. De los diferentes estudios disponibles, se desprenden cifras ligeramente dispares, desde un exceso de 27 a 41 casos de ERCT a 15 años por cada 10.000 donantes35,37. No tenemos, además, datos suficientes para conocer con precisión como se modificará la fracción de riesgo atribuible en función de las características demográficas y clínicas del candidato. Por último, hemos de considerar que el riesgo futuro de ERCT no parece lineal en el tiempo, sino que parece aumentar de forma exponencial más allá de los 10 años posdonación223.
Como resultado de estas limitaciones, diversas publicaciones han puesto en entredicho el proceso propuesto por las KDIGO de estimación del riesgo individual en un determinado donante47,226–228. Por todo ello, es obvio que la herramienta de cálculo de riesgo propuesta debe ser usada solo bajo la premisa de una clara comprensión de las limitaciones inherentes a ella, y de que puede generar importantes infraestimaciones del riesgo a largo plazo. Este modelo de evaluación del donante debe ser usado como un instrumento más, en un proceso que requiere una visión clínica global y multidisciplinar y que debe tener en cuenta múltiples factores además de las estimaciones cuantitativas de riesgo.
El grupo de Massie et al. publicó recientemente una calculadora de estimación del riesgo de ERCT en donantes229. Esta herramienta, también disponible en internet (http://www.transplantmodels.com/donesrd/), incluye un número inferior de variables que la publicada por Grams et al. No incluye, por ejemplo, algunos factores de riesgo muy relevantes como la albuminuria o la HTA y, sin embargo, sí incluye la historia familiar de ERC, ausente en la calculadora de Grams. En todo caso, cualquiera de estas herramientas de estimación de riesgo requeriría de una validación externa, de la que carecemos en la actualidad.
Análisis de las recomendaciones en las principales Guías ClínicasLas guías KDIGO recomiendan que el estándar del FG para un candidato a la donación debe ser ≥ 90.mL/min/1,73 m2, mientras que un FG <.60.mL/min/1,73 m2 debe excluir la donación9. Estos límites difieren de los previamente aceptados, que situaban el límite optimo en un FG ≥80.mL/min/1,73 m2, y no han sido graduados según las recomendaciones de medicina basada en la evidencia, ya que su razonamiento se basa en estudios no realizados en donantes. Estudios a largo plazo sobre grandes series de donantes, con una edad media de 40-50 años y un FG medido ≥ 80.mL/min/1,73 m2, han demostrado que el incremento de riesgo de ERCT es muy pequeño en términos absolutos en estas poblaciones35,37.
Aunque la elección de este nuevo estándar puede ser acertada en la evaluación de los donantes más jóvenes, la significación de estos nuevos límites en donantes de edad avanzada es incierta, dada la ya mencionada relación que existe entre el envejecimiento y la disminución del FG normal201,202,204.
Para FG entre los 60 y 90.mL/min/1,73 m2 las KDIGO recomiendan una evaluación de riesgo de ERCT a largo plazo basada en las características demográficas y de salud de cada candidato, y para ello, proporcionan una calculadora de estimación del riesgo, disponible en internet (http://www.transplantmodels.com/esrdrisk/). Gracias a la aplicación de esta herramienta, un amplio rango de cifras de FG puede considerarse válido para la donación dependiendo de la edad y de otras características del donante. Sin embargo, dada la relevancia del FG basal en determinar los resultados y el futuro del donante, estas Guías Clínicas adolecen de una orientación específica sobre los límites de FG aceptables en cada caso.
Las guías BTS, publicadas poco después de las KDIGO, aceptan como válidas los dos principios cuestionados por las KDIGO: 1) utilizando datos de FG medido en potenciales donantes británicos230,231, establece un FG de referencia para el varón adulto joven por debajo del estándar histórico de 120.mL/min/1,73 m2; y 2) tiene en cuenta la reducción fisiológica del FG con el envejecimiento, lo que conlleva diferentes rangos de normalidad del FG para cada intervalo de edad del donante2. Con estos principios construyen umbrales de FG mínimo con los que se puede acceder a la donación, con el objetivo de que la función renal del donante permanezca dentro de los límites de la normalidad durante la esperanza de vida del donante.
La interpretación de las guías BTS merecen algunas precisiones:
- 1)
Los umbrales para cada intervalo de edad, y diferenciados por sexo, predicen que el FG se mantendrá dentro de los límites de la normalidad a lo largo del envejecimiento del donante, siempre que se asuma una pendiente de pérdida de FG «idónea». Los datos existentes sobre la evolución del FG posdonación vienen a mostrar una reducción del FG que no es superior a la pérdida fisiológica en población sana, y podría ser incluso inferior, pero hemos de recordar que estos datos han sido obtenidos en series de donantes esencialmente caucásicos, con una edad media en torno a los 45 años, no hipertensos, no diabéticos y normoalbuminúricos33,211,232,233.
En el caso de los donantes de 30 a 50 años en mujeres y de 30 a 55 años en hombres, el umbral mínimo se sitúa en 80.mL/min/1,73 m2, y en los donantes de menos de 30 años el límite se sitúa en 90.mL/min/1,73 m2, igualando en este último caso el mínimo recomendado por las KDIGO. Es necesario tener en cuenta que, aceptando estos umbrales, el FG posdonación en donantes de 30 a 45 años puede caer incluso por debajo del intervalo de la normalidad. No existe en las guías BTS una clara justificación para esta decisión, que implícitamente asume que la experiencia acumulada en las últimas décadas de aceptación de donantes con FG.>80.mL/min/1,73 m2, se ha seguido de incrementos muy pequeños del riesgo absoluto de ERCT a largo plazo35,37.
- 2)
El grado de compensación de la función renal por el riñón remanente seleccionado por las BTS es un 75% de la función renal basal, cifra en el rango más alto de los observados206,207,231. Por ello, las estimaciones del FG posdonación y su evolución a largo plazo, quizá no sean extrapolables a perfiles de donantes que presenten comorbilidades o edades muy avanzadas.
- 3)
Igual que las KDIGO, las BTS reconocen la posibilidad de la donación con cifras de FG basal entre 60 y 70.mL/min/1,73 m2, y en el caso de las BTS, incluso con cifras inferiores a 60.mL/min/1,73 m2. En ambos casos, umbrales de FG tan alejados del estándar de FG aconsejado y de la experiencia previa publicada, tienen una escasa evidencia para su justificación, y su aceptación debe limitarse a casos excepcionales y centros con experiencia.
- •
Se sugiere limitar la donación de personas jóvenes, especialmente por debajo de los 30 años, a candidatos con un FG al menos en la media de su grupo de edad, sin factores de riesgo añadidos y con una evaluación de salud estrictamente normal (C).
- •
Se recomienda no contraindicar la donación por edad avanzada por sí sola, aunque estos candidatos están sometidos a mayores riesgos perioperatorios (A).
- •
Se sugiere que la HTA, uno de los factores de riesgo de ERC, podría tener un menor impacto en donantes de edad avanzada, debido a la menor expectativa de vida en estos donantes (C).
- •
Se recomienda informar a la pareja donante-receptor que, en los donantes de edad avanzada, especialmente por encima de los 60 años, la función renal alcanzada en el receptor y probablemente la supervivencia a largo plazo del injerto pueden verse reducidas (B).
Durante las últimas décadas ha crecido la utilización de donantes de edad avanzada, constituyendo en la actualidad los mayores de 50 años una proporción superior al 30% de los TRDV234. Esta tendencia refleja el cambio acontecido en los últimos años en la percepción del riesgo de ERCT a largo plazo que afrontan los donantes, y que afecta de forma más sensible a los candidatos más jóvenes.
Actualmente, reconocemos un riesgo incrementado de ERCT en todos los donantes, pequeño en términos absolutos, que se demuestra a muy largo plazo tras la donación (una o varias décadas), y que parece crecer exponencialmente cuanto más tiempo transcurre tras la donación223,229,235. El análisis de los donantes que han alcanzado una fase de ERCT nos muestra que la mayor parte de estos pacientes tardaron más de 10-15 años en alcanzar dicho punto y realizaron la donación en edades jóvenes, de modo que la juventud en el momento de la donación se constituye como un factor de riesgo de primer orden para alcanzar estadios de ERCT en los donantes235–238. Solo el 2% de los donantes del registro americano de la UNOS tiene una edad inferior a los 35 años223
En pacientes jóvenes el tiempo de exposición al riesgo de nuevas enfermedades, como HTA y DM, que pueden afectar al riesgo futuro de ERC, es muy prolongado y su aparición es difícil de prever, ya que en la mayoría de los casos estas patologías debutan más allá de los 45 años223. Sabemos, además, que la HTA y/o la DM constituyen la causa de prácticamente el 50% de los casos de ERCT en los donantes, situación a la que se llega tras varias décadas después de la donación238. Todo ello hace que la capacidad predictiva de una evaluación normal del candidato joven en el momento de la donación esté mermada y puede conducir a infraestimaciones del riesgo225. Por otro lado, la evidencia disponible para juzgar la evolución de los donantes jóvenes es inferior a la que existe en los donantes de edades intermedias223.
Todas estas evidencias son aplicables de forma inversa a los donantes de edad avanzada. Estos se ven expuestos a un mayor riesgo durante la nefrectomía y el periodo inmediato posdonación, sin embargo, a largo plazo, los donantes de mayor edad con factores de riesgo de ERC, como HTA y DM, tienen una menor probabilidad de verse expuestos durante el intervalo de tiempo suficiente para que estos factores conduzcan a una situación de ERCT239. A pesar de esto, la edad puede ser un claro factor limitante para la donación. Tal y como se analiza con detalle en otras secciones de estas recomendaciones, la edad avanzada es un factor de riesgo de complicación quirúrgica en la donación, de reingreso y de desarrollo de HTA tras la donación240,241. Por todo ello, el donante de edad superior a los 50 años debe ser sometido una evaluación cardiorrespiratoria exhaustiva242.
La edad es un factor de riesgo independiente de ERCT en los donantes, con la excepción de los de raza negra37,224,229. Este hecho podría deberse al mayor riesgo de desarrollo de HTA y DM tras la donación en la población de raza negra, por lo que una mayor expectativa de vida en los donantes de edad joven e intermedia incrementaría el riesgo de ERCT a largo plazo224.
Alteraciones urinarias menores y su impacto en la donaciónEl término de alteraciones urinarias «menores» no hace justicia a la relevancia que dichas alteraciones pueden tener sobre el pronóstico renal de un individuo, por lo que el término «menor» solo es aplicable en la medida en que nos referiremos a las alteraciones urinarias de menor grado, próximas a la normalidad.
Proteinuria y albuminuria- •
Se recomienda que la proteinuria del donante sea evaluada mediante la excreción de albúmina en orina y no únicamente con la eliminación urinaria de proteína total. Pese a ello, ambas determinaciones son necesarias en la valoración de un candidato (A).
- •
Se recomienda incluir la cuantía de albuminuria en la estimación de riesgo futuro de enfermedad cardiovascular y de ERCT en el donante (http://www.transplantmodels.com/esrdrisk/) (B).
- •
Una albuminuria inferior a 30.mg/día permite la donación sin restricciones (B).
- •
Valores de albuminuria entre 30 y 100.mg/día son una contraindicación relativa a la donación. La aceptación de un donante en este rango de albuminuria puede ser contemplada en candidatos de edad avanzada y en ausencia de otros riesgos añadidos (D).
- •
Se sugiere que una albuminuria entre 100 y 300.mg/día puede ser aceptada en casos excepcioonales, y en ausencia de otras comorbilidades adicionales. (D).
El incremento de la excreción urinaria de proteínas es un potente marcador de enfermedad renal y, en ocasiones, un marcador más precoz que el descenso del FG. La albuminuria señala un incremento de la permeabilidad glomerular, mientras que la eliminación de proteínas de bajo peso molecular refleja una reducción de la reabsorción tubular. Aunque ambas se pueden asociar a formas distintas de enfermedad renal, la determinación de albuminuria es un mejor marcador en la evaluación de la enfermedad renal. Todos los aspectos metodológicos referentes a la determinación de la proteinuria o albuminuria son recogidos en la sección 5.
La albuminuria por encima de los niveles de referencia de la normalidad se asocia en población general, de forma independiente al FG, con un mayor riesgo de ERC, enfermedad cardiovascular y mortalidad243–260. Por otra parte, la albuminuria predice la progresión de la ERC y los eventos cardiovasculares en pacientes con ERC, enfermedad cardiovascular o diabetes. Pese a que de forma habitual una albuminuria de 30.mg/día se considera como el límite de la normalidad, rangos por encima de 5.mg/día muestran ya un aumento de riesgo, proporcional al incremento de la albuminuria217,247. En un metaanálisis de casi 5 millones de individuos, de los EE. UU., seleccionados por su bajo riesgo de ERC y con un seguimiento medio de cuatro a 16 años, por cada elevación de 10 veces de la albuminuria, se detecta un incremento de tres veces el riesgo de ERCT. Aunque este hallazgo no alcanzó la significación estadística, la proyección a 15 años de la incidencia de ERCT, demostró que el aumento de la albuminuria se asoció a un mayor riesgo en todos los grupos de edad y sexo125. La proteinuria ortostática es una excepción, puesto que su pronóstico es benigno y no debe ser considerada una contraindicación a la donación247.
Pese a todo, carecemos de una evidencia firme para establecer un límite nítido que excluya la donación. Esto se debe a que la experiencia publicada sobre la evolución a largo plazo de donantes con diferentes niveles de proteinuria o albuminuria es prácticamente inexistente.
Las guías KDIGO y BTS establecen que una albuminuria <.30.mg/día, o con una ratio de albúmina/creatinina en orina <.30.mg/g, es un límite adecuado para aceptar un donante, pese a reconocer que dentro de dicho intervalo se encuentran individuos con una albuminuria normal y otros con una ligera elevación para su edad y sexo. En el otro extremo, una albuminuria superior a 300.mg/día para las guías BTS, o superior a 100.mg/día para las KDIGO, son contraindicación absoluta. Entre ambos extremos se sitúa la contraindicación relativa para la donación y la decisión de aceptar un donante debe individualizarse según las características demográficas y de salud del candidato. Según las actuales recomendaciones estos valores «intermedios» de albuminuria (30-300.mg/día) son suficientes para establecer el diagnóstico de ERC, por lo que, aun reconociendo la debilidad de la evidencia disponible, se desaconseja la donación. La justificación utilizada en las actuales guías KDIGO para admitir la aceptación de estos donantes es que el riesgo proyectado de ERCT en individuos de edad avanzada y valores de albuminuria entre 30 y 100.mg/día es muy bajo, siempre que se excluya la presencia de un FG disminuido u otras comorbilidades125.
Microhematuria- •
Se recomienda, tras descartar las causas más frecuentes, la indicación de biopsia renal ante una microhematuria aislada persistente en el estudio del donante vivo (B).
- •
Cualquier entidad patológica detectada en la biopsia renal constituye una contraindicación a la donación, incluyendo la glomerulopatía IgA. Solo la enfermedad de la membrana basal delgada (EMBD) merecería una consideración diferente (B).
- •
Los candidatos con EMBD afrontan un riesgo aumentado de ERCT. La donación podría contemplarse en individuos de edad superior a 40 o 50 años, con una evaluación clínica, histológica y genética y tras recibir una información detallada sobre los riesgos e incertidumbres asociados a la donación (D).
La presencia de microhematuria o hematuria no visible persistente se define con la presencia en el examen microscópico del sedimento urinario de más de 2-5 hematíes por campo en al menos dos determinaciones aisladas. Grados menores de hematuria, es decir, la presencia de hematíes en orina en cualquier grado (1-3 hematíes por campo) son considerados irrelevantes en población general, sin embargo, los escasos estudios disponibles demuestran que el examen histológico de estos casos arroja una presencia significativa de nefropatía subyacente146,148. Por tanto, y aun reconociendo que la indicación de biopsia es más débil, el estudio de un candidato a la donación con hematuria detectable no es sustancialmente diferente al donante con microhematuria aislada persistente. Los aspectos metodológicos referentes a la definición y la determinación de microhematuria y la secuencia diagnóstica derivada de su hallazgo son recogidos en la sección 5.
Las causas de la microhematuria son múltiples. En primer lugar, debe excluirse la microhematuria asociada al ejercicio intenso, actividad sexual, contaminación menstrual o traumatismo248,249. Entre las causas más frecuentes de microhematuria encontramos la etiología urinaria no maligna, como la infección urinaria, la hipertrofia prostática y la urolitiasis. Existen además otras muchas causas menos frecuentes, como enfermedades sistémicas, enfermedades infecciosas, neoplasias uroteliales o glomerulopatías primarias249–251. La mayor parte de los casos son, por tanto, debidos a causas benignas y potencialmente reversibles y permitirán la donación una vez haya sido resuelta la causa subyacente y los factores relacionados. En un número menor de casos la microhematuria es debida a una patología que compromete la salud del donante o la seguridad de la donación y constituye una contraindicación a la donación. Tras el estudio pertinente y descartadas otras causas más frecuentes, el estudio de microhematuria con la finalidad de posibilitar la donación deberá concluir de forma obligada con la indicación de una biopsia renal, y en estos casos, la presencia de diferentes hallazgos histológicos puede generar dudas sobre la aceptación de la donación.
En un individuo con microhematuria persistente, cualquier entidad patológica detectada en la biopsia renal constituye una contraindicación a la donación, incluyendo la glomerulopatía IgA, independientemente de su expresión clínica o histológica. Solo la EMBD genera alguna duda en cuanto a la aceptación de un posible donante173,180. Esta entidad, que fue definida únicamente bajo un criterio histológico, se corresponde en la actualidad desde un punto de vista genético con la enfermedad de Alport con herencia autosómica dominante (EAAD)252. Estos pacientes poseen solo una variante patogénica del gen COL4A3 o COL4A4, y su posible presentación clínica es muy variada, desde la microhematuria aislada hasta el desarrollo de ERCT, generalmente en edades superiores a los 40 años253. Las guías de la BTS contemplan la posibilidad de la donación en el paciente con microhematuria aislada persistente debida a una EMBD2, basándose en el hecho de que existen precedentes de donación intencional o no bajos estas circunstancias y sin notificarse eventos adversos en el seguimiento de estos donantes146,148. Sin embargo, esta decisión, incluso bajo una rigurosa evaluación genética y una historia familiar no exime del riesgo de desarrollar ERCT. Solo casos con una evaluación clínica, histológica y genética completa, y con edades superiores a los 40 a 50 años podrían ser considerados como donantes, e incidiendo en una información detallada sobre los riesgos e incertidumbres asociados a la donación. La EMBD debe ser diferenciada de las pacientes portadoras de enfermedad de Alport con herencia ligada al cromosoma X, en las que el riesgo de ERCT es significativo, 12% antes de los 40 años, aumentando al 30 y 40% a los 60 y 80 años respectivamente253, de modo que en estas candidatas no se considera aceptable la donación. La donación en mujeres portadoras de enfermedad de Alport con herencia ligada al cromosoma X se ha seguido del desarrollo de ERC, proteinuria e HTA en más del 50% de los casos254.
En casos excepcionales, y tras un estudio extenso que incluya todas las exploraciones complementarias pertinentes, incluida la biopsia renal con estudio de inmunofluorescencia y microscopía electrónica, podrá aceptarse a donación de individuos con microhematuria aislada como único hallazgo. En estos casos, es imprescindible excluir la presencia de antecedentes familiares de enfermedad renal, y realizar un estudio genético dirigido ante la mínima duda. Varias son las experiencias que apoyan la aceptación de estos donantes. Un estudio reciente sobre población general joven (16 a 25 años), con 22 años de seguimiento medio, demostró un pequeño exceso de riesgo de ERCT a largo plazo asociado a la presencia de microhematuria aislada en individuos con proteinuria menor a 200.mg/día y valores de creatinina en el rango normal. La mayor parte de los casos de ERCT correspondieron al desarrollo de enfermedad glomerular primaria255. Teniendo en cuenta que estos pacientes no fueron sometidos a un proceso tan exhaustivo y extenso de evaluación como el propuesto, es posible que dicha evaluación consiga detectar los individuos con patología renal subyacente y de este modo eliminar el exceso de riesgo detectado en este estudio. Este es el caso de una serie holandesa de 49 pacientes con microhematuria aislada persistente, que incluyó biopsia. Los 20 pacientes que tuvieron una histología normal no presentaron empeoramiento de la función renal ni desarrollo de proteinuria a lo largo de 11 años de seguimiento256.
Dislipemia- •
Se sugiere no contraindicar la donación ante dislipemia como hallazgo aislado (C).
- •
Se sugiere que la dislipemia debe ser tenida en cuenta en la estimación del riesgo cardiovascular global del donante (C).
La prevalencia de dislipemia en la población general española se encuentra en torno al 30–51%, lo que la hace uno de los factores de riesgo cardiovascular más prevalentes, superado solo en algunos estudios por la HTA258. Además, dentro de la dislipemia, la hipertrigliceridemia y niveles bajos de colesterol HDL forman parte del diagnóstico de síndrome metabólico259. Pocos estudios han analizado la posible asociación entre niveles de lípidos predonación y resultados tras la nefrectomía. Un estudio realizado en México encontró un impacto negativo del síndrome metabólico en peor FG a cinco años, aunque ninguno de los componentes de síndrome metabólico analizado (perímetro abdominal, glucemia en ayunas, hipertrigliceridemia, niveles de colesterol HDL o HTA) tuvo impacto en la función renal posdonación por sí solo. En un estudio israelí los donantes tuvieron más riesgo de aparición de síndrome metabólico que los controles261. Sin embargo, no existen estudios que analicen la influencia de la dislipemia como elemento aislado en el pronóstico de los donantes renales. En población general, un metaanálisis mostró que no existía asociación entre los niveles de colesterol LDL y el desarrollo de ERCT125. Todas las guías consultadas2,4,9,262,263 recomiendan la determinación del perfil lipídico para el estudio del donante vivo, pero ninguna define un límite para la no aceptación.
Hiperuricemia y gota- •
Se sugiere que la hiperuricemia o los antecedentes de gota en el donante no constituyen una contraindicación para la donación (C).
- •
Se sugiere informar a los candidatos con antecedentes de hiperuricemia y/o gota que la donación se asocia a un aumento de los valores de ácido úrico y quizá a un mayor riesgo de gota (C).
Un descenso en el FG se acompaña de una disminución en la excreción de ácido úrico y el subsecuente aumento de este en sangre, incrementando también el riesgo de gota264. En el contexto del descenso del FG que sucede tras la nefrectomía del donante, se ha observado un incremento de un 8% en los niveles de ácido úrico a los seis meses posdonación comparando donantes con controles sanos y este aumento persiste 36 meses tras la nefrectomía210. Si comparamos a los donantes en una situación pre y posdonación, el ácido úrico se ha visto incrementado en un 20% a los siete años de la nefrectomía y se detectaron más episodios de gota, aunque con una baja frecuencia absoluta209. Los donantes afroamericanos, varones y de mayor edad, son los más susceptibles de padecer gota tras la donación renal265. En un reciente estudio retrospectivo japonés, los donantes con niveles de ácido úrico más altos predonación tenían riesgo mayor de desarrollar hipertrofia renal compensatoria subóptima266.
Además del riesgo de gota, niveles elevados de ácido úrico se han relacionado con aumento del riesgo cardiovascular y desarrollo de ERC en población general209,267. Estos datos no se han confirmado en cohortes de donantes renales.
De las guías recientemente publicadas, solo las KDIGO de 2017 realizan recomendaciones acerca de la hiperuricemia en donantes renales204. Ya que el desarrollo de hiperuricemia y gota tras la donación parece estar fuertemente relacionado con factores sociodemográficos265, se requiere una evaluación individualizada del donante, preguntando por posibles antecedentes de episodios gotosos e informando del potencial riesgo de hiperuricemia y/o gota tras la donación.
Tabaquismo- •
Se sugiere individualizar el impacto del tabaquismo en la aceptación de un donante vivo según el riesgo global del candidato (C).
- •
Se recomienda el cese del hábito tabáquico, tanto previamente a la donación, como durante el seguimiento del donante (C).
- •
El potencial donante debe ser informado adecuadamente de los riesgos asociados al hecho de fumar y de haber fumado (NG).
El consumo de tabaco es un potente factor de riesgo cardiovascular modificable, con una prevalencia en España de un 39% entre adultos de 35-64 años268. Además de los efectos cardiovasculares y pro-cancerígenos ampliamente conocidos, fumar puede causar daño renal directo promoviendo aterosclerosis y daño microvascular a nivel tisular y se ha relacionado con la aparición de ERC269. En el metaanálisis antes mencionado sobre factores de riesgo de desarrollo de ERCT en población general a 15 años, los fumadores activos presentaron un 76% de aumento de riesgo, mientras que los exfumadores también tuvieron un 45% de exceso de riesgo125.
La literatura sobre el riesgo de los donantes fumadores tras la nefrectomía es escasa. Un estudio americano encontró un riesgo de mortalidad a 12 años cinco veces superior en donantes fumadores que en no fumadores120.
Ninguna guía recomienda contraindicar la donación a los fumadores2,4,9,262,263. Se aconseja la realización de pruebas de función respiratoria para descartar patología pulmonar estructural2 y, según el índice acumulado paquetes/año, también puede ser necesaria la realización de un escáner torácico de baja radiación como despistaje de neoplasia pulmonar263.
Consumo de alcohol y adicción a otras drogas- •
En la evaluación global y psicosocial de un candidato a la donación debe explorarse de forma específica el consumo de alcohol y otras drogas (NG).
- •
Se sugiere para todos los donantes promover la reducción del consumo de alcohol hasta los niveles recomendados como aceptables para población general (D).
No existe evidencia ni recomendación alguna para la evaluación del consumo de alcohol y/o la adicción a otras drogas de los potenciales donantes renales2,4,9,262,263. El consejo sobre una reducción en el consumo del alcohol o un consumo «moderado» del mismo, parece insuficiente para la correcta evaluación del riesgo de un donante, ya que el consumo de alcohol puede verse relacionado con el desarrollo de HTA o gota, por ejemplo204. Además, la adicción propiamente dicha debe estar contemplada dentro de la evaluación psicológica del donante.
En las guías europeas, se analizó en profundidad el factor «consumo de alcohol» 4. Los autores concluyeron que se debería, no solo recomendar, sino también fomentar y perseguir una reducción en el consumo de alcohol a una cantidad menor de 60 g al día en hombres y 40 en mujeres, de acuerdo con los criterios de la Organización Mundial de la Salud270. Aunque la extrapolación de receptor a donante renal no debe ser la norma, parece razonable recomendar, al menos, una evaluación del consumo de alcohol en los donantes, más allá de una simple pregunta como: ¿bebe usted? La prevalencia de consumo de alcohol en los últimos 30 días es de un 60% en adultos en España y hasta un 25% de varones de entre 55-64 años lo consumen diariamente264, por lo que es necesario evaluar el consumo de alcohol de una manera más precisa en nuestros candidatos a donante renal, para ofrecer la información adecuada y detectar posibles trastornos de dependencia a alcohol. Un consumo excesivo también puede ser identificado por signos indirectos, como alteraciones de la función hepática a nivel analítico o de imagen por ecografía.
Por otro lado, no existe evidencia o recomendación alguna para la evaluación de donantes con consumo esporádico de drogas. De hecho, la mayoría de las guías contextualiza el consumo de drogas dentro de la evaluación del donante desde el punto de vista infeccioso. En este escenario, la evaluación psicológica es la que cobra mayor importancia para descartar problemas de adicción, quedando la decisión de la aceptación englobada en su valoración psicológica y médica completa.
Sección 8. Evaluación metabólica y modelos de vida saludable pre y posdonación renal de vivoLa prevalencia de ERCT está aumentando a nivel mundial como resultado de una mayor prevalencia de comorbilidades como la HTA, DM y obesidad. Estas comorbilidades son, en general, contraindicaciones para aceptar a los donantes vivos debido al riesgo de desarrollar a largo plazo ERCT y aumentar la morbimortalidad postrasplante, particularmente, en aquellos de edad avanzada. Asimismo, la presencia de síndrome metabólico, el cual representa el 30% de la población general, representa la antesala de estas comorbilidades y puede constituir una potencial limitación. Con todo, la mayoría de los donantes potenciales se encuentran en los grupos de mayor edad y existe limitada evidencia científica a largo plazo respecto a la seguridad en los donantes a largo plazo. Por ello, las decisiones con respecto a la donación en estas poblaciones son controvertidas. La mayoría de los estudios han sugerido que los donantes de riñón vivos tienen un riesgo mínimo de por vida de desarrollar ERCT. Sin embargo, las complicaciones a largo plazo y las secuelas fisiológicas y psicológicas resultantes de la donación siguen sin estar claras debido a la falta de un seguimiento óptimo de los donantes después del TR.
La optimización de la selección de estos donantes debe garantizar la seguridad y eficacia de este tratamiento sustitutivo. En esta evaluación es crucial la detección de factores de riesgo para desarrollar ERCT. Además, el incremento de estos factores en los potenciales donantes obliga a ampliar la elegibilidad de estos, modificando las contraindicaciones absolutas y relativas, y siendo necesaria una evaluación individual. Su identificación permite establecer los criterios de selección y exclusión de los donantes, así como desarrollar estrategias para modificar su estilo de vida.
Obesidad- •
Se sugiere el índice de masa corporal (IMC) para la evaluación clínica del sobrepeso y la obesidad (calidad de la evidencia: C).
- •
Se sugiere desaconsejar a las personas con un IMC.> 35.kg/m2 la donación renal (C).
- •
Se recomienda contraindicar la donación renal de vivo en pacientes con obesidad y un segundo factor de riesgo (B).
- •
Se recomienda considerar la obesidad (IMC.>30.kg/m2) como una contraindicación relativa a la donación y debe ser evaluada de forma individual para detectar la presencia de otros factores de riesgo cardiovascular como la intolerancia a la glucosa, HTA y proteinuria (B).
- •
Se recomienda que el donante obeso reciba asesoramiento sobre el mayor riesgo de morbilidad perioperatoria y ante la ausencia de datos de seguridad a largo plazo (B).
- •
Los donantes con IMC.>27.kg/m2 deben ser informados que pueden presentan a largo plazo mayor riesgo de desarrollar ERC y, por tanto, deben perder peso predonación y mantener un peso saludable posdonación (C).
El sobrepeso y la obesidad son un problema de salud pública por su alta prevalencia en la población general, como consecuencia del sedentarismo y la sobrealimentación. Los Institutos Nacionales de Salud definen la obesidad como un IMC.>30.kg/m2. Históricamente, los donantes de vivo estaban exentos de patologías, pero progresivamente se van ampliando los criterios de selección de los donantes marginales271. Actualmente, más del 25% de los donantes vivos son obesos en el momento de la donación, respecto al 8% en la década de 1970, y hasta el 43% tienen sobrepeso.
La obesidad es un factor de riesgo independiente para la ERCT en la población general. Puede producir cambios funcionales y estructurales a nivel renal, como hiperfiltración glomerular, glomerulomegalia y lesiones de glomeruloesclerosis segmentaria y focal. El riesgo de ERCT se incrementa en pacientes monorrenos, los cuales desarrollan una hiperfiltración glomerular compensadora. En este sentido, pacientes con un IMC.>30.kg/m2 en el momento de la nefrectomía por otros motivos diferentes a la donación renal tienen un mayor riesgo de desarrollar proteinuria e insuficiencia renal 10 años después272.
La obesidad se asocia a mayor riesgo de HTA, DM, ERC, síndrome metabólico y enfermedad cardiovascular en la población general y, por extensión, también en los donantes vivos. El IMC es una herramienta de detección útil para identificar el sobrepeso y la obesidad, pero no hay consenso establecido sobre un IMC seguro para los donantes y existen diversas recomendaciones2–4. Con todo, el impacto a largo plazo de la obesidad en los donantes es incierto y resulta complicado conocer el límite que predice el mayor riesgo posdonación para poder excluirlos en la evaluación predonación o implementar estrategias de estilo de vida y modificar este factor.
La obesidad en los donantes renales vivos no parece comprometer la seguridad a corto plazo, a excepción de mayor complicación de la herida y tiempos quirúrgicos más largos, sin diferencias en la FG en comparación con donantes no obesos en los dos años siguientes a la donación213,273. Sin embargo, a largo plazo el impacto puede ser negativo. En un estudio nacional estadounidense la presencia de obesidad aislada (sin HTA o DM) se asoció a una mayor tasa de ERC y mortalidad frente a donantes no obesos271. También desarrollan con mayor frecuencia y más precozmente DM e HTA que los no obesos posteriormente a la donación274,275, si bien este riesgo no se agrava por la nefrectomía276.
Estos hallazgos tienen implicaciones importantes para la selección de donantes vivos con respecto a los puntos de corte del IMC establecidos previamente como contraindicación para la donación, que según los centros se sitúan entre IMC 30-35.kg/m2. Incluso el estado de sobrepeso puede conferir un riesgo elevado de ERCT a largo plazo en comparación con IMC normal, y debe facilitarse a donantes potenciales obesos y con sobrepeso un programa de rehabilitación o pérdida de peso previo a la donación, ya que a corto plazo se asocia con mejoría en otros factores de riesgo cardiovasculares. Los donantes con IMC normal en el momento de la donación experimentaron una pérdida de peso significativa antes de la donación y mantuvieron un peso corporal saludable después de la donación; los donantes con IMC ≥25.kg/m2 en la donación experimentaron un aumento de peso significativo durante un año después de la donación, sugiriendo la necesidad de mejorar los esfuerzos de control de peso entre los donantes de riñón obesos y con sobrepeso pre y posdonación para reducir el riesgo de ERC avanzada277.
En resumen, los donantes potenciales obesos deben evaluarse de forma individual para detectar otros factores de riesgo asociados con la ERC, como la intolerancia a la glucosa, HTA y proteinuria persistente. Potenciales donantes con síndrome metabólico deberían evaluarse individualmente, dada la reversibilidad de las alteraciones. La evaluación y seguimiento posdonación para controlar el peso, así como transmitir la importancia de la realización de ejercicio físico diario y la coordinación con nutricionistas para facilitar programas de dieta saludable de forma individualizada, debe ser un objetivo en los programas de TR con donante vivo para minimizar los riesgos cardiovasculares y mejorar la supervivencia renal a largo plazo.
Hipertensión arterial- •
Se sugiere la medida de la PA al menos en dos ocasiones separadas en el tiempo (C).
- •
Se sugiere realizar monitorización ambulatoria de la presión arterial (MAPA) en los siguientes casos: donantes HTA en tratamiento, cuando en la medición en consulta presenta PA elevada.>140/90.mmHg o normal-elevada.> 130/85.mmHg (C).
- •
Donantes elegibles aquellos con HTA controlada <.140/90.mmHg con uno o dos fármacos antihipertensivos sin evidencia de daño orgánico inducible por HTA. Valorar excluir como donantes a aquellos con HTA controlada pero que presentan otros factores de riesgo asociados como obesidad, tabaquismo o mayor edad (C).
- •
Se sugiere excluir a potenciales donantes con HTA.> 140/90.mmHg en tratamiento antihipertensivo o con evidencia de lesión orgánica (C).
- •
Se sugiere la monitorización anual de PA y otros factores de riesgo modificables post donación (C).
En población general, la prevalencia de HTA en adultos se estima en el 30-45%, alcanzando el 60% en personas de más de 60 años278. La HTA es una contraindicación relativa para la donación de riñón vivo, siendo necesaria una evaluación individual para determinar la presencia de otras comorbilidades asociadas. Las guías clínicas más recientes establecen como contraindicación para la donación renal de vivo una presión arterial (PA).>140/90.mmHg con uno o dos fármacos antihipertensivos o evidencia de daño orgánico inducido por HTA. Sin embargo, la definición de HTA puede tener pequeñas variaciones a lo largo del tiempo279.
En un metaanálisis que incluyó 48 estudios de 28 países con 5.145 donantes renales vivos, el aumento de PA sistólica media ponderada fue de 6.mm Hg y el de la diastólica de 4.mm Hg, superior a lo previsto con el envejecimiento normal122. Los donantes pueden tener un mayor riesgo a corto y largo plazo para desarrollar HTA280–284. Factores de riesgo asociados son la edad, el sexo masculino, la etnia afroamericana, antecedentes familiares de HTA, IMC y PA sistólica y diastólica más altas. No obstante, y dado que estos factores de riesgo son similares a los que presenta la población general en la cohorte de Framingham, se podría inferir que el efecto de la nefrectomía no modifica o aumenta el riesgo283.
Los donantes con HTA preexistente mantienen una PA más alta antes y a los dos meses posdonación que sus controles, siendo similar a los cinco años, no encontrando diferencias respecto a la función renal ni a la proteinuria285.
La mayoría de los centros excluyen a los pacientes con HTA como candidatos a la donación renal, pero de forma rutinaria usan la PA medida en la clínica, la cual no refleja la PA real. En un estudio que evaluó 178 donantes, 63 de ellos tenían HTA en la medición en consulta, dos tercios de ellos de «bata blanca» al realizar MAPA, los cuales fueron elegibles para la donación. Por el contrario, de 115 individuos normotensos en la medición clínica, el 17% presentaban HTA enmascarada en la MAPA y fueron excluidos de la donación. Las personas con HTA enmascarada eran de mayor edad, varones y tenían una PA clínica algo más alta que las personas con normotensión sostenida286. La MAPA refleja mejor la PA real en comparación con la medición en la consulta. Varios estudios han indicado el valor de la MAPA cuando la medición clínica de la PA está en el rango hipertensivo entre los donantes de riñón. El 30-60% de los donantes potenciales que tienen HTA durante la evaluación clínica cuando se estudian con MAPA están normotensos287.
Los donantes hipertensos elegibles, por tanto, deben tener un adecuado control tensional con la MAPA sin evidencia de daño orgánico inducido por HTA. Al igual que en la población general, es probable que el aumento de la PA en los donantes de riñón vivos incremente el riesgo cardiovascular y de ERC. La administración de fármacos bloqueadores del sistema renina angiotensina sería el primer escalón terapéutico. A los que no presentan HTA preexistente se les debe de informar que la donación puede acelerar el aumento de la PA respecto a lo que se esperaría con el envejecimiento normal y que es necesaria la monitorización de la PA regularmente.
Diabetes mellitus y síndrome metabólico- •
Se recomienda la determinación de glucemia basal y HbA1c en todos los donantes (B).
- •
Se recomienda realizar test de sobrecarga oral de glucosa en antecedentes de diabetes gestacional, historia familiar en primer grado de diabetes tipo 2, glucemia en ayunas alterada, sobrepeso, HTA o dislipemia (B).
- •
Donantes con DM tipo 1 deben ser excluidos (D).
- •
Donantes con DM tipo 2 en general deben ser excluidos, pero pueden considerarse en situaciones especiales (C).
- •
Prediabetes o síndrome metabólico decisión individualizada (D).
- •
Recomendación de estilo de vida saludable (C).
- •
Seguimiento posdonación para vigilancia de factores de riesgo CV (C).
En las últimas décadas ha habido un incremento importante de la prevalencia de la DM288,289. Los potenciales donantes renales deben tener una determinación de glucemia basal, de hemoglobina glicosilada (HbA1c) y en casos de antecedentes familiares en primer grado de diabetes tipo 2, historia de diabetes gestacional, glucemia en ayunas alterada (GAA), obesidad, HTA o dislipemia, debería realizarse una prueba de tolerancia oral a la glucosa (TTOG).
La hiperglucemia mantenida inicia una serie de cambios hemodinámicos y estructurales que cuando coinciden con una base genética y confluyen con otros factores como obesidad e HTA, pueden determinar la aparición de nefropatía diabética290,291. Si a esto se une la hiperfiltración por disminución de masa nefronal tras la nefrectomía, el riesgo de desarrollar nefropatía diabética en los donantes renales con diabetes puede ser considerable. Por eso, clásicamente la presencia de DM tipo 1 se ha considerado motivo de exclusión para ser donante renal. Sin embargo, en la DM tipo 2, en algunas circunstancias, especialmente si no confluyen otros factores como afectación de órganos diana, HTA o sobrepeso, la donación podría ser considerada292. En una serie de 225 donantes, se compararon los 14 diabéticos en el momento de la donación con los 211 no diabéticos, con un tiempo medio de unos cuatro años de seguimiento. No hubo diferencias de función renal ni albuminuria entre los dos grupos293. Otra serie no encontró diferencias de supervivencia a largo plazo, y ninguno de los donantes diabéticos presentó ERC avanzada294.
Hasta el 70% de personas prediabéticas (glucosa basal entre 100 y 125.mg/dL, o TTOG alterado) desarrollará DM tipo 2 a lo largo de su vida295,296. Los donantes con intolerancia a la glucosa han aumentado de un 7% a un 22% en las ultimas dos décadas297 y las publicaciones con resultados de este tipo de donantes presentan en general buena evolución, sin diferencias de FG o albuminuria tras 10 años de seguimiento respecto a los no prediabéticos298. El estudio de 93 donantes con HbA1c y TTOG, los distribuyó en tres grupos: alto riesgo de DM (HbA1c y TTOG en rango prediabético), bajo riesgo (uno de los dos parámetros alterado) y grupo control (ambos parámetros normales). Tras un tiempo medio de seguimiento de 76 meses, un alto porcentaje del grupo de alto riesgo evolucionó a DM en comparación con el grupo de bajo riesgo y el grupo control (31,3% vs. 6,5% vs. 0%). No presentaron mayor riesgo de HTA o microalbuminuria y los donantes prediabéticos presentaron similar FG que el grupo control, concluyéndose que la HbA1c identifica donantes prediabéticos con riesgo de progresar a DM pero que con cuidadosa selección estos donantes no presentan un mayor riesgo de deterioro de la función renal299.
Con todo, hay que ser prudentes con estos resultados porque sería necesario conocer la evolución a más largo plazo. En un estudio de 2.954 donantes renales de vivo tras un tiempo medio de seguimiento de casi 18 años, 154 desarrollaron DM tipo 2. Durante la primera década, después de desarrollar diabetes no tenían un riesgo aumentado de ERC, aunque sí incremento de albuminuria300. En una publicación posterior, este mismo grupo presentaba la evolución de estos donantes diabéticos, y a más largo plazo tenían un deterioro más rápido del FG que el grupo control no diabético si se asociaba a HTA y proteinuria301.
En población general, se han elaborado varios índices de riesgo para estimar la probabilidad de desarrollar DM tipo 2, pero su capacidad predictiva ha sido muy variable debido a la exclusión de importantes factores de riesgo. En la práctica, la glucosa basal en ayunas y el TTOG son las pruebas estándar recomendadas para el diagnóstico de la DM tipo 2, incluidos los enfermos renales. La figura 7 muestra un diagrama de flujo que puede ayudar a detectar DM tipo 2 antes de la donación renal.
Posibles mecanismos que conducen a la hiperfiltración, enfermedad renal progresiva y proteinuria en potenciales donantes renales de vivo que presentan síndrome metabólico antes de la donación. TFG: Tasa de Filtración Glomerular. Adaptado de Hernández D.305.
El síndrome metabólico se produce cuando concurren al menos tres de las siguientes circunstancias: perímetro abdominal (circunferencia de la cintura).>102.cm en hombres y.>88.cm en mujeres, triglicéridos séricos en ayunas.>150.mg/dL, HDL-colesterol <.40.mg/dL en hombres y <.50.mg/dL en mujeres, PA sistólica.>130.mmHg y/o diastólica.> 85.mmHg o recibir fármacos antihipertensivos y glucemia en ayunas.>100.mg/dL o recibir fármacos hipoglucemiantes. La prevalencia de este síndrome en España es del 25%, y se asocia a morbimortalidad CV, diabetes y daño renal302–304. La alta prevalencia del síndrome metabólico, las comorbilidades que lo integran y sus consecuencias negativas obligan a una exhaustiva búsqueda de esta entidad en los posibles donantes renales305. El síndrome metabólico y cada uno de sus componentes se asocia de forma independiente con un mayor riesgo de ERC306. Pero está menos claro si la presencia de síndrome metabólico en un donante se asocia con peor función renal después de la donación. En esta línea, un interesante estudio analiza la asociación del síndrome con la función renal y el daño histológico en los donantes vivos de riñón. De un total de 410 donantes, el 12% presentaban síndrome metabólico en el momento de la donación; en sus biopsias renales preimplante, los donantes con síndrome metabólico presentaban más datos histológicos de cronicidad, y este hallazgo se asoció con recuperación más lenta del FG después de la donación307. Un grupo de donantes renales con síndrome metabólico alcanzó un FG <.70.mL/min en un tiempo más corto (media de cinco vs. 12 años)260. Teóricamente, en individuos con síndrome metabólico que son sometidos a nefrectomía para donación de vivo, la resistencia a la insulina y la reducción de la masa renal pueden predisponer a hiperfiltración en el riñón remanente, con proteinuria y enfermedad renal progresiva (fig. 8).
Diagrama de flujo para detectar diabetes mellitus antes de la donación de vivo. TTOG: Test de Tolerancia Oral a la Glucosa; TTOGA: Test de Tolerancia Oral a la Glucosa Alterada; GAA: Glucosa en Ayunas Alterada. DM: Diabetes Mellitus. Adaptado de Hernández D.305.
En los posibles donantes con DM tipo 2, prediabetes o síndrome metabólico deben recomendarse cambios en el estilo de vida, dieta, pérdida de peso y ejercicio físico. El objetivo sería evitar el progreso hacia diabetes y disminuir el riesgo CV y de progresión hacia la ERC308.
Los beneficios de la reducción del peso para frenar el desarrollo de la diabetes están claramente demostrados, al menos a corto plazo309–311. Sin embargo, este beneficio no suele mantenerse en el tiempo, sobre todo porque la recuperación parcial o total del peso es prácticamente una constante a largo plazo312.
El ejercicio físico ha demostrado también su eficacia para disminuir la progresión a diabetes50. La ADA recomienda al menos 150 minutos/semana de actividad física de intensidad moderada a vigorosa o duraciones más cortas (mínimo 75 minutos/semana) de intensidad vigorosa para prevenir o retrasar la aparición de DM tipo 2 en poblaciones en alto riesgo y/o con prediabetes313. Los efectos del entrenamiento intermitente de alta intensidad y el entrenamiento continuo de intensidad moderada sobre la capacidad funcional y los marcadores cardiometabólicos en individuos con prediabetes y con DM tipo 2, tienen un efecto positivo similar314,315.
Sección 9. Compatibilidad e incompatiblidad en TR de donante vivoBarreras para la compatibilidad- •
Un trasplante grupo sanguíneo ABO y HLA compatible ofrece la mejor oportunidad de éxito (calidad de la evidencia: A).
- •
La incompatibilidad en el grupo sanguíneo ABO y en el sistema HLA son independientes. Donante y receptor pueden ser HLA idénticos y ABO incompatibles (SG).
- •
Se recomienda realizar la determinación del grupo sanguíneo de forma precoz en el estudio de una potencial pareja de donante y receptor de TR para manejar adecuadamente las expectativas y discutir las opciones de trasplante (B).
- •
La incompatibilidad en el grupo sanguíneo ABO no es contraindicación absoluta para el trasplante y se puede resolver con un TR cruzado o con un tratamiento desensibilizador (A).
- •
Para valorar las opciones de trasplante en una pareja ABO incompatible es esencial cuantificar las isoaglutininas (anticuerpos ABO) en el receptor, preferiblemente empleando los hematíes del donante (B).
- •
La tipificación HLA se debe realizar utilizando métodos de biología molecular (B).
- •
Se recomienda realizar la tipificación HLA a nivel alélico (dos campos) y en los 11 loci HLA, esto es HLA-A, B, C, DRB1, DRB3/4/5, DQA1, DQB1, DPA1 y DPB1, tanto del receptor como de los posibles donantes (B).
- •
La tipificación HLA de alta resolución permite interpretar si el receptor presenta anticuerpos donante específicos (DSA) detectados con las nuevas técnicas de estudio de anticuerpos anti-HLA (SG).
- •
Las nuevas técnicas de fase sólida tienen una sensibilidad mayor para la detección de anticuerpos anti-HLA que las técnicas clásicas celulares (A).
- •
Se debe valorar el momento del estudio de histocompatibilidad dependiendo de las características del receptor y los potenciales donantes para evitar exploraciones innecesarias orientar las expectativas de donante y receptor (SG).
- •
Se recomienda realizar una detallada historia clínica inmunológica del receptor, que debe ser compartida con el laboratorio de histocompatibilidad, que incluya sus eventos sensibilizantes y la relación entre el receptor y los potenciales donantes (SG).
- •
Es importante recoger si el potencial donante es el padre de los hijos de una receptora o un hijo, dado el riesgo de sensibilización durante los embarazos.
- •
Se deben recoger cambios en la inmunosupresión si el receptor es portador todavía de un trasplante disfuncionante.
- •
- •
Se recomienda realizar siempre una prueba cruzada entre donante y receptor (A).
- •
La prueba cruzada virtual nos dará una aproximación inicial de la compatibilidad entre donante y receptor (SG).
- •
Se debe realizar una prueba cruzada física pretrasplante con técnicas de citotoxicidad y citometría de flujo entre donante y receptor (SG).
- •
El laboratorio de histocompatibilidad o un profesional entrenado en este campo debe interpretar las pruebas y asesorar al equipo clínico sobre el riesgo de la pareja donante-receptor (SG).
El TR en humanos se convirtió en una realidad en los años 50 del siglo XX tras realizar los procedimientos siendo donante y receptor gemelos univitelinos316. Los avances técnico-quirúrgicos se habían producido décadas antes. Este hecho pone de relieve que la barrera más importante para la supervivencia de un trasplante de órgano sólido radica en la potencial «incompatibilidad» con el donante que puede desencadenar la pérdida del trasplante317.
Pueden generar incompatibilidad y potencial respuesta inmunológica en el receptor todas aquellas moléculas presentes en el donante que el receptor no posee. Sin embargo, las barreras identificadas en práctica clínica que de forma clara generan incompatibilidad y posible rechazo son:
- a)
la incompatibilidad de grupo sanguíneo, debido a la presencia de anticuerpos presentes de forma natural en cualquier individuo mayor de cuatro meses.
- b)
la incompatibilidad en el sistema mayor de histocompatibilidad (HLA), debido a la presencia de anticuerpos adquiridos por contacto previo con antígenos HLA.
Más de un tercio de los potenciales receptores de TR tiene una cantidad de anticuerpos anti-HLA que puede dificultar la compatibilidad318. La incompatibilidad en estos dos sistemas es independiente. El gen implicado en la definición del grupo sanguíneo ABO se encuentra en el brazo largo del cromosoma 9 y los genes que codifican los antígenos HLA en el brazo corto de cromosoma 6. Esto explica el hecho de que dos hermanos pueden ser HLA idénticos, y, no obstante, ser ABO incompatibles.
Sin embargo, se puede realizar un trasplante de un órgano «no» incompatible con diferentes grados de compatibilidad. La probabilidad de rechazo se asocia con el grado de incompatibilidad HLA entre donante y receptor, y una mayor compatibilidad o «match» entre donante y receptor también aumenta la supervivencia del injerto319.
Barreras para la compatibilidad por el grupo sanguíneo ABOSe han reconocido 360 grupos sanguíneos diferentes en la superficie de los hematíes humanos320. Sin embargo, solo uno de los sistemas de grupo sanguíneo descritos ha mostrado tener significación para el TR el ABO.
Características de los antígenos A, B, OEl grupo ABO es uno de los grupos sanguíneos más simples en cuanto a estructura, un solo monosacárido al final de una cadena de tres o cuatro monosacáridos es el responsable de la especificidad A, B o O. Sin embargo, es el grupo sanguíneo más importante, razón que llevó a que fuera el primer grupo en ser descrito por Landsteiner in 1901321. Se trata de cadenas de cuatro o cinco monosacáridos en la superficie de los hematíes generalmente conjugadas con polipéptidos, formando glucoproteínas o con un tipo de lípidos (ceramidas) para formar glucoesfingolípidos. La mayoría de los antígenos ABO se encuentran en las glucoproteínas de la membrana de los hematíes
Los oligosacáridos responsables de la especificidad del grupo A, B o AB se sintetizan por etapas. Sobre una cadena de base de tres monosacáridos (fucosa, galactosa y N-acetil galactosamina [NAcGlc]) llamada antígeno H, si se hereda una determinada glucosiltransferasa, se añade un monosacárido adicional. Las personas que heredan la glucosiltransferasa NAcGlc, añade una NAcGlc a la sustancia H. Esta estructura de cuatro monosacáridos se conoce como grupo sanguíneo A. No todas las glucosiltransferasas NAcGlc muestran la misma eficiencia en transformar la sustancia H en el antígeno A. Hay una forma que poseen aproximadamente el 80% de los individuos A que transforma alrededor del 85% de la sustancia H en A (sobre 1.000.000 de antígenos por hematíe). Son los individuos de grupo A1. El otro 20% de las personas A tiene una glucosiltransferasa NAcGlc que solo transforma el 15% de la sustancia H en antígeno A (unos 200.000 antígenos) y se conocen como grupo A2322.
Las personas que heredan la transferasa galactosa añaden una molécula de galactosa y la estructura es el grupo B. Aquellas que hereden ambas glucosiltransferasas son del grupo AB. En las personas que heredan genes de las glucosiltransferasas que producen enzimas no funcionales, la sustancia H queda inmodificada y son de grupo sanguíneo O. El término correcto es la letra «O», no el número cero323.
Expresión de los antígenos A, B, OEl grupo ABO se expresa, además de en los hematíes, en otros muchos tejidos del organismo y se encuentra también como glucoproteína soluble en las secreciones corporales. En el riñón los antígenos se expresan en el endotelio vascular (arteria, capilares glomerulares y peritubulares) y en el epitelio tubular distal. Por el contrario, no se encuentra en el túbulo proximal ni en las células mesangiales324.
La intensidad de la expresión de los antígenos de grupo ABO en los hematíes y en los tejidos varía de forma paralela324. Así, los individuos del grupo A1 tienen una expresión antigénica mayor (tanto en tejidos como en hematíes) que los A2. Un factor adicional afecta la intensidad de la expresión de los antígenos ABO, el gen secretor. El gen secretor permite que el antígeno H se encuentre también en las secreciones corporales y hace que la expresión de los antígenos del A y el B sea más intensa. Para saber si una persona es secretora o no se puede estudiar si es portador del gen (FUT2) por biología molecular o determinar si la persona es portadora del grupo sanguíneo Lewis (Le) b en sus hematíes. Solo las personas que tienen el gen secretor serán Le b positivo.
La trascendencia práctica en el campo del trasplante de riñón ABO incompatible de estas diferencias en la intensidad de la expresión del antígeno del ABO es importante. En el caso de los donantes de grupo A2 y no secretor, debido a la escasa presencia de antígenos A en sus riñones, se han realizado trasplantes a receptores O, sin acondicionamiento previo325.
Técnicas de estudio de los antígenos A, B, OLas técnicas actualmente utilizadas para estudiar los grupos sanguíneos en los hematíes humanos se basan en reacciones de hemaglutinación entre los antígenos de los hematíes y anticuerpos que se leen e interpretan de forma manual o automática.
Lo que ha cambiado significativamente los últimos años es el soporte donde se realizan. Desde sus inicios, las reacciones de aglutinación de los hematíes se habían realizado en tubo de vidrio y eran leídas e interpretadas manualmente mediante la agitación del tubo centrifugado frente a un fondo iluminado. Sin embargo, a finales de la década de los años 80 del siglo XX, el científico francés Yves Lapierre desarrolló una nueva técnica y la introdujo en el mercado para detectar la aglutinación de los hematíes326.
La tecnología de aglutinación en columna (TAC) se basa en microcolumnas de plástico llenas de microesferas de gel de acrilamida o vidrio, que retienen los aglutinados de hematíes. Esta técnica ofrece frente a la técnica tradicional en tubo una reacción que es estable una vez obtenida y de lectura más objetivable y reproducible e incluso permite automatizar la lectura e interpretación. Para detectar los antígenos del grupo sanguíneo, existen en el mercado tarjetas de seis u ocho microcolumnas, dependiendo del fabricante, cada una de ellas es capaz de detectar un determinado antígeno (A, B, AB, RhD) sirviendo una de ellas de control de la reacción de aglutinación. Existen actualmente en el mercado dispositivos automáticos que permiten la dispensación, incubación, centrifugación, lectura e interpretación de los resultados.
Anticuerpos ABO: isoaglutininasLo que da visibilidad, importancia y trascendencia al grupo sanguíneo ABO es que todos los individuos tienen anticuerpos contra el antígeno que les falta, a diferencia de los otros 357 antígenos en los que solo se generan anticuerpos cuando el individuo ha entrado en contacto con hematíes humanos (transfusión o embarazos y él/ella es negativo para ese antígeno). La razón de la presencia de los anticuerpos yace en el hecho que los antígenos del ABO están también presentes en vegetales y muchas bacterias aerobias gramnegativas327. A partir de los tres o cuatro meses de vida los humanos desarrollan anticuerpos contra el antígeno A o/y B, dependiendo de su grupo. Estos anticuerpos se conocen como isoaglutininas porque cuando se enfrenta plasma/suero humano con hematíes incompatibles se produce la aglutinación de los hematíes. Esta fue la razón de su descubrimiento por Landsteiner.
A diferencia de otras respuestas inmunes en los humanos en las que tras una primera exposición se generan anticuerpos de clase IgM y a continuación de clase IgG y las IgM acaban desapareciendo, en el caso del ABO la mayoría de los individuos posee en su circulación durante la mayoría de la vida una cantidad significativa de isoaglutininas de clase IgM. Se sugiere que su presencia continua podría deberse a la exposición continua a los antígenos ABO existentes en los bacilos gramnegativos de la flora intestinal.
Los anticuerpos de clase IgM son los responsables de la aglutinación de los hematíes incompatibles debido a su estructura pentamérica que permite enlazar diversos hematíes entre sí. Además, son eficaces activadores del complemento, capaces de producir las consecuencias deletéreas que se observan en los casos de una transfusión de hematíes ABO incompatible o cuando se trasplanta un riñón ABO incompatible con una pérdida casi instantánea del injerto328.
Sin embargo, la mayoría de las isoaglutininas ABO en circulación son de clase IgG. A diferencia de las IgM, las IgG son monoméricas y no producen una aglutinación directa. Para que ello ocurra es necesario añadir un segundo anticuerpo dirigido contra las IgG humanas, es lo que se conoce como la prueba de la antiglobulina indirecta (PAI). No todas las subclases de IgG son capaces de activar el complemento, solo las subclases IgG3 e IgG1 tienen una actividad significativa329.
Técnicas de estudio de los anticuerpos anti-ABODada la capacidad de aglutinar hematíes de las isoaglutininas, la técnica más utilizada por la facilidad y disponibilidad es la de hemaglutinación. El primer método utilizado para su detección fue el de la aglutinación en tubo. Para detectar la IgM se añadía la dilución de hematíes y el plasma a testar se centrifugaba y se leía. En el caso de querer medir la IgG era necesario una etapa adicional: tras añadir la dilución de hematíes y el plasma y una solución de baja fuerza iónica para favorecer la fijación de la IgG, se incubaba 15 minutos. Tras la centrifugación, se lavaba tres veces, se añadía la anti-IgG humana se centrifugaba y se leía. Dado que estás técnicas se utilizan de forma rutinaria para la transfusión, tienen la ventaja de estar disponibles en la mayoría de los hospitales durante las 24 horas los siete días de la semana.
Hoy en día las técnicas de aglutinación en columna, como en el caso del estudio del grupo sanguíneo, ha sustituido las técnicas en tubo. En el caso de las IgM se dispensa la solución de hematíes y el plasma a testar, se centrifuga y se lee y en el de las IgG se hace igual pero en una microcolumna que contiene la anti Ig-G humana, de forma que solo hay que incubar, centrifugar y leer. Además, la introducción de la automatización ha simplificado más la ejecución de la técnica y el hecho de que la lectura también sea automática reduce la variabilidad en la interpretación y permite almacenar el patrón de reacción para su posterior revisión en caso de necesidad.
En el campo del trasplante de riñón ABO incompatible, más importante que la detección de las isoaglutininas es la cuantificación. Para cuantificarlas se utiliza otra técnica habitual en inmunohematología que es la dilución. Se realizan diluciones sucesivas del plasma problema (1, 1/2, 1/4, 1/8, 1/16, 1/32/, 1/64, /128, etc.) con una solución tampón y se enfrentan con hematíes. En general, en inmunohematología se informa el inverso de la última solución que da una reacción positiva como título (por ejemplo, título 8 si la última positividad la da la dilución 1/8. Pero en nuestra experiencia, dada la frecuente administración de inmunoglobulinas endovenosas en los tratamientos de desensibilización pretrasplante en caso de ABO incompatibles que en las columnas suelen dar una positividad tenue que interfiere la lectura, utilizamos como título, la última dilución que da un patrón de reacción de + 2 (la intensidad de las reacciones positivas se grada en cuatro niveles, + 1, + 2, + 3 y + 4 dependiendo de cómo se distribuyan los hematíes a lo largo de la columna).
Otro aspecto importante para considerar en la titulación de las isoaglutininas es el de los hematíes a utilizar en la prueba. Dada la correlación directa entre la expresión en los tejidos y en los hematíes de los individuos, se recomienda utilizar siempre los hematíes del donante para el seguimiento de la titulación pre y postrasplante de un receptor de un riñón ABO incompatible.
Barreras para la compatibilidad por el sistema HLACaracterísticas del sistema HLAEl éxito de los trasplantes depende de evitar la respuesta alogénica del receptor frente a las diferencias en los antígenos mayores de histocompatibilidad del órgano trasplantado, es decir, las incompatibilidades en el sistema HLA. La alorespuesta inmunológica será más intensa cuanto mayor sea la diferencia entre donante y receptor.
Los antígenos del sistema HLA son moléculas que se expresan en la membrana celular y que se clasifican en dos tipos:
- -
Las moléculas HLA de clase I formadas por una sola cadena polipeptídica (unida a la Beta2-microglobulina) y codificadas por tres loci génicos (HLA-A, B, C). Se expresan en la membrana de todas las células y su función fisiológica es presentar antígenos (péptidos) intracelulares (ej: virus) a los linfocitos T CD8.+.citotóxicos.
- -
Las moléculas HLA de clase II son proteínas heterodiméricas ancladas a la superficie celular por sus dos cadenas (α y β). También existen tres tipos de moléculas HLA-II (DR, DP, DQ) que están codificadas en los loci génicos DRA1, DRB1, DRB3/4/5, DPA1, DPB1, DQA1 y DQB1. Se expresan en monocitos, endotelio, células B y células dendríticas. Su función fisiológica es la de presentar antígenos extracelulares (ej: bacterias) a los linfocitos T CD4.+.colaboradores. Los linfocitos T también pueden expresar en su membrana moléculas HLA-II tras ser activadas.
Una característica principal de los genes del sistema HLA es que son altamente polimórficos. Al ser diferentes de unos individuos a otros, las moléculas HLA alogénicas son reconocidas como extrañas y las células que las expresan son atacadas de forma similar a como lo serían unas células infectadas por virus. La antigenicidad de las moléculas del sistema HLA viene condicionada por el hecho de que cada individuo posee varios tipos de antígenos HLA con múltiples posibles alelos diferentes, por su expresión en la membrana celular y por su peculiar función de molécula presentadora de péptidos a los linfocitos.
El objetivo de la mayoría de las técnicas utilizadas en el laboratorio de histocompatibilidad es:
- 1)
Evaluar las incompatibilidades que el receptor va a detectar en las células del donante. Se efectúa mediante la tipificación del sistema HLA en el receptor y el donante.
- 2)
Identificar la presencia en un receptor de aloanticuerpos dirigidos contra polimorfismos de los posibles donantes. Además de su detección, es posible caracterizar estos anticuerpos a nivel de su diana (HLA-I, HLA-II o no HLA), del tipo de inmunoglobulina (IgG, subclases de IgG, IgM) o de su capacidad de fijar complemento.
- 3)
Identificar si los aloanticuerpos del receptor reaccionan contra los polimorfismos expresados en el donante propuesto. Se analiza mediante la realización de la prueba cruzada o cross-match.
Para valorar la compatibilidad HLA es imprescindible realizar la tipificación HLA del receptor y de todos los posibles donantes. La mayoría de los laboratorios realizan los estudios de tipificación HLA mediante técnicas de Biología Molecular basadas en la PCR. Dependiendo del tipo de técnica empleada se puede alcanzar en la asignación de la tipificación un nivel de baja resolución o de antígeno (un campo, ejemplo A*02) o un nivel de alta resolución o alélico (dos campos o más, ejemplo A*02:01). Existen múltiples variantes de PCR para la tipificación HLA:
- -
Sondas Oligonucleotídicas Específicas de Secuencia (PCR-SSO): se amplifican de manera genérica los exones más polimórficos de cada locus HLA para después hibridar este producto amplificado con sondas de ADN específicas para las posiciones polimórficas. Actualmente se utiliza la plataforma Luminex en que las sondas están pegadas a una suspensión de microesferas.
- -
Primers específicos de secuencia (PCR-SSP): se basa en la utilización de primers específicos para una determinada región de ADN presente solo en un determinado alelo o grupo de alelos. Esto permite realizar reacciones de PCR que solo serán positivas para cada uno de los alelos o grupos alélicos.
- -
PCR-SBT: es la secuenciación nucleotídica directa del gen a analizar. Se amplifican mediante primers específicos las regiones más polimórficas del gen (exones 2, 3 y 4 en HLA de clase I y exón 2, y en ocasiones 3, en HLA de clase II) para luego llevar a cabo la reacción de secuenciación y una electroforesis de estas reacciones en un secuenciador automático. La secuencia nucleotídica completa de la región amplificada se compara con las secuencias de todos los alelos HLA del locus correspondiente, para así determinar qué alelos están presentes en un determinado individuo.
- -
PCR a tiempo real: se emplean primers y sondas específicas sin requerimiento de ningún procesamiento post-PCR. Una sustancia fluorescente identifica la presencia o ausencia de los productos amplificados. Analizando los patrones de reacciones positivas y negativas se obtiene la tipificación HLA.
- -
Secuenciación de segunda generación o Next Generation Sequencing (NGS): Realiza una secuenciación clonal, masiva y paralela que permite un gran número de secuencias de cada nucleótido en cada prueba. Aunque existen diversas plataformas, todas emplean una tecnología que incluye la amplificación del DNA molde (genes HLA), preparación de librerías, generación de clusters, secuenciación y el análisis de los datos. Dicha técnica tiene un alto rendimiento y permite secuenciar genes completos, reduciendo el número de ambigüedades en la asignación de los resultados.
Clásicamente, en pacientes candidatos a TR y sus donantes, se ha realizado la tipificación HLA de los loci A, B y DRB1 a nivel antigénico (un campo). La asociación entre incompatibilidades HLA y supervivencia del injerto renal se ha demostrado ampliamente en el TR de donante fallecido. En el caso del trasplante de donante vivo también se ha observado que el riesgo de fallo del injerto en receptores adultos que reciben un primer trasplante procedente de donantes vivos relacionados aumenta en un 44% por cada incompatibilidad y que se incrementa dos veces si las incompatibilidades son 6/6, tomando como referencias pacientes trasplantados con 0 incompatibilidades. Estas diferencias son todavía más marcadas si el órgano procede de donantes no relacionados319.
Es recomendable realizar la tipificación HLA a nivel alélico (dos campos) y en los 11 loci HLA, esto es HLA-A, B, C, DRB1, DRB3/4/5, DQA1, DQB1, DPA1 y DPB1, tanto del receptor como de los posibles donantes (EFI European Federation for Immunogenetics. Standards for histocompatibility testing. http://www.efiweb.eu/). No todas las técnicas mencionadas anteriormente permiten realizar la tipificación en alta resolución o nivel alélico. Por este motivo la tecnología de segunda generación o NGS se está imponiendo en la mayoría de los laboratorios de tipificación HLA, ya que permite estudiar de manera relativamente fácil, rápida y con un alto rendimiento todos los genes HLA con una muy alta resolución. La tipificación HLA en alta resolución de la pareja receptor/donante permite valorar de manera más precisa la compatibilidad entre ambos y de esta manera conocer mejor la probabilidad de supervivencia del injerto a largo plazo.
Además, la tipificación HLA de alta resolución permite determinar si el receptor presenta anticuerpos donante específicos (DSA) con las nuevas técnicas de estudio de anticuerpos anti-HLA, en caso de que existan anticuerpos contra algunos alelos, pero no todos, de un mismo grupo antigénico (por ejemplo, A*02:01 positivo, A*02:03 negativo). La tipificación de todos los genes HLA permite determinar también, en el caso de que el receptor presente anticuerpos anti HLA-C o HLA-DQ o DP, si son o no DSAs330.
Otra de las ventajas de realizar la tipificación HLA en alta resolución es que permite valorar la compatibilidad receptora/donante a nivel de epítopos que pueden ser reconocidos por anticuerpos específicos y no en función de las incompatibilidades antigénicas/alélicas. Estos epítopos están determinados por aminoácidos polimórficos en la superficie de las moléculas HLA y es posible determinar la compatibilidad HLA a este nivel estructural. Se han definido «eplets» como las áreas de residuos polimórficos reconocibles por los anticuerpos y, mediante el uso del algoritmo HLAMatchmaker331. se puede estudiar su grado de compatibilidad entre receptor y donante. Múltiples estudios demuestran que la compatibilidad a nivel de eplets tiene relevancia clínica332 ya que se ha visto que incompatibilidades HLA en trasplantados renales que son compatibles a nivel de eplets tienen prácticamente la misma tasa de supervivencia que receptores trasplantados de donantes con cero incompatibilidades siguiendo los criterios convencionales (a nivel de antígeno). Aunque a día de hoy no se valora de manera rutinaria la compatibilidad receptora/donante según los eplets, es posible que, en un futuro cercano, se incorpore a la práctica clínica.
Anticuerpos anti-HLA: técnicas de determinación de anticuerposLa determinación de aloanticuerpos anti-HLA puede realizarse utilizando como diana células que expresan las moléculas HLA en su superficie celular o mediante sistemas «artificiales» que presentan las moléculas de HLA unidas a un soporte en fase sólida.
La técnica celular que se ha utilizado principalmente para la determinación de aloanticuerpos es la microlinfocitotoxicidad o citotoxicidad dependiente de complemento (CDC): Esta técnica se basa en el efecto citolítico del complemento sobre los linfocitos en cuya superficie tiene lugar una reacción antígeno-anticuerpo (sérico). Este estudio se realiza con un panel de células de diferentes donantes30–60 portadores de antígenos HLA distintos. Detecta la presencia en suero de anticuerpos citotóxicos activadores de complemento, principalmente de clase IgG1, IgG3 e IgM. Hay variantes de la técnica, como es la incubación de las células y el suero con anti-IgG humana. Esta variante, que se emplea más frecuentemente en EE. UU., aumenta la sensibilidad y detecta inmunoglobulinas IgM, IgG1, IgG3, IgG2 e IgG4.
La asignación de la especificidad se realiza por correlación matemática entre la presencia de un determinado antígeno en los linfocitos y las reacciones positivas y negativas del suero. Por tanto, mediante la prueba CDC se obtienen tres tipos de información:
- -
Si el receptor tiene o no tiene aloanticuerpos.
- -
El porcentaje de reactividad o Panel Reactive Antibody (PRA). Representa el porcentaje de la población general (representada en el panel) contra la que el paciente es incompatible. Permite predecir la probabilidad de una prueba cruzada linfocitaria positiva.
- -
Identificar, en algunos casos, contra que antígenos reaccionan estos aloanticuerpos. En los receptores con múltiples aloanticuerpos la definición de los antígenos aceptables por técnicas de citotoxicidad es imprecisa dado que cada célula expresa varios alelos. Los donantes con estos antígenos tienen una muy alta probabilidad de prueba cruzada linfocitaria positiva por citotoxicidad.
Las técnicas serológicas como la CDC cada vez se emplean menos. Se está sustituyendo por métodos más sensibles en fase sólida que pueden identificar anticuerpos específicos de manera más rápida y sencilla.
La prueba cruzada ocrossmatch consiste en enfrentar las células de un donante determinado con el suero del receptor para detectar la presencia de aloanticuerpos preformados contra ese donante. En la práctica clínica se realiza mediante dos técnicas:
- A)
Prueba cruzada linfocitaria por Citotoxicidad o «Crossmatch-CDC» (XM-CDC) entre receptor y donante: basada en la técnica CDC, se incuba el/los sueros(s) del receptor con los linfocitos del donante en presencia de complemento. La positividad de la reacción se visualiza con ayuda de un colorante vital, que penetra a través de la membrana celular si ha sido permeabilizada por el complemento. Detecta anticuerpos de clase IgG1, IgG3 e IgM. La reacción se cuantifica según el porcentaje de células muertas, por lo que la viabilidad celular en la muestra de partida es fundamental. Esta prueba cruzada, se puede realizar a partir de linfocitos totales o de subpoblaciones celulares. Si se separan las subpoblaciones de linfocitos T y B es posible diferenciar los anticuerpos anti HLA-I de los anti-HLA-II. Se puede realizar un tratamiento con DTT (que destruye las IgM) para diferenciar anticuerpos linfocitotóxicos de tipo IgM (generalmente autoanticuerpos) de los de tipo IgG. Para conocer de forma aproximada la «cantidad» de aloanticuerpos anti-HLA en el receptor se puede detectar la citotoxicidad del suero a diferentes diluciones (desde 1/1 a 1/512). Este análisis tiene interés en caso de pretender desensibilizar al receptor. El crossmatch por citotoxicidad pronostica un alto riesgo de rechazo hiperagudo y su positividad contraindica el TR. Tiene un alto valor pronóstico positivo (VPP) sobre la pérdida del injerto (80%)2.
- B)
Prueba cruzada linfocitaria por citometría de flujo entre receptor y donante (FCCM): La unión de los anticuerpos del suero del receptor a los antígenos de membrana de los linfocitos del donante se identifica con una anti-inmunoglobulina humana (generalmente un Fab2-anti-IgG) marcada con un fluorocromo detectable por citometría de flujo. Para identificar los subtipos de linfocitos con los que reacciona el suero, se emplean anticuerpos monoclonales marcados con otros fluorocromos. Habitualmente, se utiliza anti-CD3 para identificar los linfocitos T y anti- CD19 para identificar los linfocitos B. Las células T (sin activar) expresan solo HLA-I mientras que las células B expresan HLA-I y HLA-II. Así los anticuerpos anti-HLA-I reaccionarán con las células T y B, mientras que los anticuerpos anti-HLA-II solo reconocerán los linfocitos B. Permite también descartar autoanticuerpos IgM. La positividad se calcula generalmente en base al Cambio en el Canal Medio de Fluorescencia = [Canal medio del suero problema] – [Canal medio del control negativo]. El dintel de positividad debe establecerse en cada laboratorio. Los valores de corte habituales pueden ser distintos para linfocitos T (CD3 + ) y para linfocitos B (CD19 + ). El crossmatch por citometría indica un aumento de riesgo de pérdida al año del injerto, bajo en el primer trasplante (10%), pero mayor en el retrasplante (30%)333.
Las técnicas en fase sólida se fundamentan en la unión a una «fase sólida» de antígenos HLA purificados a partir de células de múltiples individuos y unidos a una superficie de plástico. Se pueden usar placas de ELISA (menos frecuentemente), o un conjunto de microesferas de poliestireno o «bead arrays» (más frecuente). Estas microesferas de poliestireno recubiertas con las moléculas HLA tienen un marcaje fluorescente interno identificable por citometría (Luminex). La reacción se revela con un anticuerpo secundario, generalmente anti-IgG humana, marcado con fluorocromo, por lo que detectan aloanticuerpos IgG tanto si son activadores de complemento (IgG1, IgG3) como si no lo activan (frecuentemente IgG2, IgG4). No se detectan anticuerpos de tipo IgM (excepto que se utilice una anti-IgM como anticuerpo secundario), ni aquellos dirigidos contra antígenos no HLA (por ejemplo, autoanticuerpos).
Las técnicas de fase sólida basadas en la tecnología Luminex más habituales son:
A) Cribaje o «Screening Bead arrays»: cada microesfera contiene moléculas HLA de clase I o II naturales de múltiples individuos. Permiten identificar la existencia o no (positivo/negativo) de aloanticuerpos contra HLA de clase I o II pero no determinar su especificidad. En algunos kits también se detecta la presencia de anticuerpos anti-MICA. Tiene mayor sensibilidad que la detección de anticuerpos por citotoxicidad (CDC)334,335.
B) Microesferas con antígenos aislados o «Single Antigen Bead arrays»: cada microesfera está recubierta con un solo alelo HLA clase I o clase II obtenido mediante recombinación genética, por tanto, se trata de antígenos recombinantes. Permite identificar directamente la especificidad de los anticuerpos. Esto es muy útil, sobre todo en pacientes hipersensibilizados, ya que hace posible la identificación de aquellos antígenos que aún siendo incompatibles se pueden considerar aceptables, es decir, aquellos alelos contra los que el receptor no tiene aloanticuerpos. A partir de las especificidades positivas, se puede calcular un PRA calculado o PRAc, que tiene el mismo significado que el PRA clásico por CDC.
No existe un criterio común entre los diferentes laboratorios para definir qué nivel de anticuerpos (Median Fluorescence Intensity [MFI]) es relevante y cual no lo es336. Además, dependiendo del kit empleado, los puntos de cortes son distintos. Por tanto, cada laboratorio tiene que establecer su punto de corte de MFI y la consideración de positividad/negatividad. Es importante diferenciar entre el positivo técnico según los criterios establecidos por el fabricante del kit y el positivo en el contexto clínico del riesgo asumible a sufrir un rechazo mediado por anticuerpos.
Enfrentando el perfil de especificidades de aloanticuerpos positivas y la tipificación HLA de un donante concreto se puede obtener el resultado del denominado Crossmatch Virtual que permite predecir el resultado del crossmatch real celular. El Crossmatch Virtual tiene un alto valor predictivo negativo sobre el crossmatch por citotoxicidad, aunque su valor predictivo positivo es menor (es decir detecta anticuerpos no evidenciables por citotoxicidad)325. Hay que tener en cuenta que el crossmatch virtual por fase sólida positivo indica un incremento del riesgo de un episodio de rechazo mediado por anticuerpos (variable según el estudio, del 5 al 55%)337,338 pero no contraindica necesariamente el trasplante.
Los métodos de fase sólida tienen la ventaja que no detectan anticuerpos contra antígenos no HLA. Sin embargo, existe la posibilidad teórica que en el proceso de obtención y unión a la fase sólida las moléculas HLA puedan sufrir cambios conformacionales que interfieran con la unión a algunos aloanticuerpos o que den lugar a reacciones inespecíficas.
En los últimos años han adquirido importancias variantes de la técnica estándar que permiten la determinación de anticuerpos anti-HLA fijadores de complemento. Así existen métodos comerciales capaces de determinar si los anticuerpos fijan C1q o C3d. La determinación de la capacidad de los aloanticuerpos anti-HLA de fijar complemento podría estar indicada en pacientes con rechazo mediado por anticuerpos agudo precoz para determinar cuál es el tratamiento más adecuado339,340.
Otras variantes de la técnica permiten la identificación de anticuerpos IgM o el estudio de las diferentes subclases de IgG (IgG1, IgG2, IgG3, IgG4). A pesar de que es conocido que IgG3 e IgG1 tienen capacidad de activar complemento, mientras que IgG2 e IgG4 no, el papel de cada una de estas subclases en el desarrollo del rechazo aún no está suficientemente claro como para llevar estas determinaciones a la práctica clínica.
Esquema de estudio de la pareja donante-receptorEvaluación de la sensibilización HLA en el receptorDentro del estudio para TRDV es fundamental la realización de una historia clínica inmunológica detallada en la fase inicial de evaluación del donante y del receptor. Se recomienda que esta historia incluya:
A) Eventos sensibilizantes del receptor329
Los eventos sensibilizantes HLA que se deben recoger en la historia clínica son:
- -
Embarazos (incluye embarazos a término y abortos)
- -
Transfusiones
- -
Trasplantes previos
- -
Implantes (dispositivos de asistencia ventricular, válvulas biológicas, entre otros.)
En algunos documentos de consenso, además, se recomienda detallar eventos inflamatorios que puedan reactivar la memoria alloinmune pre-existente como: cirugías mayores, infecciones graves o vacunación reciente263. Además, es relevante recoger información sobre el tratamiento con agentes biológicos que puedan generar falsos positivos con las técnicas celulares (anticuerpos anti-CD20, anti-IL6, etc)
B) Relación entre receptor y potenciales donantes
Conocer la relación entre receptor y donante es útil para ofrecer una aproximación inicial del grado de compatibilidad entre ambos y puede ser una herramienta fundamental en la toma de decisión cuando existen varios potenciales donantes o en caso de receptores con un alto grado de sensibilización HLA.
Estos son datos de especial interés en la práctica clínica:
Hermanos: posibilidad de pareja D/R HLA idéntica. Se asocia a una supervivencia más larga del injerto. Y es de especial interés en receptores hiperinmunizados (por ejemplo, retrasplantes)
Padres/hijos: compartirán, al menos, un haplotipo.
Mujer cuyo donante es el padre de sus hijos: posibilidad de incompatibilidad HLA por la exposición de la receptora a antígenos HLA del donante durante los embarazos.
Esta información se debe compartir con los laboratorios de Histocompatibilidad para la correcta interpretación de los resultados del estudio inmunológico.
c) Estudio de anticuerpos anti-HLA (informe de PRA)
El estudio de un receptor de TR incluye la determinación de anticuerpos HLA. Como se ha descrito previamente en este capítulo, las técnicas de detección de anticuerpos HLA nos permiten medir el grado de sensibilización del receptor: panel de anticuerpos citotóxicos o PRA CDC (con técnicas de linfocitotoxidad) o PRA c (con técnicas en fase sólida- Luminex®). El PRA nos informará de la posibilidad de acceso a un trasplante del receptor y será fundamental para el abordaje de estudio de una pareja donante-receptor.
El estudio inmunológico del receptor y su seguimiento inmunológico se escapan de las competencias de este capítulo. Las recomendaciones sobre el estudio del receptor más actualizadas son las publicadas en las últimas Guías KDIGO sobre evaluación y manejo de los receptores de TR y las del proyecto STAR263,341.
Tipificación y compatibilidad HLALa tipificación del receptor y de todos los potenciales donantes vivos se debe realizar mediante técnicas de biología molecular. No se recomienda realizar tipificación mediante métodos serológicos ya que no ofrecen la resolución suficiente para adjudicar potenciales anticuerpos dirigidos frente a un alelo concreto.
Actualmente, se recomienda realizar tipificación alélica (dos dígitos) de, al menos, los loci HLA-A, -B, -C, -DR y -DQ137. En las últimas guías KDIGO, la recomendación es tipificar los loci que permitan realizar una correcta interpretación de los anticuerpos HLA del receptor (por ejemplo, en receptores con anticuerpos frente HLA-DP, se recomienda tipificar este loci en el receptor y sus potenciales donantes)329. Aunque lo más adecuado es realizar la tipificación completa de 11 loci: HLA-A, B, C; HLA-DRB1, 3, 4, 5; DQB1, DQA1; DPB1, DPA19. Esta información será fundamental para la correcta interpretación del grado de compatibilidad entre D/R y el análisis de anticuerpos HLA, tanto preformados como de novo postrasplante.
El número de incompatibilidades (missmatch) entre donante y receptor puede ser relevante especialmente si hay más de un potencial donante o en receptores jóvenes con alta probabilidad de necesitar un nuevo injerto renal a lo largo de su vida. Además, es factor de riesgo para desarrollo de DSA de novo y por tanto tiene impacto en el desarrollo de rechazo mediado por anticuerpos y supervivencia del injerto333.
- -
Compatibilidad HLA a nivel antigénico/alélico. - El nivel de compatibilidad HLA entre donante y receptor se expresa con el número de especificidades HLA para cada locus del donante que están ausentes en el receptor. Avances en las técnicas de tipificación HLA han permitido mejoras en el análisis de la compatibilidad D/R pasando de determinar esta compatibilidad en los locus HLA-A, -B, -DR a nivel antigénico a disponer de la compatibilidad HLA en 11 locus a nivel alélico.
- -
Compatibilidad HLA a nivel epítopo. - La introducción de las técnicas de tipificación molecular y el conocimiento de la estructura tridimensional de una molécula de HLA ha permitido identificar patrones de reconocimiento de anticuerpos a nivel de la disposición de los aminoácidos en estas moléculas. Esta compatibilidad HLA se basa en que cada molécula HLA es estructuralmente única y que no puede existir respuesta inmunológico frente a epítopos propios342. Basado en estos principios se han desarrollado diferentes software para establecer la compatibilidad entre donante y receptor a nivel epítopo. El primero en desarrollarse fue HLAMatchmaker 16, que es un algoritmo informático para calcular el número de eplets incompatibles entre donante y receptor. Posteriormente, se han desarrollado otros algoritmos como Pirche-II 343 o HLA-Emma344.
En la actualidad, el uso de estos programas para la aproximación a la incompatibilidad HLA a nivel epítopo en el trasplante de donante vivo no se hace de forma rutinaria en los Laboratorios de Histocompatibilidad.
Estudios de compatibilidad entre receptor y potenciales donantesAdemás de conocer el grado de compatibilidad HLA entre donante y receptor, el estudio inmunológico de una pareja para TRDV incluye la realización de pruebas cruzadas pretrasplante que confirmen la ausencia/presencia de aloanticuerpos específicos frente al donante.
La prueba de compatibilidad virtual (crossmatch virtual [XMV]) se define como la evaluación inmunológica basada en el perfil de aloanticuerpos del receptor comparados con los antígenos HLA del donante. Este XMV virtual cada vez está cobrando más importancia y aceptación dentro de los programas de trasplante y nos permite una aproximación inicial en el abordaje inmunológico para estudio de trasplante de donante vivo. Sin embargo, en el TRDV, dado que es programado, no se recomienda realizar solo prueba de compatibilidad virtual331.
Para el estudio de TRDV se recomienda realizar siempre un estudio de compatibilidad directo con una prueba cruzada física, mediante técnicas de CDC (XM CDC) y/o citometría de flujo (XM CF), antes del trasplante. La recomendación es realizar la prueba cruzada final 14 días antes de la fecha programada de trasplante28.
No existen recomendaciones sobre el tipo de prueba cruzada física (XM CDC vs. XM CF) recomendada para el estudio en un TRDV. En las guías KDIGO se recomienda realizar una prueba cruzada por citotoxicidad o por citometría de flujo, sin preferencia sobre una u otra263. En las guías británicas, recomiendan realizar prueba cruzada por citometría de flujo en receptores con anticuerpos preformados frente a HLA clase I (utilizando linfocitos T del donante) y/o clase II (con linfocitos T y B del donante), además de realizar una prueba cruzada CDC con linfocitos T y B con suero del receptor no tratado y tratado con DTT que nos dará más información para una adecuada estratificación del riesgo inmunológico137.
Tampoco existen estudios que evalúen el número de pruebas cruzadas que se deben realizar en una pareja. Deben realizarse nuevos estudios de compatibilidad si el receptor ha tenido algún evento sensibilizante o existe discordancia entre las pruebas. Dado que el TRDV es un acto programado, parece razonable realizar prueba cruzada física con técnicas de citotoxidad y con técnicas de citometría de flujo para un correcto abordaje del riesgo inmunológico dado que ambas pruebas ofrecen información que resulta complementaria338.
Aunque es poco frecuente (< 20%) pueden existir resultados discordantes entre ambos tipos pruebas cruzadas. La correcta interpretación de estas por parte de los Laboratorios HLA junto con los equipos de trasplante es fundamental para determinar el riesgo inmunológico337 (tabla 10).
Interpretación de posibles resultados discordantes entre ambos tipos pruebas cruzadas por parte de los Laboratorios HLA junto con los equipos de trasplante es fundamental para determinar el riesgo inmunológico
| Prueba cruzada virtual | Prueba cruzada física | Interpretación |
|---|---|---|
| - | - | Concordante |
| + | + | Concordante |
| - | + | Discordante:- Considerar falso positivo*,a- Cutoff MFI elevado- Anticuerpo o alelo específico no testado en SAB- Anticuerpos no HLA |
| + | - | Discordante:- Bajo nivel de Acs HLA- Anticuerpos frente a antígenos desnaturalizados- Viabilidad de las células del donante |
Cuando abordamos el estudio de una pareja donante/receptor desde el punto de vista inmunológico, lo primero es conocer la historia inmunológica del receptor y su grado de sensibilización. Con esta información podemos clasificar en:
Receptor varón sin eventos sensibilizantes. Ya en la etapa inicial de estudio podemos aproximar que el XMV con su donante es negativo. Por tanto, podemos realizar la tipificación HLA de donante y receptor, así con el XM físico en etapas más avanzadas. Solo en caso de que exista más de un potencial donante, nos podemos plantear realizar tipificación del receptor y potenciales donantes en una fase inicial para conocer el grado de compatibilidad entre ellos, que será una herramienta relevante a la hora de tomar la decisión para aceptación de uno u otro donante. En la etapa final de estudio, realizaremos prueba cruzada por CDC y citometría de flujo y tipificación si no se ha realizado previamente.
Receptor con eventos sensibilizantes. Proponemos realizar inicialmente XM virtual para evaluar compatibilidad y riesgo. Para ello, además del estudio de Acs HLA en el receptor, realizaremos tipificación del donante y del receptor.
Si el XMV resulta positivo con anticuerpos preformados dirigidos frente al donante que tienen una MFI muy elevada y la prueba cruzada física es positiva, el trasplante directo sin tratamiento desensibilizador quedará descartado por el alto riesgo de rechazo mediado por anticuerpos precoz. Propondremos realizar trasplante cruzado dadas las pocas posibilidades de desensibilización HLA. Si la MFI de los DSA es baja, plantearemos estrategias de desensibilización HLA y/o inclusión en programa de TR cruzado.
Si el XMV es negativo, podemos esperar a una fase final para realizar XM físico.
Estimación del riesgo inmunológico (fig. 10)Con los resultados obtenidos con las diferentes técnicas podremos realizar una aproximación al riesgo inmunológico, que es fundamental para aceptar a un potencial donante, establecer una estrategia de inmunosupresión del receptor e incluso poder compartir información pronóstica263. En la figura 10 se muestra el riesgo inmunológico según los resultados de las pruebas de compatibilidad virtual y física.
Los receptores que tiene prueba cruzada por CDC y/o citometría positiva con prueba cruzada virtual positiva presenta un riesgo muy elevado con desarrollar rechazo hiperagudo (especialmente en pacientes con prueba cruzada por CDC positiva)317 y agudo precoz mediado por anticuerpos345. En estos casos, el TR directo está desaconsejado y la aproximación es inclusión de la pareja donante/receptor en programas de TR cruzado.
Si el crossmatch virtual es positivo pero con prueba cruzada por CDC y citometría de flujo negativa el riesgo inmunológico es alto346 y debemos considerar estrategias de desensibilización para salvar la barrera de incompatibilidad HLA en pacientes con anticuerpos dirigidos frente al donante que tienen niveles de MFI medios-bajos347. Sin embargo, si la MFI de estos anticuerpos es muy elevada con pocas probabilidades de éxito en la desensibilización para conseguir niveles relativamente seguros para realizar TR directo podemos optar por el TR cruzado.
Los potenciales receptores de TR que presentan prueba cruzada virtual y física negativa serán candidatos a TR directo con riesgo inmunológico alto (en caso de pacientes con alto grado de sensibilización con PRAc alto) o estándar (receptores con PRAc bajo). Debemos tener en cuenta que existe una potencial respuesta de memoria inmunológica latente en receptores con trasplante previo cuyo actual donante comparta alguna incompatibilidad o en receptoras mujeres con embarazos previos cuyo donante es el padre de los hijos341. La monitorización o vigilancia estrecha postrasplante en este tipo de receptores puede hacer anticiparnos al desarrollo de esta respuesta potencial generadora de un rechazo mediado por anticuerpos. El riesgo inmunológico será muy bajo en el caso de hermanos HLA idénticos.
Recomendaciones en el manejo de la incompatibilidad HLA (fig. 11)Las nuevas técnicas de detección de anticuerpos anti-HLA son más sensibles y es cada vez más frecuente encontrar parejas de donante vivo y receptor HLA incompatibles, especialmente en individuos con un PRA calculado muy elevado que dificulta sobremanera la posibilidad del trasplante348. Para ellos, especialmente, pero para cualquier potencial receptor con anticuerpos anti-HLA proponemos este algoritmo de trabajo junto con el receptor y potenciales donantes vivos para conseguir proporcionar un TR partiendo del donante vivo como mejor opción por calidad y por la oportunidad de evaluar el riesgo con detalle y planificar adecuadamente el trasplante y el tratamiento para ello.
En resumen, es esencial disponer de una buena caracterización del riesgo inmunológico y las oportunidades del receptor a través de una buena historia inmunológica. Los individuos con elevada sensibilización HLA se benefician de la posibilidad de disponer de un hermano HLA idéntico, incluso si es ABO incompatible, porque como veremos en los capítulos específicos, la eficacia del tratamiento de desensibilización ABO es mayor que la del HLA. Si no existen hermanos idénticos, la posibilidad de tener mayor grado de compatibilidad HLA (menor grado de incompatibilidad) reside en los familiares genéticamente relacionados. Si no se encuentra un donante vivo compatible, pero existe voluntad de donación, se debe valorar la intensidad de los anticuerpos anti-HLA donante específicos presentes en el receptor y considerar las opciones de TR cruzado o desensibilización HLA. En ocasiones, el tiempo de espera para conseguir un TR cruzado compatible o cuasi-compatible, se puede combinar con la inclusión en lista de espera para incrementar las posibilidades de TR.
Sección 10. Nefrectomía del donante vivoEl concepto de la nefrectomía de donante vivo mínimamente invasiva se ha ido desarrollando en los últimos 20 años. Con la mayor experiencia de los cirujanos en cirugía laparoscópica la nefrectomía laparoscópica de donante vivo es en la actualidad la técnica de elección en la mayoría de los centros trasplantadores349. La laparoscopia ha representado una revolución para el TRDV, ya que ha hecho la donación mucho más atractiva debido a las bajas complicaciones, corta estancia hospitalaria, menor convalecencia y mejores resultados estéticos32. Innovaciones como la cirugía a través de una única incisión laparoendoscopic single side surgery (LESS), la cirugía a través de orificios naturales, la retroperitoneoscopia y la cirugía robótica están establecidas en múltiples centros. La cirugía abierta con mini-incisión se sigue aplicando en diversos centros.
De la mano de la innovación quirúrgica y de la mayor experiencia de los centros de trasplante, los horizontes se han ensanchado para intentar conseguir un mayor número de órganos para trasplante. De esta forma, donantes con pedículo vascular complejo, litiasis y donantes vivos de riesgo no estándar se han considerado válidos.
En esta guía se desarrollan recomendaciones para seleccionar un donante y planificar la nefrectomía, aplicadas en diferentes situaciones especiales en el donante; además, se aportarán recomendaciones acerca de las diferentes técnicas quirúrgicas y sus posibles complicaciones.
Selección del donante y planificación de la cirugía- •
La nefrectomía izquierda de donante vivo es la habitualmente preferida, aunque puede llevarse a cabo la derecha, con complicaciones similares (calidad de la evidencia: SG).
- •
La nefrectomía del donante vivo con múltiples vasos o alteraciones anatómicas debe realizarse en centros con mayor experiencia (SG).
- •
Se recomienda descartar a donantes con ateromatosis extensa o displasia fibromuscular de ambas arterias renales (NG).
Una vez confirmada la viabilidad de la donación por sus características médicas, debe realizarse exploración física del donante y visualizar detenidamente los resultados del angioTAC. Es importante conocer los antecedentes quirúrgicos del donante, para prever posibles complicaciones durante la cirugía. El peso, y más específicamente, el aspecto físico, serán importantes a la hora de decidir la técnica quirúrgica. Si se pretende realizar una nefrectomía transvaginal debe efectuarse un tacto vaginal previo a la intervención para confirmar una buena elasticidad que permita la extracción del órgano con seguridad. En el caso de la nefrectomía LESS, el donante debe ser delgado y sin antecedentes de cirugías mayores previas abdominales, susceptibles de crear adherencias.
La evaluación anatómica de los donantes debe realizarse mediante una angio-tomografía con fase arterial, venosa y nefrográfica para identificar la vía urinaria y sus posibles alteraciones, los vasos y sus posibles anomalías. Esta exploración tiene una sensibilidad/precisión de más 95% en la detección de venas y arterias renales350,351. Los radiólogos son los responsables de reportar una información anatómica precisa, que dependerá de la experiencia del propio radiólogo.
A igualdad de condiciones, se prefiere la extracción del riñón izquierdo ya que presenta una vena más larga y esto facilita su posterior implante. Actualmente, el hecho de extraer un riñón derecho por laparoscopia ha dejado de ser una contraindicación y representa el 15-20% de las nefrectomías en la mayoría de las series. Una mayor tasa de trombosis del injerto en nefrectomías de donante vivo laparoscópicas derechas se había descrito históricamente. Varios estudios posteriores demostraron resultados similares entre ambos lados (2D)352. Para facilitar el implante renal en venas renales cortas se puede realizar una trasposición de la vena iliaca del receptor, hecho que reduce el espacio entre venas en la anastomosis353.
Variantes y alteraciones vascularesDurante el estudio de un donante vivo, podemos encontrarnos con diferentes situaciones que deben ser valoradas individualmente, teniendo en cuenta también las características del receptor. Una de ellas son pedículos renales complejos bilaterales (arterias y venas múltiples, displasia fibromuscular de la íntima, calcificaciones en el ostium arterial e incluso aneurismas).
Los riñones con pedículos múltiples actualmente están aceptados en la mayoría de los centros y han demostrado buenos resultados funcionales354,355. En aquellos casos con arterias múltiples, es preferible obtener una única boca anastomótica mediante cirugía de banco para el implante siempre que sea posible. Cuando las arterias son de calibre similar deben unirse entre ellas de forma laterolateral en «cañón de escopeta». En aquellos casos en los que las arterias tienen distintos calibres, las menores se anastomosan a la mayor (termino-lateral) mediante puntos sueltos o una continua de Prolene 7/0 (fig. 12A). Si la anatomía lo requiere, se puede realizar anastomosis independientes. En aquellos casos en los que se haya seccionado la arteria renal después de la bifurcación y por lo tanto tengamos vasos cortos, puede utilizarse la arteria hipogástrica y sus ramas del receptor para obtener un vaso viable (fig. 12B).
A: Anastomosis en cañón de escopeta y anastomosis termino- lateral en un riñón de donante vivo. B: Uso de la arteria hipogástrica para la obtención de una arteria única. C: Placas de ateroma en el ostium. D: Displasia fibromuscular de la íntima unilateral. Reparación en banco con injerto de cadáver. E: Reparación de aneurisma mediante injerto arterial de cadáver en cirugía de banco. F: Exéresis de tumor en cirugía de banco.
Cuando existan vasos polares superiores, se pueden desechar cuando son pequeños (< 2.mm) ya que no representan una pérdida significativa de función renal. Cuando los vasos polares son inferiores es más controvertido, porque dichos vasos irrigan el uréter y su ligadura podría provocar complicaciones de isquemia de la vía urinaria. Una opción a tener en cuenta si se decide su utilización es realizar una anastomosis urétero-ureteral con el uréter propio.
En el caso de venas múltiples, puede ligarse una de ellas si presentan diámetros dispares. Cuando las venas sean similares deberemos anastomosar las dos para procurar un buen drenaje venoso. Con la aceptación de una mayor edad del donante nos encontramos en ocasiones ateromatosis a nivel del ostium de la arteria renal. Cuando esta placa de ateroma es grande y bilateral, el donante debe descartarse (fig. 12C). En ocasiones estas placas son unilaterales, en dicho caso puede extraerse el riñón afecto teniendo precauciones especiales durante la extracción. Es importante colocar los clips con separación suficiente evitando la placa.
La displasia fibromuscular puede afectar a las arterias renales. Se trata de un grupo heterogéneo de cambios arteriales no ateroscleróticos ni inflamatorios responsables del desarrollo de cierto grado de estenosis, oclusión o aneurismas vasculares, que puede llegar a limitar el flujo renal. En el caso de la afectación bilateral, se descartará el donante. En aquellos casos en que la afectación sea unilateral, se puede considerar como donante y realizar una sustitución de la zona afectada en cirugía de banco mediante injerto renal de cadáver (fig. 12D).
Los aneurismas de la arteria renal son poco frecuentes, generalmente afectan la división arterial y tienen riesgo de ruptura cuando son mayores de 1,5.cm y no están calcificados. La nefrectomía en el donante con una arteria aneurismática es terapéutica. El riñón afecto puede ser reparado en banco utilizando un injerto de cadáver o la propia iliaca interna del receptor (fig. 12E).
Litiasis- •
La aceptación de donantes con antecedentes o presencia de litiasis debe basarse en el riesgo de su recurrencia posdonación (SG).
- •
Tras la donación deberán seguir las pautas específicas de la población general para prevención de recurrencia (SG).
- •
La extracción de litiasis en cirugía de banco es segura y reproducible (SG).
En un 5% de donantes el angioTAC pondrá de manifiesto la presencia de una litiasis asintomática356. Actualmente, estos donantes se consideran válidos para la donación en determinadas ocasiones. Debe tenerse en cuenta la historia clínica del donante, si ha padecido cólicos previos o tratamientos de la litiasis con anterioridad. La aceptación de dichos donantes se realizará en función del riesgo de recurrencia de la litiasis357 y el conocimiento por parte del donante de posibles consecuencias posdonación. Tienen alto riesgo de recurrencia los donantes de edad inferior a 40 años, los que tienen historia familiar de litiasis renal y los que tienen litiasis frecuentes y recurrentes. Si no tienen antecedentes y la litiasis es unilateral con un estudio metabólico correcto, estos donantes se pueden considerar válidos. Deberán ser controlados según las guías de litiasis para prevención de la recurrencia.
Una vez aceptados debe decidirse qué riñón extraer, con diferentes posibilidades. Si se detecta una microlitiasis unilateral, podemos extraer cualquiera de los dos riñones sin necesidad de tratar dicha litiasis. El riesgo de problemas futuros tanto para el donante como para el receptor es mínimo. Si se detecta una litiasis única pequeña (< 1.cm) unilateral, se extraerá el riñón afecto previa litotricia extracorpórea o bien se realizará una ureterorrenoscopia en banco358.
Tumores renales- •
Los riñones de donantes con tumor renal incidental menor de 4 cm y de bajo grado, pueden ser aceptados tras tumorectomía, informando del riesgo a donante y receptor (SG).
- •
Se recomienda controles oncológicos de forma periódica tanto para donante como para el receptor (SG).
Ligado a la edad del donante que cada vez es más avanzada nos encontramos con diagnósticos incidentales de masas renales pequeñas359. Estos tumores de menos de 4 cm suelen ser de bajo riesgo y bajo potencial metastásico. El tratamiento de elección es la nefrectomía parcial, que ha confirmado los mismos resultados oncológicos en la población general360. Dichos riñones (riñones de riesgo no estándar) se consideran válidos para el trasplante en función del receptor y siempre y cuando el paciente y el donante acepten el riesgo150,361,362.
El tumor se extraerá durante la cirugía de banco y se realizará biopsia peroperatoria para conocer los márgenes y las características del tumor. Mediante la biopsia fría, obtenemos información sobre agresividad (grado del tumor), que es suficiente en estos casos (fig. 12F)151,152,363.
Técnica quirúrgica- •
La nefrectomía de donante vivo laparoscópica es la técnica de elección ya que ofrece menor dolor posoperatorio, menor hospitalización y convalecencia más corta que la vía abierta (SG).
- •
La nefrectomía de donante vivo mediante lumbotomía puede estar indicada cuando el donante presente múltiples intervenciones abdominales y adherencias intraabdominales (B).
- •
La nefrectomía de donante vivo mediante mini-incisión es una opción válida para la donación (SG).
- •
La nefrectomía de donante vivo LESS o transvaginal debe realizarse en centros especializados (SG).
- •
La nefrectomía de donante vivo asistida por robot ofrece resultados similares a la laparoscópica, pero con un mayor coste económico (SG).
En la elección de la técnica quirúrgica se debe tener en cuenta la experiencia del cirujano para minimizar complicaciones y obtener un órgano de calidad. Tradicionalmente, la técnica quirúrgica de elección para la nefrectomía de donante vivo era la cirugía abierta a través de una lumbotomía, lo que comportaba una alta morbilidad y elevado riesgo de eventraciones. La mayor experiencia en cirugía laparoscópica ha permitido una expansión de dicha técnica en la mayoría de centros con buenos resultados para el donante y el receptor, minimizando las complicaciones364,365 y por eso la nefrectomía laparoscópica de donante es la técnica de elección366.
Todas las técnicas mínimamente invasivas requieren de la disposición del donante en decúbito lateral, con la colocación de tres o más trócares a través de la cavidad abdominal. La vía de extracción renal variará dependiendo de la técnica utilizada y esta puede ser una incisión periumbilical, un pfannestiel, en fosa iliaca y transvaginal.
La nefrectomía de donante vivo vía lumbotomía no se considera de elección, debido a la mayor incisión que requiere y, por lo tanto, un mayor dolor posoperatorio y estancia hospitalaria. La nefrectomía de donante vivo a través de una lumbotomía se puede considerar en determinadas circunstancias en que el donante presente múltiples intervenciones abdominales y adherencias intrabdominales.
Como alternativas se han desarrollado diferentes técnicas utilizando una mini-incisión a nivel anterior, en el flanco, subcostal o posterior que permite acceder al riñón de forma sencilla367. En estudios aleatorizados que comparan la cirugía mediante mini-incisión con la cirugía abierta clásica y laparoscópica, el tiempo quirúrgico de la mini incisión es mayor que con la lumbotomía clásica, aunque ofrece una menor morbilidad en el donante (menor necesidad de mórficos y rápida recuperación). Si la comparamos con la cirugía laparoscópica, los donantes requieren más analgesia y presentan una recuperación más lenta. En cuanto a los resultados funcionales del injerto no se han encontrado diferencias significativas en ninguna de las tres técnicas368,369. Dicha técnica permite realizar la nefrectomía con baja morbilidad y buenos resultados funcionales, por lo que constituye una buena alternativa en determinados medios en los que la laparoscopia aún no es viable370.
Nefrectomía de donante vivo vía laparoscópicaLa nefrectomía de donante vivo laparoscópica es la técnica de elección por las ventajas que ofrece frente a la cirugía abierta. Diferentes revisiones sistemáticas que comparan la técnica abierta con la laparoscopia concluyen que los resultados en cuanto a seguridad para el donante y para la función del injerto son similares. Cabe destacar que en dichos trabajos la nefrectomía abierta presentaba un menor tiempo quirúrgico con una mayor pérdida hemática. Además, la laparoscopia ofrecía un menor dolor posoperatorio, menor hospitalización y convalecencia371–374.
Una variante de la cirugía laparoscópica pura es la nefrectomía laparoscópica mano-asistida que se desarrolló para mitigar la curva de aprendizaje de la cirugía laparoscópica pura. Consiste en la introducción de la mano no dominante del cirujano durante toda la cirugía para facilitar las maniobras quirúrgicas y ofrecer una mayor seguridad. Los ensayos aleatorizados que comparan la laparoscopia pura con la mano-asistida en la nefrectomía de donante vivo no encuentran diferencias significativas entre ellas en cuanto a complicaciones, tasa de conversión, y estancia hospitalaria, con una menor isquemia caliente en el caso de la cirugía mano-asistida375,376.
Nefrectomía de donante vivo mediante retro-peritoneoscopiaEsta técnica se desarrolló para evitar la violación del peritoneo y reducir las posibles complicaciones a ese nivel. El abordaje retroperitoneal implica la realización de una cirugía en un espacio reducido y con una visión anatómica diferente a la que estamos habituados que sería la transperitoneal, confiriéndole mayor dificultad. Las posibles desventajas asociadas a dicha técnica son el riesgo de provocar pneumomediastino, pneumotórax, pneumopericardio o embolismo gaseoso377.
Un beneficio de esta técnica es evitar el contacto con el intestino y puede ser muy atractiva para donantes con abdómenes hostiles por cirugía previas. En un metaanálisis realizado para comparar le nefrectomía de donante vivo laparoscópica y retroperitoneal mano-asistida, no se encontraron diferencias en perdidas hemáticas, estancia hospitalaria y supervivencia del injerto. En cambio, la técnica retroperitoneal requería menor tiempo quirúrgico y menor isquemia caliente377. Recientemente, se ha insinuado que la retroperitoneoscopia puede ser de elección en el caso de los donantes derechos378.
Nefrectomía de donante vivo asistida con robotEs posible practicar la nefrectomía del donante vivo asistida con robot. La cirugía robótica permite movimientos más finos, con una mayor movilidad respecto a la laparoscopia convencional, todo ello con mayor coste económico. Un metaanálisis que compara la cirugía robótica con la laparoscópica objetivó un menor tiempo quirúrgico, menor isquemia caliente y menor sangrado en la laparoscopia convencional. En cambio, el dolor posoperatorio era menor en la robótica. No se encontraron diferencias en la estancia hospitalaria y niveles de creatinina entre técnicas379.
Nefrectomía de donante vivo a través de una única incisión (LESS)La cirugía mediante la técnica LESS implica la realización de una pequeña incisión a través de la cual se introducen varios instrumentos laparoscópicos para la realización de una cirugía intrabdominal, obteniendo los mismos resultados quirúrgicos que en la cirugía laparoscópica convencional, pero con menos morbilidad y mejores resultados estéticos380–386. Es una alternativa atractiva, ya que la cirugía se realiza a través de una única incisión mediante la cual se extrae el órgano.
Dos ensayos clínicos aleatorizados387,388 y estudios de cohortes389–391, comparan el LESS con la laparoscopia convencional, sin encontrar diferencias en cuanto a complicaciones y conversiones a abierta. Un menor sangrado se atribuye a la técnica LESS, pero con un mayor tiempo quirúrgico.
Nefrectomía laparoscópica transvaginal asistida de donante vivoLa vía asistida transvaginal permite la realización de la nefrectomía de donante vivo laparoscópica asistida por un puerto transvaginal a través del cual se extraerá el riñón. Dicha técnica mejora los resultados estéticos y reduce la morbilidad, al reducir las cicatrices abdominales392. No existen estudios que comparen dicha técnica con la laparoscopia convencional.
Sistemas de clipadoUn punto controvertido de la nefrectomía de donante vivo realizada por laparoscopia es el tipo de clipaje que se realiza sobre la arteria renal. Pueden distinguirse dos tipos de clipado: las grapadoras y los clips393. Inicialmente, se utilizaron grapadoras metálicas, que no están exentas de complicaciones mecánicas (malfuncionamiento de la grapadora), provocan un acortamiento de la arteria del injerto debido a su anchura, y son caras. Para subsanar estas dificultades, hace más de dos décadas se abogó por la utilización de clips tipo Hem-o-lok, que son más sencillos de aplicar y permiten obtener una arteria unos milímetros más larga, ya que no hace falta clipar la parte proximal. La práctica actual de los equipos de extracción renal en Europa muestra que la utilización de Hem-o-loks puede ofrecer buenos resultados en la nefrectomía de donante vivo. Sin embargo, tanto la FDA como el fabricante los contraindican para dicho uso por el fallecimiento de algún donante de manera excepcional tras hemorragia 394, 395
Sección 11. Cirugía del receptor en el TR de donante vivoLa cirugía del TRDV tiene una alta complejidad técnica que incluye la realización de anastomosis vasculares y de la vía urinaria, y que es realizada por equipos quirúrgicos dedicados al TR. En España, el TR es un área de conocimiento reconocida dentro del programa de la especialidad de Urología. Aunque en la mayoría de los centros el TRDV se realiza por vía abierta («gold standard»), también se ha explorado de forma experimental la vía laparoscópica396, y ya existen grupos que han publicado su experiencia con el TR robótico397. A pesar de ello, de momento, las Guidelines de la EAU (European Association of Urology), no lo recomiendan de forma rutinaria dada la falta de evidencia al respecto398.
En la presente revisión, describiremos la técnica quirúrgica de la cirugía del receptor tanto vía abierta como robótica para, posteriormente, analizar resultados y complicaciones. Finalmente, se analizará la forma de actuación en situaciones especiales como son trasplantes en receptores complejos: tercer-cuarto trasplante, pacientes con arteriosclerosis y TR en pacientes con alteraciones del tracto urinario.
Cirugía mediante abordaje abierto convencional- •
Se recomienda realizar cirugía de banco con técnicas de reconstrucción y alargamiento vena renal con vena safena y gonadal para conseguir una longitud óptima, en caso de riñón derecho con vena muy corta (calidad de la evidencia: B).
- •
No se recomienda administrar a todos los receptores de manera rutinaria profilaxis tromboembólica con heparina de bajo peso molecular (C).
- •
Se recomienda administrar profilaxis antibiótica en monodosis (A).
- •
Se recomienda ligar o coagular los linfáticos para evitar la aparición de linfoceles (A).
- •
Se recomienda mantener frío el riñón durante la cirugía, envolviéndolo con una gasa que contenga hielo triturado o colocando dos gasas con hielo encima y debajo del riñón (B).
- •
Se recomienda para la anastomosis del uréter en vejiga, la menor longitud posible de uréter y mantener la grasa periureteral para asegurar una adecuada irrigación (B).
- •
Se recomienda el reimplante extravesical tipo Lich Gregoire utilizando un doble J (A).
- •
Se recomienda la colocación de una malla profiláctica en pacientes obesos, diabéticos y/o tratados con inhibidores de diana de rapamicina en células de mamífero (mTOR) (A).
La cirugía del receptor se inicia cuando el cirujano recibe el riñón recién extraído del donante. En una mesa preparada para cirugía de banco se localiza la arteria renal y se inicia la perfusión399. Esta perfusión se prolonga hasta la salida de líquido claro por la vena renal y después de haber pasado unos 500-1.000 cc. Posteriormente, se inicia la cirugía de banco en la que se deben seguir de forma ordenada los siguientes pasos:
- -
Liberación de la grasa perirrenal para comprobar la correcta perfusión del injerto y verificar la ausencia de lesiones macroscópicas traumáticas o tumorales.
- -
Disección de la arteria y vena hasta conseguir una longitud adecuada para la anastomosis. La arteria no tendrá parche de aorta por lo que su ostium será menor. En caso de arterias dobles o triples el cirujano debe decidir si anastomosarlas entre ellas y cómo: término-lateral, laterolateral o por separado.
En casos especiales, se puede recurrir a técnicas de cirugía vascular utilizando la safena o un segmento de iliaca interna del paciente400,401. La vena cuando es derecha queda habitualmente corta, pero con suficiente longitud para ser anastomosada. Si la vena renal queda excesivamente corta, existen técnicas de reconstrucción con vena safena y vena gonadal para conseguir una longitud óptima402,403. La transposición de la arteria y vena iliaca es una maniobra que puede ser de utilidad para facilitar la anastomosis venosa353.
El receptor se sonda en campo estéril y previamente habrá recibido profilaxis tromboembólica con heparina de bajo peso molecular en caso de ser paciente de riesgo y profilaxis antibiótica en monodosis según protocolo específico de cada centro404.
La incisión habitual es una pararrectal en fosa iliaca derecha. Se diseca y separa el peritoneo de las estructuras retroperitoneales medial y cranealmente hasta identificar los vasos iliacos y crear el espacio adecuado para hacer el trasplante.
Después se disecan y liberan los vasos iliacos en las zonas donde se van a realizar las anastomosis. Debe elegirse un punto en el que los vasos no se acoden. La anastomosis debe realizarse alejada de zonas con calcificaciones vasculares y placas de ateroma para no hacer la anastomosis sobre ellas y evitar una posible disección arterial. Es recomendable ligar o coagular los linfáticos durante estas maniobras para evitar la aparición linfoceles durante el posoperatorio. Tras la colocación de un clamp en la vena del receptor para aislarla de la circulación, se realiza la venotomía, se irriga la vena del receptor con heparina y se hace una anastomosis venosa término-lateral con una sutura de 5/0 o 6/0 monofilamento continua. En la arteria se coloca un clamp y se hace la arteriotomía. La íntima del receptor y la del donante deben revisarse antes de empezar la anastomosis para asegurarse que no hay ninguna rotura. Posteriormente, se hace la anastomosis arterial término-lateral con una sutura de 6/0 o 7/0 monofilamento continua o puntos sueltos. Como ya hemos comentado, en el implante de un riñón de DV la anastomosis arterial es el momento más delicado de la cirugía ya que la arteria no tiene parche y en ocasiones puede tener un calibre muy reducido.
Toda la cirugía se realiza intentando mantener frío el riñón con hielo. Se puede hacer envolviéndolo con una gasa que contiene hielo o colocando dos gasas con hielo encima y debajo del riñón.
Una vez finalizadas las dos anastomosis se inicia la perfusión renal. En el TR de DV el riñón adquiere habitualmente un color rosado inmediato. Si no es así, se revisan por palpación vena y arteria, y se le indica al anestesiólogo que compruebe que los parámetros de tensión arterial son correctos. De igual modo, si existe duda, se puede realizar un eco-doppler intraoperatorio. Posteriormente, se procede a hacer el reimplante ureteral. Debe emplearse la menor longitud posible de uréter y mantener la grasa periureteral para asegurar una adecuada irrigación vascular en el uréter y así disminuir la probabilidad de estenosis ureterales y fístulas urinarias en el posoperatorio. Habitualmente, se hace un reimplante extravesical tipo Lich Gregoire dejando un catéter doble J405.
Al acabar la cirugía, se coloca un drenaje y se cierra la herida. Dada la posibilidad de aparecer una hernia incisional en el posoperatorio o durante el seguimiento, se recomienda la colocación de una malla profiláctica en aquellos casos de mayor riesgo: pacientes obesos, diabéticos o tratados con un inhibidor de mTOR (imTOR).
El drenaje se retirará al segundo o tercer día según el débito y la sonda vesical a los cinco a siete días.
Complicaciones quirúgicas- •
Se recomienda, ante una trombosis arterial, la exploración quirúrgica inmediata y según el aspecto macroscópico, valorar desmontar la anastomosis arterial, extraer el coágulo, perfundir el riñón y realizar reanastomosis (B).
- •
Se recomienda exploración quirúrgica inmediata ante el diagnóstico de una trombosis venosa. Si el injerto es viable puede realizarse una venotomía con trombectomía (B).
- •
Se recomienda tratar la estenosis significativa de arteria renal con angioplastia y colocación de stent vascular. En caso de trasplante muy reciente, estenosis larga o angioplastia fallida el tratamiento puede ser quirúrgico (B).
- •
Se recomienda tratar linfoceles mediante colocación de un drenaje percutáneo. Si el linfocele es grande y sintomático estará indicada la marsupialización laparoscópica (B).
- •
Se recomienda tratar la fuga urinaria inicial y de bajo débito de forma conservadora con sondaje uretral y nefrostomía o catéter doble J (B).
- •
Se recomienda que, si el tratamiento conservador de la fuga urinaria fracasa o la fuga es masiva y muy inicial, debe optarse por tratamiento quirúrgico: re-reimplante o anastomosis ureteral al uréter nativo (B).
Se recomienda que, ante una estenosis ureteral de > 3 cm o fracaso del tratamiento mínimamente invasivo, se opte por cirugía de re-reimplante o urétero-ureterostomía (B).
A pesar de los buenos resultados actuales406,407, el TRDV no está exento de complicaciones quirúrgicas. Las más frecuentes son (tabla 11):
Principales complicaciones postoperatorias en trasplante renal
| Complicación (%) | Clínica | Diagnóstico | Tratamiento |
|---|---|---|---|
| Hemorragia (0.2-25)398,408 | Hematoma | TC | Revisión quirúrgica si sangrado activo |
| Trombosis arterial (0,5-3,5)398,409 | Elevación creatininaAnuria | Eco-doppler | Cirugía inmediata |
| Trombosis venosa (0,5-4)398,410 | DolorElevación creatininaAnuria | Eco-doppler | Cirugía inmediata. |
| Estenosis arterial (1-25)398,411 | Elevación creatininaHTA refractaria | Eco-dopplerAngio-TC | <50% sin clínica: Observación>50%: Stent, Cirugía |
| Linfocele (1-26) 398,412 | DolorElevación creatininaFiebre, infección | EcografíaTC | Drenaje percutáneoMarsupialización |
| Fuga urinaria (0-9,3)398,413 | Aumento débito drenaje | Aumento creatinina en líquido de drenajeTCPielografía | Bajo débito: Nefrostomía, doble JAlto débito: Cirugía |
| Estenosis ureteral (0,6-10,5)398,414,415 | Dilatación vía urinariaElevación creatinina | NefrostomíaPielografía anterógrada | <3cm. Dilatación percutánea>3cm. Cirugía |
| Hematuria (1-34)398 | Hematuria | Clínico | Lavado vesicalRevisión endoscópia |
| Infección herida (4)398 | Dolor, exudado, infección | Clínico | Curas tópicasAntibióticos |
| Eventración (4)398 | Apertura de heridaRotura de aponeurosis | Clínico | Reparación con malla |
Hemorragia (0,2-25%): habitualmente, se manifiesta por un hematoma asintomático que no requiere actuación. En hematomas mayores que puedan comprimir los vasos, con inestabilidad hemodinámica y en los que la tomografía computarizada (TC) demuestre sangrado activo, será necesaria la revisión quirúrgica398,408.
Trombosis arterial (0,5-3,5%): suele ser consecuencia de un error técnico al hacer la anastomosis, aunque la aterosclerosis, rotura de la íntima, rechazo agudo, compresiones por hematomas o linfoceles, estados de hipercoagulabilidad, hipotensión severa e inmunosupresión pueden también participar en el cuadro. Se manifiesta por anuria y empeoramiento de la función renal. Se diagnostica mediante eco-doppler. Habitualmente, se aconseja la exploración quirúrgica inmediata, aunque las probabilidades de encontrar un injerto viable son pocas. Si eso ocurre, se desmonta la anastomosis arterial, para extraer el coágulo y se perfunde el riñón para volver a anastomosarlo398,409.
Trombosis venosa (0,5-4%): es una de las causas más importantes de pérdida del injerto durante el primer mes. Producida por errores técnicos, dificultades durante la cirugía, o un estado de hipercoagulabillidad en el receptor. La eco-doppler mostrará la ausencia de flujo venoso con una señal arterial anormal. La exploración quirúrgica es recomendable a pesar de que la mayoría de las veces se pierde el injerto. Si el injerto es viable puede realizarse una venotomía con trombectomía después de clampar la vena iliaca. Alternativamente, se puede explantar el injerto, extraerle el coágulo, perfundirlo e implantarlo de nuevo398,410.
Estenosis arterial (1-25%): suele ser tardía. Como factores de riesgo están la aterosclerosis de la arteria del donante, trauma sobre la arteria del donante durante la extracción, ausencia de parche de aorta, técnica de sutura (puntos sueltos o sutura continua) y lesión de la arteria iliaca durante el trasplante. Puede sospecharse en caso de HTA refractaria al tratamiento médico o aumento de la creatinina. Se diagnostica mediante eco-doppler y, en caso de duda, se realiza un angio-TC o una resonancia magnética. Las estenosis por encima del 50% se asocian habitualmente a empeoramiento de la función renal. En caso de estenosis < 50% sin repercusión clínica y analítica se puede optar por una observación estrecha. En caso de estenosis significativa > 50% el tratamiento de primera línea será la angioplastia con colocación de stent vascular. En caso de trasplante muy reciente, estenosis muy larga o angioplastia fallida el tratamiento puede ser quirúrgico398,411.
Linfocele(1-26%): La simple punción y vaciado recidiva en el 95% de los casos y añade riesgo de infección. La colocación de un drenaje percutáneo puede solucionar el problema en el 50% de los casos. Si el linfocele es grande y sintomático estará indicada la marsupialización laparoscópica398,412.
Fuga urinaria (0-9,3%): La fuga urinaria puede ser ureteral o vesical. El fallo de sutura del reimplante o la necrosis ureteral son las causas más frecuentes. La edad avanzada del receptor, el rechazo agudo y anomalías vesicales también se han asociado a esta complicación. Aparece la sospecha cuando aumenta el débito del drenaje y su líquido tiene la creatinina aumentada. Si la fuga es inicial y de bajo débito puede tratarse de forma conservadora (sondaje uretral o nefrostomía y catéter doble J). Si el tratamiento conservador fracasa o la fuga es masiva y muy inicial, es aconsejable el tratamiento quirúrgico en el que se puede hacer un re-reimplante o una anastomosis ureteral al uréter nativo398,413.
Estenosis ureteral (0,6-10,5%): Se considera que las estenosis tempranas (primeros tres meses de la cirugía) son por defectos en la técnica o problemas isquémicos. Si la estenosis es tardía (> 6 meses de la cirugía) pueden participar las infecciones, fibrosis, enfermedad vascular y rechazo. El diagnóstico se hará ante la presencia de dilatación de la vía urinaria y alteración de la función renal. El primer paso será colocar una sonda de nefrostomía y hacer una pielografía anterógrada. Las estenosis < 3 cm pueden ser tratadas con dilatación percutánea o incisión. Este tratamiento conservador soluciona el problema en el 50% de los casos, obteniéndose los mejores resultados en estenosis inferiores a 1 cm. Ante estenosis > 3 cm o fracaso del tratamiento mínimamente invasivo se optará por cirugía: re-reimplante, pielo-vesicostomía, reimplante con vejiga psoica o Boary Flap o urétero-ureterostomía398,414,415.
Hematuria (1-34%): Habitualmente, se produce por el sangrado del vaso que acompaña al uréter. La hemostasia cuidadosa durante el reimplante previene esta complicación. El lavado continuo vesical suele solucionar el problema. En caso de sangrado importante se llevará el paciente a quirófano para vaciar coágulos y coagular los vasos sangrantes398.
Infección de herida quirúrgica (4%): Los factores predictivos más frecuentes son: obesidad, edad > 60 años, anemia, hipoalbuminemia y cirugía prolongada. Las curas tópicas diarias y antibióticos en caso de celulitis asociada resuelven la infección398.
Eventración (4%): aparece con más frecuencia en obesos, diabéticos, antecedente de hematoma, rechazo del injerto, reintervención y uso de imTOR. La reparación de la hernia con la colocación de una malla será el tratamiento habitual398.
TR robótico- •
El TR robótico presenta buenos resultados a medio plazo y podría ser, en un futuro próximo, una alternativa a la cirugía abierta (SG).
- •
Una mayor tasa de función retardada del injerto, trombosis arteriales y no poder realizarse en pacientes con arteriosclerosis avanzada limita el TRR a receptores seleccionados (SG).
En 2015, dos centros realizaron los primeros trasplantes totalmente robóticos en Europa y desde entonces se han publicado numerosas experiencias de centros especializados y también de series multicéntricas416,417. El TR robótico es una alternativa a la cirugía abierta, factible, reproducible, segura y que ofrece ventajas quirúrgicas a la hora de realizar las anastomosis vasculares y el reimplante ureteral. El aumento de la visión y el elevado grado de libertad de movimientos que proporciona el robot ayudan a ello. Se ha sugerido también que potencialmente podría disminuir las complicaciones, estancia hospitalaria, dolor posoperatorio y mejorar los resultados estéticos respecto a la cirugía abierta418,419.
El TRR es una cirugía compleja, con múltiples pasos y que requiere del dominio de la cirugía robótica. El tiempo quirúrgico no debe prolongarse en exceso y es esencial un adecuado manejo de los líquidos y utilizar presiones intraabdominales adecuadas. De este modo, podría prevenirse la potencial reducción del flujo renal y en relación con el neumoperitoneo, así como una cirugía prolongada420–422. Algunos grupos han descrito buenos resultados durante el primer año de evolución423–426.
Técnica quirúrgicaEl paciente se coloca en posición de Trendelemburg 20°-30° y se procede al sondaje estéril. Se introducen cinco puertos, uno de ellos para la cámara y se acoplan los brazos del robot. Se inicia entonces la cirugía transperitoneal, preparando los vasos iliacos y también la vejiga para el reimplante posterior. En esta fase inicial se crea un colgajo peritoneal para retroperitonealizar el riñón al final del procedimiento. El riñón envuelto en una gasa con hielo se introduce en el paciente a través de una incisión periumbilical de 6 cm. que será cubierta por un dispositivo (Gelpoint). El Gelpoint permitirá introducir hielo alrededor del riñón durante la cirugía y también introducir el trocar de la cámara a través de este. Después de clampar con bulldogs la vena iliaca se hace una venotomía y una anastomosis venosa continua término-lateral con Goretex6/0. Se repite la maniobra con la arteria haciendo una anastomosis continua término-lateral de 6/0 Goretex. Se completa el reimplante extravesical siguiendo la técnica de Lich-Gregoire y finalmente se retroperitonealiza el riñón que queda fijado, reduciendo así el riesgo de torsión del pedículo.
Finalmente, se coloca un drenaje hipogástrico y se cierra la herida periumbilical. El drenaje se retirará al segundo o tercer día según el débito y la sonda vesical a los cinco a siete días.
Complicaciones del TR robóticoA pesar de estos buenos resultados, también se le han encontrado inconvenientes, como el no poderse hacer en pacientes con aterosclerosis severa, tasa de función retardada del injerto mayor de lo esperado y desarrollo de trombosis arteriales, a pesar de ser pacientes seleccionados. Las complicaciones tempranas no parecen superiores a las de las técnicas de implante convencionales397.
Receptores retrasplantados- •
Se recomienda para segundos trasplantes la utilización de la fosa iliaca libre, habitualmente lado izquierdo (B).
- •
Se recomienda para un tercer o cuarto trasplante hacer una trasplantectomía que puede ser previa o simultánea al implante (B).
Un porcentaje relevante de receptores van a requerir la realización de un segundo TR. Dicho TR se hace en la fosa iliaca libre, habitualmente la izquierda, y técnicamente no supone una dificultad superior. Se sabe que la evolución de los retrasplantes es mejor que la de pacientes que vuelven a dializarse y semejante a primeros trasplantes.
Existen pocas series de tercer y cuarto trasplantes que presenten sus resultados. El tercer o cuarto trasplante supone el retrasplante en una fosa renal operada y ocupada lo que implica una mayor dificultad técnica: cirugía prolongada, aumento del sangrado y segunda isquemia caliente, aumento del riesgo de lesión arterial o venosa debido a las adherencias posquirúrgicas y mayor riesgo de reintervención. Dependiendo de la localización y del tamaño del injerto no funcionante, se podrá realizar el trasplante en vasos iliacos más distales o en iliaca común y sector íleo-cavo. Habitualmente para un tercer y cuarto trasplantes será necesario hacer una trasplantectomía que puede efectuarse previa o simultáneamente al implante (en la mayoría de los casos). Hay autores que realizan el tercer o cuarto trasplante intraperitoneal en la línea media utilizando vasos más proximales y de esta manera se alejan de la fosa renal ocupada427. Igualmente, si ambas fosas iliacas están ocupadas puede estar indicado el trasplante ortotópico428. El tercer y cuarto trasplantes constituyen una opción válida con resultados aceptables, aunque son habitualmente un reto quirúrgico y médico por la elevada tasa de complicaciones429,430.
Receptores con arteriosclerosis severa- •
Se sugiere, en receptores con arteriosclerosis muy severa, valorar una prótesis aorto-femoral seis a 12 meses antes del trasplante o un trasplante ortotópico (C).
La arteriosclerosis severa y la vasculopatía periférica son factores de riesgo relacionados con la pérdida del injerto y también dificultan la cirugía. Se sabe, además, que los pacientes en insuficiencia renal crónica tienen placas escleróticas más gruesas que la población general y también grosores de la íntima y media mayores, especialmente después de largos periodos en diálisis.
La detección de los pacientes con problemas vasculares se inicia en la consulta externa. Los pacientes con claudicación intermitente y sin pulsos pedios deben ser valorados por el cirujano vascular. El angio-TC pre-trasplante será clave para valorar las potenciales dificultades quirúrgicas431. En pacientes con calcificaciones, el cirujano busca por palpación un segmento arterial libre y realiza el trasplante. Si se prevé dificultad para colocar los clamps proximal y distal a la anastomosis, existe la posibilidad de utilizar un balón de oclusión arterial que se introduce percutáneamente y que ocluye la circulación proximal y distal a la zona elegida para la anastomosis.
A pesar de ir con precaución en ocasiones al hacer la arteriotomía, se puede apreciar un cierto desplazamiento de la íntima. En esos casos, es necesario fijarla con un punto para evitar una disección arterial durante la reperfusión. En casos muy severos puede ser crucial hacer una endarterectomía fijando la íntima distal a la pared431.
En ocasiones, los vasos iliacos comunes y externos se encuentran totalmente ocupados por calcificaciones. En estos casos hay dos opciones, colocar una prótesis aorto-femoral o hacer un trasplante ortotópico. La prótesis vascular se coloca habitualmente entre seis y 12 meses antes del trasplante y sobre esta prótesis se hará la anastomosis arterial. Hacer el by-pass aorto-femoral y el trasplante en el mismo procedimiento es factible, pero supone una cirugía larga y de riesgo431. Podría indicarse en trasplantes de DV en los que los equipos de cirugía vascular y urología conocen y se han preparado para la cirugía. El trasplante ortotópico es otra opción en caso de calcificaciones difusas428.
Receptores con problemas de vejiga y vías urinarias- •
Se recomienda realizar estudio urodinámico pretrasplante a los pacientes con sospecha de tener problemas funcionales vesicales (B).
- •
Se recomienda que, en caso de vejigas de altas presiones en las que esté indicada la ampliación vesical, esta se realice preferentemente antes del trasplante (B).
Las principales alteraciones urológicas causantes de insuficiencia renal son el reflujo vésico-ureteral, las válvulas uretrales, vejiga neurógena 10-37% y síndrome de Prune Belly. Por tanto, la mayoría son anomalías que aparecen en la edad pediátrica y los pacientes se trasplantarán habitualmente antes de ser adultos432.
Por otro lado, hasta un 20% de pacientes adultos candidatos a recibir un TR tendrán anomalías del tracto urinario. Tendrán riesgo de tener anomalías del tracto urinario: pacientes con vejiga neurógena, mielomeningocele, espina bífida, traumatismo vertebral, esclerosis múltiple, enfermedades degenerativas del sistema nervioso central, accidente vascular cerebral, vejiga desfuncionalizada, vejiga fibrosada (por radioterapia, tuberculosis, tumor vesical), estenosis de uretra, derivaciones urinarias y obstrucción infravesical432. En estudio pretrasplante de estos pacientes debe hacerse un buen interrogatorio, exploración física y evaluarse mediante exploraciones la capacidad vesical, acomodación y el vaciado vesical. Para ello, se indicarán: 1) uretrografía retrógrada y miccional que nos dará información fundamentalmente de la anatomía de la uretra, de la capacidad vesical y de la presencia de reflujo y 2) estudio urodinámico que aportará información sobre la fase de llenado (capacidad vesical y acomodación), fase de vaciado (contracción del detrusor y obstrucción infravesical)432.
Dependiendo del resultado de estas exploraciones, podrá disponerse de una estrategia postrasplante que puede ir desde la observación a la realización de autocateterismos o una cirugía desobstructiva. En caso de vejigas de altas presiones en las que esté indicada la ampliación vesical, esta se realizará preferentemente antes del trasplante432.
En el TR con vejigas ampliadas se intentará hacer el reimplante en la parte vesical efectuando un túnel submucoso o un reimplante tipo Lich Gregoire. En reservorios continentes con colon se hará un túnel submucoso. En pacientes con un conducto ileal, se implantará el riñón de forma invertida para que el uréter quede proximal y más cercano a la derivación urinaria. En estos casos, el reimplante se hará tipo Bricker. En pacientes con un Mitrofanof al ombligo debe tenerse en cuenta la disposición de la derivación a la hora de hacer el implante398.
Sección 12. Inmunosupresión en receptores de TR de donante vivoLa mayoría de los estudios en el campo de la inmunosupresión en TR han incluido donantes fallecidos y donantes vivos sin diferenciar los resultados, siendo muy escasa la investigación específica en receptores de TRDV. No hay evidencia suficiente que indique si la procedencia del injerto según el tipo de donante modifica el riesgo de rechazo agudo o pérdida del injerto de origen inmunológico433. Por tanto, con los conocimientos actuales tanto la terapia inmunosupresora de inducción como la de mantenimiento deben elegirse por criterios similares en TRDV y de donante fallecido.
La selección de la terapia inmunosupresora de inducción como la de mantenimiento dependen principalmente del riesgo del receptor de desarrollar rechazo agudo (el riesgo inmunológico). En las guías KDIGO se consideran pacientes de alto riesgo de padecer un rechazo agudo los que presentan una o más de las siguientes características434: una o más incompatibilidades en antígenos HLA, receptor joven y donante añoso, etnia afroamericana (en EE. UU.), anticuerpos reactivos contra panel mayores del 0%, presencia de DSA, incompatibilidad ABO, función retrasada del injerto o isquemia fría mayor de 24 horas. Se consideran pacientes de bajo riesgo inmunológico los que no presentan estos condicionantes.
Tratamiento inmunosupresor de inducción en TRDVTerapia de inducción en pacientes con bajo riesgo inmunológico- •
Se sugiere que tanto la terapia inmunosupresora de inducción como la de mantenimiento se elijan por criterios similares en TRDV a los utilizados con donante fallecido, ya que no hay evidencia de que la procedencia del injerto modifique el riesgo de rechazo agudo o pérdida del injerto (calidad de la evidencia: C).
- •
Se recomienda la asociación de terapia de inducción y fármacos inmunosupresores convencionales, ya que es superior a la terapia con fármacos convencionales sola en la reducción de rechazo del injerto renal y fallo del injerto (A).
- •
Se recomienda la inducción con basiliximab en receptores de TRDV de bajo riesgo inmunológico por su mejor perfil de eficacia y seguridad (B).
- •
Se sugiere evitar el uso de terapia de inducción con agentes depleccionantes de linfocitos o antagonistas del receptor de la interleukina en receptores de TRDV vivo HLA idénticos (C).
- •
Se sugiere la administración de al menos una dosis de esteroides intraoperatorios incluso en TRDV entre gemelos en los que no se use terapia de inducción (D).
Dado que el riesgo de pérdida del injerto es especialmente importante en los primeros meses postrasplante se han desarrollado terapias de inducción con agentes biológicos. No hay suficiente evidencia de que utilizar terapia de inducción con agentes biológicos sea superior a emplear la triple terapia inmunosupresora estándar en supervivencia de paciente e injerto ni en la función renal a largo plazo. No obstante, gran número de ensayos controlados y metaanálisis en todo el espectro de riesgo inmunológico sugieren que la asociación de terapia de inducción y agentes inmunosupresores convencionales es superior a la terapia aislada con agentes convencionales en la reducción de rechazo y fallo del injerto renal435-438.
En pacientes de bajo riesgo inmunológico la eficacia de la inducción con basiliximab439 ha sido probada en una revisión sistemática Cochrane de 71 estudios controlados y 10.537 pacientes440 y en revisiones sistemáticas. Comparada con placebo, los antagonistas del receptor de la IL-2 reducen las tasas de rechazo y la pérdida de injerto a un año, aunque no modifican la supervivencia de paciente e injerto a largo plazo; comparada con otros anticuerpos mono y policlonales muestra mejor perfil de seguridad441. Así, pese a los variables resultados obtenidos respecto a su eficacia con timoglobulina442–449 y alentuzumab450,451, la timoglobulina se asocia con un riesgo aumentado de efectos adversos como leucopenia, trombocitopenia, infección por CMV y mortalidad ligada a infecciones452–454 y alentuzumab presenta una mayor tasa de rechazo agudo tardío453, no es una medicación disponible en muchos centros y se le ha atribuido riesgo de inducción de enfermedades autoinmunes como trombocitopenia y enfermedad tiroidea autoinmune455,456.
Al analizar específicamente la evidencia en receptores de riñón de donante vivo con bajo riesgo inmunológico, aunque la timoglobulina parece mostrarse beneficiosa en algunos estudios de cohortes, al compararla con basiliximab457,458, dos recientes ensayos prospectivos muestran resultados similares con ambos459,460, con mayor tasa de infecciones por virus BK en el grupo de timoglobulina459.
Una razonable excepción al uso de terapia de inducción sería la constituida por receptores de riesgo inmunológico especialmente bajo, como son quienes reciben un riñón de un donante vivo emparentado HLA-idéntico. Cuando donante y receptor son gemelos idénticos, se han reportado buenos resultados tras la interrupción de tratamiento inmunosupresor461, si bien en muchos pacientes este se mantiene462; en cualquier caso, se recomienda la administración de al menos una única dosis de esteroides intraoperatorios para la prevención del riesgo de activación de respuesta inmune inducida por el daño isquemia-reperfusión463. También, cuando donante y receptor son HLA idénticos, pero no gemelos, diferentes estudios sugieren que es posible evitar el uso de terapia de inducción, pero no hay ensayos prospectivos que permitan conocer la mejor pauta inmunosupresora464–466.
Terapia de inducción en pacientes con alto riesgo inmunológico- •
Se recomienda la inducción con timoglobulina en receptores de TRDV de alto riesgo inmunológico (A).
- •
Se recomienda el uso de basiliximab como terapia de inducción en receptores de alto riesgo inmunológico cuando se desaconseje el uso de timoglobulina (B).
A nivel general, hay evidencia sustancial de que la globulina antitimocítica de conejo (ATG) es superior a placebo, a los anticuerpos contra el receptor de la IL2 y a inmunoglobulina antilinfocítica de caballo (Atgam®) entre pacientes con alto riesgo inmunológico439,445,467–470. Alemtuzumab es similar a timoglobulina en la prevención de rechazo agudo precoz, pero obtiene peores resultados en la tasa de rechazo agudo tardío450, supervivencia de paciente y de injerto y desarrollo de nefropatía crónica del injerto450,468,471,472. Como ya se ha mencionado, su falta de disponibilidad y la posibilidad de asociarse a la aparición de enfermedades autoinmunes han limitado su utilización452,453. Rituximab no parece añadir beneficio en la prevención del rechazo agudo en los seis primeros meses473, aunque sí se ha observado en pacientes de alto riesgo inmunológico474, y a tres años ha mostrado mayor mortalidad475, principalmente de origen cardiovascular, quizá por el efecto antiaterogénico que pueden inducir las células B depleccionadas por el rituximab476. Su utilidad más demostrada se encuentra en el trasplante ABO-incompatible, basada por una revisión sistemática de 45 estudios que muestran resultados comparables a la esplenectomía477.
Los estudios realizados en receptores de TRDV con alto riesgo inmunológico también describen la superioridad de la timoglobulina respecto a los anticuerpos anti-IL2 y a placebo456,478,479. Sin embargo, en pacientes en quienes no se aconseje la timoglobulina (por ejemplo, por leucopenia o plaquetopenia severas) es planteable su sustitución por basiliximab en combinación con tacrolimus, micofenolato y corticoides459.
La dosis óptima de timoglobulina no ha sido definida, pero para proporcionar eficacia suficiente en la prevención del rechazo agudo y reducir el riesgo de aparición de infecciones o linfomas puede ser de 3 a 6 mg/kg en total, administrando 2 mg/kg en los tres primeros días o bien 1-1,5 mg/kg durante cinco a siete días480–484.
Tratamiento inmunosupresor de mantenimiento en receptores de TRDVInmunosupresión inicial de mantenimiento en pacientes de alto riesgo- •
Se recomienda el uso de triple terapia inmunosupresora de mantenimiento durante el primer año de trasplante (A).
- •
Se recomienda la asociación de un inhibidor de la calcineurina (ciclosporina o tacrolimus), un antimetabolito (micofenolato mofetil o micofenolato sódico con cubierta entérica) y glucocorticoides para inmunosupresión de mantenimiento (A).
- •
Se recomienda el uso de tacrolimus frente a otros inhibidores de la calcineurina, incluida ciclosporina (B).
- •
Se sugiere el uso de ciclosporina cuando sea necesario evitar los efectos secundarios de tacrolimus (C).
- •
Se recomienda el micofenolato frente a otras agentes antimetabolitos como la azatioprina (B).
- •
Se recomienda evitar el uso de micofenolato en mujeres que intentan gestación por su teratogenicidad (B).
- •
Se recomienda el uso de azatioprina como alternativa al micofenolato en mujeres que intentan gestación (C).
Los regímenes más empleados en la terapia inmunosupresora de mantenimiento combinan varios fármacos con diferentes mecanismos de acción, buscando optimizar la eficacia y minimizar sus efectos secundarios. La mayoría de los centros combinan un inhibidor de la calcineurina (ciclosporina [CsA] o tacrolimus), un antimetabolito (micofenolato mofetil [MMF] o micofenolato sódico con cubierta entérica [MFS]), y glucocorticoides, principalmente la prednisona485–487. Transcurrido un tiempo después del trasplante, en casos de toxicidad o por la aparición de una neoplasia, se emplean mTOR como la rapamicina/sirolimus o el everolimus, si bien hay centros que utilizan de inicio una combinación entre un inhibidor de la calcineurina, prednisona y un imTOR. Y, en la evolución, se emplea belatacept en casos de toxicidad o de mala adherencia al tratamiento486–488.
La eficacia de la triple terapia inmunosupresora de mantenimiento en la prevención del rechazo agudo y la supervivencia del injerto a un año se basa en varios ensayos aleatorizados y controlados y metaanalisis448,487,489,490, y la confirman las guías KDIGO434. Varios estudios han demostrado beneficio de las combinaciones que usan micofenolato en comparación con las que incluyen un imTOR491,492, cuyo uso se ha visto asociado a complicaciones tempranas postrasplante como función retrasada del injerto, problemas en la cicatrización y aumento de la incidencia de linfoceles.
Entre los inhibidores de la calcineurina, el tacrolimus es claramente preferido frente a la ciclosporina493, pese a que, en general, las supervivencias de paciente e injerto sean similares, porque con tacrolimus se reducen más las tasas de rechazo agudo487,494,495, y la función renal del injerto parece ser mejor con tacrolimus a uno y dos años455. Sus efectos adversos muestran algunas diferencias488,496,497, por lo que para evitar los efectos secundarios de tacrolimus se ha sustituido a veces por ciclosporina de forma razonablemente segura498, o bien por belatacept o un imTOR, aunque la evidencia a favor del uso de estos últimos es escasa.
La evidencia de que retrasar la introducción del inhibidor de la calcineurina reduzca la incidencia de función retrasada del injerto es escasa448,499. Las guías KDIGO recomiendan no esperar al comienzo de la función del injerto para administrar el inhibidor de la calcineurina434.
Entre los agentes antimetabolito, aunque algunos estudios de cohortes han encontrado menores efectos gastrointestinales con MFS que con MMF500,501, los ensayos clínicos muestran que ambos son similares en eficacia y seguridad502,503. Las guías KDIGO 2009 los recomiendan frente a la azatioprina434 por su mayor capacidad de prevenir rechazo agudo y por su mejor perfil de efectos secundarios504.
La diarrea persistente puede llevar a la interrupción de micofenolato, pero su reducción o suspensión se ha asociado a un mayor riesgo de rechazo y fallo del injerto505,506. En el embarazo está contraindicado por ser teratogénico, y en mujeres que buscan gestación se prefiere el uso de azatioprina, que no parece afectar fertilidad ni embarazo507.
Respecto a los glucocorticoides, en el TR no hay consenso en la dosis óptima ni en la pauta de mantenimiento de, que depende del criterio de cada centro y de las características del paciente508-512, pero los datos Organ Procurement and Transplantation Network/Scientific Registry of Transplant Recipients (OPTN/SRTR) muestran que en la mayoría de los pacientes los glucocorticoides no se suspenden durante el primer año 513. Su suspensión comparada con la continuación de prednisona 5 mg/día no está asociada con mejoría en la sensibilidad a la insulina y puede magnificar el efecto mielosupresor de azatioprina, MMF o MFS514 y asociarse a aumento de riesgo de recurrencia de glomerulonefritis515.
Inmunosupresión inicial de mantenimiento en pacientes de bajo riesgo- •
Se sugiere la posibilidad de suspender la inmunosupresión de mantenimiento durante el primer año de trasplante entre gemelos idénticos (C).
- •
Se sugiere, en el caso de optar por minimizar la inmunosupresión, eliminar corticoides y/o anticalcineurínicos en trasplantes renales entre gemelos idénticos (D).
- •
Se sugiere comprobar el carácter monocigótico de la relación gemelar donante-receptor antes de decidir minimizar la terapia inmunosupresora (C).
- •
Se sugiere evitar el uso de anticalcineurínicos en el mantenimiento a largo plazo manteniendo MMF y/o corticoides, en receptores de TRDV HLA idénticos no gemelos (C).
- •
Se sugiere no retirar totalmente los corticoides en receptores de TRDV de bajo riesgo inmunológico no HLA idénticos por poder asociarse a un mayor riesgo de rechazo (C).
No hay consenso sobre la necesidad de inmunosupresión de mantenimiento en el trasplante entre gemelos idénticos, en quienes la genética hace esperar una ausencia de respuesta inmune en el receptor. Los estudios de registro muestran que la inmunosupresión se mantiene entre 1/3 y 2/3 de los pacientes, y que la supervivencia de paciente o injerto es similar en quienes mantienen inmunosupresión y quienes la suspenden461,462. En cualquier caso, se aconseja comprobar el carácter monocigótico de la relación gemelar antes de decidir minimizar la terapia inmunosupresora, ya que el 25% de gemelos no monocigóticos pueden presentar identidad HLA516 y la existencia de diferencias fenotípìcas entre gemelos no debería descartar la posibilidad de monocigosis, porque en su nivel de parecido influyen otros factores517. La tendencia más observada en la literatura de minimización de la inmunosupresión es la eliminación de los corticoides y de los anticalcineurínicos, para evitar su nefrotoxicidad433.
En pacientes caucásicos que reciben un injerto de donante vivo emparentado, no gemelar, HLA idéntico también se ha planteado una reducción en la inmunosupresión465,466,518,519, principalmente basada en la monoterapia con micofenolato y en la suspensión de corticoides. En estos pacientes incluso se ha observado una mayor pérdida de injertos por nefropatía crónica desde el comienzo de uso de los anticalcineurínicos464. Sin embargo, la retirada de tacrolimus y mantenimiento con everolimus y corticoides no parece aconsejable, porque se ha asociado a una alta tasa de rechazos520.
Finalmente, en pacientes de bajo riesgo inmunológico en los que no existe identidad HLA entre donante y receptor se ha sugerido el uso de terapia de inducción y la suspensión de la prednisona durante la primera semana postrasplante, para evitar sus efectos adversos434, pero no se dispone de ensayos de calidad que evalúen el efecto de esta suspensión a largo plazo, y hay estudios que describen que puede asociarse a una mayor probabilidad de rechazo y de pérdida del injerto521.
Fármacos alternativos en inmunosupresión de mantenimiento- •
Se sugiere la sustitución por imTOR en pacientes que no puedan recibir inhibidores de la calcineurina (C).
- •
Se recomienda la sustitución por belatacept en pacientes que no puedan recibir inhibidores de la calcineurina (B).
- •
Se sugiere limitar belatacept a pacientes con serología positiva a virus de Epstein-Barr (C).
Algunos ensayos sugieren que los imTOR proporcionan mejor función renal a uno o dos años, aunque no mejoran la supervivencia del injerto522,523. También menor riesgo de malignidad a largo plazo524. Otros estudios les atribuyen mayor riesgo de muerte de origen cardiovascular e infeccioso524, dislipidemia, linfoceles, toxicidad medular522 y rechazo agudo524. Su posible uso como alternativa en pacientes que muestran toxicidad con ciclosporina parece seguro525, pero su introducción en lugar de tacrolimus se asocia a un aumento en la tasa de rechazos526, lo cual también se confirma en el TRDV527,528.
Belatacept, al compararlo con ciclosporina, proporciona una mejor función del injerto a largo plazo, pero su tasa de rechazo agudo y de trastornos linfoproliferativos postrasplante, especialmente en los pacientes con serología negativa previa a EBV, es mayor529–531. Y al compararlo con tacrolimus presenta mayor tasa de rechazo agudo con variable efecto en la función renal a largo plazo532,533, aunque supone una alternativa en caso de toxicidad con inhibidores de la calcineurina534,535.
Sección 13. El receptor pediátrico de donante vivoAspectos demográficos del TR infantil- •
Se recomienda el TRDV emparentado como la terapia de elección de tratamiento sustitutivo en niños y se recomienda valorar realizarle de forma anticipada para obviar el paso transitorio por diálisis (calidad de la evidencia: B).
El TR es la forma ideal y universalmente aceptada de tratamiento de la ERCT del niño, ofreciendo un sinfín de ventajas reales sobre los otros tratamientos alternativos de reemplazo renal como la hemodiálisis hospitalaria o domiciliaria y la diálisis peritoneal. La tendencia compartida por los nefrólogos pediátricos es la realización de un TR anticipado que permita evitar el paso transitorio por diálisis; este hecho permite minimizar el impacto de la enfermedad renal y disminuir el gasto sanitario tanto de la institución como de la comunidad, permitiendo además innumerables ventajas sociales y familiares. Es excepcional la exclusión definitiva de un niño de un programa de TR y cuando por motivos médicos, quirúrgicos o psicosociales se hace, es siempre de forma transitoria.
A pesar de ello, la realización de un TR anticipado se consigue en nuestro medio tan solo en el 40% de los pacientes y globalmente el TRDV representa un 20-30% de todos los trasplantes pediátricos29.
Los diferentes registros revelan la tendencia mundial próxima al TR como práctica predominante en pediatría, no obstante, existe una disparidad entre los diferentes países que está influida por la renta per cápita y por la política nacional preferente de donación hacia el niño536. Así, con una escasa desviación entre los diferentes países, la incidencia media en Europa de tratamiento renal sustitutivo en niños es de seis nuevos pacientes anuales en por millón de habitantes menores de 14 años537, pero la prevalencia de TR es bastante dispar: los países nórdicos, Francia, Austria y España tienen más de un 85% de su población menor de 14 años en tratamiento renal sustitutivo como portadores de un TR, y este dato es más difícil de obtener de otros registros que no incluyen a toda la población nacional538,539. Europa, en general, cuenta con una política de prioridad para el trasplante pediátrico que prevalece por encima de la diálisis540,541.
Ventajas de la donación de vivo para el receptor pediátrico- •
Se recomienda el TRDV en la infancia como la opción que ofrece mejores resultados de supervivencia en el tratamiento de la ERC (B).
La consideración generalizada de que el TR es la mejor opción de tratamiento sustitutivo en niños y que debe ser la primera opción terapéutica se enlaza con la búsqueda de donante idóneo. En general el TRDV emparentado, y especialmente de padres a hijos, es una práctica habitual en los programas de trasplante en el mundo y casi exclusiva en algunos países frente a la de donante fallecido. En términos de eficacia, la ONT ha definido al TRDV como «la alternativa terapéutica que ofrece mejores resultados de supervivencia en el tratamiento de la insuficiencia renal crónica»542. En niños, su uso se justifica por una doble necesidad; inicialmente por la escasez de órganos infantiles de donante fallecido para cubrir de forma razonable la demanda pediátrica existente o incluso por la ausencia de una opción preferencial de TR de donante fallecido adulto a niños y por otra, para asegurar los mejores resultados a corto o medio plazo. La donación de vivo debe ser respaldada por un sistema organizativo que asegure la ausencia de coerción o compensación económica para el donante, hecho que inicialmente no plantea problemas en la donación de padres e hijos.
La existencia de un sistema organizativo nacional que asegure unos programas de donación de vivo adecuados permite además ampliar la donación pediátrica al TR cruzado en aquellas situaciones que por incompatibilidad donante-receptor el trasplante no puede llevarse a cabo en la pareja seleccionada. En estos casos, las parejas donante-receptor pueden cruzarse, dentro del mismo centro o en centros hospitalarios que actúen coordinadamente bajo un estricto programa nacional que permita la realización del trasplante de forma simultánea543,544. Otras ventajas de la donación de vivo, además de la compatibilidad inmunológica, son la planificación del trasplante en el momento más adecuado para el receptor, la posible desensibilización donante específica dirigida a receptores con anticuerpos anti-HLA o de otro tipo y finalmente, asegurar una mejor supervivencia del injerto en aquellos niños en los que por dificultades anatómicas vasculares o urológicas las opciones ulteriores de retrasplante serán mucho más complejas o incluso inabordables. La principal contraindicación de la donación de vivo es el riesgo potencial para el donante o el riesgo de recidiva de la enfermedad primaria en el injerto.
El receptor pediátrico de donante vivo- •
Se sugiere que el receptor pediátrico deba ser informado de acuerdo con su edad del propio proceso de trasplante, obteniendo de él mismo el consentimiento informado y teniendo en cuenta su opinión y deseos (SG).
- •
Los extremos de la edad pediátrica (lactantes y adolescentes) son los que presentan mayores dificultades para la realización de un trasplante constituyendo por sí mismos, grupos de riesgo especial (SG).
El posible receptor pediátrico de un TRDV debe ser tratado en un centro pediátrico por especialistas conocedores de todos los aspectos específicos asociados a la enfermedad primaria y a los intrínsecos de la infancia tanto físicos (crecimiento, desarrollo y maduración) como aquellos psicosociales, fundamentales para el propio proceso del trasplante (estatus socioeconómico, grado de dependencia, cumplimiento terapéutico, etc). Asimismo, el receptor pediátrico debe ser informado de acuerdo a su edad del propio proceso de trasplante, obteniendo de él mismo el consentimiento informado y teniendo en cuenta su opinión y deseos.
Los extremos de la edad pediátrica (lactantes y adolescentes) son los que de antemano presentan mayores dificultades para la realización de un trasplante, y constituyen grupos de riesgo especial545–547.
El receptor pediátrico de donante vivo muy pequeño- •
El TRDV en receptores extremadamente pequeños (edad o peso) presenta mayor tasa de fracaso primario del injerto, principalmente de causa vascular (trombosis arterial y venosa) (A).
- •
Se recomienda retrasar el trasplante hasta que el receptor alcance los dos años o 10 kg de peso (B).
- •
De forma excepcional, se podría realizar un TR en receptores de 6 a 10 kg de peso en centros con experiencia realizando un cuidadoso balance entre riesgos y beneficios (D).
El grupo de pacientes que presenta una mayor morbimortalidad en cualquier modalidad de tratamiento sustitutivo es el grupo de niños menores de dos años545,548. El hecho de iniciar tratamiento sustitutivo durante el primer año de vida está asociado a un riesgo relativo independiente de mortalidad de tres a seis veces mayor que en otros grupos de edad545,548.
En población pediátrica, el inicio de tratamiento sustitutivo con un TR tiene mejores resultados a corto y medio plazo que con diálisis, sin embargo, este hecho no está totalmente corroborado en menores de dos años548,549. La realidad nos muestra que el TR en menores de dos años y especialmente en menores de un año no es una práctica universal; el 99% de estos pacientes inician tratamiento con diálisis, especialmente diálisis peritoneal545,548–550.
El inicio de los programas de TR en receptores extremadamente pequeños se asocia con mayor número de complicaciones vasculares, especialmente trombosis arterial y venosa, así como fallo primario del injerto. Estas complicaciones son especialmente frecuentes cuando la edad del donante es asimismo muy baja, siendo en muchos programas desestimado este tipo de donante para el receptor pequeño551.
En la realización de un TR con una edad inferior a dos años o peso inferior a 10 kg son fundamentales las consideraciones quirúrgicas y el manejo perioperatorio y posoperatorio536,550,552–554. En esta población, una política adecuada de monitorización hemodinámica y de aporte de fluidos coloides y cristaloides se asocia con buenos resultados en receptores muy pequeños, evitando pérdidas de injerto tempranas por causas técnicas como la trombosis vascular, la ausencia de función primaria o la necrosis tubular aguda550–554. Las aisladas experiencias cuando el peso del receptor es inferior a 6 kg son en general negativas551–552.
En definitiva podemos considerar un buen receptor de donante vivo al lactante con peso superior a 10 kg, correspondiente a una edad de dos años; hasta entonces, el tratamiento sustitutivo ideal es la diálisis peritoneal, y el TR debe diferirse hasta que se haya alcanzado ese peso y/o edad si las circunstancias lo permiten. De forma excepcional (fracaso peritoneal o de accesos vasculares u otros riesgos no definidos) se podría realizar un TR en receptores de 6 a 10 kg de peso en centros con experiencia, efectuando un cuidadoso balance entre riesgos y beneficios. En cualquier caso, dado el importante riesgo de pérdida del injerto, debe evitarse la realización de un TR en receptores con peso inferior a 6 kg. Finalmente, el abordaje de un TR en receptores muy pequeños requiere un equipo multidisciplinar que incluya cirujanos y/o urólogos con amplia experiencia, anestesiólogos, nefrólogos, intensivistas, nutricionistas y un amplio respaldo de otros especialistas pediátricos. Por razones técnicas este tipo de trasplantes debe realizarse en centros pediátricos de referencia.
El receptor adolescente de TRDV- •
Se sugiere un abordaje multidisciplinar en los pacientes con edades entre los 13 y 18 años, principalmente en el proceso de información antes y después del TR, para disminuir el riesgo de no adherencia al tratamiento (D).
La población pediátrica entre 12 y 18 años susceptible de recibir un TR convive con el proceso normalizado de la adquisición paulatina de autonomía y responsabilidades; este hecho hace a esta población especialmente vulnerable al incumplimiento terapéutico y al riesgo permanente de rechazo553,554. Además, los datos de registro muestran un incremento de pérdida del injerto por no adherencia al tratamiento, con incidencia máxima entre los 13 y los 21 años y disminución en edades posteriores555.
El establecimiento de una contraindicación temporal para la realización de un TRDV en un adolescente no adherente al tratamiento parece obvia, sin embargo, el tratamiento prolongado con diálisis no parece mitigar el riesgo posterior de incumplimiento terapéutico556. En estos casos, el proceso informativo antes, durante y después del trasplante y el apoyo de trabajadores sociales y psicólogos especialistas en adolescentes, es útil en la prevención de la falta de adherencia terapéutica555,556.
Teniendo en cuenta que el mayor porcentaje de pérdida del injerto se produce durante el proceso de transferencia, es fundamental asegurar un proceso adecuado de transición de este receptor a las unidades de adultos.
TR de donante adulto a un receptor muy pequeño (disociación donante-receptor)- •
La donación de vivo de un progenitor a un lactante implica un secuestro de la volemia del 33 al 50% y son fundamentales el abordaje quirúrgico y el manejo perioperatorio (B).
El TR de donante adulto a un receptor muy pequeño es una práctica habitual que requiere una mayor presión de perfusión inicial y puede condicionar un secuestro de la volemia del 33 al 50%, siendo el manejo quirúrgico, periperatorio y anestésico fundamental550,557,558.
Abordaje quirúrgico: un riñón de adulto para un receptor pediátrico, en especial si es un niño pequeño, presentará discrepancia de tamaño entre el riñón donado y la cavidad abdominal del receptor. Esta situación puede provocar un compromiso de espacio y dificultar la realización de las anastomosis vasculares y el cierre del abdomen tras la colocación del injerto, con síndrome compartimental. El abordaje extraperitoneal mediante incisión de Gibson es el de elección para el TR en el niño, tanto para donante vivo como donante fallecido. Sin embargo, cuando el receptor es muy pequeño o presenta problemas abdominales de otra índole, pueden plantearse dudas. El abordaje intraperitoneal se recomienda cuando el peso del receptor es inferior a 15 kg, teniendo la ventaja de proporcionar mayor campo quirúrgico y una exposición más amplia de los grandes vasos, pero también la desventaja de una posible obstrucción intestinal559. En cualquier caso, la elección del abordaje debe realizarse con base en las condiciones del receptor y de la experiencia de cada centro.
Anastomosis vasculares: la discrepancia de tamaño se observa también entre los vasos del hilio renal y los del receptor, por lo que los mejores sitios donde realizar las anastomosis se deben elegir en función de esta disparidad. La anastomosis arterial se puede realizar término-lateral en la aorta, en la iliaca común o en la iliaca externa, y término-terminal a la iliaca interna. Cuando el receptor tiene un peso inferior a 20 kg, se recomienda que la anastomosis se realice a la aorta y a la cava inferior558. Si tiene un peso entre 20-30 kg, el sitio recomendado es la arteria y la vena iliaca común. Cuando el injerto tiene doble arteria, si ambas están separadas, se realizarán las dos anastomosis independientes, pero si están próximas, se unirán en cirugía de banco, suturando la arteria accesoria a la arteria principal.
Cierre de la pared abdominal: el cierre de la cavidad abdominal tras el trasplante, puede verse comprometido y requerir cierre diferido en 48 o 72 horas. Cuando la disociación entre el donante y el receptor es muy llamativa, el cierre de la pared puede ocasionar un aumento de la presión abdominal que puede llegar a colapsar la cava inferior y dificultar el retorno venoso del injerto, llegando a progresar hasta la trombosis (síndrome compartimental). En estos casos, la colocación de una lámina de Goretex suturada a los bordes de la herida puede evitar esta complicación, permitiendo el cierre progresivo de la pared en los días sucesivos558,559. Esta aproximación progresiva de los bordes de la herida quirúrgica se realizará bajo control con eco-doppler.
Manejo perioperatorio: para mantener una correcta presión de perfusión y disminuir el riesgo de trombosis vascular, el manejo perioperatorio debe incluir la administración de fluidos intravenosos (cristaloides y/o coloides) y fármacos inotrópicos, junto con una correcta monitorización hemodinámica552:
- -
Monitorización de la presión venosa central mediante con catéter venoso central (12-18 cm H2O) y monitorización directa arterial presión arterial.
- -
Por riesgo de función retrasada del injerto, la presión arterial media obtenida a los diez minutos de la reperfusión del injerto no debe ser inferior a la del desclampaje.
- -
La ratio entre la presión arterial media y el peso debe ser mayor de 4,3 en pacientes con peso de 13 a 21 kg (56–90.mmHg), e idealmente mayor de 2,5 en mayores de 22 kg.
- •
La supervivencia a los cinco años del TRDV mayor de 50 años es inferior a la de los trasplantes de donantes vivos jóvenes, pero mejor que la de cualquier injerto precedente de donante fallecido, incluidos los jóvenes (B).
- •
Se sugiere valoración individual del donante vivo mayor de 50 años para receptor pediátrico, por presentar menor supervivencia, aunque esta sea superior a la de cualquier injerto precedente de donante fallecido, incluidos los jóvenes (D).
En los últimos años se observa en los registros internacionales una tendencia a un mayor empleo de riñones procedentes de donantes mayores de 50 años en TR infantil560. La supervivencia a los cinco años es inferior a la de los TRDV jóvenes, pero mejor que la de cualquier injerto precedente de donante fallecido, incluidos los jóvenes554,557,561–563. La supervivencia a largo plazo del injerto es peor a medida que aumenta la edad del donante por encima de los 50 años554,557,563.
Anomalías vasculares complejas en el TRDV y receptor pediátrico- •
La trombosis oclusiva de la vena cava inferior y el síndrome de aorta media requieren una planificación del trasplante que incluye la elección del donante óptimo y la planificación del abordaje quirúrgico adaptado a la anatomía del receptor (D).
Dentro de las anomalías vasculares que comprometen la realización de un trasplante en un receptor pediátrico, la trombosis oclusiva de la vena cava inferior constituye una de las situaciones de mayor reto y aunque rara, es la más frecuente564–566. La otra anomalía vascular compleja es el síndrome de la aorta media, habitualmente progresiva durante la infancia pero que tiende a estabilizarse durante la pubertad, por lo que el trasplante debe retrasarse en la medida de lo posible pudiendo incluso no ser factible. En la planificación del trasplante debe elegirse el donante óptimo y planificar el abordaje quirúrgico, considerando el mejor lugar anatómico para la anastomosis adaptado a la anatomía del receptor.
Todos los candidatos a TR deben tener una evaluación vascular previa iliocava con eco-doppler, además, en aquellos pacientes en los que se sospecha trombosis venosa o anomalías arteriales debemos realizar otras pruebas de imagen más específicas como angio-TAC, angiorresonancia o venografía retrógrada transyugular que permitan la planificación de la cirugía. Asimismo, es importante determinar, si existen factores de riesgo de hipercoagulabilidad.
En la trombosis de cava inferior deben evitarse las venas colaterales a la trombosis porque el drenaje venoso del injerto puede verse comprometido y favorecer la trombosis. Estructuras vasculares posibles son: vena ovárica, vena renal izquierda, vena mesentérica superior o inferior, vena porta o incluso venas más profundas como las lumbares. Como primera opción, y siempre que esté libre de trombo, deberíamos utilizar la vena cava infrahepatica con la colocación del injerto en posición ortotópica en el lado izquierdo565, realizando nefrectomía izquierda y utilizando la vena renal nativa para la anastomósis a la vena renal del injerto con anastomosis de la arteria renal del injerto directamente a la aorta. Si la vena renal donante es corta, puede recurrirse a algún procedimiento de elongación; ya sea con la cava del donante o con un segmento de vena gonadal564,565. El uréter se reimplantará según técnica de Lich-Gregoir modificada si tenemos longitud suficiente o mediante uretero-ureterostomía entre el uréter donante y el nativo si el primero es excesivamente corto558,559,567.
Durante el posoperatorio se debe utilizar anticoagulación con heparina y posteriormente antiagregación plaquetaria, además de asegurar la permeabilidad venosa mediante eco-doppler en el posoperatorio inmediato y resonancia magnética y/o tomografía vascular a los tres meses del trasplante.
Anomalías urológicas complejas y su abordaje en el TRDV y receptor pediátrico- •
Se recomienda la evaluación urológica pretrasplante con cistouretrografía que permita identificar anomalías y realizar el tratamiento oportuno antes del implante (B).
Los pacientes portadores de vejigas neuropáticas, válvulas de uretra posterior, malformaciones urológicas complejas y problemas urológicos asociados a la malformación ano-rectal como la fístula cloacal son frecuentes entre los candidatos a TR. Estas anomalías pueden constituir un peligro para la supervivencia del injerto, debido fundamentalmente a la disfunción vesical que los acompaña. Por lo tanto, la evaluación urológica pretrasplante es un requisito para un TRDV, permitiéndonos identificar los problemas y realizar el tratamiento oportuno antes del implante568. La cistouretrografía será la prueba inicial de esta evaluación.
Ante la sospecha de disfunción vesical, realizaremos un estudio urodinámico para confirmar si existe una vejiga disfuncional, e identificar de qué tipo se trata (hiperreflexia, baja acomodación o fallo miogénico). El reflujo vésico ureteral de alto grado en los riñones nativos favorece las infecciones de repetición postrasplante. y debería tratarse, quirúrgica o endoscópicamente, antes del trasplante558,559,567,568.
La corrección de la disfunción vesical requerirá tratamientos específicos antes del trasplante como son el uso de anticolinérgicos y/o cateterismo intermitente, inyección de toxina botulínica, ampliación vesical o derivación urinaria continente.
La hipoplasia o la agenesia vesical y la atresia de uretra requieren una reconstrucción del tracto urinario antes del trasplante con la realización de una neovejiga, construida con segmento colónico o ileal, y un canal de vaciamiento tipo Mitrofanoff564,569,570.
Cáncer en el receptor pediátrico- •
El periodo de contraindicación antes del TRDV en un proceso maligno debe ser evaluado juntamente con oncología según tipo, grado y extensión del tumor (D).
No existe evidencia ni acuerdo definido de cuánto tiene que ser el tiempo de espera necesario para recibir un trasplante después de la curación completa de una neoplasia por lo que, en el momento actual, lo más aconsejable es valorar junto con los oncólogos, los riesgos de recidiva, según el tipo, grado y extensión del proceso maligno, individualizando el tiempo de espera necesario571. En cualquier caso, los estudios genéticos actuales son muy útiles ya para ayudar a distinguir entre los diferentes subtipos biológicos y, por tanto, a la toma de decisiones.
Constituye un caso excepcional el antecedente de tumor de Wilms; puede considerarse el posible receptor candidato a trasplante inmediatamente después del proceso de curación completa, sin estar sujeto a una espera tradicional de uno a dos años567.
Retraso intelectual y receptor pediátrico- •
No existe contraindicación del TRDV en receptores con déficit intelectual grave ya que no existen diferencias en supervivencia del injerto respecto al resto de pacientes. La decisión final se basa en un consenso entre equipo trasplantador y los padres (SG).
La decisión de realizar un TR en un receptor pediátrico con retraso psicomotor grave es siempre difícil y debe ser adoptada por todos los integrantes de los equipos multidisciplinares de trasplante y por los padres, en los que descansa la autonomía del paciente572. Dada la supervivencia del paciente e injerto similar al resto de los pacientes, es perfectamente válida la no contraindicación de un grave déficit intelectual para recibir un TR573. Las contraindicaciones absolutas derivan de la asociación del retraso psicomotor con otras situaciones concomitantes y que por sí mismas representan ya una restricción total571–576.
Obesidad y receptor pediátrico- •
Se sugiere adaptar el momento de la realización del TRDV en receptores con un IMC superior a 35 kg/m2 por mayor riesgo de pérdida del injerto, estimulando la pérdida de peso mediante hábitos que modifiquen su estilo de vida (D).
Datos derivados del registro europeo señalan la alta frecuencia de sobrepeso y obesidad infantil en niños españoles receptores de TR577, a lo que contribuye el cambio occidental del modo de vida. Determinadas patologías hereditarias como el Síndrome de Prader-Willi o de Bardet- Biedl asocian insuficiencia renal subsidiaria de tratamiento sustitutivo y problemas específicos de obesidad, que deben ser orientados, valorados y tratados antes del trasplante.
Antes del trasplante, los posibles receptores deben ser evaluados en unidades de nutrición, modificando la dieta y estimulando la actividad física y el deporte. Los receptores con un IMC > 35 kg/m2 tienen riesgo aumentado de pérdida del injerto a los diez años del trasplante578, por lo que se debe estimular la pérdida de peso. La decisión de realización de un TR a un receptor pediátrico con obesidad debe estar basada en decisiones del equipo.
TR de donante vivo ABO incompatible y receptor pediátrico- •
Aunque la situación ideal es que el receptor pediátrico reciba un donante isogrupo, el TRDV ABO incompatible en receptor pediátrico del grupo O y B con niveles bajos de isoaglutininas, es una opción a considerar (C).
Aunque sin evidencia que avale la indicación pediátrica, el TRDV ABO incompatible en receptor pediátrico del grupo O y B con niveles bajos de isoaglutininas frente a su posible donante y con utilización de recambios plasmáticos, inmunoadsorción o rituximab es una opción razonable en aquellos casos que aumente mucho el tiempo en lista de espera579–581. En los últimos años se ha comprobado que en pacientes con títulos bajos de isoaglutininas (< 16) se puede realizar un trasplante ABO incompatible sin necesidad de recambios plasmáticos582, aunque no existe evidencia de qué niveles de isoaglutininas permiten realizar el trasplante sin tratamiento previo583–586.
TR de donante vivo en receptores pediátricos altamente sensibilizadosLa presencia de anticuerpos anti-HLA preformados, empeora drásticamente el resultado del TR tanto en niños como en adultos562,563. Aunque los programas de desensibilización proporcionan buenos resultados a corto y medio plazo, el pronóstico a largo plazo sigue siendo decepcionante. Diferentes países han desarrollado programas a nivel nacional o internacional dirigidos a priorizar el trasplante de estos pacientes con la realización de un crossmatch virtual587–591.
El TRDV en niños altamente sensibilizados no difiere de los adultos y sería de elección si el posible donante no presenta ningún antígeno prohibido para los anticuerpos del receptor. En caso contrario, un niño con presencia de un título superior al 98% frente al panel podría ser incluido en el programa nacional de pacientes hiperinmunizados591, mientras que aquellos pacientes con anticuerpos preformados pero con título inferior, podrían incluirse en lista de espera de donante fallecido valorando la posibilidad de TRDV cruzado o incluso realizar un protocolo de desensibilización específico, dependiendo de la situación del paciente y el tiempo en diálisis592,593.
Contraindicaciones absolutas en receptores pediátricosSon pocas las contraindicaciones absolutas para realizar un TR en la edad pediátrica567,573–576: neoplasia maligna en los últimos 12 meses, enfermedad pulmonar que requiere tratamiento con oxígeno continuo, fallo cardiaco irreversible, infección activa, negativa para completar el calendario habitual de vacunas o un soporte social inadecuado para el tratamiento postrasplante.
Consideraciones sobre la elección del donante vivo en niñosLa extracción laparoscópica tiene menor morbilidad que la nefrectomía abierta para el donante, siendo los resultados funcionales del injerto iguales (B).
Edad y aspectos sociales: el 90% de las donaciones de vivo en la infancia proceden de los padres y los aspectos de límite de edad quedaron reflejados en un apartado anterior. La elección de uno u otro progenitor en igualdad de compatibilidad y estado de salud obedece a una decisión de la pareja después de ser informados del grado de compatibilidad. Asimismo, se deben tener en cuenta todos los de aspectos psicosociales y económicos que influyen en la donación594. Además, en la donación de vivo infantil se aceptan también otros donantes familiares o donantes relacionados emocionalmente; hay que tener en cuenta la compatibilidad y balancear las ventajas en relación con un trasplante de donante fallecido563,593. No se considera una contraindicación la donación de un hermano joven (menor de 25 años), aunque requiere una evaluación mucho más exhaustiva para demostrar su madurez. En ocasiones nos enfrentamos a situaciones de familias monoparentales sin ningún apoyo social, que nos orientan a desaconsejar el TRDV. En cualquier caso, es fundamental ofrecer apoyo psicológico antes y después de la donación y aunque el TRDV puede reforzar los sentimientos positivos entre donante y receptor, puede también desarrollar tensiones y ansiedad, sobre todo con los receptores adolescentes594.
Aspectos quirúrgicos y relacionados con la extracción: la principal limitación del TRDV para el receptor pediátrico se encuentra en la discrepancia de tamaño de los vasos entre donante y receptor. Para que se pueda garantizar un flujo adecuado al riñón, la arteria receptora para la anastomosis debería tener el doble de tamaño (ancho) o al menos, el mismo tamaño que la arteria renal del donante595. En niños con peso inferior a 15 kg con frecuencia es necesario esperar un tiempo para llevar a cabo el trasplante con garantías. La presencia de anomalías vasculares o pedículos múltiples aumentan el riesgo de trombosis del injerto; de tal forma que cuando existe una arteria doble y esta se encuentra próxima a la arteria principal, debe hacerse la anastomosis termino-lateral de la accesoria a la principal y realizar una sola anastomosis en el receptor. Si ambas arterias están a cierta distancia será necesario efectuar las anastomosis por separado. No está establecido cuál es el número máximo de arterias a partir del cual se debería descartar el riñón. El criterio del cirujano y su experiencia serán las que decidirán si el trasplante es posible de realizar. La angiotomografía renal con reconstrucción tridimensional, incluyendo fase excretora, es el método de elección en la evaluación anatómica arterial, venosa y del parénquima y del sistema colector del potencial donante vivo596.
En cuanto al tipo de extracción abierta vs. laparoscópica y bajo la premisa de que el mejor riñón debe permanecer en el donante en igualdad de condiciones, se prefiere realizar la extracción del riñón izquierdo, que suele facilitar las anastomosis vasculares, siendo la nefrectomía laparoscópica la prioritaria para la extracción renal del donante vivo597, por su menor morbilidad para el donante y los resultados funcionales similares. El problema mayor reside en una mayor dificultad para conseguir una adecuada longitud de los vasos renales, sobre todo de la vena renal y con mayor frecuencia si es el riñón derecho es el extraído. El abordaje laparoscópico mano-asistida mejora la tracción sobre el riñón, consiguiendo una longitud más adecuada de los vasos. También, la colocación invertida del injerto en el receptor puede facilitar las anastomosis vasculares de un injerto con vasos cortos.
Sección 14. TR de donante vivo con incompatibilidad HLAEl TR se considera la mejor opción terapéutica de la insuficiencia renal crónica598, y el TRDV ofrece mejores resultados que el de donante fallecido599. El número de TRDV ha descendido en los últimos años en España600.
El contexto actual es de incremento de receptores altamente sensibilizados por embarazos, transfusiones o trasplantes previos601,602. Esta tendencia es similar a la reportada por países como EE. UU.15, inferior a la de Corea603 o Reino Unido604. La definición de paciente sensibilizado es imprecisa, si bien la presencia de anticuerpos frente a su donante se considera factor de riesgo para desarrollar un rechazo mediado por anticuerpos y desaconsejaría realizar el trasplante317. Hace menos de 30 años, se consideraban hipersensibilizados a aquellos candidatos con más de 50% del PRA605. Actualmente, en EE. UU. se define altamente sensibilizado a partir de Panel-Reactive-Antobodies (PRA) calculado (cPRA) > 80% y muy sensibilizado > 99%606; en Eurotransplant de 85%607 y en otros países en torno al 80%608–610. En España, funciona un programa nacional para pacientes hipersensibilizados que establece una cifra mínima del 98% de cPRA para su inclusión602.
Las opciones de trasplante para pacientes altamente sensibilizados varían en función de la disponibilidad o no de un donante vivo. Si no existe incompatibilidad, se procedería al trasplante. Si por el contrario existe incompatibilidad entre donante y receptor, las opciones incluyen la incorporación en listas de TR donante cruzado, el tratamiento mediante desensibilización o la incorporación a listas de donante fallecido específicas. Desde hace casi dos décadas, se han diseñado protocolos de desensibilización basados en el tratamiento con inmunoglobulina endovenosa (IVIG), distintas técnicas de aféresis y agentes depletantes de linfocitos B o células plasmáticas. Recientemente, se han incorporado nuevas medidas de desensibilización que incluyen agentes bloqueadores del complemento, o Imlifidase (endopeptidasa) capaz de escindir inmunogloblinas G, que pueden reducir la incidencia de rechazo agudo, si bien el pronóstico a medio plazo se desconoce348.
Desensibilización para TR de donante vivo HLA incompatible- •
Se sugiere considerar sensibilizado al candidato a trasplante que presente anticuerpos cPRA mayores del 80-85% frente a potenciales donantes (calidad de evidencia: C).
- •
Se sugiere que el candidato a TRDV y su donante sean informados del trasplante HLA incompatible en sus diferentes opciones (cruzado, desensibilización o listas específicas con preferencia para donante fallecido) (C).
- •
La decisión de realizar trasplante HLA incompatible mediante protocolo de desensibilización debe ponderarse según condiciones del receptor, del donante y demora en lista de espera, frente al mayor riesgo de rechazo agudo mediado por anticuerpos y otras complicaciones debidas a la sobreinmunosupresión (SG).
- •
Se recomienda protocolo de desensibilización que contemple rituximab, IVIG y técnicas de aféresis (inmunoadsorción o recambios plasmáticos) (B).
- •
Se recomienda añadir anti-CD20, ya que aumenta la probabilidad de acceso a trasplante (A).
- •
No se recomienda sustituir rituximab por bortezomib, por toxicidad y peores resultados (B).
- •
No existen estudios comparativos de diferentes preparaciones de IVIG (inespecífica o CMV hiperinmune), por lo que no es posible recomendar el uso de una u otra (SG).
- •
La inclusión de eculizumab a los protocolos habituales de desensibilización reduce la incidencia de rechazo agudo mediado por anticuerpos a corto plazo (B).
- •
Imlifidase permite transformar una prueba cruzada altamente positiva en negativa en seis horas (C).
- •
Se sugiere incluir en listas de trasplante fallecido específicas para altamente sensibilizados a candidatos a TRDV HLA incompatible no susceptibles de desensibilización (C).
La desensibilización consiste en retirar del organismo los anticuerpos pre-existentes mediante técnicas de aféresis, bloquear los ya existentes o sus acciones con el uso de IVIG, impedir la formación de nuevos mediante el bloqueo de la proliferación de células B e impedir el reconocimiento y la respuesta inmune mediante tratamiento inmunosupresor. Existen varios protocolos de desensibilización, y en general, se basan en el uso de rituximab, IVIG y técnicas de aféresis2,611 En los últimos años, se han incorporado nuevos fármacos, entre ellos eculizumab e imlifidase, que reducen la incidencia de rechazo agudo. Un esquema de acondicionamiento se muestra en la figura 13.
Esquema de desensibilización más extendido. Se inicia rituximab 31 días previos a la fecha programada para el trasplante. Entre 7 y 14 días previos al trasplante se ingresa al paciente y se inicia PFS o IA hasta que el cross-match sea negativo. Se infunde 100mg/kg de Igs CMV específica tras cada sesión de PFS/IA. Asimismo, se inicia inmunosupresión con tacrolimus, derivados del ácido micofenólico y prednisona. Profilaxis valganciclovir, septrin, itraconazol o anfotericina inhalada desde el trasplante. Se induce con basiliximab o timoglobulina y se realiza PFS los días+3,+5,+8614.
a) Agentes depletantes de células B
Actualmente, el régimen más empleado consiste en utilizar rituximab un mes antes del inicio de aféresis. Ejerce su acción a los dos a tres días de su infusión, con un pico máximo entre dos y cuatro semanas, y este efecto puede mantenerse hasta 12 meses612. La dosis utilizada en la mayoría de los protocolos es de 375 mg/m2 de superficie corporal y premedicación con paracetamol, esteroides y antihistamínicos para evitar reacciones adversas secundarias. Algunos autores utilizan bortezomib, un agente depletante de células plasmáticas con diferentes resultados611, aunque con elevada incidencia de efectos secundarios613.
b) Inmunosupresión
Entre una y dos semanas antes del trasplante se inicia inmunosupresión con tacrolimus (0,15 mg/kg para conseguir niveles 8-12 ng/mL el primer mes), MMF a dosis de 1 g cada 12 horas o MFS 720 mg cada 12 horas y prednisona 20 mg diarios614.
c) Aféresis
En pacientes que carecen de acceso vascular (prediálisis o peritoneal), es necesaria la canalización de una vía central (preferible vena yugular interna)615 para la realización de aféresis con o sin diálisis. En caso de aplicar la técnica del recambio plasmático con centrifuga, se puede realizar a través de vías periféricas. Las técnicas de aféresis utilizadas son la plasmaféresis (PPF) o recambio plasmático, la PPF de doble filtración y la inmunoadsorción (IA). La ventaja de la IA sobre la PPF es que no retira plasma, por lo que no se pierden proteínas plasmáticas, incluida la albúmina y factores de coagulación en el intercambio y por tanto no necesita la reposición que sí es necesaria con la PPF616. El inconveniente es que depura menos eficientemente la IgG 3 y es más costosa; lo habitual es combinar ambas técnicas617. El volumen plasmático utilizado para intercambio suele oscilar entre 1 y 2,5 volúmenes por sesión, siendo el número de sesiones variable y en general asociado al grado de sensibilización del paciente. Cuando las pruebas cruzadas con el donante por CDC y CF son negativas y el MFI del anticuerpo o anticuerpos donante-específicos disminuye por debajo de 1.000 se considera que el paciente esta desensibilizado y se procede al trasplante614,618.
d) Inmunoglobulinas
Después de cada sesión de aféresis, en la que se han retirado parte de los anticuerpos, se administra IVIG con el objeto de neutralizar los anticuerpos y modular la respuesta inmune619. Su empleo disminuye la incidencia de rechazo agudo y la pérdida de injerto en pacientes sensibilizados620,621. Existen dos preparaciones en el mercado, las IVIG inespecíficas y las IVIG CMV hiperinmune. No existen estudios que comparen la eficacia entre las dos preparaciones entre sí. Un estudio comparó series históricas de candidatos tratados con dosis altas de IVIG o con dosis bajas más PPF, siendo los resultados favorables al último grupo, en el que se empleaba PPF622. La IVIG inespecífica se emplea en dosis de 500-2.000 mg/kg de peso623, dosis máxima 150 g, y requiere un volumen mayor para su administración, suele incluir isoaglutininas anti ABO en sus presentaciones y necesita premedicación para evitar reacciones adversas624. La IVIG CMV específica se emplea en dosis de 100 mg/kg 625–627, por lo que el volumen de administración es considerablemente menor, es altamente purificada y presenta anticuerpos neutralizantes frente al CMV y el virus Epstein Barr, por lo que podría ofrecer resultados beneficiosos en la prevención de infecciones oportunistas a corto plazo628. Los resultados en coste parecen más favorables con el uso de IVIG inespecífica, pero no existe ningún estudio de coste-eficiencia.
e) Eculizumab
Eculizumab es un anticuerpo monoclonal humanizado, dirigido frente a la fracción C5 del complemento impidiendo su escisión y bloqueando tanto la capacidad opsonizante e inflamatoria de C5a como la formación del complejo ataque membrana C5b-9629. El empleo de eculizumab durante cuatro a nueve semanas se asoció a una disminución en la incidencia de rechazo agudo mediado por anticuerpos630,631, aunque se ha detectado un incremento en el MFI de los DSA y mayor frecuencia de glomerulopatía de trasplante. El fármaco es bien tolerado, aunque es necesario vacunar previamente a los pacientes frente a meningococo, neumococo y haemophilus.
f) Imlifidase
Imlifidase (endopeptidasa) es un fármaco extraído del Streptococo pyogenes, que funciona a modo de tijera, rompiendo los enlaces que unen las distintas cadenas de las inmunoglobulinas, convirtiendo una prueba cruzada positiva en negativa en el transcurso de seis horas. Los datos de los primeros estudios internacionales manifiestan la posibilidad de trasplantar a pacientes sensibilizados con una disminución en la incidencia de rechazo respecto a los protocolos habituales632,633.
g) Otros
Tocilizumab es un anticuerpo monoclonal dirigido frente al receptor de IL-6 que en estudios iniciales ha mejorado los resultados respecto a protocolos previos de desensibilización, aunque no disponemos de información suficiente para su uso en la práctica clínica634.
Existen otros fármacos en desarrollo635 que podrían mejorar los resultados ya conocidos, como la administración de un inhibidor de la fracción C1 del complemento (C1Inh) aunque todavía se encuentra en fase I/II636.
h) Inducción
Cuando se considera que se ha conseguido una desensibilización con éxito se procede a la realización del trasplante. Se administra inducción con basiliximab o timoglobulina dependiendo del protocolo y de los grupos614. Algunos protocolos contemplan el uso de alemtuzumab en lugar de timoglobulina623,637.
i) Profilaxis
Los protocolos de desensibilización tienen como objetivo disminuir la respuesta inmune y, por tanto, pueden aumentar las infecciones oportunistas. A pesar de ello, la profilaxis no difiere demasiado de la empleada en los trasplantes que no reciben desensibilización: cotrimoxazol durante tres a seis meses y valganciclovir entre tres y seis meses fundamentalmente en donantes CMV seropositivos y receptores CMV seronegativos. Profilaxis antifúngica según práctica local; algunos centros utilizan itraconazol oral o anfotericina inhalada durante tres a cuatro meses614.
Los pacientes que reciben eculizumab deben vacunarse frente a meningococo, haemophilus, neumococo y recibir penicilina via oral al menos hasta un mes de finalizado el tratamiento tal como se recomienda para pacientes con SHUa638,639.
Resultados- •
La incidencia de rechazo agudo mediado por anticuerpos es elevada en pacientes que reciben un trasplante tras desensibilización (B).
- •
La supervivencia es menor en pacientes trasplantados mediante desensibilización que en los pacientes con un TRDV compatible (B).
- •
La supervivencia del paciente HLA incompatible trasplantado tras desensibilización es mayor en comparación con permanecer en diálisis y trasplantarse después, o frente a permanecer en diálisis y en lista de espera (B).
Un estudio multicéntrico retrospectivo de centros de EE. UU. detectó que los resultados de supervivencia en pacientes trasplantados tras desensibilización son superiores a la de los pacientes que permanecen en diálisis y posteriormente se trasplantan y a la de aquellos que permanecen en diálisis y no se trasplantan640. Otros no encontraron esas diferencias respecto a los otros grupos, trasplantados o en lista de espera604. Esto podría explicarse por las diferencias en la definición, desensibilización, método de elección del grupo control, población y mortalidad en diálisis, que es superior en EE. UU. que en Europa49. En los pacientes en lista de espera con cPRA elevado, este representa un factor independiente de mortalidad para los candidatos a trasplante641,642.
La probabilidad de acceso a trasplante tras la realización de desensibilización oscila entre un 37 y 96%, dependiendo del protocolo utilizado, el nivel de sensibilización y la experiencia del grupo611,614,622,623,630,643–649. En una revisión, la probabilidad de trasplante era de 90,7% cuando se empleaba PPF, 95,5% cuando se empleaba IA, 73% con el uso de IVIG a dosis elevadas sin aféresis y 30,8% con bortezomib611. El grupo probablemente con mayor experiencia en desensibilización es el CedairsSinai de Los Angeles. Vo et al. han trasplantado a 45/56 (80%) de los pacientes en lista de espera con PRA > 80% con donante vivo mediante desensibilización, frente a solo 2% por año en lista de espera sin desensibilización. No han conseguido trasplantar a 9/56 (16%) de los candidatos623. Hay escasa información sobre la frecuencia de trasplante en los pacientes en la que la desensibilización fracasa.
Cuando se utiliza bortezomib, la probabilidad de trasplantar es variable, entre el 43% y el 84%613,650,651, siendo necesario suspender bortezomib por efectos adversos en 11,5% asociados a bortezomib y en 15,4% sin relación con bortezomib.
Supervivencia y rechazoEn las sucesivas series, la supervivencia del paciente es superior al 90% a uno a cinco años y 80% a ocho años y la supervivencia del injerto superior al 90% al año y del 60-70% a cinco a ocho años, a pesar de tasas de rechazo agudo elevadas611,614,618,623,630,637,643,646,652–655.
Publicaciones recientes muestran los resultados del uso de endopeptidasas (Imlifidase) en 46 pacientes fundamentalmente con donante fallecido (n = 39), aunque se han incluido pacientes que recibían un TRDV (n = 7). Los pacientes presentaban una prueba cruzada positiva en el 85% de los casos, DSA en el 93% y cPRA > 97%. El protocolo contempla además el uso de rituximab e IVIG. La supervivencia del paciente y del injerto son del 100 y 96% al sexto mes, respectivamente con una incidencia de rechazo mediado por anticuerpos del 27%632,633. Añadiendo eculizumab al protocolo habitual de desensibilización permite reducir esa tasa de rechazo al 12-15% el primer año, con supervivencia renal superior al 90%630,654.
Una experiencia de la clínica Mayo en pacientes con DSA MFI.> 1.000 y CF negativa, el 75% TRDV, muestra una incidencia de rechazo mediado por anticuerpos del 0%. La incidencia de rechazo crónico mediado por anticuerpos fue del 17%, la supervivencia del paciente del 96,3% y la del injerto (muerte censurada) del 86% tras un seguimiento medio de cuatro años637. Estos pacientes no son sometidos a desensibilización, por lo que los autores consideran que determinados pacientes podrían beneficiarse de un trasplante, especialmente si es de un donante vivo antes que permanecer en lista para encontrar a un donante con una prueba cruzada totalmente negativa (DSA negativo, MFI< 1.000).
Es posible aplicar protocolos de desensibilización en TR con donante fallecido con IA en el período preoperatorio inmediato. Si la prueba cruzada era positiva pre-IA pero negativa post-IA, el paciente se trasplantaba. Con este protocolo han trasplantado a 101 pacientes, 27 de los cuales eran CDC positiva pre-IA y negativos post-IA. La incidencia de rechazo mediado por anticuerpos fue del 41%. La supervivencia renal censurada para muerte era peor en los pacientes con DSA frente a los controles sin DSA656.
Algunos autores han comunicado los resultados de la combinación de desensibilización y TRDV cruzado, con un número reducido de pacientes, pero han podido trasplantar a candidatos con 100% de cPRA657,658.
En la tabla 12 figura un resumen de las últimas publicaciones sobre resultados de desensibilización.
Resumen de protocolos de desensibilización en donante vivo
| Autor | Año | N° (seguim) | RAMA (%) | RAMT (%) | S. PAC (%) | S. renal (%) | Método |
|---|---|---|---|---|---|---|---|
| Stegall (Mayo Clinic)1 | 2006 | 61 (12) | 37 | 93 | 82 | CDC | |
| Magee (Boston)2 | 2008 | 28 (22) | 39 | 42 | 96 | 89 | CDC/CF |
| Thielke (Illinois-Chicago)3 | 2009 | 51 (23) | 24 | 43 | 91 | 81 | CDC |
| Rogers (Adelaida-Australia)4 | 2011 | 10 (12) | 0 | 30 | 90 | 90 | CDC/CF/Luminex |
| Montgomery (Baltimore)5 | 2011 | 211 (96) | 86 | ||||
| Morath (IA) (Heidelberg. Alemania)6 | 2012 | 10 (19) | 30 | 20 | 100 | 90 | CDC/Luminex |
| Vo (Cedairs Sinai- L.A.)7 | 2013 | 46 (48) | 22 | 29 | 96 | 92 | CDC/CF/Luminex |
| Kute (BORT) (India)8 | 2011 | 29 (10) | 10 | 24 | 100 | 88 | CDC/CF |
| Riella (Boston)9 | 2014 | 39 (60) | 61 | 23 | 84 | 86 | CDC/CF/Luminex |
| E. De Sousa-Amorin (Hospital Clinic)10 | 2015 | 24 (37) | 41 | 21 | 86 | CDC/CF/Luminex | |
| Okada (Japón)11 | 2019 | 15 (48) | 60 | 93,3 | 85,6 | CDC/CF/Luminex | |
| Jordan (IdeS) (LA+Lund+Paris)12 | 2018 | 35 (6) | 25 | 100 | 94% | CDC/CF/Luminex | |
| Winstedl (IMLIFIDASE) ESOT 201913 | 2019 | 46 (6) | 27 | 100 | 93,5 | CDC/CF/Luminex | |
| Marks (Eculi vs. PP+Igs)14 | 2019 | 102 (36) | 11,8vs29,4 | 98 vs 98 | 91,8 vs 78,5 | CDC/CF/Luminex | |
| Fernandez (A Coruña)15 | 2017 | 23 (43) | 8,6 | 8,6 | 91,8 | 85 | CDC/CF/Luminex |
| Kim (Corea)16 | 2019 | 17 (37) | 47 | 100 | 85 | CDC/CF/Luminex |
N° (SEGUIM): n° pacientes incluidos y (meses de seguimiento); RAMA: Rechazo agudo mediado por anticuerpos; RAMT: Rechazo agudo mediado por células T; S. PAC: Supervivencia paciente; S. RENAL: Supervivencia renal; Método: Metodología empleada para medir la sensibilización; CDC: Citotoxicidad mediada por anticuerpos; CF: Citometría de flujo, Luminex.
Stegall MD. Am J. Transplant. 2006; 6: p. 346-341.
Magee C. Transplantation. 2008; 86: p. 92-103.
Thielke JJ. Transplantation. 2009; 87: p. 268-273.
Rogers NM. Transplant Int. 2011; 24: p. 21-29.
Montgomery, RA. Am J. Transplant 2010; 10: 449–457
Morath C. Transplant Internat. 2012; 25: p. 506-517.
Vo AA. Transplantation. 2013; 95: p. 852-858.
Kute VB. Saudi J Kidney Dis Transpl. 2011; 22(4): p. 662-669.
Riella LV. Transplantation 2014; 97: 1247-1252.
De Sousa-Amorim E. Transplant Proc. 2015; 47: 2332e2335.
Okada D. Transplant Internat. 2018; 31: 1008-1017.
Jordan S. NEJM. 2017; 377: 442-453.
Winstedt L. Transplant Int. 2019; 32(S2): 62.
Marks WH. Am J. Transplant. 2019; 19: 2876-2888.
Fernández C. Nefrologia. 2017; 37(6): 638-645.
Kim DG. BMC Nephrology. 2019; 20: 456.
- •
Los protocolos de desensibilización pueden exponer a los pacientes a mayor incidencia de infecciones y otros efectos adversos (SG).
- •
Los costes del TR de donante vivo HLA incompatible son mayores que para el HLA compatible, aunque es coste-efectivo en relación con permanecer en diálisis (SG).
El número de complicaciones infecciosas (CMV, BK, infección urinaria) es ligeramente mayor en el grupo de sensibilizados frente a los que no lo están. Existen pocos datos sobre la incidencia de EBV, incluso es posible que las IVIG ejerzan efecto protector603,614,632,640,643,646,655,659–664 (tabla 13).
Principales infecciones tras desensibilización
| Autor | CMV (%) | Urinarias (%) | BK (%) |
|---|---|---|---|
| Khwaji (L.A.)1 | 15 vs. 10 | 34 vs. 31 | 10,6 vs. 5,5 |
| Jeong (Korea)2 | 5,3 | 10,5 | |
| De Sousa (H Clinic)3 | 13 | 85 | 4,3 |
| Morath (Heidelberg)4 | 10 | 20 | 20 |
| Thielke (Illinois)5 | 7 | 4,9 | |
| Niederhaus (Wisconsin)6 | 15 | 0 vs. 5,6 | 21 |
| Okada (Japón)7 | 20 vs. 11 | 0 vs. 1,6 | |
| Jordan (USA+Suecia)8 | 0 | 0 | |
| Fernández (A Coruña)9 | 26 | 33 | 4 |
| Toyoda (L.A.)10 | 16 vs. 25 | EBV: 2,9 vs. 11,3 | 11,2 vs. 13 |
| Amrouche (Necker)11 | 9 | 75 | 10 |
| Kim (Corea)12 | 64,7 vs. 48,7 vs. 13,9 | 23,5 vs. 51,5. 7,7 | 0 vs. 5,1 vs. 6,6 |
Kahwaji J. Transplantation. 2011; 91: 225-230.
Jeong JC. Medicine. 2016; 95(5): e2635.
De Sousa-Amorim E. Transplant Proc. 2015; 47: 2332e2335.
Morath C. Transplant Internat. 2012; 25: 506-517.
Thielke JJ. Transplantation. 2009; 87: 268-273.
Niederhaus SV. Transplantation. 2011; 92: 1-17.
Okada D. Transplant Internat. 2018; 31: 1008-1017.
Jordan S. NEJM. 2017; 377: 442-453.
Fernández C. Nefrologia. 2017; 37(6): 638-645.
Toyoda M. J Immunol Res. 2017; 2017:5672523.
Amrouche L. Transplantation. 2017; 101:2440-2448.
Kim DG. BMC Nephrology. 2019; 20: 456.
Se han comunicado otras complicaciones en relación con los protocolos de desensibilización especialmente relacionadas con el uso de técnicas de aféresis y otras medicaciones 639.
El TRDV HLA incompatible es más costoso que un TR compatible, por el uso de agentes depletivos de células B, aféresis, IVIG, la inducción, medicación inmunosupresora y el tiempo de estancia hospitalario665. Si bien el coste absoluto es mayor, el TRDV es coste-efectivo comparado con la permanencia en diálisis623,666. Los costes de medicación adicional como eculizumab no han sido evaluados.
ConclusionesEn resumen, la desensibilización actualmente hace posible el acceso al trasplante al 70-90% de los pacientes que inician los protocolos, con una supervivencia elevada de paciente y riñón, a pesar de un incremento en la incidencia de rechazo agudo mediado por anticuerpos que podría reducirse con el uso de imlifidase o eculizumab.
La posibilidad de un receptor altamente sensibilizado de acceder a un trasplante HLA compatible mediante un trasplante cruzado sería una excelente opción. Sin embargo, las probabilidades de trasplante son bajas, especialmente en aquellos con cPRA del 97% o superior667. Los programas específicos de TR para hipersensibilizados a nivel nacional permiten trasplantar a muchos pacientes que no encuentran posibilidad de acceso a trasplante cruzado y que además resulta imposible desensibilizar. Esta opción disminuye considerablemente cuando el cPRA supera el 99,9%.
Decidir una u otra opción depende fundamentalmente de sopesar la situación particular del candidato y su donante en función del grupo sanguíneo y cPRA, ya que va a condicionar el tiempo en lista de espera en programa de donante cruzado o especial de donante fallecido, con la mayor probabilidad de trasplante y más rápida con desensibilización a pesar de una incidencia elevada de rechazo. Las guías británicas presentan un simulador donde en función del grupo sanguíneo de donante y receptor, estado de sensibilización y edad, se calcula la probabilidad de trasplante cruzado según el grado de sensibilización HLA y grupo ABO, realizando una previsión de supervivencia2. Recientemente, se ha desarrollado un software que facilita el manejo de un programa de donación cruzada668.
Finalmente, existe un considerable porcentaje de pacientes en los que la desensibilización no es posible por su elevado cPRA o MFI. Además, debido a su alto cPRA resulta difícil encontrar un donante adecuado en las listas de TR cruzado o incluso en las listas para donante fallecido con programas específicos. La incorporación de donantes compatibles a la lista de donación cruzada, la aceptación de grupos A2 para receptores O, la disminución del umbral de donante no aceptable o los programas transnacionales, permiten incrementar las posibilidades. Otra opción podría ser desensibilizar a los pacientes para tratar de disminuir el cPRA y tener más opciones para poder trasplantarse. Los resultados con imlifidase son esperanzadores de cara a plantear una desensibilización 100% efectiva.
Sección 15. Donante vivo con incompatibilidad ABODe las diferentes opciones de tratamiento renal sustitutivo, el TRDV ofrece las mayores tasas de supervivencia de paciente e injerto, mejor calidad de vida a largo plazo y menor coste económico669. En el proceso de selección donante-receptor, la incompatibilidad de grupo sanguíneo (ABOi) se ha considerado tradicionalmente una contraindicación absoluta para la donación. Pero desde hace ya bastantes años se conoce que el trasplante con donantes ABOi ofrece excelentes resultados. A diferencia de la incompatibilidad HLA, en el trasplante ABOi (una vez superado con éxito el proceso de desensibilización) la evolución clínica es similar a la de los trasplantes ABO compatibles (ABOc).
Eficacia del TRDV ABO incompatible- •
Se recomienda el TRDV ABOi al obtener resultados comparables a los alcanzados con el TRDV ABOc (calidad de la evidencia: B).
- •
Se sugiere que la opción del trasplante ABOi, debe ser contemplada en los centros que realizan TRDV para aumentar las oportunidades de trasplante (SG).
La regla de evitar la donación ante casos con incompatibilidad de grupo sanguíneo ha sido abandonada y superada con éxito670. Los malos resultados iniciales671 dejaron de lado esta opción de trasplante hasta que en los años 90, diferentes grupos, especialmente en Japón672,673 comunicaron resultados excelentes en series con un número amplio de pacientes, que abrieron las expectativas para su empleo por grupos estadounidenses674,675, franceses676 y suecos677,678. En España, el primer TRDV ABOi se realizó en 2006 en el Hospital Clínic de Barcelona y los buenos resultados iniciales confirmaron los de otros grupos679–683. Rápidamente se sumó el Hospital Universitario de A Coruña684 y posteriormente varios centros más685.
¿Qué necesitamos estudiar para realizar TRDV ABO incompatible?- •
Se sugiere que el trasplante ABOi debería contemplarse como una alternativa a tener en cuenta si no existe un donante ABO compatible (D).
- •
Se sugiere monitorizar los títulos de isoaglutininas IgG e IgM. Hay controversia con la trascendencia de ambos tipos de inmunoglobulinas para llevar a cabo el trasplante (D).
Los criterios de aceptación iniciales son los mismos que para un TRDV ABOc9 a los que añadiremos la posibilidad de determinar los anticuerpos frente a los antígenos A o B incompatibles, denominados isoaglutininas. El título de isoaglutininas IgG e IgM debería ser igual o inferior a 1/8 para proceder al trasplante. Así pues, el siguiente requerimiento será contar con alguno de los tratamientos de aféresis utilizados para reducir la concentración de isoaglutininas si fuera necesario (siempre lo es, excepto para títulos basales muy bajos < 1/8). Normalmente se requieren entre tres y cinco sesiones de aféresis para reducir los títulos hasta el nivel de seguridad para llevar adelante el trasplante. Si los títulos basales son muy elevados (> 1/512) aumenta el riesgo de que el tratamiento de aféresis no consiga una reducción efectiva de los mismos y se descarta la donación. Ello supone un coste enorme desde el punto de vista económico y emocional686-689 por lo que muchos centros recomiendan o contraindican el tratamiento de desensibilización cuando los títulos basales son muy elevados 9,686,687. No existe consenso sobre si es necesario un título bajo simultáneamente para ambas inmunoglobulinas (IgM e IgG)690,691 o únicamente para una de ellas. Algunos grupos opinan que lo crucial es reducir el título de IgG, mientras que otros opinan todo lo contrario. Por otra parte, centros con mucha experiencia aceptan trasplantar a pacientes con títulos más elevados (1/32) en el momento del TR692,693.
Cuando el grupo sanguíneo incompatible del donante es A2, dada la baja expresividad antigénica, algunos centros no consideran formalmente esta como incompatibilidad ABO si los títulos son bajos y proceden directamente al trasplante como si se tratara de un donante ABO compatible694.
¿Cómo medir las isoaglutininas?Este aspecto se ha desarrollado con detalle en la sección 9.
Técnicas de desensibilización (tabla 14)El esquema de desensibilización de un TR ABOi requiere dos acciones esenciales: eliminar de la circulación las isoaglutininas e inhibir la síntesis de las mismas. El tratamiento se puede complementar con la administración de IVIG, que podrían tener un efecto inmunomodulador, además de permitir restaurar los anticuerpos protectores perdidos por la aféresis. No obstante, estos preparados también contienen isoaglutininas, lo que puede ser un factor de confusión a la hora de interpretar la evolución de los títulos durante el tratamiento686,695.
Técnicas de sensibilización y sus objetivos
| Técnicas | Variantes | Objetivos | Comentarios | Calidad evidencia |
|---|---|---|---|---|
| Recambio plasmático | Filtración únicaDoble filtración | Reducción de isoaglutininas circulantes | Posibles complicaciones hemorrágicas post-trasplante debido a alteraciones en el sistema de la coagulación | B |
| Inmunoadsorción | EspecíficaInespecífica | Reducción de isoaglutininas circulantes | La inmunoadsorción específica es más eficiente en reducir los títulos de IgM | B |
| Inmunoglobulinas | Dosis bajasDosis altas | Reposición de inmunoglobulinas y posible efecto inmunomodulador | Administrado a dosis altas puede contener isoaglutininas que interfieran en la interpretación de los resultados de la titulación | C |
| Esplenectomía | Depleción de células B | Se ha dejado de practicar de forma rutinaria | C | |
| Rituximab | Dosis convencionales vs. dosis bajas | Depleción de células B | No hay consenso en cuanto a dosis ni frecuencia de administración | C |
Si nos centramos en las diferentes técnicas de aféresis, en los últimos años han sido múltiples las opciones que han ido surgiendo53,683,696–701. Básicamente, tenemos tres técnicas con sus diversas variantes: recambio plasmático, inmunoadsorción inespecífica e inmunoadsorción específica. Cuando nos enfrentamos a títulos bajos, cualquiera de las modalidades es efectiva. Para reducir de forma eficaz los títulos elevados, ninguna técnica ha mostrado evidencia de ser más eficaz que otra, aunque algunos autores apuntan que la inmunoadsorción específica sería la mejor. Además de la eficacia, debe tenerse en cuenta el coste económico, los aspectos logísticos y los efectos secundarios, especialmente en relación a alteraciones en los factores de la coagulación, reacciones de intolerancia y riesgo de infecciones688,698. En este sentido, las técnicas de inmunoadsorción son mejor toleradas, permiten un mayor volumen de plasma tratado en cada sesión y no alteran los factores de la coagulación. Un aspecto logístico interesante es la posibilidad de realizar hemodiálisis y aféresis de forma simultánea.
En lo que se refiere al bloqueo de la producción de isoaglutininas, en las primeras experiencias japonesas, se practicaba la esplenectomía671,672. El principal inconveniente, además de las posibles complicaciones quirúrgicas e infecciosas, era la necesidad de vacunación rutinaria frente a bacterias encapsuladas de forma indefinida. La sustitución de la esplenectomía por el tratamiento con rituximab, no solo demostró ser más eficaz y seguro, sino que su efecto se reduce a unos pocos meses. Aunque no existen ensayos clínicos que lo respalden, actualmente es el tratamiento de elección676,678,682,684,697,698,702–704, sin que exista consenso en cuanto al número o cantidad de dosis, días de antelación respecto al inicio de la desensibilización y otros elementos de la pauta de administración. Algunos equipos ven suficiente una única dosis administrada tres a cuatro semanas antes del trasplante; otros prefieren dos dosis, la primera tres a cuatro semanas antes del trasplante y la segunda inmediatamente antes del mismo, buscando combinar el efecto farmacológico inmediato y diferido678,682,684,692. También hay disparidad de criterio en relación con la cuantía de la dosis. Inicialmente se utilizaba la misma que en el tratamiento del linfoma, 375 mg/m2 una o dos veces473, pero debido a la publicación de estudios que indicaban que una dosis más baja era suficiente para hacer desaparecer de la circulación los linfocitos B CD19 positivos, se establecieron pautas que oscilaban entre 50 mg y 400 mg678,705–707. Diversos metaanálisis relacionan el uso excesivamente extendido de este fármaco (no así la dosis suministrada) con una mayor mortalidad por infecciones697,698,700,708,709. En consecuencia, con estos hallazgos y la mejora en la eficiencia de las técnicas de aféresis han hecho que algunos grupos cambien la necesidad de administrar rituximab de forma sistemática, para darlo únicamente en determinados casos710,711.
Entre otras opciones terapéuticas con el fin de bloquear la síntesis de isoaglutininas estaría el bortezomib. Se ha ensayado como tratamiento de desensibilización en TRDV ABOi en casos refractarios a rituximab o en sustitución de este680,712. También se ha ensayado la utilidad de eculizumab, que en cuatro pacientes fue capaz de prevenir el rechazo mediado por anticuerpos en ausencia tratamiento con aféresis713,714. Existe interés por conocer la posible eficacia del empleo de imlifidase capaz de escindir en dos pasos y en pocos minutos, tras una sola dosis, todas las IgG circulantes. Un factor limitante sería su ineficacia frente a anticuerpos IgM.
Finalmente, muchos centros utilizan IVIG de forma rutinaria. Su utilidad sería doble: restaurar las inmunoglobulinas eliminadas por la aféresis, para lo que la administración de dosis bajas de 100-200 mg/kg sería suficiente, o bien administrarlas a dosis elevadas (1-2 g/kg) para conseguir un efecto inmunomodulador de carácter multifactorial, destacando especialmente la provisión de anticuerpos anti-idiotipo que facilitarían el fenómeno de acomodación715. En contra del uso sistemático aparecen tres factores: no es necesario reponerlas cuando se utiliza IA específica; no se ha demostrado su eficacia por lo que supone un gasto innecesario y finalmente, su contenido en isoaglutininas puede artefactar los resultados de titulación677,682,683,690,695.
¿Cuál es el comportamiento de las isoaglutininas postrasplante? ¿Es correcto monitorizar los títulos y no intervenir mientras se mantengan bajos?
Se sugiere practicar una o dos sesiones de aféresis postrasplante de forma protocolizada, aunque al no existir recomendaciones claras, otros grupos optan por esperar al posible repunte de los títulos (C).
Para que se realice un TRDV ABOi se tiene que alcanzar un nivel de seguridad de isoaglutininas como se ha comentado anteriormente. Después del mismo, los anticuerpos anti-A o B pueden rebotar incluso a niveles mayores que al inicio de la terapia de desensibilización 687,706. Ese potencial rebote puede condicionar la aparición de un rechazo precoz, pero en la mayoría de casos en que se detecta un incremento de títulos sin alteración de la función del injerto, la biopsia del mismo muestra ausencia de daño inmunológico a excepción de la habitual presencia de depósitos de C4d 716,717. Puede que un nivel bajo de isoaglutininas en sangre periférica se deba a que la mayor parte ha sido adsorbida por el injerto, con lo que los anticuerpos anti-A o B circulantes tendrían menos avidez para los antígenos del donante, reduciendo así su implicación patológica718.
En cualquier caso, tras el trasplante algunos grupos creen necesario reinstaurar las sesiones de aféresis si los títulos de isoaglutininas aumentan durante las dos primeras semanas, mientras que otros solo lo hacen si existe disfunción renal o una biopsia muestra signos de rechazo diferentes de los depósitos de C4d. Algunos centros prefieren incluir una o dos sesiones de aféresis de forma protocolizada y así tratar de evitar un repunte de los títulos o incluso prevenir un rechazo mediado por anticuerpos, que no hay que olvidar que puede aparecer a pesar de que el paciente no haya presentado todavía una elevación de los títulos680–682. Por el contrario, otros centros solo ven inconvenientes (problemas hemorrágicos, logísticos y un gasto innecesario) y ningún beneficio672,684,698,719 en practicar sesiones aféresis profilácticas postrasplante.
¿Es la supervivencia de paciente e injerto la misma que con un TRDV ABOc?
Los resultados publicados con series de centros reportan resultados similares o pequeñas diferencias, para supervivencia del paciente y del injerto (C).
Los metaanálisis o análisis de registros son capaces de detectar peor supervivencia del paciente y del injerto por causas infecciosas en los primeros años de evolución (B).
Se recomienda estrecha vigilancia ante complicaciones infecciosas en receptores ABOi ante algunas experiencias que han reportado incrementos de mortalidad secundaria a infecciones (B).
Los metaanálisis que reportan resultados de supervivencia de los pacientes receptores de un TRDV ABOi lo hacen comparándolo con los resultados que ofrece el trasplante ABOc. En su mayoría señalan que no hay diferencias, o que estas son pequeñas53,696,697,703,704 y que desaparecen a largo plazo. Incluso considerando el potencial aumento de riesgo de complicaciones infecciosas por el tratamiento de desensibilización, el TRDV ABOi sería superior en cualquier caso respecto al TR de donante fallecido o la permanencia en diálisis720. Por otra parte, cuando se compara con la donación cruzada, tampoco se ha reportado mayor mortalidad721.
En cuanto a la supervivencia del injerto, muchos grupos han reportado similares resultados a corto-medio plazo, o incluso a largo plazo682,692,693,700,708,722. Otras series observan peores resultados y datos de metaanálisis y estudios de registro destacan una menor supervivencia del injerto que los TRDV ABOc a uno, tres y cinco años, pero sin diferencias a largo plazo53,697,703,704,722.
Aunque el trasplante ABOi se considera un procedimiento razonablemente seguro, el empleo de potentes fármacos inmunosupresores, en especial rituximab, se asocia a un incremento de infecciones700,708,709. Diversas series reportan una mayor frecuencia de infecciones virales723,724 así como de neumonías, infecciones urinarias o de la herida quirúrgica724,725. No todas las series coinciden en ello, y la moderación en el uso de rituximab propuesta por grupos japoneses se ha visto acompañada de una significativa reducción de la infección por CMV693. Además, con estas y otras medidas de profilaxis antiinfecciosa, se ha reportado recientemente una tasa de infección urinaria y neumonía, comparables a las de trasplante ABOc698,723.
A diferencia de lo que ocurre con las infecciones, la incidencia de tumores no parece estar aumentada en los trasplantes ABOi, si bien es cierto que no existe literatura tan abundante al respecto726,727.
¿Qué ocurre con el rechazo agudo?
La incidencia de rechazo agudo, en particular el rechazo agudo mediado por anticuerpos es más elevada en metaanálisis de trasplantes ABOi, aunque a nivel de centro, muchos reportan resultados comparables (B).
La serie inicial japonesa reportaba una incidencia significativa de pérdidas de injertos por rechazo hiperagudo o acelerado y de hecho, esta podría ser la principal o tal vez la única diferencia entre los trasplantes ABOi y ABOc. Se debería al desarrollo rápido de rechazo agudo mediado por anticuerpos contra los antígenos A o B incompatibles. Por el contrario, la serie inicial sueca preconizaba una incidencia de rechazo muy baja, tanto celular como humoral, que atribuía a la importante carga inmunosupresora administrada. Otros trabajos destacan mayor incidencia de rechazo celular leve679,728.
Mecanisnos de acomodación y rechazo
Un fenómeno de posible acomodación inmunológica frente a la incompatibilidad ABO aparece casi universalmente en los trasplantes ABOi: presencia de títulos altos de isoglutininas, expresión de antígenos AB en el endotelio y positividad para C4d en capilares peritubulares, en ausencia de otros signos de rechazo y con función renal conservada (B).
Las pérdidas precoces por rechazo acelerado son poco frecuentes y en general se acompañan de microangiopatía trombótica (C).
Se sugiere la anticoagulación profiláctica en las primeras semanas del trasplante por la susceptibilidad del endotelio ABOi ante cualquier insulto inmunológico o no inmunológico a los fenómenos de trombosis (C).
Lo más intrigante del rechazo mediado por anticuerpos contra antígenos ABO es que raramente aparece una vez superadas las dos a tres semanas después del trasplante, a pesar de detectarse isoaglutininas a títulos incluso elevados y evidencias en las biopsias de protocolo de que ha habido activación del complemento. Los mecanismos que intervienen en la acomodación pueden ser varios y podrían afectar tanto a la síntesis de anticuerpos, a la exposición de los antígenos y al desarrollo de mecanismos activos de protección. Para que se establezca la acomodación se requiere superar favorablemente la primera fase en la que el daño inicial provocado por los anticuerpos, y el complemento activaría una respuesta de reparación y protección frente a la citotoxicidad que propiciaría a largo plazo la adquisición de mecanismos activos de protección a nivel celular y tisular64. Si en la primera fase hubiera una alteración ultraestructural en la membrana plasmática con cambios regionales de la agregación plaquetaria y reclutamiento de neutrófilos, se perdería esa resistencia intrínseca a la citotoxicidad y podría llegarse a la trombosis del injerto en las primeras horas718. De ahí la recomendación de realizar anticoagulación profiláctica durante la primera semana.
¿Qué papel tendría el complemento y el depósito de C4d en la biopsia del trasplante?
La sistemática presencia de C4d en las tinciones de biopsia de protocolo en trasplantes ABOi es bien conocida y su significado exacto no se conoce, aunque tiende a interpretarse como un fenómeno de acomodación713,730,731. Aquellos pacientes trasplantados ABOi con depósito de C4d sin otras anormalidades histológicas no suelen desarrollar glomerulopatía del trasplante o disfunción crónica del injerto. De hecho, cuando presentan de forma persistente deposito difuso de C4d tienen menor daño crónico después del primer año. El bloqueo farmacológico de la activación del complemento puede tener interés para prevenir o para tratar el rechazo humoral y también para prevenir los fenómenos de microangiopatía trombótica asociados al daño endotelial. Existen pocas experiencias, aunque exitosas, del uso profiláctico de eculizumab en este tipo de trasplantes.
Sección 16. Trasplante cruzado y donante altruistaEl TRDV propone intercambiar los donantes de distintas parejas donante-receptor, que por incompatibilidad biológica u otro motivo decide no realizarse directamente, para dar lugar a nuevas parejas donante receptor entre las que se efectúa un trasplante directo.
La incompatibilidad biológica entre donante y receptor es una barrera para el TRDV. Se estima que alrededor de un 35% de los pacientes son incompatibles con su potencial donante vivo732, debido a la incompatibilidad de grupo sanguíneo (ABOi) o a la existencia de anticuerpos preformados en el receptor contra los antígenos del sistema HLA de su potencial donante, que da lugar a una prueba cruzada positiva (HLAi). Como se ha comentado en secciones previas, entre las posibles opciones de tratamiento, se encuentran9: realizar la búsqueda de otro donante vivo, incorporar a la pareja en un programa de TR cruzado, plantear un trasplante incompatible con desensibilización o mantenerse en lista de espera de donante fallecido.
El TRDV cruzado fue planteada por Rapaport en 1986733 y, para ello, el autor consideró fundamental garantizar el anonimato entre los miembros de las nuevas parejas formadas. Posteriormente, el grupo de Park734 llevó a cabo el primer trasplante cruzado entre dos receptores con donante incompatible en Corea del Sur, en 1991. Suiza (1999) y EE. UU. (2000) diseñaron programas de TRDV cruzado a nivel de centro. Holanda puso en marcha el primer programa nacional en 2004, seguido de Reino Unido (2007), Canadá (2009)735–738 y España (2009)543. El programa español, con 203 trasplantes realizados entre 2009 y 2018, se ha posicionado como el segundo en actividad, detrás de Reino Unido51.
Los resultados obtenidos han mostrado un incremento en el número de trasplantes15,51,667,739–743 y resultados similares en supervivencia de injerto y paciente con respecto a los de TRDV directo compatible744,745 y mejores respecto al TRDV directo HLA incompatible6,54,746,747.
Bases del programa de TR cruzado en España- •
Se recomienda la opción de TR cruzado frente al trasplante HLA incompatible debido a la mejor supervivencia, por lo que esta información debe ser presentada a las parejas con incompatibilidad HLA (calidad de la evidencia: B).
- •
En pacientes con muy pocas opciones de trasplante (grupo sanguíneo O e hiperinmunizados) se les debe explicar la posibilidad de añadir al TR cruzado, tratamientos como la desensibilización para aumentar sus opciones de trasplante (SG).
El programa español de trasplante cruzado543 tiene como objetivo principal aumentar las posibilidades de TRDV en aquellos casos en que no existe compatibilidad entre donante y receptor, ya sea por grupo sanguíneo ABOi o por haber resultado la prueba cruzada positiva, así como en otros supuestos en los que, sin existir una imposibilidad real para trasplante entre la pareja, existe un beneficio real asociado a un procedimiento de TR cruzado (por ejemplo, obtener una menor diferencia de edad entre donante y receptor o unas características antropométricas del donante acordes a las necesidades del receptor).
La normativa que establece el procedimiento para realizar trasplantes cruzados fue desarrollada y publicada en el año 2009 por la ONT en colaboración con un comité multidisciplinar de expertos en diferentes aspectos del procedimiento de TR de donante vivo: nefrólogos, inmunólogos, urólogos, coordinadores de trasplantes y expertos en bioética y legislación.
Tras el inicio del programa se estableció un mecanismo para la mejora continua, basado en la creación de un grupo de trabajo y un comité científico (cuyos miembros pertenecen al grupo de trabajo). El grupo de trabajo está compuesto por los responsables del programa, en la ONT y en cada uno de los centros participantes y es convocado por la ONT una vez al año para analizar los resultados obtenidos en el programa y establecer modificaciones en los diferentes apartados, en la búsqueda de la mejora continua. El comité científico tiene como funciones la evaluación de casos complejos y la elaboración de propuestas de mejora.
De esta manera, el programa ha ido añadiendo elementos de mejora, como la incorporación de nuevos centros, homogeneización de criterios clínicos e inmunológicos, actualización de la información registrada, ampliación del tipaje de los donantes, incorporación de cadenas de donante altruista, algoritmo de compatibilidad, incorporación reciente de la posibilidad de realizar trasplante ABOi en el programa en potenciales receptores con sensibilización HLA, el score de priorización, la búsqueda de opciones de traslado renal que acorten tiempos y sean sostenibles y la ampliación de parejas y diversidad HLA con la internacionalización del programa. De hecho, se han realizado tres trasplantes cruzados internacionales, entre España e Italia y entre España y Portugal748.
Los elementos del programa son tres: los requisitos que deben cumplir los centros de trasplante para participar, la herramienta informática, que contiene la base de datos de parejas donante y receptor, un algoritmo de selección de posibles intercambios y una herramienta de optimización de ciclos detectados, para maximizar el número de trasplantes y aumentar las opciones de receptores «difíciles de combinar», y un protocolo de funcionamiento, que describe el procedimiento de registro de parejas, la realización del cruce (o matching-run) y el procedimiento hasta el trasplante.
Opciones de intercambio que ofrece el programa (fig. 14)- •
Intercambio de los donantes entre parejas donante-receptor registrados previamente en una base de datos, para formar ciclos de dos y de tres TR.
Los donantes y receptores de estos ciclos forman nuevas parejas que son «más» compatibles desde el punto de vista inmunológico o, en caso de ser previamente compatibles, que tienen una mejor adecuación en criterios antropométricos o edad. Por tanto, para que un ciclo se forme la compatibilidad debe ser bidireccional. Es decir, todos los donantes del ciclo formado deben ser compatibles con el receptor seleccionado para ellos. Por imperativo legal, los miembros de las nuevas parejas formadas no se conocerán41.
Los procedimientos de trasplante se llevan a cabo de manera simultánea, para minimizar el riesgo de que uno o varios receptores del ciclo no reciba un trasplante, después de que se haya realizado la nefrectomía de su donante incompatible.
- •
Incorporación de un donante altruista al programa iniciando una cadena de TR. En esta opción la compatibilidad es unidireccional, es decir, solo es necesario que el donante sea compatible con el siguiente receptor en la cadena, lo que facilita su construcción749.
En este caso no es necesario realizar todos los trasplantes al mismo tiempo, ya que si hay un evento inesperado y como consecuencia un receptor de la cadena no recibe el riñón que le corresponde, su donante no habrá efectuado aún la donación. Poder realizar la cadena de trasplantes en varios tiempos permite además añadir eslabones, favoreciendo un mayor número de trasplantes. Esta opción es la que se conoce como cadena de trasplantes con donante puente. El último eslabón de la cadena es un paciente de la lista de espera del hospital que ha evaluado al donante altruista750.
Dado que las cadenas de trasplantes tienen como principal característica diferencial la incorporación del donante altruista (buen samaritano), se tratarán en un apartado específico.
Centros participantesLos centros que deseen participar en el programa de TR cruzado deben disponer de la infraestructura necesaria y del acuerdo, por parte de los servicios clínicos implicados, para cumplir con las condiciones de funcionamiento de este. Además, los equipos de trasplante deben tener experiencia en el procedimiento de TRDV. Este punto es de vital importancia, pues se va a producir el intercambio entre los donantes de diferentes hospitales y debe existir confianza en la forma de proceder de todos los centros.
Por estos motivos, el protocolo del programa nacional de donación renal cruzada establece los siguientes requisitos:
- •
Un criterio de actividad mínima, que en el momento actual es la realización de 15 TRDV en los tres años previos a la adscripción del centro.
- •
La utilización de técnicas mínimamente invasivas para la realización de la nefrectomía32.
- •
La aceptación de las condiciones establecidas en el programa en cuanto a la realización de pruebas diagnósticas (por ejemplo, la ampliación de un tipaje de donante).
- •
La designación de un responsable del programa a nivel de centro.
- •
La aprobación de la participación en el programa por parte de la autoridad sanitaria competente543.
En la actualidad, el programa cuenta con 26 centros participantes y 19 laboratorios de histocompatibilidad (uno de ellos es centro de referencia de dos centros en Madrid y otro de seis centros en Cataluña) en 12 comunidades autónomas. Se trata de un dato importante, pues países como Holanda basan parte del éxito de su programa en la existencia de un laboratorio central de histocompatibilidad para este programa751. A pesar de la mayor dificultad que supone el manejo de pacientes inmunológicamente complejos en diferentes laboratorios, España ha obtenido resultados excelentes. La organización del programa inglés es similar a la de España, con 20 laboratorios de histocompatibilidad diferentes y 23 centros trasplantadores y Reino Unido es, hoy en día, el programa europeo con mayor número de TR cruzados51.
Los hospitales no adscritos al programa pueden incluir parejas donante-receptor a través de los hospitales participantes. Para ello, las Coordinaciones Autonómicas de Trasplantes establecen los acuerdos y procedimientos oportunos543.
De esta manera, todos los enfermos renales con un posible donante incompatible (o compatible, que pueda beneficiarse de un intercambio) tendrán la oportunidad de participar en el programa, garantizando así la equidad en el acceso. Esta oportunidad para los pacientes y sus posibles donantes lleva implícito el derecho que tienen todos ellos a ser informados adecuadamente acerca del programa de TRDV cruzado2,9.
Herramienta informáticaSe trata de una aplicación online, a la que solo pueden acceder los centros adscritos al programa y el personal responsable del mismo en la ONT, mediante usuario y contraseña, para cumplir con lo establecido en la ley de protección de datos. La búsqueda de posibles intercambios puede realizarse de manera manual, si bien el volumen de parejas y su complejidad recomiendan la automatización del sistema para obtener buenos resultados. La herramienta comprende543,752,753:
- •
Una base de datos de parejas donante-receptor, en la que se registra y actualiza la información demográfica y clínica de los pacientes y sus posibles donantes, necesaria para el cruce:
- •
Un paciente puede ser registrado con más de un donante. El receptor podrá formar pareja para intercambiarse con tantos donantes como aporte, lo que hará incrementar sus opciones de cruce752,754. Entre 2009 y 2018 se han incorporado al programa español de donación renal cruzada 656 parejas donante-receptor (557 receptores con un donante, 36 receptores con dos donantes y nueve pacientes con más de dos donantes).
- •
No existe un límite de edad inferior ni superior para incluir un receptor. El donante debe cumplir con los requisitos que establece nuestra ley con respecto a la edad mínima (≥ 18 años) sin existir un límite superior, siempre y cuando el donante en su conjunto haya sido considerado adecuado por el hospital participante. La edad media de donantes y receptores registrados en el programa español es similar, 50 años y 46,3 años, respectivamente.
- •
El programa contempla el registro de pacientes con posibles donantes, tanto incompatibles como con compatibilidad biológica a priori, pero que desean realizar un intercambio, ya sea para obtener un donante más joven, adecuar el tamaño, mejorar la compatibilidad HLA o por motivos meramente altruistas755,756. Los motivos de inclusión en el programa han sido ABOi en un 43% de los casos, presencia de DSA en el 51%, incompatibilidad ABO y HLA en el 4% y 12 parejas compatibles, que suponen un 2% de las parejas registradas.
- •
La base de datos contempla el registro de donantes altruistas para construir una cadena de trasplantes51.
- •
La aplicación asocia de manera automática un código numérico a cada donante y a cada paciente registrado, que permitirá mantener el anonimato entre los miembros de las nuevas parejas formadas tras el cruce, sin perder la trazabilidad del proceso.
- •
- •
Un algoritmo de compatibilidad, que busca todas las opciones de intercambio posibles en el pool de parejas donante-receptor, para formar ciclos de dos o tres trasplantes y cadenas iniciadas con donante altruista. Las reglas son dos:
- •
Compatibilidad ABO y compatibilidad HLA: mediante una prueba cruzada virtual, selecciona aquellos receptores que no poseen anticuerpos preformados frente a los diferentes antigenos HLA del donante (tanto para HLA de clase I como de clase II)736,740,746.
- •
Compatibilidad HLA exclusivamente, permitiendo en este caso el TR ABOi697,757.
- •
- •
Una herramienta de selección de ciclos detectados para maximizar el número de trasplantes y aumentar las opciones de receptores que tienen más dificultades para encontrar un donante compatible, como los del grupo O y/o los pacientes hiperinmunizados543. Para ello, el sistema cuenta con:
- •
Un scorede puntuación, que tiene en cuenta el grado de inmunización (cPRA), el grupo sanguíneo, el tiempo en diálisis, la edad de los donantes y receptores, el tiempo que el receptor lleva incluido en el programa y, en caso de empate, la distribución geográfica. Dado el carácter excepcional de inclusión de una pareja compatible y, ya que es un elemento que aumenta las opciones de trasplante, se le da prioridad51.
- •
Un modelo de optimización, que trata de maximizar:
- •
El número de trasplantes realizados.
- •
Los trasplantes realizados a pacientes con dificultades para encontrar un donante compatible
- •
Los ciclos seleccionados, lo que implica obtener más ciclos de dos que de tres trasplantes (siempre que se maximice el número total de trasplantes)
- •
El número de ciclos robustos. Al seleccionar ciclos de tres trasplantes, si debemos elegir entre dos ciclos que compartan una o dos parejas y tengan la misma puntuación, se seleccionará siempre el que pueda acortarse a un ciclo de dos trasplantes (lo que facilita su realización final)752.
- •
- •
La aplicación del algoritmo de compatibilidad y la herramienta de selección se aplican de manera conjunta, para buscar un set óptimo de posibles combinaciones. Para ello, en Europa, se utilizan actualmente dos modelos de programación752:
- •
La construcción de un grafo de compatibilidad y la asignación de una puntuación (llamado peso) a cada uno de los miembros de la pareja, con base en los criterios que el programa establezca (edad, grado de inmunización, etc.) Es el que utiliza el programa español.
- •
Formulación de los distintos intercambios mediante programación integral.
Antes de incluir a las parejas donante-receptor en el programa de trasplante cruzado y continuar con la dinámica del cruce, se debe informar a las parejas sobre el funcionamiento y otras consideraciones del programa.
Información a las parejas- •
Se recomienda la opción de TR cruzado frente al trasplante HLA incompatible debido a la mejor supervivencia, por lo que esta información debe ser presentada a las parejas en las que el trasplante directo no sea posible (B).
- •
Se debe proporcionar al receptor y a su potencial donante vivo, información sobre el programa de trasplante cruzado, con la evidencia científica existente respecto al mismo y comparada con los resultados de otras opciones de tratamiento. Además, se debe explicar la probabilidad de recibir un trasplante cruzado, en función de sus características (grupo sanguíneo y grado de inmunización) (SG).
- •
El donante y el receptor de una pareja compatible que puedan beneficiarse de un trasplante cruzado, deben recibir toda la información disponible acerca del mismo para decidir su participación (SG).
- •
La participación de las parejas en el programa de donación cruzada requiere firmar un consentimiento específico (B).
- •
Los donantes deben ser informados acerca de la regulación sobre la confidencialidad y el anonimato en el procedimiento, tanto de cruzado, como en cadenas/donación directa de donante altruista y asegurar que el donante lo acepta antes de seguir adelante (SG).
- •
Se debe informar al donante de los riesgos y beneficios de que se traslade el riñón en vez del donante y de la contingencia de que el riñón extraído se trasplante en otra persona (SG).
El donante y el receptor deben firmar un consentimiento específico2,9,543 de su participación en el programa, lo que implica que han entendido las responsabilidades que tienen frente a otras parejas, si son seleccionadas en un ciclo o cadena de trasplantes. Para ello, deben haber sido previamente informados acerca de los riesgos y beneficios del TRDV, de las opciones que ofrece este programa, de la forma de proceder con respecto a la lista de espera de donante fallecido, de la obligatoriedad de mantener el anonimato entre los miembros de las nuevas parejas formadas, de la probabilidad de éxito del trasplante en base a sus características (grupo sanguíneo, grado de inmunización, etc.), y de la posibilidad, si es el caso, de realizar tratamiento de desensibilización añadido al trasplante cruzado, para aumentar las opciones de éxito del trasplante y de la posibilidad, por pequeña que sea, de que ocurra un evento no esperado (ver apartado de logística del trasplante), por lo tanto:
La información que se facilita a un paciente candidato a trasplante y a su potencial donante vivo incompatible debe incluir la evidencia científica con respecto a los resultados del trasplante compatible, del incompatible y de ambos respecto a permanecer en lista de espera. En los receptores del grupo O, en pacientes hiperinmunizados, o en aquellos en los que se den ambas circunstancias a la vez, se les debe informar de la menor probabilidad de trasplantarse en este programa9. Se debe informar al receptor de que si está en lista de espera de donante fallecido podrá permanecer en las dos listas de espera, pero que saldrá de la lista de donante fallecido si es seleccionado en un cruce. La información proporcionada a cada pareja debe ser comprensible y accesible en todo momento.
Los donantes ABOi y/o HLAi con su receptor deben ser informados de la existencia del programa de trasplante cruzado, y de las diferentes opciones de tratamiento que existen, así como de los riesgos de cada opción y sus probabilidades de éxito2,9.
Los donantes deben saber que un trasplante compatible tiene la mayor probabilidad de éxito que el trasplante directo HLAi con mayor riesgo a corto y largo plazo, si es lo que se les va a proponer2,6.
Si una pareja es compatible y decide incluirse en el programa de trasplante cruzado, para obtener otros beneficios como, por ejemplo, acortar la diferencia de edad con su donante vivo, mejorar la compatibilidad HLA o adecuar el peso, debe recibir toda la información adecuada para decidir su inclusión.
Realización de cruce- •
Se recomienda registrar a la pareja donante-receptor en el programa de TR cruzado solo cuando tengan el estudio clínico finalizado y el screening inmunológico completo (B).
- •
Se recomienda que el responsable del programa de TR cruzado en cada hospital participante, revise y actualice antes de cada cruce, la información relativa a las parejas registradas (B).
- •
Se recomienda detallar posibles limitaciones de aceptación de un donante (complejidad quirúrgica, edad, etc.) en el momento de la inclusión de una pareja en el programa de TR cruzado (B).
- •
Se sugiere excluir de la lista de espera de donante fallecido en el momento en que salga seleccionado en un ciclo de trasplante cruzado. Mientras tanto, pueden estar activos en ambas listas de espera (SG).
Como norma general, el programa establece la realización de tres cruces al año, es decir, uno cada cuatro meses, de modo que los equipos de trasplante tengan tiempo suficiente de revisar y actualizar sus parejas. Existe la posibilidad de realizar un cruce extra en circunstancias especiales, como es el caso de un donante altruista que ha finalizado el estudio.
En Holanda o Reino Unido, los cruces se hacen trimestrales y en el programa de la UNOS, semanales (51). Sin embargo, no hay evidencia de que un mayor número de cruces revierta en un mayor número de trasplantes. Son el número y las características de las parejas registradas, las que condicionan el número de posibles intercambios758,759. De hecho, el número de intercambios detectados aumentó en España al incrementarse el número de parejas activas. El número medio de parejas activas para cada cruce en España ha sido de 120 en los últimos seis años, con un 60% de nuevas parejas en cada cruce.
Tres semanas antes del cruce, la ONT envía un correo electrónico informando de la fecha concreta del cruce, para que los centros incorporen nuevas parejas donante-receptor y actualicen la información registrada. No podrá incorporarse una pareja donante-receptor hasta que el estudio esté finalizado y el screening inmunológico sea completo y esté actualizado, para asegurar que en el caso de ser seleccionada, se puedan seguir los pasos del proceso en los tiempos establecidos. De otro modo, se obtendrán potenciales ciclos con alto riesgo de no poder llevar a cabo los trasplantes, con consecuencias negativas para los pacientes seleccionados y para el funcionamiento del programa756,760. Similar recomendación ha sido publicada en la última edición de la guía británica de TRDV2.
Además, es necesario que la información esté actualizada, para evitar la detección de ciclos que después no se puedan realizar, debido, por ejemplo, a la aparición de nuevos anticuerpos donante específicos no registrados o a la contraindicación médica de un receptor o un donante para seguir adelante con el procedimiento746,760. De hecho, el 50% de las causas por las que un ciclo de trasplantes no se lleva a cabo se pueden evitar si se revisa la información registrada (por ejemplo, DSA registrados), se informa de posibles restricciones en la aceptación de un donante para pacientes concretos (por ejemplo, la no aceptación de un donante de más de 70 años para un receptor menor de 40) y se actualiza el estado de donantes y receptores antes de cada cruce (para detectar posibles contraindicaciones médicas, tanto en donante como en receptor).
Los pacientes pueden estar activos en la lista de espera de donante fallecido y en la lista del programa de trasplante cruzado al mismo tiempo, de modo que ampliarán sus oportunidades para trasplante. Sin embargo, los pacientes deben ser excluidos de la lista de espera de fallecido en el momento en que salen seleccionados en un ciclo o cadena y permanecerán en exclusión temporal de la lista de espera de donante fallecido, mientras sigue el procedimiento de trasplante cruzado. Si el ciclo o cadena falla, volverán a estar activos en la lista de espera543.
Resultados del cruceUna vez seleccionadas las posibles combinaciones, la ONT emite un informe de resultados para los centros implicados, a través de un espacio seguro de intercambio de información. A partir de ese momento, los responsables a nivel hospitalario de cada uno de los ciclos evaluarán la información recibida (edad, grupo sanguíneo y tipaje HLA), compartirán los informes clínicos de los donantes y acordarán con los laboratorios de inmunología la realización de la prueba cruzada.
Se establece un plazo de siete días para compartir los informes clínicos, al que se suman 15 días más para la realización de la prueba cruzada. Como norma general, esta prueba se hará en el laboratorio de histocompatibilidad del hospital que haya registrado al receptor, para lo que los laboratorios del hospital del donante y del receptor acuerdan fecha y modo de envío de muestras. Dicha prueba se llevará a cabo mediante citotoxicidad mediada por complemento y/o citometría de flujo.
Algunos pacientes tienen un grado de inmunización tan elevado que hace improbable encontrar un donante para el que no tenga DSA. En estos casos puede llevarse a cabo una estrategia combinada de desensibilización y trasplante cruzado. Es decir, el equipo de trasplantes puede, tras valorarlo con el servicio de inmunología y acordarlo con el receptor, no registrar en la base de datos aquellos DSA que el paciente presenta a títulos bajos. En caso de ser seleccionado un intercambio con donante compatible, que presente en su tipaje uno o varios de estos DSA no registrados en la aplicación, se podrá realizar desensibilización y trasplante55,761,762.
Si los resultados de las pruebas cruzadas de un mismo ciclo son negativas, los centros compartirán las imágenes del angioTAC de la anatomía renal de los donantes y acordarán la fecha de trasplante.
Al igual que cualquier TRDV directo, el comité de ética debe evaluar el procedimiento, y los donantes tendrán que proporcionar su consentimiento expreso para la donación ante el juez de Primera Instancia del juzgado que corresponda a la localidad en la que se realizará la nefrectomía o el trasplante41.
En nueve años de funcionamiento del programa, en España se han realizado un total de 29 cruces y 203 trasplantes, distribuidos en 42 ciclos de dos trasplantes, 27 ciclos de tres trasplantes y 14 cadenas de trasplantes iniciadas con donante altruista763 (fig. 15). El 32,8% de los pacientes se han trasplantado dentro del programa, con una distribución desigual en función del grupo sanguíneo de donante y receptor, siendo la probabilidad más alta en aquellas parejas en las que el donante es grupo B y el receptor grupo A (tabla 15). La donación altruista ha facilitado la realización de 43 trasplantes, por lo que sin ella, la tasa de trasplantes dentro del programa habría sido de un 26,1%.
Número de ciclos de 2 trasplantes, de tres trasplantes y cadenas iniciadas con donante altruista. España 2009-2021763.
Porcentaje de pacientes trasplantados dentro del programa en función del grupo sanguíneo y mediana de PRA calculado (PRAc), con Rango intercuartílico (RIC). España 2009-2018
| GS | N trasplantados/N incluidos | Mediana PRAc (RIC) de los incluidos |
|---|---|---|
| D0-R0 | 26/111 (23,4%) | 88 (56-99) |
| D0-RA | 47/77 (54,5%) | 79 (11-94) |
| D0-RB | 9/22 (40,9%) | 88 (51-98) |
| D0-RAB | 3/9 (33,3%) | 100 (92-100) |
| DA-R0 | 42/194 (21,6%) | 0 (0-54) |
| DA-RA | 19/77 (24,7%) | 86 (44-99) |
| DA-RB | 20/42 (47,6%) | 0 (0-48) |
| DA-RAB | 2/12 (16,7%) | 97 (90-99) |
| DB-R0 | 15/48 (31,3%) | 0 (0-70) |
| DB-RA | 16/24 (66,7%) | 0 (0-36) |
| DB-RB | 2/12 (16,7%) | 75 (34-92) |
| DB-RAB | 1/5 (20%) | 96 (89-100) |
| DAB-R0 | 3/11 (27,3%) | 56 (0-99) |
| DAB-RA | 4/9 (44%) | 56 (0-99) |
| DAB-RB | 0/4 | 48 (0-98) |
- •
Se recomienda realizar la nefrectomía del donante en el propio centro y trasladar el riñón al hospital del receptor para trasplante (B).
Aunque el programa contempla la posibilidad que de que el donante se desplace al hospital en el que se encuentra el receptor de su riñón, la opción recomendada es que las nefrectomías se lleven a cabo en el hospital donante y los riñones sean trasladados. La nefrectomía en el propio centro facilita al donante el contacto con su familia y le permite permanecer en un entorno conocido, atendido por los profesionales que le han estudiado, lo que contribuye a un menor grado de estrés para el donante y la familia. Además, si el donante no se desplaza al hospital en el que se encuentra el receptor, será más fácil preservar el anonimato. En España, el 97% de los trasplantes cruzados se han llevado a cabo con traslado renal (utilizando para ello ambulancia, tren de alta velocidad o avión) y un tiempo medio de isquemia fría de 5,6 (2,8) horas.
El transporte renal implica necesariamente que los riñones sean trasplantados con tiempo de isquemia fría, pero se ha evidenciado que isquemias frías < 12 h no afectan a la incidencia de función renal retardada ni a la supervivencia de injerto y paciente en el medio plazo744,745,764. Las guías KDIGO proponen informar a los donantes acerca de la opción de desplazarse al hospital del receptor si lo desean, pero explicándoles que los resultados del traslado renal son excelentes9.
Como norma general, el medio de transporte a utilizar es el siempre que sea posible consiga tiempos de isquemia inferiores a ocho horas y que sea coste-efectivo543. Los traslados, si se precisan, podrán realizarse por vía terrestre (en ambulancia, coche de alquiler o tren de alta velocidad) o aérea (vuelo privado o comercial). La ONT tiene acuerdos específicos que permiten transportar un injerto en la cabina del avión, custodiado por la tripulación, sin coste para el sistema sanitario.
El procedimiento contempla además que las nefrectomías de todos los donantes que intervienen en un mismo ciclo sin donante altruista se realicen de forma simultánea, salvo en casos excepcionales. Esta condición se establece para minimizar el riesgo de que uno de los receptores del ciclo no reciba un riñón, cuando se ha realizado la nefrectomía de su donante original.
En todo caso el programa contempla diferentes escenarios de eventos no esperados:
- •
Los riñones de un ciclo han sido extraídos y uno de los implantes no puede llevarse a cabo: el riñón se trasplantará a un paciente de la lista de espera del hospital donde se esté realizando la nefrectomía y el centro devolverá un riñón al hospital del receptor. El receptor que no ha sido trasplantado recibirá posteriormente prioridad en la lista de espera.
- •
Si el evento no esperado (ya sea durante la nefrectomía en el donante, cirugía de banco, transporte u otro supuesto) invalidara uno de los riñones, el resto de los trasplantes se realizaría según lo pautado. Esta circunstancia se considera un evento adverso y se notifica al sistema de biovigilancia (se informan a las coordinaciones autonómicas implicadas) y se investiga el caso, para detectar el origen del fallo y establecer medidas preventivas. En este caso, el receptor que no ha sido trasplantado recibirá posteriormente prioridad en la lista de espera local.
- •
En caso de que se trate de una cadena de donante altruista con donante puente y éste no siguiera adelante con la donación con parte de la cadena ya efectuada (por cambio de opinión, por algún problema de salud durante la espera, etc.) el receptor que queda sin trasplantarse recibirá un riñón de donante fallecido del hospital al que pertenezca el donante puente.
- •
Todo donante altruista debe ser evaluado siguiendo los mismos criterios que cualquier otro donante vivo renal, siendo especialmente relevantes la exploración de motivaciones, sus expectativas y el soporte socio familiar (SG).
- •
Es recomendable que todos los donantes altruistas inicien cadenas de trasplante, debido al mayor beneficio en el número de trasplantes. Aunque, se les debe informar de la posibilidad de donar directamente a lista de espera (B)
Los términos donante altruista, buen samaritano o no-directo se utilizan para denominar a aquellas personas que donan un órgano a otra persona desconocida que necesita un trasplante. En este documento nos referiremos a ellos como «Donantes Altruistas»172.
En el caso de España, el donante altruista tras ser adecuadamente informado puede decidir realizar la donación de dos maneras:
Por medio de la donación del órgano a una persona de la lista de espera local (no conocida y de manera anónima). En algunos países, como Reino Unido buscan primero un receptor compatible entre aquellos con prioridad nacional, y en caso de no encontrarse, por defecto, todos los donantes altruistas inician una cadena de trasplantes (2).
Por medio de la donación renal cruzada, en la que también se selecciona un receptor final de cadena, de la lista de espera local, pero el beneficio esperado, según número de trasplantes intermedios realizados, es mayor. Las guías KDIGO recomiendan que los donantes altruistas sean informados del mayor beneficio en número de trasplantes al iniciar una cadena9.
Datos nacionales e internacionalesLa donación renal altruista es cada vez más aceptada como estrategia para hacer frente a la escasez de órganos para trasplante765,766. Existen en el mundo un porcentaje de personas (estimado entre el 11% y 54%) dispuestas a donar un riñón en vida a pacientes con enfermedad renal terminal, sin vínculo previo767,768.
Sin embargo, la figura del donante renal altruista adquiere especial relevancia cuando se incluye como complemento del programa de donación renal cruzada, lo que se denomina Domino Kidney Paired Donation (DKPD)649. Por este motivo, diferentes países, como Corea del Sur769, Estados Unidos749, Canadá769,770, Reino Unido772 Países Bajos773 y España han desarrollado programas de donación renal altruista con excelentes resultados49.
Si nos centramos en países de nuestro entorno, y concretamente en aquellos que han obtenido los mejores resultados, podemos observar cómo las tasas de donación renal altruista en los últimos seis años rondan entre el 8% y 12% de la actividad total de vivo de Reino Unido y Países Bajos respectivamente, siendo la actividad en España inferior al 1%774,775. Sin embargo, cabe resaltar del programa español, la capacidad de multiplicar los beneficios de la donación renal altruista, obteniendo una tasa de efectividad por cada donación altruista de tres trasplantes, así como de incorporar cadenas prolongadas con la utilización de donantes puente. Entre el año 2010 y el 2018, se han realizado en nuestro país 14 cadenas iniciadas con donante altruista: seis de dos eslabones, tres de tres, cuatro de cuatro y uno de seis, lo que ha aportado 43 trasplantes adicionales al programa de donación renal cruzada, incrementando su efectividad del 27% al 33%.
Protocolo de actuaciónEl protocolo establecido para evaluar a un potencial donante renal altruista, fue publicado en 2010 por la ONT en colaboración con un comité multidisciplinar de expertos en diferentes aspectos del procedimiento de TR de donante vivo: nefrólogos, inmunólogos, urólogos, coordinadores de trasplantes y expertos en bioética y legislación172.
Evaluación del donante altruistaTodo donante altruista debe ser evaluado siguiendo los mismos criterios que cualquier otro donante vivo renal9, descritos convenientemente en la sección correspondiente de estas recomendaciones.
Algunas guías nacionales, como la de Reino Unido, enfatizan la necesidad de que todos los donantes altruistas sean evaluados por un profesional, cualificado para valoración de salud mental, antes de la donación2, aunque en el caso español esto es un requisito sine qua non para cualquier donante renal vivo41.
La peculiaridad del programa español radica en que la evaluación de cada candidato altruista está estructurada en tres fases consecutivas, que deben ser superadas para avanzar en el proceso. Todas ellas están coordinadas desde la ONT o en Cataluña desde la Organització Catalana de Trasplantaments (OCATT)172:
Entrevista inicial semi-estructurada realizada desde la ONT/OCATT o bien en un hospital con experiencia en TRDV cruzado, cuyo objetivo es doble, por un lado, informar convenientemente sobre el proceso y por otro, recoger variables sociodemográficas, motivacionales y de salud, para finalmente derivar al candidato al centro o centros hospitalarios autorizados de su CCAA, en caso de que supere este primer triaje.
Primera evaluación hospitalaria, en hospital con experiencia en la evaluación de donantes vivos de riñón, con el objetivo de descartar contraindicaciones clínicas para la donación.
Segunda evaluación hospitalaria, realizada en un centro autorizado para el Programa de TRDV Cruzado. El objeto es descartar contraindicaciones quirúrgicas, psicológicas o relacionadas con su soporte sociolaboral.
Consideraciones específicas para tener en cuenta durante la evaluación- •
Se recomienda explorar la motivación subyacente, que debe provenir de un afán altruista (B).
- •
Se sugiere informar a los potenciales donantes altruistas jóvenes que pueden considerar esta donación en un momento posterior de su vida (SG).
- •
Se sugiere dejar un tiempo razonable tras la entrevista inicial, alentando a meditar y reflexionar sobre la información recibida (SG).
De manera trasversal a todo el proceso, se debe garantizar (desde el punto de vista ético y legal) que la donación sea desinteresada y que no busque beneficio económico, publicidad o promoción personal. En estos casos, explorar la trayectoria altruista de la posible donante cobra especial importancia, así como el soporte familiar (debiendo ser fuerte) y la situación económica (sólida) de la persona172.
InformaciónDe manera adicional a la información que ha de recibir cualquier donante vivo renal, en los primeros contactos con la red de donación, los potenciales donantes altruistas deberán ser informados de los siguientes aspectos:
- •
Que para el proceso de estudio y evaluación, deben desplazarse a un centro médico con experiencia en donación renal cruzada, y que quizá podría estar distante de su residencia. Aunque siempre se tendrá en cuenta la mayor comodidad para el potencial donante en caso de que existan varias opciones172.
- •
Acerca de la regulación sobre la confidencialidad y el anonimato del procedimiento, y asegurar que el donante lo acepta antes de seguir adelante9,41.
- •
Los riesgos/beneficios de que se traslade el riñón y los mecanismos de seguridad previstos para que el riñón extraído se trasplante, a pesar de que pudieran suceder eventos adversos9.
- •
Que no podrán elegir una fecha exacta para la donación, aunque sí se harán todos los esfuerzos necesarios para respetar los periodos de tiempo que ellos comuniquen como preferibles2,172.
- •
Que la participación en el programa requiere un consentimiento informado específico9,172,543, para lo cual debe haber entendido y ha debido de ser informado previamente, de todas las cuestiones específicas descritas en este apartado.
- •
Recomendar un período de tiempo tras la entrevista inicial, alentando a meditar sobre toda la información adicional recibida y reflexionar sobre la decisión final, es reconocido como buena práctica. En España pueden hacerlo el tiempo que necesiten, y en la mayoría de los casos se obtiene una respuesta en menos de un mes2.
En el caso de los donantes altruistas, existen consideraciones particulares relativas a la ausencia de vínculo entre el donante y receptor que deberían ser cuidadosamente exploradas durante el proceso de evaluación743. Deben estar preparados para afrontar supuestos como, por ejemplo, después de la donación, no tener información de la evoluion del receptor, o enterarse de que el trasplante no tuvo éxito. Aunque en España no hay datos concretos, en otros ámbitos se ha observado que el donante necesita saber que el receptor ha evolucionado bien776.
Debe informarse al candidato de la hipotética posibilidad de que en un futuro pudiera necesitar el riñón que en la actualidad desea donar, para una persona significativa y querida de su entorno: hijo, cónyuge, hermano, etc. o para sí mismo172.
MotivaciónLa investigación sobre donantes altruistas ha disipado muchas preocupaciones preexistentes con respecto a la motivación del donante777. No obstante, con el fin de evitar perjuicios en la salud mental del futuro donante altruista, es necesario estudiar la motivación subyacente, verificando que ésta proviene de un afán altruista, que es consecuencia de los aspectos reparadores del sujeto, y no de una motivación basada sobre todo en la psicopatología. En este sentido, resulta de ayuda, explorar la trayectoria altruista vital del individuo172. Algunas preguntas que pueden ayudar a explorar dicha faceta quedan recogidas en la tabla 16.
Preguntas para explorar la motivación y trayectoria altruista del potencial donante
| ¿Considera usted que ha tenido una trayectoria vital altruista? |
| En caso afirmativo, ¿Podría hablarme sobre ello? |
| ¿Alguna vez ha conocido a alguien que padeciera una enfermedad renal y necesitara un trasplante? ¿Qué sintió? |
| ¿Cómo surge la idea de donar un riñón a alguien desconocido? ¿Desde cuándo lleva pensándolo? |
| Si le preguntase qué ha sido lo que le ha impulsado a ponerse ahora en contacto con nosotros ¿podría describirlo? |
Al igual que en el programa español, en otros países se ha encontrado que los donantes están esencialmente motivados por un deseo de ayudar a otro individuo y piensan que los inconvenientes son mínimos para ellos.
EdadOtro tema discutido dentro del campo de la donación altruista es la edad del donante, particularmente adultos jóvenes. La mayoría de las preocupaciones están relacionadas con si los donantes más jóvenes tienen más probabilidades de arrepentirse de su decisión. No hay evidencia que sugiera que este sea el caso. Sin embargo, puede resultar útil con los donantes más jóvenes incluir preguntas sobre por qué es importante para ellos donar ahora y si es algo que podrían considerar en un momento posterior2.
Soporte familiar y socialOtro aspecto en el que los donantes altruistas y los donantes convencionales parecen diferir es en el apoyo social y la percepción de la necesidad de ser ayudado y atendido. Algunos donantes altruistas deciden no comunicar a sus seres queridos su decisión, por no ser suficientemente entendida por las personas de su entorno afectivo. Sin embargo, la falta de apoyo social podría ser un motivo de que finalmente no se produzca la donación2. Por esta razón es importante identificar pronto la relación con su entorno familiar, siendo recomendable animarlos a compartir su decisión con sus seres queridos, con el fin de obtener su ayuda en el periodo de convalecencia tras la nefrectomía y evitar que abandonen el proceso, cuando ya se ha iniciado, por presiones de su entorno754.
RegistroLos donantes altruistas que han finalizado la evaluación, tras la aprobación del comité de ética asistencial hospitalario, son comunicados a la ONT por el responsable hospitalario del programa y registrados en la base de donación renal cruzada172.
Asignación renal de un donante altruistaEn caso de que el donante haya decidido donar directamente a la lista de espera, el centro hospitalario que lo evaluó seleccionará a uno de sus receptores, siguiendo los criterios de selección de receptor en lista de espera.
- •
En caso de que el donante haya decidido iniciar una cadena de trasplantes, se procederá de manera similar a la establecida en el programa de donación renal cruzada, detallada previamente, con las siguientes singularidades:
- •
Es necesario informar al resto de centros participantes con al menos 15 días de antelación, sobre la realización de un nuevo cruce extraordinario, motivado por la entrada de un nuevo donante altruista al programa (si este es realizado fuera de los tres cruces anuales establecidos). El objetivo es que puedan introducir nuevas parejas que tengan estudiadas completamente y beneficiarse de esta opción.
- •
Informar al hospital que aporta el donante altruista que debe seleccionar un receptor de su lista de espera, para el final de la cadena.
- •
Para las cadenas de donante altruista no existe límite en el número de eslabones. Para las cadenas que impliquen a más de cuatro parejas, o en las que se demoren los tiempos de inicio pactados con el donante altruista, puede proponerse que alguno de los donantes sea puente, de manera que la cadena se desarrolle en varias fases. Esta opción debe plantearse desde el principio a los centros implicados, para que puedan consensuarlo con los donantes afectados y es recomendable que las diferentes fases no se distancien mucho más allá de una o dos semanas.
- •
El riesgo de HTA a largo plazo post-donación es superior al de una población igualmente sana no nefrectomizada (Calidad de la evidencia: B).
- •
El riesgo de mortalidad de cualquier causa y de eventos cardiovasculares a largo plazo, no difiere del de la población control sana (B).
- •
Se recomienda informar a los donantes de los riesgos de enfermedad renal y cardiovascular asociados a la obesidad y recomendar de forma activa cambios en el estilo de vida y control del peso (B).
- •
La prevención de factores de riesgo cardiovascular durante el seguimiento post-donación contribuirá al mantenimiento de la salud del donante a largo plazo (NG).
Conocer e informar sobre los riesgos potenciales de un donante renal vivo a medio y largo plazo resulta fundamental para orientarle en la toma de decisiones y guiar el proceso de estudio y selección del equipo trasplantador. Para conocer los riesgos a largo plazo atribuibles a la donación renal, se precisan estudios con seguimientos prolongados y con un número elevado de casos (dada la escasa tasa de eventos esperados). Por otra parte, los donantes constituyen un grupo rigurosamente seleccionado, con un alto nivel de salud. La población control, por tanto, debe ser equiparable, no solo por factores demográficos sino también médicos para evitar la infra o sobreestimación de los riesgos en los donantes778.
La mayoría de los estudios son retrospectivos, observacionales y basados en información de registros unicéntricos o nacionales. El 95% son estudios observacionales, la mitad tuvieron tiempos de seguimiento cortos (≤ 1 año) y en su mayoría refirieron resultados relacionados con FG, presión arterial y complicaciones peri-quirúrgicas779.
Cuatro estudios han analizado la mortalidad y los eventos cardiovasculares a largo plazo con seguimiento prolongado y tamaño muestral representativo, empleando como control una selección de individuos con criterios de salud similar a los donantes. Tres de ellos no encontraron aumento de mortalidad o de eventos cardiovasculares en los donantes120,780,781. El otro estudio contradice a los anteriores37, pero presenta dos limitaciones: (a) la población control es casi 10 años de media más joven que la de los donantes, lo que indica un sesgo en el emparejamiento y clara ventaja para los controles (la edad es un factor que se asocia a mortalidad) y (b) había un porcentaje importante de casos sin información para variables como el IMC o el tabaquismo y los análisis se realizaron con y sin imputación de datos. Los resultados para mortalidad cardiovascular difieren según se utilicen casos con o sin imputación, lo que debilita el resultado final. Una revisión sistemática no encontró evidencias que sugirieran aumento de riesgo para mortalidad global, enfermedad cardiovascular o HTA en donantes vivos comparado con las poblaciones de no donantes782. Con la información actual no hay evidencia de un mayor riesgo de mortalidad y eventos cardiovasculares a largo plazo en donantes. No obstante, son necesarios más estudios con seguimiento superior a los 20 años para analizar el impacto de la donación a muy largo plazo. En cualquier caso, el riesgo absoluto de mortalidad y eventos cardiovasculares es muy bajo e inferior o similar al de la población general33,783,784 y controles sanos120,780–782.
En dos análisis que incluyeron un amplio número de donantes y controles se observó un riesgo de HTA significativamente superior en los donantes tras seguimientos medios de seis785 y 11 años786. En el primero, la aparición de HTA en los controles se asoció con un descenso del filtrado anual mayor del esperado y en los donantes con una detención en la curva de aumento previsto del filtrado post-donación. En una serie de 3.700 donantes renales normotensos pre-donación, se observó tras 16 años de seguimiento medio que el 25% había desarrollado HTA787. Los factores que se asociaron fueron IMC más altos, tabaquismo, dislipemia, historia familiar y mayor edad. Con la evidencia actual, el riesgo de HTA a largo plazo en los donantes es mayor si se compara con una muestra de población igualmente sana no nefrectomizada. Nuevamente el seguimiento a largo plazo del donante es fundamental para detectar precozmente y tratar la HTA si llegara a aparecer.
La prevalencia de la obesidad ha aumentado en las últimas décadas en la población general. Esto se ha traducido en un incremento en el porcentaje de potenciales donantes con IMC ≥ 30 kg/m2 que son evaluados en los programas de TRDV. La obesidad se asocia en la población general con aumento de riesgo de diabetes, síndrome metabólico, HTA, ERCA y mortalidad788. Distintos autores han observado también un mayor riesgo de HTA, diabetes o ERCA en el seguimiento de donantes renales obesos274,789–791. Las guías clínicas contraindican la donación cuando el IMC ≥ 35 kg/m2 pero para pacientes moderadamente obesos IMC ≥ 30 kg/m2 no hay consenso, y tanto la Guía Británica como la Guía KDIGO sugieren que la decisión de aceptar o no a un donante deberá individualizarse en cada centro en función de otros factores de riesgo asociados para ese mismo donante2,9.
Pocos estudios han analizado las posibles implicaciones de la obesidad en la mortalidad a largo plazo de los donantes. Recientemente, y aunque el riesgo absoluto fue bajo, se ha descrito un aumento de mortalidad a largo plazo en donantes con IMC ≥ 30 kg/m2271. Esta información, refuerza la necesidad de insistir en la importancia de conseguir un descenso ponderal suficiente en los potenciales donantes, y también en el seguimiento posterior, con programas de cambios de estilo de vida si fuera necesario.
Impacto de la reducción del FG post donación en la mortalidad a largo plazo- •
La disminución del FG que se observa tras la nefrectomía no se asocia con un incremento en la mortalidad o en la enfermedad cardiovascular (B).
Tras la nefrectomía electiva el FG de los donantes se reduce 20-30% con respecto al de la predonación y hasta el 15% de los donantes presentan FG < 60 mL/min en el seguimiento post-nefrectomía792,793. Es importante destacar que la reducción progresiva del FG que caracteriza a la ERC y la pérdida de función renal tras la donación no son comparables. El donante es un sujeto sano en el que se reduce la masa nefronal de forma aguda por efecto de la nefrectomía. Esto lleva al desarrollo de mecanismos de hiperfiltración compensatorios del riñón remanente, que era previamente sano, no relacionados con la hipertensión glomerular, sino con mecanismos benignos como un posible aumento de la superficie de filtración o del flujo plasmático glomerular794,795. De esta forma se observa en la mayoría de los donantes una curva de aumento compensatorio del FG que se mantiene durante varios años tras la donación207,257.
En pacientes con ERC, reducciones del FG se asocian con un incremento del riesgo cardiovascular796–798. La presencia de albuminuria, por otro lado, potencia esta asociación. En cualquier caso, el paciente con ERC no es comparable al donante.
En las cohortes de Framingham o NHANES I, reducciones moderadas del FG no se asociaron con mayor riesgo de enfermedad cardiovascular799,800. En el grupo PREVEND801, en ausencia de proteinuria, un FGe de 30-59 mL/min/1,73 m2 tampoco se relacionó con mayor riesgo de enfermedad cardiovascular. Sin embargo, otros estudios243,802–805 encontraron una asociación entre FGe < 60-75 mL/min y mortalidad cardiovascular, especialmente si se asociaba con la presencia de albuminuria. Los resultados no coincidentes pueden explicarse por diferencias en los factores de riesgo para enfermedad renal y cardiovascular en las diferentes cohortes. Nuevamente, la población general por su heterogeneidad no sería comparable a los donantes.
Para aislar el impacto de la nefrectomía en el riesgo cardiovascular del donante se precisan estudios con seguimiento prolongado, tamaño muestral representativo y población control emparejada que sea comparable no solo en factores demográficos sino también en morbilidad y factores de riesgo cardiovascular con los donantes. Es decir poblaciones igualmente sanas que los donantes pero no nefrectomizadas. Estudios en sujetos sanos sometidos a una nefrectomía por otros motivos son útiles para analizar este problema. Narkun-Burgess et al.806 comparó la mortalidad tras 45 años de seguimiento de dos grupos de soldados tras la segunda guerra mundial. El primer grupo lo formaban 62 veteranos que perdieron un riñón como lesión de guerra y el segundo, un grupo control de soldados no nefrectomizados. Los autores no encontraron diferencias en cuanto a supervivencia en ambos grupos tras casi cinco décadas de seguimiento. Se ha comentado que estudios recientes no encontraron diferencias en cuanto a supervivencia o eventos cardiovasculares entre donantes y controles seleccionados sanos120,780–782, y que la discrepancia del estudio noruego37 puede deberse a las limitaciones antes descritas. Con la evidencia de la que se dispone, no se puede afirmar que la disminución del filtrado que se observa tras la donación se asocie a un incremento en la mortalidad o en la enfermedad cardiovascular.
Finalmente, a la hora de evaluar cómo influye la disminución del FG en el riesgo cardiovascular y la mortalidad de los donantes cabe mencionar otros factores que pueden determinar la evolución a largo plazo. Por un lado, la evaluación inicial y los estudios de selección juegan un papel fundamental. Debe conocerse con exactitud el FG basal del donante porque de él dependerá, entre otros factores, la función renal post-donación. Las fórmulas de estimación de función renal presentan una tasa de error de.±.30%807. En la selección de candidatos potenciales mediante fórmulas, algunos podrían donar con filtrados no óptimos205,808 y en consecuencia serían un subgrupo de riesgo de desarrollar enfermedad renal y cardiovascular futura. Por otra parte, es posible que exista un grupo de donantes con una menor dotación renal (bajo peso al nacer, prematuridad) o una predisposición genética, cuyo riesgo adicional no se ha evaluado en el momento de la selección809. Estos donantes podrían tener más riesgo de HTA y albuminuria en el seguimiento810,811, especialmente si se añaden situaciones de mayor demanda como la ganancia ponderal o el síndrome metabólico tras la donación. Finalmente, el seguimiento a muy largo plazo y la corrección de los factores de riesgo cardiovascular añadidos pueden influir en la evolución47. De hecho, está descrito que si bien los casos de ERCA en donantes diagnosticados en la primera década se deben a factores inmunológicos o genéticos, en décadas posteriores prevalecen como causa factores como la HTA y la diabetes812.
Riesgo de preeclampsia en donantes- •
Se sugiere informar a las donantes en edad fértil del mayor riesgo de HTA gestacional y preeclampsia en las gestaciones post-donación, sin evidencia de otros resultados adversos materno-fetales (C).
En las potenciales donantes en edad fértil es importante informar sobre los riesgos asociados a un futuro embarazo. Hasta la fecha se han publicado ocho estudios relevantes que incluyen casi mil gestaciones tras donación renal en 800 donantes (de raza caucásica en su mayoría).
Tres estudios unicéntricos813–815 de las décadas de los 80-90 incluían pocos casos, sin controles y basados en encuestas. En ninguno de ellos se identificó un mayor riesgo de deterioro del FG, proteinuria o HTA mantenida asociado a las gestaciones de las donantes. En 2009, un estudio noruego comparó las complicaciones de gestantes post-donación con dos grupos controles no emparejados: gestantes predonación y gestantes seleccionadas al azar de un registro de nacimientos en población general816. El porcentaje de preeclampsia en gestaciones post-donación fue significativamente mayor que en los embarazos de donantes anteriores a la nefrectomía y que en el grupo control del registro (5,7% vs. 2,6% vs. 3,1%; p = 0,026). El bajo número de eventos hizo imposible un análisis multivariante. Un estudio norteamericano observó resultados similares, aunque sin grupo control de no donantes124. Un estudio canadiense de mujeres donantes renales con gestaciones comparó su evolución con las de mujeres sanas no donantes similares en edad y acceso sociosanitario123. La preeclampsia y la HTA gestacional conjuntamente fueron mayores en donantes que en controles (11% (15/131) vs. 5% (38/788), OR 2,4 p < 0,01). No hubo diferencias en incidencia de cesárea, prematuridad o bajo peso al nacer, mortalidad perinatal o materna. Nuevamente la tasa baja de eventos limitó el análisis multivariante. Finalmente, dos estudios más recientes uno en población asiática817 y otro basado en un registro norteamericano818 compararon gestaciones post-donación con grupos controles de población general sin encontrar diferencias significativas en cuanto a resultados adversos materno-fetales.
Son necesarios más estudios para establecer recomendaciones definitivas. Los estudios publicados presentan baja cantidad de eventos y falta de un grupo control pareado para las características de las donantes. Si bien podemos informar a las potenciales donantes en edad fértil del riesgo de preeclampsia e HTA gestacional, este riesgo absoluto es bajo y no se asocia con incremento de partos pretérmino.
TR en donantes de riñónSegún datos del registro americano más de 150.000 personas habían donado un riñón en vida. Su incidencia de ERCA fue de 10-30 eventos por 10.000 donantes en 15 años35,229 y su riesgo varía según la edad, sexo, raza y tiempo post-donación224.
Muchos programas de trasplante han instaurado políticas de priorización en lista de espera para los donantes renales vivos previos con ERCA que no quieran o no puedan optar por un TRDV anticipado. EE. UU. desde 1996 y Holanda desde 2011 les asignan prioridad para minimizar su tiempo en diálisis127,819. Otros países con priorización para estos casos son Suecia, Noruega, Bélgica, Luxemburgo, Austria, Croacia y Eslovenia. En España cada centro trasplantador es responsable del seguimiento de sus donantes vivos; llegado el caso puede establecer políticas de priorización.
Ante la baja presencia de casos de ERCA en cada programa de TRDV la bibliografía de la evolución de estos pacientes pre y postrasplante es escasa. Los registros multicéntricos son esenciales para una comprensión global del problema. Todos los esfuerzos van encaminados a asegurar una adecuada evolución del donante, pero en el caso de que progresara hasta una ERCA es responsabilidad del centro trasplantador devolverle el beneficio terapéutico que en su momento él generó en el programa.
Mortalidad por cualquier causa- •
La mortalidad precoz derivada de la donación renal es muy baja e inferior a la de procedimientos electivos similares (B).
- •
La tasa de mortalidad por neoplasias en el donante a largo plazo no difiere de la de una población control comparable (B).
Según datos del registro americano la mortalidad en los primeros tres meses post-nefrectomía se sitúa en el 0,03%118,120,820, inferior al de otros procedimientos quirúrgicos como la colecistectomía laparoscópica o la nefrectomía por otros motivos, pero superior al riesgo estimado de mortalidad periparto820. Las causas más frecuentes son las hemorragias, eventos cardiovasculares y tromboembolismos pulmonares. Pasado este tiempo, la mortalidad en el primer año es comparable a la de los controles sanos120. A los estudios previamente mencionados sobre supervivencia y riesgo cardiovascular cabe añadir dos publicaciones recientes que no encontraron diferencias en la mortalidad de donantes y controles sanos tras seguimientos medios de 8 años821 y 11 años822. Las neoplasias fueron la causa más frecuente de mortalidad en el seguimiento en cada uno de los grupos de estos dos últimos estudios. Varios estudios de registro confirman este dato784,823,824. La ausencia de población control, sin embargo, no permite extraer conclusiones sobre riesgos. De ninguna de las publicaciones se puede concluir que exista en los donantes más riesgo de mortalidad por neoplasias del que existe en la población general. Sin embargo, sí se reitera la importancia de un despistaje extenso de neoplasias pre-donación que debe incluir recientes revisiones urológicas y ginecológicas y descartar malignidad en lesiones cutáneas sospechosas antes de avanzar en el proceso.
Sección 18. Resultados del TR donante vivo en situaciones estándar y especialesLos receptores de TRDV tienen una mayor supervivencia que la de receptores de riñones de donantes fallecidos. Numerosos factores pueden explicarlo, se evita la lesión renal asociada a la muerte encefálica, los donantes gozan de buena salud y asocian escasa comorbilidad, los tiempos de isquemia fría son muy cortos y las condiciones quirúrgicas para el receptor son óptimas al tratarse de un procedimiento electivo y programado. Además, a menudo con este tipo de donantes se intenta realizar trasplantes anticipados o minimizar la duración de diálisis de los receptores.
Datos del Reino Unido muestran que 10 años después del trasplante, el 75% de los adultos que recibieron su primer TR de donante en muerte encefálica entre 1998-2000 están vivos. Esto se compara con la supervivencia del 90% de los pacientes con un primer TRDV en el mismo periodo. Por lo tanto, hubo una mejora del 20% en 10 años de la supervivencia del paciente con donación de vivo versus fallecido para los trasplantados en esa etapa825.
Trasplante vs. diálisis- •
Se recomienda el TR por menor mortalidad respecto a la global de los pacientes en lista de espera, independientemente del tipo de trasplante, observándose estas diferencias a partir del tercer mes post-TR (Calidad de la evidencia: B).
- •
Se recomienda acortar la duración de la diálisis antes del trasplante, ya que es un factor potencialmente modificable y muy importante en la supervivencia a largo plazo después del trasplante (B).
- •
Se sugiere que TRDV se considere siempre como primera opción en pacientes con ERC y sobre todo en situaciones clínicas desfavorables (jóvenes, elevada comorbilidad, alta complejidad quirúrgica o hiperinmunizados) con menores opciones de acceso a un trasplante de donante fallecido (C).
Los pacientes con ERC presentan una mortalidad significativamente mayor que la población general y que los enfermos con un injerto renal funcionante826. Centrándonos en los enfermos candidatos a TR, estudios longitudinales han demostrado que la mortalidad global de los pacientes en lista de espera es significativamente superior a la de los enfermos trasplantados, independientemente del tipo de trasplante, observándose estas diferencias a partir del tercer mes post-TR827. Las causas más frecuentes de mortalidad durante el primer año de tratamiento sustitutivo son la enfermedad cardiovascular, seguida de las complicaciones infecciosas828. No solo hay un claro beneficio frente a la diálisis en términos de morbimortalidad del receptor, sino que este beneficio abarca también a la repercusión económica para los sistemas sanitarios829.
La decisión a la que nos enfrentamos para un destinatario de un riñón rara vez está entre un TRDV «subóptimo» e «ideal». La alternativa a un donante de TRDV, de cualquier calidad, es permanecer en diálisis esperando un órgano de donante fallecido adecuado. La tasa de mortalidad anual en pacientes en diálisis en España es del 15% a 16%, y se dispara enormemente en la población más añosa, donde una proporción no despreciable muere mientras permanece en lista830. Para complicar más esta situación, la comorbilidad puede progresar con el transcurso del tiempo en los enfermos en diálisis831 y, por tanto, a mayor comorbilidad, mayores probabilidades de ser excluidos de la lista de TR832.
Además, hay que considerar que la larga permanencia en lista puede incrementar las posibilidades de recibir transfusiones sanguíneas por aparición de complicaciones añadidas. Esto puede dar lugar a un mayor riesgo de sensibilización frente a un posible injerto a través de la formación de anticuerpos anti-HLA, y alargar aún más el tiempo de espera y la aparición de comorbilidades833.
La duración de la terapia de diálisis antes del trasplante sigue siendo un factor importante y potencialmente modificable en la supervivencia a largo plazo después del trasplante. Desafortunadamente los receptores jóvenes pueden tardar un tiempo en acceder al TR debido a la escasa oferta de donantes de menor edad. Los pacientes incluidos en LE en Reino Unido en 2011-12, el 56% había recibido un trasplante después de tres años, el 6% había sido eliminado de la LE y el 5% había muerto mientras esperaba un donante825. Esta situación que se da frecuentemente, con tiempos prolongados hasta el acceso al trasplante y la mortalidad durante la espera es otro tema importante cuando se considera un posible donante vivo en las opciones de trasplante
Criterios extendidos en TR de donante vivo- •
Se recomienda el TRDV incluso con donantes mayores de 60 años ya que es una alternativa beneficiosa a permanecer en diálisis o al mayor tiempo de espera de TR de donantes fallecidos (B).
- •
La supervivencia del injerto resulta menor en receptores con donantes vivos mayores de 70 años, que, en receptores de donantes estándar, aunque la supervivencia del paciente resulta similar (B).
- •
Se sugiere que la función renal del donante puede ser un determinante mayor que la edad en los resultados del TRDV, aunque no todos los estudios lo confirman (C).
- •
Se sugiere no excluir de la donación por criterios exclusivamente de edad. El donante mayor debe ser aceptado o rechazado tras una evaluación médica exhaustiva (SG).
La persistente disparidad entre el número de pacientes que esperan un TR y los órganos disponibles en el grupo de donantes fallecidos, junto con el creciente conocimiento y familiaridad de los resultados para los donantes vivos y sus receptores, ha llevado a la comunidad de trasplantes a considerar posibles donantes que previamente habrían sido desestimados debido a características demográficas o problemas médicos inherentes.
Las áreas de incertidumbre relacionadas con los resultados a corto y largo plazo para el donante de vivo médicamente complejo debe considerarse en virtud de la causa que provoca esta situación clínica (edad, HTA, obesidad, DM, litiasis, antecedentes oncológicos) y que se detallan en otras secciones de esta guía.
En términos del resultado del receptor, se deben considerar diversas opciones alternativas: la probabilidad de recibir un trasplante procedente de donante fallecido con criterios estándar o extendidos, el resultado de dicho trasplante, la morbilidad y el potencial riesgo de mortalidad mientras espera un órgano adecuado de un donante fallecido, la idoneidad / riesgos asociados con la cirugía de emergencia versus cirugía electiva, el resultado esperable de este órgano de donante vivo en comparación con la esperanza de vida proyectada de este individuo, etc.
La literatura está suficientemente desarrollada para respaldar el TRDV mayores para al menos una cohorte de pacientes. La función renal disminuye progresivamente con la edad y puede ser que los riñones de donante vivo mayor tenga una función más reducida835. Varios estudios unicéntricos o de registro muestran peores resultados de supervivencia renal tras un TRDV a medida que la edad del donante era más avanzada560,836,837. En comparación con los receptores de donantes estándar, la supervivencia del injerto disminuyó en receptores con donantes vivos de ≥ 70 años, pero la supervivencia del paciente fue similar. Los receptores de riñón de donante vivo más mayores tuvieron una mejor supervivencia del injerto y del paciente que los receptores con criterios extendidos560 (tabla 17). En general, el uso de donantes de TRDV mayores parece ser una alternativa beneficiosa y equivalente a la espera de riñones de donantes fallecidos560. La estimación de la tasa del FG ha demostrado ser un factor importante de la función renal trasplantada216 y se ha sugerido que la función renal que aporta el donante puede ser un determinante mayor que la edad en los resultados obtenidos, aunque no todos los estudios lo han confirmado838.
Supervivencia del injerto renal y del paciente ajustado a sexo y raza del donante, y edad, sexo, raza, etiología de la enfermedad renal y HLA del receptor560
| Supervivencia del injerto a 10 años | Supervivencia del paciente a 10 años | |
|---|---|---|
| Grupo donante (referencia=Donante estándar) | ||
| TRDV <60 añosTRDV 60-64 añosTRDV 65-69 añosTRDV>70 añosDonante con criterios expandidos | 0,73 (0,71-0,74), p<0,0011 (0,91-1,11), p=0,991,2 (1,02-1,41), p=0,031,73 (1,29-2,31), p<0,0011,83 (1,78-1,88), p<0,001 | 0,70 (0,69-0,72), p<0,0010,82 (0,76-0,89), p<0,0010,98 (0,86-1,11), p=0,741,08 (0,86-1,36), p=0,521,32 (1,29-1,35), p<0,001 |
| Grupo donante (referencia=TRDV<60 años) | ||
| TRDV 60-64 añosTRDV 65-69 añosTRDV>70 años | 1,41 (1,25-1,59), p<0,0011,67 (1,36-2,05), p<0,0012,18 (1,50-3,17), p<0,001 | 1,15 (1,03-1,28), p=0,011,39 (1,18-1,64), p<0,0011,54 (1,14-2,08), p=0,01 |
| Grupo donante (referencia=TFGe>150) | ||
| TFGe: 120-149 mL/min/1,73 m2TFGe: 90-119 mL/min/1,73 m2TFGe: 60-89 mL/min/1,73 m2TFGe: <60 mL/min /1,73 m2 | 0,99 (0,76-1,29), p=0,961,08 (0,84-1,39), p=0,521,16 (0,9-1,48), p=0,251,32 (1,01-1,71), p=0,04 | 1,12 (0,85-1,47), p=0,411,08 (0,84-1,4), p=0,551,07 (0,83-1,38), p=0,611,09 (0,84-1,43), p=0,51 |
TRDV: Trasplante renal de donante vivo; TFGe: Tasa de filtrado glomerular estimado.
Los donantes mayores son más propensos que los donantes más jóvenes a ser excluidos de donar en base de los problemas descubiertos durante la evaluación médica. Sin embargo, debe considerarse caso a caso y si el donante mayor se considera adecuado después de una evaluación médica rigurosa, y si la función renal del donante es normal después de la corrección por edad y sexo, no hay evidencia para excluir donación solo en función de la edad cronológica839,840. De manera similar a la edad, la conveniencia de asumir lo que puede ser una supervivencia «no ideal» del riñón de un donante vivo (debido a co-morbibilidades, función renal, identidades HLA) a un paciente debe ser considerado de forma individual para cada destinatario en particular.
Receptores de alto riesgo- •
Se sugiere no descartar de entrada a receptores de «alto riesgo» para no crear inequidades de acceso al TR. Aunque los resultados de supervivencia puedan ser estadísticamente «inferiores» por las comorbilidades asociadas, hay que valorar caso por caso tras los estudios pertinentes (SG).
- •
Se sugiere que, salvo excepciones, los pacientes aceptados para TR de donante fallecido son aptos también a TRDV (C).
- •
Se sugiere no considerar la opción de TRDV en casos en los que se estime que la perspectiva de supervivencia postrasplante no llegue a dos años o de alta probabilidad de recidiva de la enfermedad renal sobre el injerto (C).
- •
El TRDV puede brindar oportunidades a pacientes cuyos riesgos perioperatorios para un procedimiento de emergencia se consideran inaceptablemente altos, pero que pueden ser asumibles para un TR electivo, optimizando la extracción de un donante óptimo, con un equipo para hacer frente a dificultades especiales, iniciando la inmunosupresión pretrasplante y minimizando el retraso en la función del injerto (SG).
- •
Se sugiere basar la aceptación o rechazo para el TRDV en pacientes de alto riesgo, en las opiniones de equipos multidisciplinarios expertos. La insuficiencia de datos no permite recomendaciones claras en receptores de alta complejidad (SG).
El éxito de un programa de TR no puede ser juzgado únicamente por la supervivencia del receptor y del injerto, como resultados de pacientes en la etapa final de la ERC. Pueden existir errores en la interpretación de los datos y es más probable que un programa que no asume riesgos aporte resultados de excelente supervivencia del receptor. Esta política se puede asociar potencialmente a una inequidad en el acceso al trasplante para pacientes de alta complejidad quirúrgica, o riesgo inmunológico sometidos a un mayor riesgo de muerte en la lista de espera. No es sencillo medir la dificultad que determinadas poblaciones tienen en el acceso al trasplante841.
Con el fin de establecer la misma terminología, un receptor de alto riesgo es un receptor con un riesgo significativamente mayor de muerte, complicaciones o fallo del injerto debido a la comorbilidad preexistente o estado inmunológico. Estadísticamente, esto equivale a peores resultados para el injerto y la supervivencia del paciente. No existen sistemas de puntuación robustos para esta evaluación de riesgo. Aunque es probable que los modelos se desarrollen en breve842, se reconoce que con la incertidumbre de las herramientas de predicción actuales hay una dependencia continua en el juicio clínico de los profesionales de trasplante involucrados. En las recientes guías británicas y tan solo a modo de sugerencia en la fuerza de recomendación y con un nivel de evidencia bajo (C2), en casos en los que se estime que la probabilidad de supervivencia postrasplante no llegue a dos años no debería considerarse la opción de TRDV2.
El TRDV puede brindar oportunidades a las personas cuyos riesgos perioperatorios para un procedimiento de emergencia se consideran inaceptablemente altos, pero puede ser adecuado para un trasplante electivo. Las ventajas incluyen: optimización del receptor, solucionando y controlando previamente problemas de salud activos, disponibilidad ad integrum de todo el personal que forma el equipo multidisciplinario (cirujanos, anestesistas, intensivistas, nefrólogos, inmunólogos, personal de enfermería, etc.), administración de inmunosupresión previa al trasplante y la obtención de un órgano de buena calidad con muy bajo riesgo de retraso en la función del injerto.
La cuestión clave es que, si bien estos pacientes pueden esperar un resultado relativamente peor del trasplante en comparación con las personas consideradas en riesgo estándar, su resultado puede ser mejor de lo que sería si permanecieran en diálisis. Hay que considerar que la persistencia de enfermedad cardiovascular, enfermedad pulmonar, obesidad, diabetes o HTA afecta tanto a la supervivencia de los pacientes renales ya sea que tengan un trasplante o sean dependientes de diálisis843.
Otro grupo de pacientes que se pueden considerar complejos son los pacientes de alto riesgo inmunológico, sensibilizados. No es infrecuente que los TRDV con incompatibilidad HLA sean excluidos del análisis de supervivencia en los resultados de TRDV ya que las tasas de supervivencia no son tan buenas como los trasplantes sin anticuerpos y compatibles. Sin embargo, para algunos pacientes, el trasplante en dichas circunstancias representa la única opción para independizarse de la diálisis. Las recomendaciones es establecer programas específicos para seleccionar un donante para el que el receptor no produzca anticuerpos. En la donación de vivo, este objetivo puede lograrse mediante estrategias de intercambios de pareja. Se puede plantear trasplantar pacientes con DSA solo si estas medidas antes mencionadas no se pueden lograr y con programas de desensibilización. En sí mismo la presencia de DSA detectables por otras técnicas que no sean la técnica de citotoxicidad dependiente del complemento se considera como un factor de riesgo, pero no una contraindicación101. Frente a la incompatibilidad HLA, el uso de las técnicas de desensibilización en el TR ABOi ofrece resultados a largo plazo similares a los TR ABOc53.
Los posibles riesgos y resultados deben transmitirse tanto a donante y receptor. Aunque tal discusión es aplicable al proceso de donación de trasplante de vivo en general, es particularmente importante para el receptor de alta complejidad donde el riesgo de un resultado adverso es mayor que para el trasplante estándar. Si no se puede lograr un acuerdo dentro de un centro de trasplante en particular debido a las diferencias de opinión sobre el grado de riesgo, la opción de derivación a otro centro de trasplante para una segunda valoración debe ser discutida con el potencial receptor y donante.
Al final, aunque unifiquemos los criterios de inclusión en nuestros protocolos, la práctica clínica nos llevara seguramente a diferencias en las inclusiones, pero esto no sería un problema y se corrige con la libertad del paciente en el acceso a segundas o terceras opiniones sobre la conveniencia de realizarle un TRDV. Es importante que la decisión de trasplantar a receptores de alto riesgo no esté influenciada por la preocupación en ocasiones indebida de los resultados que se pueden obtener. Es muy difícil establecer estándares de resultados en este grupo de TRDV dada la heterogeneidad de los pacientes y la variación que cada unidad pueda tener en la definición de alto riesgo.
Sección 19. La Coordinación del proceso de donación renal de vivoEl adecuado desarrollo del proceso de TRDV requiere la perfecta coordinación de sus sucesivas fases, a lo largo de las cuales ha de garantizarse la protección integral del donante vivo, pilar básico de cualquier programa de TRDV2,3,8,27,42,64,844,845. Los diferentes estándares internacionales coinciden en garantizar el principio de no comercialización y la ausencia de prácticas compatibles con la trata de personas y el tráfico de órganos humanos. En el proceso ha de incidirse en la obtención de un consentimiento libre, informado y expreso. También han de evaluarse diferentes aspectos médicos, familiares, sociolaborales y económicos que promuevan el bienestar del donante a corto y largo plazo, y minimicen los riesgos asociados con la donación.
El proceso de TRDV está regulado en España por la Ley 30/1979, de 27 de octubre, sobre extracción y trasplante de órganos846 y el Real Decreto 1723/2012, de 28 de diciembre, por el que se regulan las actividades de obtención, utilización clínica y coordinación territorial de los órganos humanos destinados al trasplante y se establecen requisitos de calidad y seguridad41. Nuestro marco regulatorio incide en el respeto por los principios básicos ya mencionados y estandariza algunos aspectos del proceso, incluyendo; i) la valoración del potencial donante desde una perspectiva médica y psicosocial por parte de un médico independiente de quien va a llevar a cabo la extracción y el trasplante del órgano; ii) la evaluación del procedimiento por un Comité de Ética; y iii) la comparecencia del donante ante el Juez de Primera Instancia. El cumplimiento de estas premisas legales y el abordaje de los diferentes aspectos logísticos del proceso exigen una labor de coordinación que puede ser llevada a cabo por uno o varios profesionales de diferentes perfiles y procedencias.
Según el documento titulado TR de donante vivo en España. Análisis de Situación y Hoja de Ruta, elaborado por la ONT, la SEN y la SET, de 33 centros españoles con programa de TRDV, el Coordinador de Trasplantes (CT) es el responsable de la coordinación del proceso en 10 de ellos, principalmente en hospitales trasplantadores de baja actividad847. En 15 de 19 centros que no cuentan con un profesional específicamente designado para esta labor coordinadora, el CT brinda apoyo en diferentes etapas del proceso. En concreto, colabora con los equipos de trasplante en los aspectos logísticos del proceso, apoya al Comité de Ética Asistencial (CEA) y participa como garante de la protección del donante de forma independiente del equipo de trasplante, tal y como indica nuestra legislación y promueven las recomendaciones internacionales – figura del «donor advocate» en terminología anglosajona88.
El profesional responsable de la coordinación del TRDV ha de actuar de forma coordinada con el equipo de TR, por lo que su integración en el grupo multidisciplinario del programa de TRDV está justificada, siempre que se asegure su independencia y su papel de garante de los derechos del donante3,27.
Coordinación del TR de donante vivo- •
Debe asegurarse la cobertura sanitaria por el Sistema Nacional de Salud o las aseguradoras privadas, de los gastos directos con la evaluación pretrasplante y las intervenciones médicas y quirúrgicas del proceso de TRDV. Debe asegurarse que el impacto económico de la donación sea de costo neutro para el donante, facilitando el reembolso de los gastos directos e indirectos. (Calidad de la evidencia:B)
- •
Para los donantes vivos extranjeros, debe verificarse el vínculo entre donante y receptor y cumplir con los requisitos legales de entrada y permanencia en el país durante el proceso de TRDV. (B)
La logística del proceso debe organizarse de modo que la evaluación de la viabilidad y compatibilidad del donante y receptor se lleven a cabo de la manera más eficaz y fluida posible, ofreciendo siempre información completa, en particular al donante, de los riesgos que asume y los beneficios esperados con el TRDV.
Además de colaborar con los nefrólogos del programa en la promoción del TRDV informando a pacientes, profesionales de las unidades de diálisis y las unidades de ERCA del propio centro y de los centros para los que el hospital trasplantador es centro de referencia, el responsable de la coordinación del proceso de TRDV puede colaborar en el desarrollo de las siguientes 10 fases:
Valoración inicial por el nefrólogo responsable del donante vivoEl proceso se inicia con la entrevista entre el nefrólogo responsable y el potencial donante, lo que permite una primera evaluación de la factibilidad del proceso y de factores relativos a la protección del donante. Según el Real Decreto 1723/2012, de 28 de diciembre 41, se ha de constatar que se respetan los principios de voluntariedad, altruismo, confidencialidad, ausencia de ánimo de lucro y gratuidad. A continuación, han de solicitarse las pruebas de laboratorio, HLA y estudios de imagen descritos en otras secciones de este documento. Además, ha de gestionarse la consulta con otros profesionales involucrados en el programa para recoger todas las opiniones que permitan discutir el caso de forma multidisciplinar para su aprobación o descarte: urología, anestesia, psicología o psiquiatría y otras especialidades (cirugía vascular, cardiología, oncología, hematología, etc.).
Generación de un espacio abierto al donante para expresar dudas y resolver preguntasEs aconsejable ofrecer al potencial donante una entrevista a la que acuda sin el receptor, ofreciéndole un espacio en el que se exprese de forma libre, manifestando sus inquietudes y dudas. En esta entrevista ha de volver a explicarse el proceso de donación y aclarar y resolver dudas que permitan un consentimiento informado válido. Además, ha de explicarse la importancia del CEA y la obligación legal de comparecencia ante el Juzgado de Primera Instancia, para ratificar que la donación del órgano se realiza de forma libre, sin coacción económica o de otro tipo, y debidamente informada.
Al ser una entrevista individual con el donante, es importante evaluar que el donante cumpla los requisitos recomendados en la Guía del Consejo de Europa sobre la calidad y la seguridad de los órganos para trasplante27 y las presentes Recomendaciones, incluyendo la evaluación de factores y comportamientos de riesgo para minimizar la posibilidad de transmisión de enfermedades infecciosas – y de otro tipo - al receptor. Aunque esta tarea la debe realizar el médico responsable de la evaluación del estado de salud del donante, es importante que también la realice un profesional independiente quien, de forma coordinada con el equipo de trasplantes, debe indicar medidas de precaución al donante, informándole de los riesgos que determinadas conductas conllevan para el receptor.
Revisión de documentación y vínculo del donante vivo con el potencial receptor (tabla 18)Ha de solicitarse documentación que demuestre la identidad del potencial donante y del receptor y que avale el vínculo entre ambos, si bien la comprobación de la veracidad de esta documentación es responsabilidad del Juez de Primera Instancia.
Este hecho adquiere particular importancia en los casos de donante vivo no relacionado genética o emocionalmente, así como cuando el donante (y/o el receptor) sean extranjeros, bien personas procedentes de otro país que viajan específicamente para el trasplante, bien extranjeros que residen en España. En estos casos, algunos grupos proponen que, antes de iniciar las pruebas del estudio de salud del donante y el receptor, se realice una entrevista para revisar, de forma exhaustiva, la documentación que demuestra el vínculo y asegurar la autorización de estancia legal en el país tanto del donante como del receptor. Además, se sugiere una consulta preliminar al CEA para que evalúe la conveniencia de realizar una entrevista al donante antes de continuar con el proceso de evaluación.
En el caso de donantes (y/o receptores) extranjeros que viven fuera de España, se recomienda contar con un equipo médico conocido y de confianza en un centro de referencia, que pueda realizar en el país de origen las pruebas básicas y necesarias para valorar la idoneidad del donante y evitar desplazamientos y costes innecesarios al donante en caso de estar contraindicada la donación. Estas pueden incluir como mínimo el grupo sanguíneo, serologías virales, función y ecografía renales. En este supuesto, se recomienda aceptar exclusivamente al donante vivo relacionado genética o emocionalmente con el receptor, tanto para los trasplantes directos, como cuando participan en el Programa de TR Cruzado de la ONT543. La legislación establece que deberá facilitarse al donante vivo asistencia sanitaria para su restablecimiento, así como un seguimiento de por vida, por lo que es imprescindible asegurar la cobertura sanitaria en el país de origen para garantizar la atención médica al donante tras el proceso de donación y su seguimiento posterior, fomentando hábitos de vida saludables para ayudarle a preservar su salud. Las anteriores recomendaciones quedan especificadas en una Resolución gubernativa sobre los principios para la selección, evaluación, donación y seguimiento de los donantes vivos de órganos no residentes85.
La tabla 18 describe la documentación de demostración del vínculo entre donante y receptor, que se sugiere revisar según el origen del donante y/o receptor.
Documentación de demostración del vínculo entre donante y receptor
| Nacionalidad Española |
| DNI |
| Seguro de asistencia médica (seguridad social, privado, etc.) |
| Justificante del vínculo con el receptor (libro de familia, registro civil, certificado del padrón municipal histórico, fotografías, cuentas bancarias comunes, testimonios de amigos o familiares) |
| En el caso que el donante tenga hijos menores de edad y que la familia del hijo viva en el extranjero o no conviva con el donante, algunos grupos sugieren el conocimiento por parte de la pareja o la familia del proceso de donación |
| Extranjeros: Además de los cuatro documentos anteriores, se sugiere |
| Que los documentos que demuestren el vínculo estén traducidos al castellano, inglés o algún idioma de origen latino que permitan su comprensión. En caso de traducción, debe ser realizada por traductor oficial. Es recomendable consultar con la Embajada o el Consulado respectivo, para verificar la validez de los documentos que demuestren el vínculo |
| Pasaporte vigente, recomendable con validez superior a seis meses |
| Visado o autorización legal de residencia que cubra el período del proceso de donación y trasplante |
Una adecuada coordinación de todos los estudios, en función de las necesidades del paciente, facilita que se lleven a cabo en un corto espacio de tiempo. De igual forma, permite hacer un seguimiento de los estudios del donante vivo y constatar que no falta nada relevante y facilita agilizar los mismos. Como se menciona en el Documento de análisis de situación y hoja de ruta del Donante Vivo847, la falta de una persona encargada de este aspecto (salvo en los centros en los que hay implantada una vía clínica o similar) enlentece los procedimientos, porque se transforman en un extra en el día a día del profesional.
Colaboración en la toma de decisiones y valoración socioeconómica, familiar, social y laboral del donanteCon en fin de ofrecer una protección integral al donante, la entrevista busca conocer cómo ha sido el proceso de la toma de decisión, el contexto familiar y social, así como su situación laboral y económica:
Decisión de donar:
- •
Cómo ha obtenido la información para ser donante
- •
Motivaciones para ser donante
- •
Sentimientos que ha experimentado
- •
Si ha consultado su decisión con otras personas de su entorno
- •
Presiones que hayan influido en su decisión
- •
Implicaciones y consecuencias a todos los niveles
Situación familiar:
- •
Personas que integran su entorno familiar
- •
Conflictos familiares
- •
Personas que se harán cargo de los cuidados en casa al ser dado de alta hospitalaria post-donación
- •
Cómo ha previsto el bienestar de las personas a su cargo en el caso de existir alguna complicación, en particular si existen menores de edad o familia residiendo en el extranjero y dependencia económica del donante
- •
Situación laboral y económica
Profesión y empleo:
- •
Tipo de contrato, repercusiones laborales de su decisión, posibilidad de baja laboral
Repercusiones económicas:
- •
Medidas adoptadas
- •
Situación social y soporte familiar y social
De esta forma, el equipo multidisciplinar puede verificar y orientar al donante sobre las posibles compensaciones de gastos directos e indirectos derivados de la donación, como viajes, dietas, alojamiento, cuidado de los hijos, baja laboral, para prevenir un impacto económico negativo derivado de la donación. Estos aspectos adquieren especial relevancia en el caso del donante vivo extranjero. En España, los costes para el donante derivados de la evaluación pretrasplante y los procedimientos médicos y quirúrgicos están cubiertos por el Sistema Nacional de Salud o por el seguro privado del receptor. En caso de donación privada, debe velarse por que estén cubiertos por el receptor. En particular, en el caso del donante vivo extranjero, en especial cuando se requieren tratamientos no vinculados al proceso de donación (por ejemplo, en caso de detección de una neoplasia no conocida previamente), es importante informar al donante que estos gastos no quedan cubiertos por la cobertura sanitaria del receptor2,85,848. Es recomendable verificar que el donante tenga una persona de su entorno que puede ofrecerle cuidados por lo menos en los primeros días del alta hospitalaria2.
Participación en el procedimiento del Consentimiento informadoEl proceso del consentimiento válido (libre, informado y expreso) ya ha sido explicado en el Capítulo de Ética de la donación de vivo en este documento. El coordinador del TRDV ha de verificar que el donante comprende la información proporcionada y que todas sus preguntas han sido contestadas. Actuando como garante de los derechos del donante, ha de evaluar que el consentimiento se otorga de forma expresa, libre, consciente y desinteresada. Ha de aclararse que es una decisión reversible, de modo que el potencial donante en cualquier momento puede retirarse del proceso sin explicación, ni repercusión alguna. En todos los casos, y en particular en el donante vivo no relacionado y en el donante altruista, debe verificarse que no existe presión externa o cualquier otra circunstancia que sugiera que media condicionamiento económico o de otro tipo, social o psicológico.
Facilitación de reunión multidisciplinar de aceptación del donante vivoSegún la actividad de TRDV, es recomendable establecer una reunión periódica en la que se discutan todos los casos una vez evaluados como posibles donantes vivos, antes de ser presentados para la valoración por el CEA. Dicha reunión busca la participación multidisciplinar de los profesionales que colaboran en la evaluación de la idoneidad del estado de salud físico y mental del donante vivo, incluyendo nefrología, urología, anestesiología, enfermería, radiología, inmunología, hematología, trabajo social, psicología y psiquiatría. En dicha reunión, el coordinador del TRDV puede colaborar aportando su visión como defensor del donante e informando del vínculo entre donante y receptor y explicando la situación social, familiar y laboral del donante. En conjunto se realizará una valoración clínica del donante y del receptor para determinar que ambos cumplen los criterios establecidos por cada grupo de trasplante y se decide si se aprueba el caso como donante vivo para un receptor específico o si entra en el Programa Nacional de Trasplante Renal Cruzado. De esta reunión es conveniente realizar un Acta que se puede adjuntar a la historia clínica del donante.
Coordinación del proceso legal: CEA y comparecencia en el JuzgadoEl TRDV se ve facilitado por la coordinación del proceso ético-legal por un profesional determinado. Debe garantizar a su vez que el centro donde se va a realizar el proceso de donación, extracción y trasplante, es un centro sanitario expresamente autorizado para la extracción de órganos de donante vivo, por la autoridad sanitaria de la Comunidad Autónoma correspondiente.
Es recomendable que la reunión del CEA sea periódica, en especial en los centros con alta actividad trasplantadora. El CEA debe recibir los informes médicos del donante y receptor, elaborados por el nefrólogo responsable del proceso, además del informe del estado de salud mental elaborado por el psicólogo o psiquiatra y la valoración social, familiar y laboral del donante que puede aportar el coordinador del TRDV. A la reunión del CEA, asiste el nefrólogo, el coordinador y otros profesionales que se juzgue pertinente. Tras deliberación, el CEA elabora el informe autorizando la donación.
El coordinador del proceso de TRDV puede gestionar la comparecencia ante el Juez de Primera Instancia, coordinando con el Juez Decano día y hora de comparecencia para presentar la documentación y ratificación del consentimiento. Deben acudir al Juzgado el donante, el responsable médico y el cirujano responsable de la extracción y el implante. Todos deberán presentar el DNI o pasaporte (si el donante es extranjero). En caso de donante vivo que no hable alguno de los idiomas oficiales de España, deberá comparecer acompañado de traductor independiente, no vinculado al donante, al coordinador del proceso o al equipo de trasplante, previamente aceptado por el Juez.
Se deben aportar al Juzgado los documentos pertinentes:
- •
Solicitud de Asistencia al Juzgado firmada por el donante
- •
Certificado del Estado de Salud del Donante firmado por un médico independiente al proceso de estudio del donante vivo.
- •
Copia del consentimiento o autorización extracción renal de donante vivo
- •
Informe del CEA
- •
En caso de donante del Programa Nacional de TR Cruzado, se entregará al Juez una copia de los Códigos generados por el Programa. Además, se entregará una copia del Documento de Autorización de TR Cruzado, que genera la ONT y que contiene la información de las parejas que participan, firmado por el donante.
En el Juzgado de Primera Instancia, el Juez verificará la libre decisión del donante y los asistentes firmarán ante el Juez y el Secretario el Acta de Consentimiento para la Donación de órganos humanos entre vivos. El Juzgado entregará copia para la historia del donante y otra al mismo donante.
Reporte del TRDV a las autoridades competentes y a los registrosEn caso de donante vivo extranjero, antes de la donación, se debe informar a la Coordinación Autonómica de Trasplantes y a la ONT y enviar la información que demuestra el vínculo, pasaportes y cobertura sanitaria del donante y receptor. En caso de donante vivo para TR cruzado, la Unidad de TR ha de comunicar a la ONT la aceptación del donante y receptor a participar en el programa. A través del portal web de la ONT se obtienen los Códigos del Programa Nacional de TR Cruzado543, la tabla de los centros y donantes involucrados en cada cruce y el Documento de Autorización del Programa de Cruzado de la ONT, que debe firmar el donante. A su vez, el día siguiente a la donación, se comunicará a la Coordinación Autonómica de Trasplantes y se registrará en los sistemas nacional y autonómico de Registro de Donante Vivo y, en el caso de un donante extranjero, se podrá comunicar también al Registro respectivo en el país de origen del donante.
Gestión del traslado renal en el programa de donante vivo cruzadoEn el Programa Nacional de TR Cruzado543, ha de organizarse el envío y/o la recepción del riñón hacia o desde los otros centros respectivos implicados. Debe verificarse el empaquetamiento, preservación y transporte adecuados, según lo especificado por la ONT849,850 y el Real Decreto 1723/2012, de 28 de diciembre41. Se adjuntará un documento propio del centro generador, que permita identificar el donante (Código ONT de Cruzado, historia clínica hospitalaria, etc.), la lateralidad del riñón, aspecto macroscópico del órgano, tipo de procedimiento de extracción, tiempos de isquemia caliente y hora de perfusión renal y solución con que se preserva el órgano. Ha de incluirse también el informe sobre las características del donante y del órgano (incluyendo grupo sanguíneo y serologías recientes, de al menos 7 días antes de la donación), de forma similar a como se realiza con el riñón de donante fallecido, y según especifica la legislación.
Es necesaria una adecuada comunicación y coordinación entre los diferentes equipos que participan en el Programa Nacional de TR Cruzado, junto con la ONT y las Coordinaciones Autonómicas de Trasplante implicadas, para garantizar la mayor eficacia de los medios de trasporte terrestre y aéreos y que se vaya informando en tiempo real a todos los implicados la situación en cada centro. De esta forma, se puede minimizar el tiempo de isquemia fría. Algunas publicaciones recientes, de EE. UU. y Australia, donde las distancias son significativas, han descrito que un tiempo de isquemia fría inferior o igual a 16 horas no afecta de forma significativa a la función renal745,851,852. Con posterioridad a la cadena de cruzado, es conveniente comunicar cualquier incidencia que se hubiera presentado en el proceso y poder realizar las correcciones oportunas y acciones de mejora al Programa Nacional. Toda la información de la donación y el implante debe constar en la historia clínica del donante sea en documento en papel o en historia clínica informatizada.
En resumen, los programas de TRDV han de cumplir escrupulosamente la normativa legal vigente. La protección integral del donante vivo ha de ser una prioridad de todos los programas. La labor de coordinación del proceso de TRDV aquí descrita ha de recaer en uno o varios profesionales de cada centro autorizado, labor que en algunos hospitales de nuestro país es asumida por el CT de forma total o parcial. El último objetivo es facilitar y coordinar las diversas etapas del proceso, velando por el correcto cumplimiento ético y legal, garantizar la protección del donante y la transparencia del proceso y promover medidas que mejoren toda la sistemática.
Composición del grupo de trabajoCoordinadores: Miguel Ángel Frutos, Marta Crespo, María de la Oliva Valentín.
Editores Especiales: Julio Pascual, Domingo Hernández, Beatriz Domínguez-Gil, Marta Crespo, María de la Oliva Valentín, Miguel Ángel Frutos.
Coordinadores: Miguel Angel Frutos, Marta Crespo, María de la Oliva Valentín.
Editores: Miguel Angel Frutos, Marta Crespo, María de la Oliva Valentín, Domingo Hernández, Beatriz Domínguez-Gil, Julio Pascual.
Una colaboración de la Sociedad Española de Nefrología, la Sociedad Española de Trasplante y la Organización Nacional de Trasplantes.
Conflicto de interésNinguno de los autores refiere algún conflicto de interés.
El presente estudio fue apoyado en parte por subvenciones del Instituto de Salud Carlos III cofinanciadas por el Fondo Europeo de Desarrollo Regional –FEDER (Redinren RD16/0009) y subvenciones ICI14/00016 y PI17/02043) del Ministerio de Economía y competitividad del Gobierno de España. Estas instituciones no participaron en el diseño del estudio y la recopilación, análisis e interpretación de datos ni en la redacción del manuscrito. Agradecemos a Silvia Musquera la realización de dibujos de la figura 12.
- Inicio
- Todos los contenidos
- Publique su artículo
- Acerca de la revista
- Métricas
- Open access