La afectación renal de las vasculitis asociadas a anticuerpos anticitoplasma de neutrófilos (ANCA) puede conducir a enfermedad renal crónica con necesidad de tratamiento renal sustitutivo. En estos enfermos el trasplante renal ofrece excelentes tasas de supervivencia del injerto y del receptor a largo plazo, por lo que pueden ser trasplantados cuando la enfermedad está en remisión. Sin embargo, la amenaza de recidivas de la enfermedad en el injerto se mantiene, aunque, con las modernas pautas de inmunosupresión, su incidencia es menor. Presentamos el caso de un varón diagnosticado de glomerulonefritis extracapilar tipo III C-ANCA (+) que desarrolló una recidiva de la enfermedad en el injerto renal 8 años después de ser trasplantado. La intensificación de la inmunosupresión con plasmaféresis consiguió controlar la enfermedad.
Renal disease secondary to vasculitis associated with anti-neutrophil cytoplasmic antibodies (ANCA) can lead to chronic renal disease requiring renal replacement therapy. In these patients, kidney transplantation offers excellent long-term rates of allograft and patient survival; consequently, they can be trasplanted when the clinical disease activity has remitted. However, the risk of disease relapses in the renal allograft remains, although at lower rates due to modern immunosuppressive regimens. We describe the case of a male patient with extracapillary glomerulonephritis type III C-ANCA (+) who developed a recurrence in the renal allograft 8 years after transplantation. Intensive immunosupression with plasmapheresis controlled the disease.
En la nomenclatura actual, la glomerulonefritis extracapilar tipo iii que asocia la demostración de anticuerpos anticitoplasma de netrófilos (ANCA) forma parte de una de las 3 variantes de vasculitis asociadas a ANCA (VAA) aunque con enfermedad limitada al riñón. Las otras 2 serían la granulomatosis con poliangeítis (granulomatosis de Wegener) y la poliangeítis microscópica1. Estas vasculitis son la causa más frecuente de glomerulonefritis rápidamente progresiva. El diagnóstico precoz y el tratamiento, basado principalmente en esteroides y ciclofosfamida, mejoran de forma evidente la supervivencia de los pacientes y preserva la función renal. Sin embargo, más de un 20% de los pacientes que presentan la enfermedad evolucionan hacia enfermedad crónica terminal, con necesidad de tratamiento renal sustitutivo2–4.
En estos enfermos, el trasplante renal es una alternativa que ofrece excelentes resultados, aunque no está exenta de interrogantes4–6. En primer lugar, cuál sería el momento más adecuado para incluir a los pacientes en lista de espera, ante la posibilidad de recidiva de la enfermedad en el injerto6–11. Por otra parte, no existe un claro consenso sobre cómo debe ser tratada la recidiva una vez que se ha producido12.
Presentamos el caso de un enfermo diagnosticado de glomerulonefritis extracapilar tipo iii asociada a ANCA antiproteínasa 3 (C-ANCA) que, al cabo de 8 años de ser trasplantado con un injerto renal de cadáver, presentó una recidiva de la enfermedad en el injerto. A propósito del caso hacemos una breve revisión del tema.
Caso clínicoVarón de 60 años diagnosticado en otro hospital en el año 2000 de glomerulonefritis extracapilar tipo iii asociada a C-ANCA. Fue tratado con 5 bolos intravenosos de 6-metilprednisolona seguidos de corticoides por vía oral en pauta descendente asociados a ciclofosfamida por vía oral (no hemos podido recabar la dosificación exacta). En su momento la ciclofosfamida fue suspendida por mielotoxicidad.
En el año 2002 fue incluido en programa de hemodiálisis periódica.
En septiembre de 2006, en otro centro trasplantador, recibió un injerto renal de cadáver. El paciente recibía tacrolinus en monoterapia, aunque no podemos asegurar si previamente había recibido alguna otra combinación de inmunosupresores. Sus creatininas séricas oscilaban entre 1,5 y 1,7mg/dl.
En diciembre de 2013, con motivo de la implantación de una válvula aórtica percutánea en nuestro hospital, se realizó en nuestro servicio una valoración pre- y postintervención. En ese momento su situación clínica era buena, con creatinina sérica de 1,5mg/dl y proteinuria 0,3g/día, con sedimento urinario normal.
En octubre de 2014, ante la aparición de síntomas respiratorios con fiebre y deterioro de la función renal, el paciente decide trasladar a nuestro hospital su control clínico. El cuadro febril y los síntomas respiratorios, sin evidencia microbiológica ni radiológica, mejoraron con tratamiento empírico con levofloxacino. Sin embargo, la función renal empeoró en pocos días hasta alcanzar creatininas séricas de 4mg/dl, con proteinuria de 6,8g/día y hematuria. La determinación de C-ANCA fue 74,2UI/ml (valores normales: 0-5UI/ml) y P-ANCA 8,4UI/ml (valores normales: 0-6UI/ml). El resto de los parámetros de autoinmunidad (ANA, anticuerpos anti-MBG, complemento, crioglobulinas, etc.) fueron negativos. La serología HIV, VHC, VHB y viremia CMV y BK fueron también negativos.
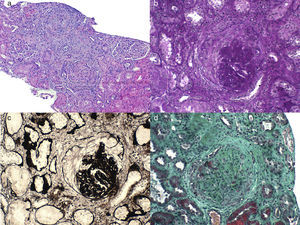
Se realizó una biopsia del injerto renal en la que los hallazgos más relevantes fueron (fig. 1): de los 19 glomérulos valorables, 3 presentaban esclerosis glomerular global, 12 glomérulos presentaban semilunas celulares. Algunos de ellos presentaban disrupción de la cápsula de Bowman que provoca reacción inflamatoria pseudogranulomatosa de células mononucleadas. En 2 glomérulos había lesiones compatibles con necrosis fibrinoide. Encontramos necrosis tubular en un 15%, atrofia tubular en un 20% y algunos cilindros hemáticos, además de infiltrado intersticial en un 25% con algún eosinófilo y focos de hemorragia intersticial reciente y hialinosis arteriolar, con alguna imagen de degeneración mucoide de la pared sin infiltrado transmural. El estudio de inmunofluorescencia fue negativo. El estudio inmunohistoquímico para C4d fue negativo.
Ante la evidencia de una recidiva de la enfermedad de base, el paciente recibió 3 bolos intravenosos de 500mg de 6-metilprednisolona (el paciente era diabético) en días consecutivos, seguidos por prednisona oral a dosis de 0,5mg/kg/día en pauta descendente. Así mismo, se le aplicaron 8 sesiones de plasmaféresis y se inició tratamiento con micofenolato mofetil (1g/12 h, vía oral) asociado a tacrolimus.
A los 12 días del ingreso, el paciente fue dado de alta con una creatinina sérica de 2,9mg/dl. En un control ambulatorio un mes más tarde, la creatinina era de 2,3mg/dl y la proteinuria de 3,6g/día.
DiscusiónAunque el tratamiento de las VAA, basado principalmente en la asociación de ciclofosfamida y corticoides, ha demostrado evidente eficacia en mejorar la supervivencia de los pacientes y la preservación de la función renal, más de un 20% de los pacientes evolucionan hacia enfermedad renal crónica con necesidad de tratamiento renal sustitutivo2–4. En estos pacientes, el trasplante renal es una excelente alternativa, puesto que consigue tasas de supervivencia del injerto a 5 años del 90% y de alrededor del 70% a los 10 años, con supervivencia de los receptores a 10 años del 65% y una supervivencia media de 13,4 años, datos que son muy favorables si se comparan con pacientes trasplantados por otras causas4–6.
La amenaza para los pacientes llega de la naturaleza recidivante de la enfermedad. Estudios recientes que comparan tasas de recidiva de la enfermedad con distintos regímenes inmunosupresores, ciclofosfamida versus rituximab asociados a corticoides, reportan tasas de recidiva de 32% con ciclofosfamida y de 29% con rituximab a 18 meses13,14.
Una vez los pacientes son trasplantados, el riesgo de recidiva de la enfermedad persiste. La información de la que disponemos viene de casos aislados o de series cortas de centro, pero de la recopilación de datos disponibles se deduce que la incidencia de recidiva de la enfermedad ha disminuido conforme se han modificado las pautas de inmunosupresión. En 1999, Nachman et al. revisan 127 casos publicados y encuentran una tasa de recurrencia del 17%, con un tiempo medio desde el trasplante hasta la recurrencia de 31 meses, con rango de entre 5 días a 13 años7. Es de notar que, en estos casos, el régimen inmunosupresor se basaba fundamentalmente en ciclosporina A. En los años siguientes, con pautas de inmunosupresión más actuales, utilizando inducción con anticuerpos, corticoides, micofenolato mofetil y tacrolimus, se publican tasas de recurrencia claramente inferiores que varían según las series: 8,6% (Gera et al., 2007)8, 4,7% (Little et al., 2009)9 y 8,2% (Geetha et al., 2011)10. Es muy probable que la introducción de estos fármacos para el control de la respuesta inmune celular y humoral en el trasplante haya colaborado de forma significativa en la reducción de la tasa de recidivas8. De hecho, se ha utilizado timoglobulina. Se sugiere timoglobulina o micofenolato mofetil para el control de la actividad vasculítica en determinados casos de resistencia o intolerancia a ciclofosfamida15,16.
El paciente que presentamos experimentó una recidiva de la enfermedad en el injerto renal a los 8 años del trasplante. Aunque nos ha resultado imposible recabar información completa del paciente por haber sido trasplantado en otro centro, parece que la actividad de su vasculitis estaba controlada, dado que un año antes, en nuestro centro, no había evidencia en sentido contrario. Tampoco conocemos el motivo del tratamiento inmunosupresor en monoterapia con tacrolimus. Este hecho pudiera tener algún tipo de implicación en la aparición de la recidiva de la enfermedad. Por esto, nos atrevemos a señalar que, en este tipo de enfermedades, cualquier modificación «a la baja» del régimen inmunosupresor de mantenimiento deber ser sopesado y meditado de forma especial.
El momento en el que los pacientes deben ser incluidos en lista de espera para el trasplante renal es otro aspecto a considerar. Aunque algunos autores señalan la conveniencia de esperar un año una vez se ha producido la remisión de la enfermedad, como sucede en otras enfermedad afines, parece que existe consenso generalizado en que los pacientes pueden trasplantarse una vez la enfermedad está en remisión completa, entendiendo como tal la ausencia de síntomas de la enfermedad8,9,11. Aunque es de notar que, en la revisión de Little et al., el trasplante renal realizado antes de un año de la remisión de la enfermedad es un factor riesgo de muerte del receptor (HR 2,3; p=0,04)9.
La persistencia de ANCA detectables no implica que la enfermedad esté activa, de hecho el estatus de ANCA no se incluye ni en la versión 3 del Birmingham Vasculitis Activity Score (BVAS) ni en la definición más reciente del European Vasculitis Study Group17. Guillevin et al. en un estudio muy reciente describen positividad ANCA en un 62% (por IFI) o un 46% (por ELISA) de enfermos considerados en remisión17. De la misma manera, una parte muy significativa de enfermos trasplantados, en algunas series más del 40%, se demuestran ANCA (+) en el momento del trasplante7–9. Por otra parte, el estatus ANCA en el momento del trasplante no condiciona de forma significativa la probabilidad de recaída, ni el pronóstico del injerto ni del paciente, como tampoco lo hace el tipo de ANCA (antimieloperoxidasa o antiproteínasa-3), aunque en algún trabajo se demuestra cierta asociación con el desarrollo de vasculopatía en el injerto9.
La escasez de casos y su amplia dispersión hacen muy difícil establecer pautas consensuadas de tratamiento de las recidivas de las VAA en los enfermos con trasplante renal y, como consecuencia, extraer conclusiones fundamentadas de eficacia. Por otra parte, a la hora de decidir la intensidad del tratamiento de la recidiva debe considerarse su gravedad, es decir, si se trata de recidivas mayores o menores utilizando, por ejemplo, los criterios BVAS.
El tratamiento en los casos publicados es muy variado, casi tanto como los autores que los describen. Se ha recurrido a reintroducir ciclofosfamida, sesiones de plasmaféresis, bolos de esteroides, intensificación de la inmunosupresión basal, etc.12,18,19. Como indicamos antes, creemos que los resultados obtenidos no pueden ser valorados con estricto fundamento. En los últimos años la introducción con éxito de rituximab, no solo para la inducción de la remisión de la enfermedad sino para el control de las recidivas, abre nuevas expectativas en el tratamiento de las VAA17. Si es aplicable en los enfermos trasplantados está por comprobar.
En nuestro caso, optamos por intensificar la inmunosupresión con la introducción de corticoides después de bolos de 6-metilprednisolona, la introducción de micofenolato mofetil, manteniendo tacrolimus, a la vez asociado a sesiones de plasmaféresis. Con ello logramos controlar la afectación renal a corto plazo.
En resumen, describimos el caso de un paciente con una recidiva de una variante de VAA controlada a corto plazo con intensificación de la inmunosupresión y plasmaféresis. Para los pacientes con insuficiencia renal crónica terminal secundaria a VAA, el trasplante renal ofrece excelentes resultados y se debe considerar una vez establecida de remisión de la enfermedad. La posibilidad de recidivas de la enfermedad existe, aunque en tasas decrecientes, probablemente como consecuencia de modernos fármacos inmunosupresores. La suma de rituximab a otros tratamientos más convencionales añade una esperanza para el control de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.