La infección por el virus de la hepatitis B (VHB) presenta una elevada morbimortalidad en la población general. En la enfermedad renal crónica (ERC), esto es variable por las características de los pacientes. En diálisis, la prevalencia oscila entre el 0-7% al 10-20%1. En España, según el estudio PIBHE, este valor alcanza el 1,03%2. La vacunación y el uso de medidas de protección universal han contribuido a su disminución1–4. En el trasplante renal (TR) la prevalencia aumenta debido al riesgo de reactivaciones por los inmunosupresores1,5–7. Presentamos un caso de reactivación del VHB en un paciente con infección previamente controlada, que reinicia diálisis peritoneal (DP), tras TR fallido, en el que se mantuvo la inmunosupresión para evitar síndrome de intolerancia al injerto (SII).
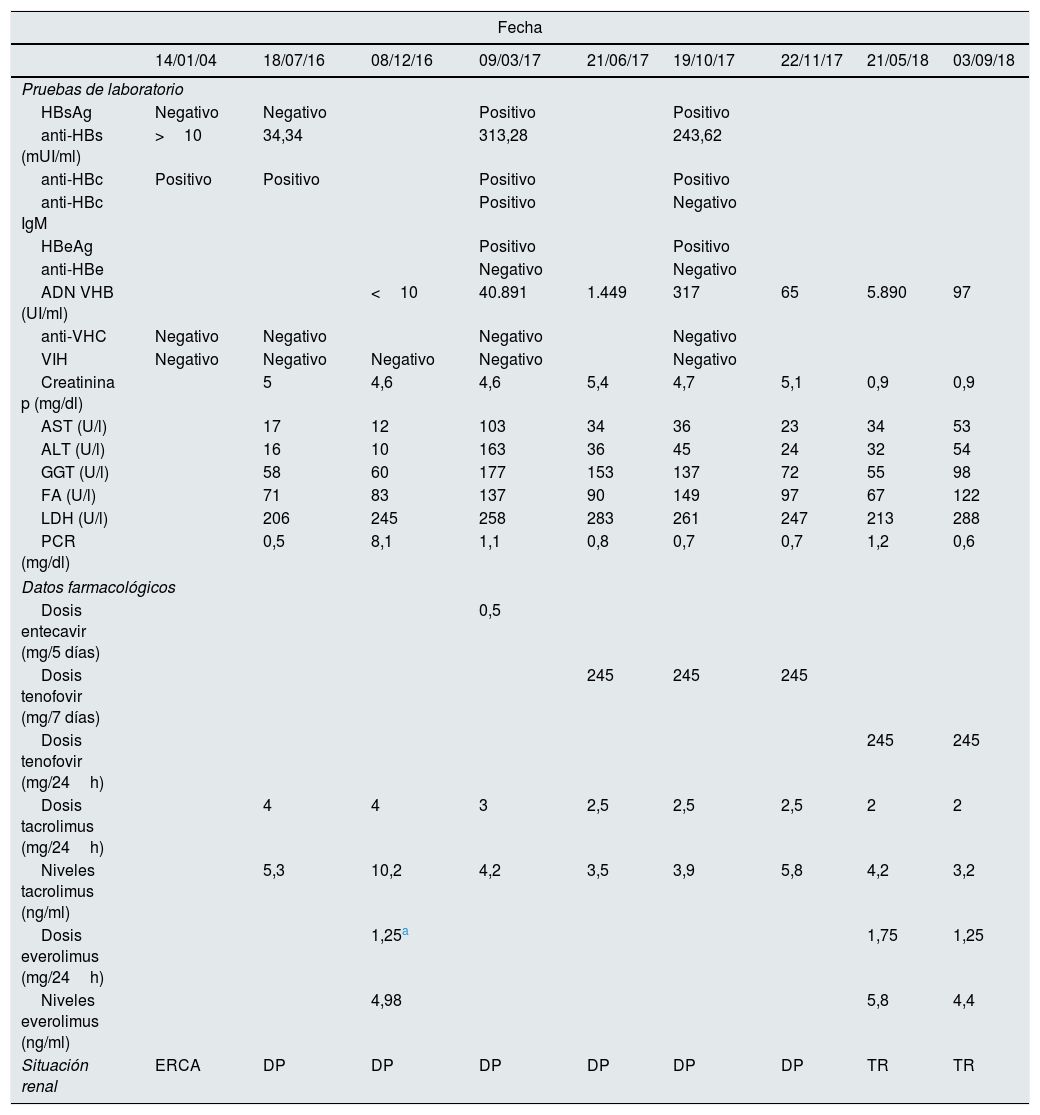
Varón de 64 años con ERC secundaria a glomerulonefritis IgA. En enero/2004 presentaba marcadores frente al VHB compatibles con infección pasada y resuelta (HBsAg negativo, anti-HBc y anti-HBs positivos). Nunca había sido vacunado frente al VHB. En marzo/2004 inició DP. Seis meses después recibe TR iniciando inmunosupresión con tacrolimus, micofenolato de mofetilo (MMF) y prednisona. Durante el TR se cambió MMF por everolimus. Reinició DP en julio/2016 por nefropatía crónica del injerto. Presentaba perfil hepático normal y los mismos marcadores serológicos de infección resuelta frente al VHB (tabla 1). Se mantuvo la inmunosupresión a dosis bajas con everolimus, prednisona y tacrolimus para evitar SII. En diciembre/2016 ingresó por síndrome febril de origen no filiado. Se decidió suspender everolimus y disminuir la dosis de prednisona y tacrolimus, con notable mejoría del paciente. En marzo/2017, en control analítico de rutina, se observó elevación de transaminasas. El paciente se encontraba asintomático. Se realizó estudio serológico y ADN del VHB que confirmó la presencia de infección activa por probable reactivación del VHB (tabla 1). Para ampliar el estudio, se envió una muestra al Centro Nacional de Microbiología (CNM). Los resultados indicaron: genotipo H; mutación 145R en el HBsAg asociada a escape vacunal, resistencia a la inmunoterapia y escape a la detección del HBsAg en determinados inmunoensayos; y 2 mutaciones en la polimerasa (posible resistencia) para 169L (entecavir) y 173A (lamivudina). Inicialmente se trató con entecavir 0,5mg/cada 5 días, pero ante la falta de respuesta y tras recibir los resultados del CNM, se cambió por tenofovir 245mg/semana. Tras esto, el paciente mejoró considerablemente (tabla 1). En diciembre/2017 se reincluyó en lista de espera de TR. En febrero/2018 recibió segundo TR. En mayo/2018, se incrementó la dosis de tenofovir a 245mg/24h al presentar función renal normal y aumento del ADN del VHB. Actualmente, el paciente se encuentra asintomático y con parámetros analíticos y serológicos normales (tabla 1).
Evolución clínica, bioquímica y serológica del paciente
| Fecha | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 14/01/04 | 18/07/16 | 08/12/16 | 09/03/17 | 21/06/17 | 19/10/17 | 22/11/17 | 21/05/18 | 03/09/18 | |
| Pruebas de laboratorio | |||||||||
| HBsAg | Negativo | Negativo | Positivo | Positivo | |||||
| anti-HBs (mUI/ml) | >10 | 34,34 | 313,28 | 243,62 | |||||
| anti-HBc | Positivo | Positivo | Positivo | Positivo | |||||
| anti-HBc IgM | Positivo | Negativo | |||||||
| HBeAg | Positivo | Positivo | |||||||
| anti-HBe | Negativo | Negativo | |||||||
| ADN VHB (UI/ml) | <10 | 40.891 | 1.449 | 317 | 65 | 5.890 | 97 | ||
| anti-VHC | Negativo | Negativo | Negativo | Negativo | |||||
| VIH | Negativo | Negativo | Negativo | Negativo | Negativo | ||||
| Creatinina p (mg/dl) | 5 | 4,6 | 4,6 | 5,4 | 4,7 | 5,1 | 0,9 | 0,9 | |
| AST (U/l) | 17 | 12 | 103 | 34 | 36 | 23 | 34 | 53 | |
| ALT (U/l) | 16 | 10 | 163 | 36 | 45 | 24 | 32 | 54 | |
| GGT (U/l) | 58 | 60 | 177 | 153 | 137 | 72 | 55 | 98 | |
| FA (U/l) | 71 | 83 | 137 | 90 | 149 | 97 | 67 | 122 | |
| LDH (U/l) | 206 | 245 | 258 | 283 | 261 | 247 | 213 | 288 | |
| PCR (mg/dl) | 0,5 | 8,1 | 1,1 | 0,8 | 0,7 | 0,7 | 1,2 | 0,6 | |
| Datos farmacológicos | |||||||||
| Dosis entecavir (mg/5 días) | 0,5 | ||||||||
| Dosis tenofovir (mg/7 días) | 245 | 245 | 245 | ||||||
| Dosis tenofovir (mg/24h) | 245 | 245 | |||||||
| Dosis tacrolimus (mg/24h) | 4 | 4 | 3 | 2,5 | 2,5 | 2,5 | 2 | 2 | |
| Niveles tacrolimus (ng/ml) | 5,3 | 10,2 | 4,2 | 3,5 | 3,9 | 5,8 | 4,2 | 3,2 | |
| Dosis everolimus (mg/24h) | 1,25a | 1,75 | 1,25 | ||||||
| Niveles everolimus (ng/ml) | 4,98 | 5,8 | 4,4 | ||||||
| Situación renal | ERCA | DP | DP | DP | DP | DP | DP | TR | TR |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; Creatinina p: creatinina plasmática; DP: diálisis peritoneal; ERCA: enfermedad renal crónica avanzada; FA: fosfatasa alcalina; GGT: gamma-glutamil transferasa; LDH: lactato deshidrogenasa; PCR: proteína C reactiva; TR: trasplante renal.
La reactivación del VHB en la población renal tiene mayor morbimortalidad que en la población general1,5,6. Varios autores han alertado de reactivaciones del VHB en pacientes en diálisis o tras terapia inmunosupresora en TR1. Se han descrito factores de riesgo (FR) como edad avanzada, rechazo del injerto, uso de rituximab y/o everolimus y la pérdida o ausencia de anti-HBs1,2,5,7. Nuestro paciente no presentaba ninguno, por lo que era poco probable la reactivación, pero ocurrió. Las guías clínicas recomiendan realizar controles anuales serológicos de los pacientes con anti-HBc positivo independientemente de anti-HBs positivo/negativo1,3. Algunos autores recomiendan realizar ADN del VHB en los casos HBsAg negativo y anti-HBc positivo para detectar una posible infección oculta por VHB1,6. En nuestro caso se realizaron todos estos controles, pero fue la realización rutinaria de un perfil hepático lo que nos alertó. Ante la presencia de alteraciones hepáticas en un paciente anti-HBc positivo, se debe realizar serología del VHB completa y ADN del VHB. El diagnóstico precoz nos permitirá iniciar tratamiento inmediato, y aislar y proteger a la población sanitaria y a los pacientes en diálisis. Algunos autores aconsejan iniciar DP a los pacientes renales HBsAg positivos o con antecedentes de infección por VHB resuelta (HBsAg negativo, anti-HBc positivo), siempre que sus condiciones clínicas lo permitan4. En nuestro caso, el paciente eligió libremente DP. Esto facilitó la no transmisión de la infección. Quizás habría que establecer un debate entre priorizar la libre elección de diálisis y la seguridad de otros pacientes en diálisis. En cuanto a los fármacos, actualmente se consideran de primera línea el entecavir y el tenofovir1,6. Gracias al estudio molecular precoz, se detectaron resistencias farmacológicas y un genotipo poco usual en España (genotipo H, frecuente en América del Sur8). Esto permitió una evolución favorable del paciente, así como su re-inclusión en lista de TR.
En definitiva, los pacientes con ERC e infección resuelta por VHB constituyen un reto para el nefrólogo. La reactivación del VHB puede ocurrir en cualquier momento. La monitorización del perfil hepático puede ser un buen método para la detección precoz. Siempre que no exista contraindicación médica, los pacientes anti-HBc positivos deberían iniciar DP o hemodiálisis domiciliaria para prevenir contagio masivo. El estudio molecular del VHB es muy útil para optimizar el tratamiento.