El tumor pardo (TP) en una enfermedad renal crónica (ERC), consecuencia de la enfermedad ósea renal (EOR) de alto remodelamiento, provocado por el hiperparatiroidismo (HPT) secundario (HPTS). El TP se diferencia de la osteítis fibrosa quística (OFQ), por la presencia de células multinucleadas y depósitos pardos de hemosiderina; posee una clínica, imagenología e histopatología distinta a otras enfermedades por HPT o por osteodistrofia renal1.
Se trata de un paciente masculino de 13 años de edad, procedente de una localidad rural de Loja en Ecuador; con antecedente de ERC y retraso de crecimiento simétrico; el cuadro comenzó con dolor crónico nocturno que se exacerbó por un trauma en rodilla izquierda. En la antropometría padecía de un estado ponto-estatural de baja talla, peso y emaciación severa (por debajo de la puntuación Z −3 de la mediana en las curvas de peso/edad, talla/edad e IMC/edad), se observó infantilismo sexual y en extremidades escasa masa muscular y deformidad angular en genu valgo (fig. 1).
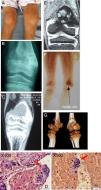
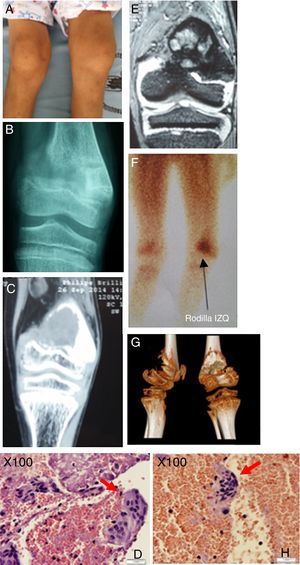
Descripción de la lesión ósea de tumor pardo en el paciente. A) Genu-varo marcado en miembro inferior izquierdo con edema leve. B) Rx AP de rodilla izquierda, fractura incompleta zona de epífisis distal de fémur izquierdo, con imagen radiopaca infiltrante. C) TC en misma zona anatómica, lesión sólida osteolítica de 40×33mm en la epífisis distal del fémur, el cartílago de crecimiento impresiona respetado. D) Muestra histológica procesada, se denota gran cantidad de células multinucleadas. E) RMN en misma zona anatómica, proceso ocupativo heterogéneo irregular metafisario con compromiso de porción ósea y de la cortical con epicentro en la porción metafisaria femoral distal de 35×33mm y con la presencia de líquido perilesional, no compromete otras estructuras. F) Estudio de gammagrafía con rastreo corporal total con 99mTc-sestaMIBI muestra captación de radiofármaco en metáfisis distal de fémur izquierdo. G) Visión tomográfica en 3 dimensiones, vista lateral y posterior de epífisis distal de fémur izquierdo. H) Identificación precisa de la célula gigante multinucleada, característica del tumor pardo óseo.
Fuente: Elaborado por Juan Miguel Alemán I; Tomado del Centro de Imágenes del Hospital José Carrasco Arteaga y Centro de Patología del Hospital José Carrasco Arteaga.
Los exámenes complementarios mostraron metabolismo fosfo-cálcico alterado (tabla 1). El examen de imagen y la biopsia obtenida a través de la aguja de Jamshidi® identificaron el TP (fig. 1).
Descripción del metabolismo fosfocálcico en el paciente
| Indicador | Valor previo a la terapia con calcitriol y diálisis | Interpretación | Valor previo a la cirugía ortopédica |
|---|---|---|---|
| A) Características del metabolismo fosfocálcico | |||
| Calcio sérico corregido con la albúmina, mg/dl | 6,1 | Hipocalcemia, mg/dl | 5,6 |
| Fósforo sérico, mg/dl | 6,3 | Hiperfosfatemia, mg/dl | 6,1 |
| Valor sérico de 1,25(OH) vitamina D3, ng/dl | 18 | Niveles séricos bajos, ng/dl | 18,3 |
| Paratohormona, pg/dl | 621 | Hiperparatiroidismo severo, pg/dl | 123 |
| Fosfatasa alcalina, U/l | 1.110 | Alta actividad osteoclástica, U/l | 250 |
| Factor de crecimiento insulínico tipo 1, ng/ml (somatomedina C) | 231 | Valores de un niño de 10, ng/ml años | 233 |
| Tasa de filtrado según la ecuación MDRD | 23ml/min/1,73m2 | Estadio funcional severo 4 de ERC | 23ml/min/1,73m2 |
| B) Características de la ERC | |
| Anemia microcítica e hipocrómica leve | |
| Azoados elevados: | |
| Urea de 125mg/dl | |
| Creatinina de 4,64mg/dl | |
| Proteinuria: | |
| Macroalbuminuria: cociente albúmina/creatinina de 301,25mg/g | |
| Proteinuria: cociente proteína/creatinina de 0,54mg/mg | |
ERC: enfermedad renal crónica; MDRD: modification of diet in renal disease.
Los aspectos destacados del tratamiento fueron calcitriol intravenoso (0,5-1μg, dosis respuesta), además diálisis; ante el descenso de la paratohormona (PTH) se procedió a la intervención ortopédica.
El comportamiento de seudoneoplasia se produce por el reemplazo de tejido óseo mineral por fibrosis y la proliferación de células multinucleares gigantes2.
Los criterios usados en el diagnóstico fueron: presencia de hipocalcemia, hiperfosfatemia y deficiencia de la 1,25(OH)3D, con relación a HPTS3,4; presencia de células gigantes multinucleadas y hemosiderina coexistentes con OFQ5; glándula tiroides y paratiroides, sin alteración estructural6; finalmente ausencia de antecedentes de corticoterapia prolongada, sus valores de PTH fueron mayores de 120pg/l y no tuvo historia de exposición alumínica, lo diferencia de una EOR de bajo remodelamiento3,4.
El dolor crónico desencadenado por trauma, muestra que el cuadro clínico es inadvertido; cuando se ubican en extremidades pueden producir periodos de prurito nocturno; en otros casos comienza con fracturas patológicas. La localización aún tiene gran controversia; en el HPTS no respeta patrón frecuente; en las extremidades, tienden a hallarse en falanges de las manos7. La localización en fémur no está reportado en la literatura. Los diagnósticos diferenciales, de acuerdo a la localización pueden ser; tumores primarios malignos: osteosarcoma, condrosarcoma y tumor de Ewing; tumores primarios benignos como el quiste aneurismático óseo; otros como: mieloma múltiple, plasmocitoma óseo solitario, granuloma de células gigantes (enfermedad de Langerhans) y displasia fibrosa poliostótica; causas infecciosas como osteomielitis multifocal y otras alteraciones producto del HPT como la osteomalacia y raquitismo7.
Los hallazgos radiográficos incluyen resorción ósea cortical subperióstica y cambios quísticos; además esclerosis ósea y calcificación extraesquelética5. En el caso, la lesión subperióstica se limitaba al hueso y no afectaba a los tejidos blandos, importante para diferenciar del osteosarcoma.
La coexistencia de TP con ERC depende proporcionalmente de la PTH, son en los estadios 4 y 5 con valores de PTH mayores a 250pg/ml, donde se presenta con mayor frecuencia7. En tanto el TP en adolescentes con ERC 4 está poco documentada, los pocos casos se refieren a niños con HPT primario5.
Por ser una condición dependiente del HPTS, el manejo está orientado en estabilizar la PTH para la posterior corrección ortopédica. En un estudio que compara 2 tratamientos: farmacológico y quirúrgico en pacientes con HPTS a ERC con la curva sigmoide de la concentración de calcio extracelular y los niveles de PTH en plasma, se vio que el calcitriol tiene efectos positivos en la fisiopatología de la OFQ8, desde 2010 se ha diseñado terapia genética, con el objetivo de actuar en la síntesis de la PTH9.
En el caso se combinó el calcitriol y hemodiálisis trisemanal. Sin embargo, la mejor medida es el trasplante renal ya que puede restaurar expresiones de los genes que codifican los receptores de VD que son sensibles al calcio en las células de una glándula paratiroides con hiperplasia de tipo nodular2.
La otra etapa del manejo fue la intervención ortopédica una vez estabilizada la PTH y consiguiendo reducir valores de 150pg/ml por mes (tabla 1). Las fracturas patológicas incompletas en el fémur tienen indicación de fijación quirúrgica e injerto óseo10.
En conclusión, la presentación atípica no solo se refiere a la localización, sino a la edad del paciente, en poblaciones pediátricas es criterio de inicio de diálisis independiente de los valores de filtrado glomerular. El pronóstico del paciente es bueno, pero se debe discutir la posibilidad de trasplante renal para evitar recaídas y aparición de nuevos TP.