La fístula arteriovenosa autóloga (FAV) en la extremidad superior según todas las guías clínicas es el acceso vascular de elección para la hemodiálisis1–3, aunque un elevado porcentaje de ellas no llegarán a madurar ni ser utilizadas (hasta un 50%)4. Por esto se han propuesto múltiples herramientas intraoperatorias para intentar predecir su permeabilidad y futura maduración, siendo el flujo postoperatorio inmediato medido mediante ecografía doppler uno de los más útiles5–9. Sin embargo, este tiene importantes limitaciones: es explorador dependiente, requiere equipos dedicados y necesita de entrenamiento para su utilización. Se ha propuesto como alternativa el uso de cámaras térmicas como método predictor de flujo y maduración, por su fácil utilización, reproducción y bajo coste. Podría ayudar a cambiar la estrategia quirúrgica en el mismo periodo intraoperatorio, y evitar que pacientes salieran del área quirúrgica con accesos destinados al fracaso.
El objetivo de nuestro estudio fue demostrar una disminución en la temperatura distal posterior a la creación de una FAV durante el postoperatorio inmediato, y una correlación negativa entre este cambio de temperatura y el flujo de esta. Realizamos un estudio observacional prospectivo en un periodo de 6 meses, incluyendo pacientes con enfermedad renal crónica etapa IV-V que fueran candidatos a la creación de una FAV nativa en nuestro centro, bajo anestesia local y sin accesos previos.
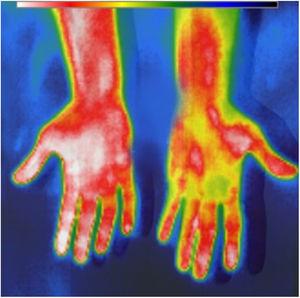
Se midió la temperatura mediante una cámara térmica portátil (fig. 1) y el flujo de la fístula mediante ecografía doppler, en el pre y postoperatorio inmediato, utilizando como control la mano no intervenida. Para el cálculo de flujo se utilizó la fórmula: Qa(ml/min)=Área en cm2 (0,785×D2, en cm2)×velocidad media (cm /s)×factor de conversión (0,06)2,3. Se realizó un análisis univariado usando test paramétricos: Chi-cuadrado y T-test para muestras apareadas para el estudio de cambio de temperaturas y flujos pre-post de cada brazo. Para la comparación de los cambios relativos de temperatura entre ambos brazos se utilizó T-test para muestras independientes.
Se obtuvieron un total de 52 pacientes, cuyas características se muestran en la tabla 1. La temperatura en la mano intervenida disminuyó 0,91°C (±2,34) posterior a la intervención (p=0,003), y el cambio relativo de temperatura entre ambas manos fue de −1,15°C (p=0,015). El flujo en la arteria humeral proximal aumentó en 621,6ml/min (±548,5; p<0,001). Se evidenció una tendencia a mayor velocidad de flujo en la FAV a menor temperatura postoperatoria en la mano, sin embargo, esta correlación no fue estadísticamente significativa (R=−0,117; p=0,418).
Características
| Características | n=52 | Porcentaje |
|---|---|---|
| Edad (años) | 67,3 | (DS±13,9) |
| Sexo | ||
| Mujer | 21 | 40,4 |
| Varón | 31 | 59,6 |
| Comorbilidades | ||
| Diálisis | 18 | 34,6 |
| Diabetes | 20 | 38,5 |
| HTA | 49 | 94,2 |
| DLP | 27 | 51,9 |
| Cardiopatía isquémica | 6 | 11,5 |
| Tratamiento | ||
| Antiagregación | 10 | 19,2 |
| Anticoagulación | 2 | 3,8 |
| FAV | ||
| Lateralidad | ||
| Izquierda | 45 | 86,5 |
| Derecha | 7 | 13,5 |
| Tipo | ||
| Distal | ||
| Radio-cefálica | 28 | 53,8 |
| Proximal | ||
| Húmero-cefálica | 20 | 38,5 |
| Húmero-basílica | 2 | 3,8 |
| Húmero-perforante | 2 | 3,8 |
DLP: dislipidemia; DS: desviación estándar; FAV: fístula arteriovenosa; HTA: hipertensión arterial.
El resto de variables analizadas, tanto demográficas, comorbilidades y las características de la fístula realizada, no se relacionaron de manera estadísticamente significativa con el cambio relativo de temperatura. Se realizó también una regresión lineal con las variables analizadas, para identificar factores pronósticos independientes que pudieran ser predictores del flujo de la FAV, quedando los cambios de temperatura excluidos como factor predictor del mismo.
A modo de discusión, sabemos que al crear una FAV se distribuye de forma preferente el flujo arterial al territorio venoso de baja resistencia en lugar del sistema arterial distal de la extremidad, debido a la mayor resistencia periférica distal, y esto podría traducirse en una disminución en la temperatura de la mano ipsilateral por hipoperfusión. Nuestros resultados tanto en la comparación de las temperaturas pre y poscirugía, como en el cambio relativo de temperatura en la mano intervenida constataron que estos cambios ya se producen de forma inmediata tras su creación. Sin embargo, no encontramos una relación entre esta disminución de temperatura y el aumento del flujo postoperatorio de la fístula que nos permitiera asociarlos y recomendar su uso como predictor de este flujo o su posterior maduración.
En un estudio previo10, también se utilizó una cámara térmica para medir la temperatura distal a la FAV (como factor binario de enfriamiento o no de la extremidad), y encontraron de forma significativa que predecían una correcta maduración y permeabilidad de la FAV con una sensibilidad del 96 y 96% y una especificidad del 68 y 69%, respectivamente. Sin embargo, no se comparó el cambio de temperatura con el flujo postoperatorio. Nuestros resultados, incluso al rehacer un análisis secundario por grupos binarios (enfriamiento o no) no apoyan esta relación (p=0,331), por lo que creemos difícil su uso como predictor de maduración, si no se relaciona de forma significativa con el flujo intraoperatorio de la fístula.
En conclusión, comprobamos que existe una disminución de la temperatura distal posterior a la creación de la fístula en la mano intervenida. Sin embargo, según nuestros resultados, este cambio no se relaciona de forma significativa en el flujo de la FAV y, por lo tanto, los cambios de temperatura son poco fiables como factor pronóstico de maduración.