Introducción: Paricalcitol, un activador selectivo de los receptores de la vitamina D, se usa con éxito en el tratamiento del hiperparatiroidismo secundario a la enfermedad renal crónica (ERC). Además, se ha propuesto que reduce la proteinuria en pacientes con ERC. Sin embargo, poco se sabe de su efecto sobre las pérdidas proteicas peritoneales en pacientes en diálisis peritoneal (DP). Objetivos: Analizar la eficacia de paricalcitol en formulación oral en el control del hiperparatiroidismo secundario en pacientes en DP y comprobar su efecto sobre las pérdidas proteicas urinarias y en el efluente peritoneal. Material y métodos: Estudio prospectivo, de 12 meses de seguimiento, sobre una cohorte de pacientes en DP. La intervención fue la introducción de paricalcitol para el tratamiento de su hiperparatiroidismo secundario. Paricalcitol se dosificó en función de la hormona paratiroidea (PTH); así, si la PTH era menor de 500 pg/ml, cada paciente recibió una cápsula de 1 mg/día; si la PTH era mayor de esa cifra, recibieron la dosis de 2 mg/día. Se analizaron datos epidemiológicos, clínicos y analíticos. Resultados: 38 pacientes (edad 56 ± 19 años, 55 % mujeres, 16 % diabéticos, tiempo en técnica 14 ± 10 meses) fueron incluidos en el estudio. Treinta y tres de ellos recibieron 1 mg/día de paricalcitol; el resto, 2 mg/día. El empleo de paricalcitol se asoció a un descenso de la PTH del 30,7 ± 6,8 % (p < 0,001) tras los 12 meses de tratamiento, sin cambios en los niveles de calcio (8,82 ± 0,96 vs. 9,02 ± 0,91; p = 0,153) y fósforo (4,78 ± 0,63 vs. 4,93 ± 0,77; p = 0,693). Los pacientes no modificaron el tratamiento concomitante con captores del fósforo a lo largo del período de estudio; tampoco cambió la dosis de cinacalcet, aunque menos pacientes precisaron su uso a la finalización del estudio. Los niveles basales de PTH fueron predictores independientes de su descenso (b = 0,689, p = 0,018), no influyendo el resto de los parámetros analizados. A lo largo del período de estudio se produjo un descenso de la proteinuria (0,79 ± 0,41 vs. 0,64 ± 0,36 g/día, p = 0,034) sin cambios en la función renal (7,2 ± 1,1 vs. 6,3 ± 0,9 ml/min, p = 0,104), en el porcentaje de pacientes que tomaba inhibidores del sistema renina angiotensina (71 vs. 68 %, p = 0,472) ni en las dosis pautadas. No hubo modificación en las pérdidas proteicas peritoneales (5,8 ± 1,9 vs. 6,0 ± 2,2 g/24 h, p = 0,731) ni en los niveles de albúmina sérica (3,7 ± 1,1 vs. 3,7 ± 1,2 g/dl, p = 0,697). Conclusiones: El uso de paricalcitol oral reduce de forma sustancial y segura los niveles de PTH en pacientes en DP. Su uso se asocia a un descenso de la proteinuria no relacionado con el descenso del filtrado glomerular ni con cambios en la medicación que pudiera modificarla. No encontramos una modificación en la cuantificación de las pérdidas proteicas peritoneales.
Introduction: Paricalcitol, a selective activator of Vitamin D receptors, is successfully used as a treatment of hyperparathyroidism secondary to chronic kidney disease (CKD). In addition, it has been proposed for reducing proteinuria in patients with CKD. Nonetheless, little is known about its effect on peritoneal protein loss in patients on peritoneal dialysis (PD). Objectives: To analyse the efficiency of oral paricalcitol in secondary hyperparathyroidism control in PD patients and to verify its effect on urinary and peritoneal effluent protein loss. Material and method: Prospective study with a 12-month follow-up on a cohort of PD patients. Invention consisted of the introduction of paricalcitol for the treatment of secondary hyperparathyroidism. Paricalcitol was dosed according to parathyroid hormone (PTH): 1mg/day for patients with PTH < 500pg/ml, and 2mg/day for those with higher PTH levels. Epidemiological, clinical and analytical data were analysed. Results: 38 patients (56 ± 19 years, 55% women, 16% diabetics, technique time (14 ± 10 months) were included in the study. Thirty-three of them received 1mg/day of paricalcitol; the rest received 2mg/day. The use of paricalcitol was associated with a PTH decrease of 30.7 ± 6.8% (P<.001) after 12 months of treatment with no changes in calcium (8.82 ± 0.96 vs. 9.02 ± 0.91; P = .153) and phosphate levels (4.78 ± 0.63 vs. 4.93 ± 0.77; P = .693). Patients did not modify treatment concurrent with phosphate binders over the study period, nor did they change the cinacalcet dosage. However, fewer patients needed it by the end of the study. The PTH baseline levels were independent indicators of its decrease (b = 0.689, P = .018), and the rest of the analysed parameters were not affected. Over the study period there was a proteinuria decrease (0.79 ± 0.41 vs. 0.64 ± 0.36g/day, P = .034) with no changes in renal function (7.2 ± 1.1 vs. 6.3 ± 0.9ml/min, P =.104). Similarly, no differences were found in in the percentages of patients taking renin-angiotensin system inhibitors (71 vs. 68 %, P = .472) or the doses needed. There was no significant change in peritoneal protein loss (5.8 ± 1.9 vs. 6.0 ± 2.2g/24h, P = .731) nor in serum albumin levels (3.7 ± 1.1 vs. 3.7 ± 1.2g/dl, P = .697). Conclusions: The use of oral paricalcitol reduces PTH levels safely and substantially in patients on PD. Their use is associated with a proteinuria decrease and is not linked to a decrease of glomerular filtration rate or changes in the medication that could modify it. We have found no modification in the amount of peritoneal protein loss.
INTRODUCCIÓN
El hiperparatiroidismo secundario (HPTS) es prácticamente universal en la población con enfermedad renal crónica (ERC) en diálisis1 y condiciona una peor supervivencia2. Con el deterioro de la ERC se reduce la síntesis de calcitriol y los niveles de calcio (Ca) sérico, con un incremento en los de fósforo (P), factor de crecimiento fibroblástico 23 (FGF-23) y hormona paratiroidea (PTH), espectro bioquímico que caracteriza el HPTS3. Estas alteraciones condicionan un aumento de las calcificaciones vasculares y del riesgo de enfermedad ósea2.
El tratamiento del HPTS se ha basado, tradicionalmente, en el control de la hiperfosforemia mediante restricción en la dieta y el uso de quelantes intestinales, de la hipocalcemia con el empleo de sales cálcicas y calcitriol y de los niveles de PTH mediante calcitriol. Posteriormente, en los primeros años del siglo XXI, se fueron introduciendo los activadores selectivos de los receptores de la vitamina D y los calciomiméticos4,5.
Las características del HPTS en diálisis peritoneal (DP) no difieren mucho de las que se muestran en aquellos pacientes en hemodiálisis, habiéndose destacado clásicamente un mejor balance de P por mejor depuración peritoneal de este6 y una mayor tendencia a la enfermedad ósea adinámica7.
Los inhibidores del sistema renina-angiotensina-aldosterona (ISRAA) se usan con éxito en el control de la presión arterial. Además, se conoce que su empleo se asocia a una reducción en la proteinuria a consecuencia de una mayor vasodilatación de la arteriola eferente glomerular, en relación con la arteriola aferente8, así como a su capacidad de reducir la inflamación, el estrés oxidativo y el remodelado de la fibra muscular lisa vascular9,10. Por todo ello, los ISRAA juegan un papel fundamental en el tratamiento de la mayoría de los enfermos renales.
Las pérdidas proteicas peritoneales en los pacientes en DP son un buen marcador de disfunción endotelial y un predictor independiente de mortalidad en pacientes en DP11,12. Se ha considerado la hipótesis de que el empleo de los ISRAA tengan un efecto beneficioso en los pacientes en DP al ser capaces de reducir las pérdidas proteicas peritoneales, por mecanismos no aclarados, pero en probable relación con la mejoría en la disfunción endotelial13,14. Sin embargo, un reciente estudio no encontró esa asociación15.
Paricalcitol, un activador selectivo de los receptores de la vitamina D, forma parte del tratamiento del HPTS, como anteriormente se comentó. Se ha comprobado que es capaz de reducir la PTH con cambios mínimos en la calcemia y fosforemia tanto en pacientes en hemodiálisis como en DP16. Por otro lado, estudios experimentales han demostrado que paricalcitol tiene un efecto inhibidor del sistema renina-angiotensina-aldosterona, al ser capaz de disminuir la expresión de renina y angiotensinógeno17.
El objetivo del presente trabajo es analizar la eficacia de paricalcitol sobre el control del hiperparatiroidismo en una amplia cohorte de pacientes en DP, investigando además su posible efecto sobre la proteinuria y las pérdidas proteicas peritoneales. Para ello, se diseñó un estudio teniendo como variable principal del análisis la evolución de la PTH. Se analizaron, como variables secundarias, la variación en la calcemia y fosforemia, la ingesta de otros fármacos relacionados con el metabolismo óseo y mineral y de ISRAA, la proteinuria y las pérdidas proteicas peritoneales.
PACIENTES Y MÉTODOS
Selección de pacientes
Se valoraron todos los pacientes en programa de DP en el Hospital Universitario Central de Asturias, tanto en modalidad continua como automatizada.
Se consideraron criterios de inclusión: 1) pacientes de ambos sexos, mayores de 18 años, 2) clínicamente estables, definido como ausencia de complicaciones que requirieran ingreso hospitalario las 8 semanas previas, 3) en programa de DP al menos 3 meses, 4) con ausencia de reacción conocida o eventual intolerancia al fármaco en estudio y 5) que estuvieran diagnosticados de HPTS, definido como un valor de PTH superior a 300 pg/ml18. Fueron excluidos aquellos pacientes con niveles de Ca superiores a 9,5 mg/dl o de P por encima de 5 mg/dl o con conocida mala adherencia al tratamiento.
Los pacientes participantes firmaron un consentimiento informado para incorporarse al estudio.
Procedimientos
La intervención consistió en la administración de paricalcitol oral durante 12 meses. La dosis inicial se determinó en función de la concentración basal de PTH, según lo descrito en la literatura19. Se eligió una pauta de administración diaria, de forma que aquellos pacientes con niveles de PTH inferiores a 500 pg/ml recibieron 1 mg una vez al día, mientras que aquellos individuos con PTH por encima de 500 pg/ml recibieron 2 mg diarios. Las variaciones posteriores en la dosificación se basaron en la evolución de los valores de PTH y Ca. Si el descenso en los niveles de PTH era menor del 15 %, se doblaba la dosis; si la reducción oscilaba entre el 15 y el 60 %, se mantenía, y si era mayor del 60 %, se reducía la dosis a la mitad. Por otro lado, si la calcemia superaba los 10,2 mg/dl, se reducía la dosis a la mitad y, si superaba los 10,5 mg/dl, se suspendía la administración de paricalcitol. A los pacientes que previamente estaban recibiendo calcitriol se les sometió a un período de lavado de 4 semanas para evitar interferencias que pudieran alterar los resultados. Aquellos pacientes que por cualquier razón no concluyeron el período de estudio se analizaron por intención de tratar.
Determinaciones bioquímicas
La analítica general, incluyendo los niveles séricos de Ca total y de P, se midió con autoanalizador siguiendo los procedimientos del laboratorio del hospital. Los valores de Ca referidos en el presente estudio se expresan como Ca total sin corregir con los niveles de proteínas o albúmina séricas. La determinación de la PTH se llevó a cabo mediante electroquimioluminiscencia (EQL Elecsys® PTH, de Roche) y se corrigieron los resultados con el coeficiente 0,97 para expresarlos como IRMA NICHOLS según las guías K/DOQI20. La función renal se determinó mediante el aclaramiento de creatinina con recogida de orina de 24 horas.
Cronograma
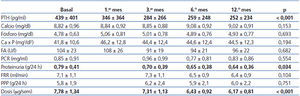
Antes del inicio se realizaron una anamnesis y un examen físico, junto a una analítica general. Se hizo además un registro de la medicación prescrita al paciente, con especial énfasis en aquellos fármacos comúnmente utilizados en el control del metabolismo óseo y mineral y en los ISRAA. Mensualmente fueron registradas las posibles incidencias y efectos adversos que pudieran estar relacionados con la medicación a estudio. Al inicio del estudio y al 1.er, 3.er, 6.° y 12.° mes se determinaron los niveles séricos de PTH, proteinuria y las pérdidas proteicas peritoneales, y se registraron los cambios en la medicación.
Análisis estadístico
Las variables continuas se expresaron como media y desviación típica si seguían una distribución normal y como mediana y rango intercuartílico cuando no la tenían; previamente se había empleado el test de Kolmogorov-Smirnov para ver si seguían una distribución normal. Las variables categóricas se expresaron como porcentaje. Para analizar la evolución de los parámetros del estudio durante el período de estudio, se utilizó el modelo lineal general con medidas repetidas. Los cambios porcentuales se compararon mediante t Test o U de Mann-Whitney, según procediera. Para las correlaciones univariadas, se empleó la r de Pearson. Para conocer los mejores predictores de respuesta al tratamiento, se aplicó un modelo de regresión lineal. Se utilizó el paquete estadístico SPSS® 15.0 para Windows (SPSS Inc, Chicago, IL) para el análisis de los resultados.
RESULTADOS
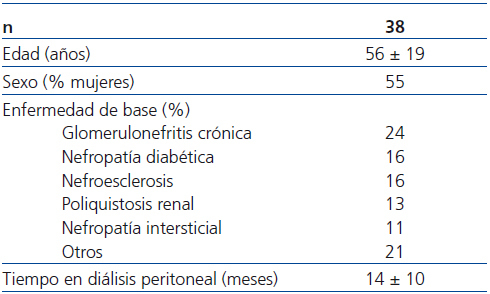
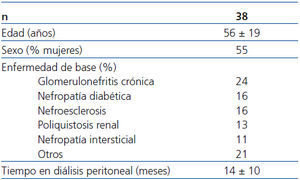
Del total de pacientes valorados para el estudio, 38 cumplieron los criterios de inclusión y exclusión, y fueron los finalmente incluidos. En la tabla 1 se exponen las características basales de la población. La dosificación inicial fue la siguiente: 33 pacientes recibieron 1 mg diario de paricalcitol, mientras que los 5 pacientes restantes recibieron 2 mg diarios. Trece pacientes estaban tomando previamente calcitriol oral, que fue suspendido para iniciar la administración de paricalcitol; los 25 restantes fueron considerados naïve. El período de seguimiento medio fue de 10,8 ± 0,9 meses. Dos pacientes fallecieron y otros dos recibieron trasplante, por lo que abandonaron el estudio de forma prematura. Ningún paciente abandonó el estudio por efectos adversos asociados a la toma de paricalcitol; uno de ellos precisó la asociación de un inhibidor de la bomba de protones por molestias gástricas.
Efectividad del tratamiento
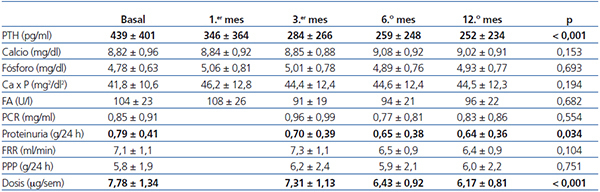
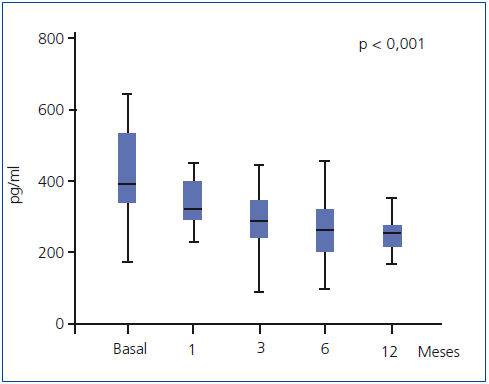
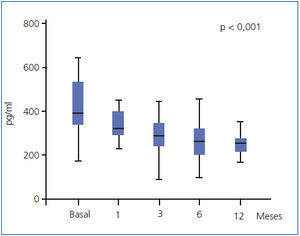
El empleo de paricalcitol oral se asoció a un descenso de los niveles de PTH (figura 1). Porcentualmente, el mayor descenso se produjo en las primeras 4 semanas del tratamiento (22,1 ± 2,4 %, p < 0,001), mientras que a continuación se produjo una reducción menor en los niveles, para acabar a los 12 meses con un descenso de 30,7 ± 6,8 %. No encontramos variaciones significativas en cuanto a los niveles séricos de Ca ni P a lo largo del período de estudio ni tampoco episodios de hipercalcemia o hiperfosforemia que motivaran descensos y suspensión de la medicación a estudio (tabla 2). No encontramos diferencias en el descenso de PTH al analizar por separado a aquellos pacientes que recibían previamente calcitriol oral y los que fueron naïve (29,6 ± 2,5 vs. 30,8 ± 3,2 % a los 12 meses de tratamiento). Mediante regresión lineal analizamos los posibles predictores independientes del descenso de la PTH y encontramos que únicamente los valores basales de PTH influían en la respuesta al tratamiento (b = 0,689 [intervalo de confianza –IC– 95 % = 0,067-0,223], p = 0,018).
La eficacia en el descenso de la PTH permitió un descenso de la dosis de paricalcitol, que pasó de una media de 8,03 mg/semana al inicio del estudio a 5,94 mg/semana a los 6 meses y 5,32 mg/semana a los 12 meses.
Respecto al resto de los tratamientos implicados en el control de los parámetros relacionados con el metabolismo óseo y mineral, apenas hubo diferencias en cuanto al porcentaje de pacientes que recibían quelantes, tanto cálcicos (30 vs. 28 %) como no cálcicos (lantano 32 vs. 29 %, sevelamer 38 vs. 39 %) entre el inicio y la finalización del estudio. Sí que apreciamos una discreta disminución en la dosis de Ca administrada (1664 ± 346 vs. 1571 ± 333 mg/día) y aumento en la dosificación de lantano (1575 ± 325 vs. 1875 ± 425 mg/día) y sevelamer (2222 ± 245 vs. 2455 ± 238 mg/día). Respecto al empleo de cinacalcet, se redujo su uso, del 21 al 16 % de los pacientes, con un mantenimiento de la dosis media (30 vs. 28 mg/día). No hubo modificaciones en cuanto a la concentración de Ca en el líquido de diálisis a lo largo del seguimiento.
Evolución de la función renal y la proteinuria
Durante el año de seguimiento a estos pacientes, se produjo un descenso del 19 % en la proteinuria (0,79 ± 0,41 vs. 0,64 ± 0,36 g/24 horas; p = 0,034) sin cambios en la función renal (7,1 ± 1,1 vs. 6,3 ± 0,9 ml/min; p = 0,104) (tabla 2). No hubo modificación en cuanto a la dosis de fármacos ISRAA ni el porcentaje de pacientes que los tomaban (71 vs. 68 %; p = 0,472), que pudieran haber influido en la reducción de la proteinuria. No encontramos diferencias en los cambios en la proteinuria al analizar por separado a aquellos pacientes que recibían previamente ISRAA o no (18,83 vs. 19,62; p = 0,622). Al analizar los predictores independientes de dicho descenso, encontramos una correlación entre los descensos de la proteinuria y de la PTH (b = 0,454 [IC 95 % = 0,326-0,823], p = 0,007), no viéndose influenciada por la variación en la función renal.
Evolución de las pérdidas proteicas peritoneales
A lo largo del período de seguimiento, no se modificaron las pérdidas proteicas peritoneales (5,8 ± 1,9 vs. 6,0 ± 2,2 g/día; p = 0,731) por el efluente, así como tampoco observamos variación en cuanto a los niveles séricos de albúmina (3,7 ± 1,1 vs. 3,7 ± 1,2 g/dl; 0 = 0,697). No encontramos diferencias al analizar por separado a aquellos pacientes que recibían fármacos ISRAA o no.
DISCUSIÓN
Presentamos los datos de este estudio, donde se confirma la eficacia de paricalcitol en el tratamiento del HPTS en pacientes en DP. Además, se comprueba su capacidad de reducir la proteinuria, incluso en pacientes bajo tratamiento renal sustitutivo, aunque no se observa que sea capaz de disminuir las pérdidas proteicas peritoneales.
Ross16 describió, por primera vez, el efecto de paricalcitol oral sobre el control del hiperparatiroidismo en una cohorte de 26 pacientes (y otros 62 en hemodiálisis), a los que siguió durante 26 semanas. Comprobó un descenso de en torno al 30 % en la PTH con solo 3 semanas de tratamiento, con una leve disminución desde entonces hasta el fin del estudio. No se apreciaron cambios en los niveles de Ca ni P ni tampoco en la toma de quelantes del P. De este estudio, llama la atención las dosis elevadas de paricalcitol que recibieron los pacientes. Recientemente, Coronel21 comunicó un descenso aún más llamativo (en torno al 60 % al mes de tratamiento y al 70 % a los 3 meses) con unas dosis similares a las nuestras. Nuestro estudio representa el de mayor número de pacientes incluidos hasta ahora y con un mayor tiempo de seguimiento. Parece claro el efecto de paricalcitol sobre el control de la PTH, con un descenso superior al 30 %. Una de las limitaciones a la activación de los receptores de la vitamina D para el control del hiperparatiroidismo es el incremento en los niveles séricos de Ca y P por el aumento de su absorción intestinal mediante el tránsito citosólico de la célula intestinal tras la síntesis de proteínas transportadoras de Ca y calbindinas. Paricalcitol ha demostrado tener una menor capacidad de promover la expresión de dichas proteínas22. En nuestro estudio (tampoco en los anteriormente referidos en pacientes en DP), ningún paciente tuvo que suspender la medicación del estudio por episodios de hipercalcemia.
La proteinuria es un factor de progresión independiente de deterioro del filtrado glomerular23. Además, sabemos que aquellos tratamientos capaces de reducir la proteinuria tienen un efecto nefroprotector, enlenteciendo la progresión del daño renal24. En los pacientes en DP, el mantenimiento de la función renal residual no solo contribuye de forma decisiva a conseguir un adecuado aclaramiento de moléculas25, sino que parece que también influye en la supervivencia de la técnica y del paciente26,27. Por ello, toda estrategia encaminada a su preservación debería ser bienvenida. Los ISRAA son fármacos comúnmente utilizados en el tratamiento de los pacientes nefrológicos no solo por su eficacia en el control de la presión arterial, sino por otros efectos coadyuvantes, como la reducción de la proteinuria y su efecto nefroprotector8-10,24. Fishbane28 y de Zeeuw29 demostraron que paricalcitol tenía un efecto antiproteinúrico en pacientes con distintos estadios de ERC, tanto diabéticos como no. En una población en DP21, la administración de paricalcitol se asoció a un descenso de la proteinuria de alrededor del 15 %. En nuestro estudio, pudimos comprobar como la administración de paricalcitol se asoció a un descenso en la proteinuria cercana al 20 % a los 6 meses de tratamiento, sin cambios destacados posteriormente, hasta la finalización del estudio. Esta reducción podría ser una de las justificaciones del mantenimiento de la función renal residual, que no se modificó de forma significativa durante el estudio. Una posible explicación al efecto antiproteinúrico de paricalcitol es que se piensa que tiene un efecto inhibidor del sistema renina-anigiotensina-aldosterona. Deb17 comprobó como la administración de paricalcitol a una cohorte de ratas que recibían losartán inducía una reducción en la expresión de renina y angiotensinógeno, y concluyó que el activador selectivo de los receptores de la vitamina D tenía un efecto inhibidor del sistema, actuando en los escalones superiores de esta cascada enzimática. De esta probable actuación se podrían desprender otros efectos beneficiosos que se están otorgando a paricalcitol, como son la reducción de la hipertrofia del ventrículo izquierdo30 o del proceso aterogénico31.
Existe una controversia en cuanto al papel de los inhibidores del sistema renina-angiotensina-aldosterona en la reducción de las pérdidas proteicas peritoneales en pacientes en DP. Hoy en día, consideramos que la disfunción endotelial juega un papel fundamental en la iniciación del proceso aterosclerótico32, tanto en sujetos sanos33 como en aquellos con hipertensión34 o diabetes35. Dado que es el endotelio el que regula la permeabilidad vascular, se ha propuesto que la pérdida de proteínas por la orina sea debida a la presencia de un endotelio dañado a nivel glomerular36. Algo parecido se ha sugerido a la hora de explicar la pérdida proteica a nivel del peritoneo11. Son interesantes las asociaciones que se han encontrado entre las pérdidas proteicas peritoneales y el mayor riesgo de desarrollar enfermedad vascular periférica11, eventos cardiovasculares o una mayor mortalidad37. Se ha demostrado la capacidad de los inhibidores del sistema renina-angiotensina-aldosterona de mejorar la disfunción endotelial y por ello reducir la microalbuminuria y la morbimortalidad de origen cardiovascular38. Respecto a su capacidad de reducir las pérdidas proteicas peritoneales, irbesartán13 y candesartán14 han demostrado ser capaces de reducirlas, en pequeñas series de pacientes. Sin embargo, Zhuo15 no encontró dicha capacidad al analizar la evolución de 156 pacientes tratados con inhibidores del sistema, aunque se achacó, en parte, a las bajas dosis farmacológicas que recibían. En nuestro estudio, valoramos la capacidad de paricalcitol para reducir las pérdidas proteicas por el peritoneo. A pesar de que a paricalcitol se le han otorgado propiedades antiinflamatorias39 e inhibidoras del sistema renina-angiotensina-aldosterona17, no evidenciamos cambios en las pérdidas proteicas. Nuestros datos no están en consonancia con los recientemente publicados por Coronel40, quien analiza las pérdidas proteicas peritoneales en 23 pacientes en DP tratados con paricalcitol, encontrándose un descenso en ellas de en torno al 15 %. Alguna explicación a los hallazgos encontrados por nosotros podría ser que las dosis utilizadas no son elevadas (como en el caso de Zhou o de Coronel), que las poblaciones estudiadas son bastante diferentes (nuestros pacientes son más jóvenes y el porcentaje de diabéticos es muy significativamente menor, menor tiempo en programa de DP), que el estudio no estuviera específicamente dirigido a analizar este aspecto o que los pacientes ya estuvieran recibiendo de forma mayoritaria otro inhibidor del sistema renina-angiotensina que hubiera ya saturado el efecto reductor de las pérdidas peritoneales.
En conclusión, la utilización de paricalcitol en pacientes de DP es eficaz en el control del HPTS y seguro, al no condicionar hipercalcemia ni hiperfosforemia, ni producir efectos adversos que conlleven al abandono del tratamiento. Se consigue además una reducción en la proteinuria, no relacionada con variaciones en la función renal ni con cambios en el empleo de fármacos que pudieran modificarla, que podría tener un efecto beneficioso sobre la función renal residual. Que este descenso en la proteinuria tenga alguna influencia sobre la función renal residual o sobre el riesgo cardiovascular necesitará de estudios prospectivos controlados que exploren esta hipótesis, de la misma forma que nuevos estudios con mayor número de pacientes y especialmente diseñados para ello nos ayudarán a conocer el efecto real del uso de paricalcitol sobre las pérdidas proteicas peritoneales.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características basales de la población
Tabla 2. Evolución de los parámetros analíticos y la dosis de paricalcitol administrada
Figura 1. Evolución de los valores de hormona paratiroidea (expresados como mediana y rango intercuartílico).