Las patologías renal y cardíaca asociadas son de alta prevalencia en la población en diferentes contextos clínicos: fracaso renal agudo en el contexto de insuficiencia cardíaca (IC) descompensada, pacientes con IC que desarrollan enfermedad renal crónica (ERC) o pacientes con ERC que desarrollan IC. En los últimos años se ha descrito el síndrome cardiorrenal (SCR) como el deterioro de la función renal en el contexto de IC. Sin embargo, existen otras situaciones clínicas en las que la Nefrología puede aportar su conocimiento como parte de la estrategia de tratamiento integral, como es el caso de la IC refractaria (ICR). Todas estas situaciones obligan a un trabajo conjunto interdisciplinario entre cardiólogos y nefrólogos con el fin de proporcionar un tratamiento integral. Este documento pretende hacer una revisión del papel del nefrólogo en el tratamiento de la IC haciendo hincapié en el subgrupo de pacientes con ICR y la evidencia actual de la utilidad de la diálisis peritoneal (DP) como tratamiento crónico coadyuvante.
Associated renal and cardiac diseases have a high prevalence among the population in several clinical contexts: acute renal failure in the context of decompensated heart failure (HF), HF patients who develop chronic kidney disease (CKD) and patients with CKD who develop HF. In recent years, cardiorenal syndrome has been described as deteriorating kidney function in the context of HF. However, there are other clinical situations for which nephrologists can contribute their knowledge as a part of an integral treatment strategy, as is the case with refractory HF (RHF). All of these situations require an interdisciplinary cooperative effort between cardiologists and nephrologists with the aim of providing integral treatment. This article aims to review the role of the nephrologist in HF treatment, with an emphasis on the subgroup of patients with RHF and current evidence regarding the usefulness of peritoneal dialysis (PD) as a chronic coadjuvant treatment.
INTRODUCCIÓN
La IC es un trastorno progresivo crónico con una incidencia y prevalencia en aumento originada por el envejecimiento de la población y la innovación en el tratamiento de los pacientes con patologías coronarias e hipertensivas, que son sus causas principales. La IC supone una de las mayores causas de morbimortalidad en la población general, además de ocasiona altos índices de hospitalización y readmisión hospitalaria1, y a pesar de los avances realizados en su tratamiento, la tasa de mortalidad global a 8 años alcanza el 80%.2 Entre las estrategias de tratamiento, los diuréticos son la herramienta más útil para eliminar el exceso de fluidos. Sin embargo, la insuficiencia cardiaca refractaria (ICR) al tratamiento convencional es una patología en aumento1. La IC es un problema de salud pública, y se estima en 23 millones de personas la prevalencia mundial. En EE.UU. afecta al 2,3% de la población y la incidencia aumenta en la población anciana2,3. En Europa la prevalencia en pacientes de edades comprendidas entre 70 y 80 años es del 10-20% y en España es la principal causa de hospitalización en mayores de 65 años4,5. En EE.UU. cada año se diagnostican 550.000 nuevos casos, en 2003 fue la causa de un millón de hospitalizaciones y de 57.000 muertes, y su coste en el 2005 fue de 27,9 billones de dólares2,3,6. La ICR no es infrecuente, se estima que en EE.UU. la presentan entre 50.000 y 200.000 pacientes y su supervivencia es menor al 50% a 6 meses7.
La disfunción renal es una patología común en pacientes con IC, con una prevalencia del 36-50% y hasta un 25% de pacientes con ERC tienen el diagnóstico de IC, cifra que se incrementa hasta un 64% ente los pacientes que inician diálisis8-10. Además, es frecuente observar episodios de deterioro agudo de la función renal durante las etapas de descompensación de la IC11.
INSUFICIENCIA CARDÍACA. CLASIFICACIÓN, FISIOPATOLOGÍA Y FACTORES PRONÓSTICOS
La IC es la consecuencia de diversas enfermedades que afectan al tejido cardíaco. Existen dos escalas de clasificación, la de la New York Heart Association (NYHA), que está basada en síntomas y actividad física, y la diseñada por el American College of Cardiology/American Heart Association (ACC/AHA), basada en anormalidades estructurales del tejido cardíaco (tabla 1)4,12.
En la fisiopatología de la IC participan diversos mecanismos hemodinámicos, neurohormonales e inmunológicos, que también afectan a la función renal2. La coexistencia de IC y ERC es deletérea para ambas y se asocia con un aumento en la celeridad de la aterosclerosis, alteración en la regulación del volumen intravascular e inadecuada compensación de mecanismos regulatorios, lo que finalmente lleva a la morbimortalidad13. Ambas comparten un grupo de factores de riesgo en común como la hipertensión arterial (HTA), diabetes mellitus (DM) y la aterosclerosis14. En la IC el factor disparador es el bajo gasto cardíaco que conduce a activación del sistema renina-angiotensina-aldosterona (SRAA) y del sistema nervioso simpático (SNS), a alteración en el equilibrio del óxido nítrico y a la liberación de hormona antidiurética. Todos ellos producen vasoconstricción sistémica y retención de sodio y agua (efecto antidiurético y antinatriurético). Este último es el que ocasiona la sobrecarga progresiva de volumen, contribuye a los mayores síntomas relatados por los pacientes, desencadena la principal causa de hospitalización y tiene un efecto en la progresión de la IC15. Asimismo, diversos factores inflamatorios participan en el daño progresivo al tejido renal y cardíaco9. El bajo gasto cardíaco conlleva baja perfusión renal y, además, el tratamiento farmacológico utilizado en la IC con diuréticos e inhibidores del SRAA puede empeorar la función renal, en especial durante los episodios de descompensación de la IC o cuando existe disfunción renal previa6,16. El Síndrome cardiorrenal (SCR) aparece por el empeoramiento en la IC que lleva a insuficiencia renal (IR) ocasionando sobrecarga hídrica, resistencia al efecto de diuréticos y desarrollando, por último, ICR al tratamiento1. Son dos las situaciones que favorecen la resistencia renal al efecto diurético: el estado de hipervolemia secundaria a la retención de líquidos y sodio, y la azoemia secundaria a hipoperfusión renal15.
TRATAMIENTO DE LA INSUFICIENCIA CARDÍACA
Existen diversas alternativas para el tratamiento de la IC. En la figura 1 se exponen los objetivos de la terapia. El tratamiento estándar incluye antagonistas del SRAA, betabloqueantes, diuréticos convencionales y digitálicos. Uno de los pilares fundamentales en el tratamiento de la IC es el control en el equilibrio de sodio y agua. El 80% de las hospitalizaciones en casos de IC se deben a descompensaciones agudas y la mayoría de estos pacientes ingresan por sobrecarga hídrica y sólo un 5% por bajo gasto cardíaco2. Muchos pacientes responden al tratamiento estándar, pero el uso de diuréticos no siempre es efectivo. La mortalidad para este grupo de pacientes es próxima a un 75% en el siguiente año5.
Se considera IC terminal al grupo de pacientes con IC no candidatos a trasplante cardíaco a quienes sólo se les puede ofrece tratamiento paliativo. Los síntomas en ICR se atribuyen en especial a la retención de sodio y agua. La respuesta a los diuréticos se ve alterada por una serie de factores, que oscilan entre el 65 y el 70%17. Además, algunos estudios han demostrado una asociación entre algunas clases de diuréticos y la mortalidad. El estudio SOLVD refirió una asociación entre diuréticos no ahorradores de potasio y aumento en el riesgo de hospitalización y mortalidad18. El reto en el tratamiento de los pacientes con ICR con el fin de mejorar síntomas, disminuir continuas hospitalizaciones y tratar de mejorar su supervivencia ha llevado a desarrollar nuevas terapias para mejorar la contractilidad miocárdica (fármacos inotrópicos y vasodilatadores, terapias de resincronización, soporte circulatorio mecánico, etc.). Sin embargo, no se ha avanzado mucho en la principal causante de la sintomatología de estos pacientes que es la sobrecarga hídrica. La refractariedad al tratamiento diurético ha llevado al uso de nuevas estrategias para la excreción y/o eliminación del exceso de sodio y agua y es ahí donde el nefrólogo puede desempeñar un papel fundamental.
TRATAMIENTOS ALTERNATIVOS PARA MEJORAR LA EXCRECIÓN DE SODIO Y AGUA
Entre ellos se incluye el uso de antagonistas del receptor de vasopresina, péptidos natriuréticos, antagonistas del receptor de adenosina y técnicas de ultrafiltración (UF)19,20.
Los antagonistas del receptor de vasopresina (vaptanes), cuyo objetivo farmacológico es inhibir los receptores V2 del segmento colector medular parecen ser, en teoría, una estrategia adecuada para inducir diuresis acuosa, disminuir la sobrecarga hídrica y mejorar la hiponatremia. Hay estudios que han demostrado su utilidad reduciendo el peso, corrigiendo la hiponatremia y disminuyendo la mortalidad14. Por el contrario, el estudio EVEREST, con más de 4.000 pacientes reclutados, que comparó pacientes tratados con tolvaptán más tratamiento estándar frente a sólo tratamiento estándar, no observó diferencias en morbimortalidad (mejoría de la clase funcional, disminución en reingresos hospitalarios, disminución de la mortalidad)21.
Los péptidos natriuréticos, en teoría, inducen vasodilatación, natriuresis y supresión del SRAA e inhibición del SNS y, entre ellos, se han ensayado el péptido natriurético cerebral recombinante (nesiritide) y el ularitide (urodilantina). En el caso de nesiritide, los metaanálisis no han demostrado ningún beneficio teórico en mejoría de función renal e incluso se ha observado un aumento en mortalidad20.
TÉCNICAS DE ULTRAFILTRACIÓN
El registro nacional de IC descompensada refiere que el 42% de los pacientes son dados de alta sin resolución de su sintomatología y hasta el 70% con inadecuada pérdida de peso, lo que genera altas tasas de readmisión hospitalaria9,22. Esta situación ha llevado a utilizar técnicas de UF en situaciones agudas y crónicas de IC con el fin de eliminar el exceso de fluidos, incluyendo la diálisis peritoneal (DP). La UF extracorpórea fue propuesta por Silverstein en 1974 como una modificación al circuito de hemodiálisis. Desde 1979 se han publicado diversos trabajos utilizando esta técnica para el tratamiento de pacientes con ICR23. Ha sido propuesto como un método alternativo en el tratamiento de pacientes con descompensaciones agudas, y se ha observado una rápida mejoría de los síntomas, disminución en la tasa de reingreso, disminución del edema pulmonar y periférico, mejoría en la clase funcional, restauración de la respuesta a diuréticos y disminución de citoquinas proinflamatorias circulantes2,24-26. Sin embargo, otros estudios han demostrado la aparición de episodios frecuentes de hipotensión, el aumento en la necesidad de tratamiento diurético, la falta de recuperación de la función renal, anemia e infecciones asociadas al catéter2,24. El estudio multicéntrico (UNLOAD), que incluyó a 200 pacientes con IC descompensada aguda que fueron aleatorizados para recibir diuréticos por vía intravenosa o UF extracorpórea temprana, comunicó una disminución de peso y una pérdida de líquidos mayor, así como una menor incidencia de reingresos en el grupo de UF, pero no se observó diferencia en los niveles de creatinina y en la mortalidad27. En el mercado existe un dispositivo portátil para UF que se puede utilizar incluso en el domicilio con entrenamiento previo23. No cabe duda de que la UF extracorpórea, aunque no tenga impacto en la mortalidad, es una herramienta adicional en el tratamiento de los pacientes con descompensación aguda de la IC.
DIÁLISIS PERITONEAL: UNA ALTERNATIVA DE TRATAMIENTO EN INSUFICIENCIA CARDÍACA REFRACTARIA
La DP puede ser una opción de tratamiento crónico de la ICR,6 con algunas ventajas frente a la hemodiálisis (HD) para tratar estos pacientes, como son la mayor preservación de la función renal residual (FRR), UF continua, mayor estabilidad hemodinámica, mejor aclaramiento de moléculas de mediano tamaño, cribado de sodio con mantenimiento de normonatremia y menor inflamación sistémica2. La DP también favorece el aclaramiento de moléculas inflamatorias como interleuquina 1 (IL-1) y factor de necrosis tumoral (TNF) que desempeñan un papel importante en la progresión de la IC (depresores miocárdicos)2,28. La DP, como técnica de UF en ICR, fue descrita en 1949 por Schneierson29 y después se ha utilizado tanto en descompensaciones agudas de IC como en el tratamiento continuado de pacientes con IC crónica. Las modalidades terapéuticas empleadas han ido variando, desde la DP intermitente (DPI) inicial hasta la DP continua ambulatoria (DPCA), DPA y uso de nuevas soluciones como la icodextrina2.
Diálisis peritoneal intermitente
Múltiples publicaciones han referido que el tratamiento con DP de forma aguda en pacientes con IC descompensada da como resultado una disminución de edemas, mejoría de la sintomatología clínica, normalización de la natremia, disminución de la presión de enclavamiento pulmonar, restauración de la respuesta a los diuréticos e, incluso, mejoría del filtrado glomerular6. Mailloux, en un grupo de 15 pacientes, observó una mejoría en la respuesta a diuréticos en 12 casos, disminución de peso (promedio 5,2 kg) y mejoría del gasto cardíaco30. Shapira comunicó su experiencia con 10 pacientes, observando reducción del peso, mejoría en la sintomatología clínica, aumento de diuresis con respuesta a diuréticos y normalización en los niveles de sodio. Estas ventajas se vieron contrarrestadas por la necesidad de tratamiento hospitalario y por la alta tasa de peritonitis por bacterias gramnegativas descrita31. También se ha descrito la aparición de hipotensión arterial por rápida UF1. Las dificultades técnicas de la DPI realizada de forma aguda hacen que generalmente se prefieran los métodos de UF extracorpórea como terapia de rescate en pacientes con ICR hospitalizados sin respuesta a diuréticos6,32.
Diálisis peritoneal crónica (diálisis peritoneal continua ambulatoria y diálisis peritoneal ambulatoria)
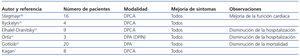
El papel de la DP crónica en el tratamiento a largo plazo de pacientes con ICR no ha sido formalmente evaluado en grandes estudios clínicos y los datos que se tienen hasta la fecha son sobre todo de series pequeñas6. Los primeros casos publicados eran pacientes con ICR y ERC no terminal tratados con DPCA33-37. El número de pacientes incluidos era pequeño y la duración del tratamiento varió entre 5 y 24 meses. Los resultados fueron casi unánimes en mejoría de la sintomatología clínica, de la clase funcional y en la disminución en la frecuencia de hospitalizaciones, aunque también se observó una alta tasa de peritonitis sin impacto en la mortalidad. A partir de la década de 1990 se empieza a emplear la DPA. En esta fase, además de confirmarse la mejoría clínica, se observan una disminución en la mortalidad esperada a un año y una mejoría en los parámetros cardiovasculares como fracción de eyección (FE) y presión arterial sistólica pulmonar2,6,7. En la tabla 2 se recogen los datos más importantes de estos estudios en los que, además, los problemas relacionados con la técnica, como las peritonitis, disminuyeron de forma importante7,38-42. El estudio prospectivo de Gotloib es el que incluye mayor número de pacientes y sus principales resultados están referidos en la tabla 342. En este estudio, al igual que en otros, los pacientes fueron tratados inicialmente con UF extracorpórea para estabilizarlos durante la descompensación aguda y posteriormente iniciaron la DP crónica. Esta técnica también ha sido utilizada como puente para el tratamiento posterior con trasplante cardíaco, o incluso en pacientes no candidatos al mismo (IC terminal) como tratamiento paliativo43. Actualmente no existen estudios que comparen el tratamiento con DP frente a la no utilización de una técnica de UF de forma crónica.
Oportunidades relacionadas con la solución de icodextrina
La icodextrina es un polímero de glucosa de alto peso molecular que genera una presión oncótica prolongada que permite una mayor UF durante tiempos de permanencia prolongados. El uso de soluciones en DP con icodextrina, comparadas con soluciones de glucosa, se ha relacionado con menor generación de productos de degradación de la glucosa (PDG), menor inflamación intraperitoneal, menor absorción sistémica de glucosa, disminución de las alteraciones del metabolismo de carbohidratos y lípidos y mayor UF con largas permanencias6. Estas características la convierten en una solución ideal para el tratamiento de pacientes con ICR, incluso utilizando un solo intercambio nocturno,1 aunque los estudios existentes son aún escasos. Bertoli utilizó un intercambio nocturno de icodextrina en 2 pacientes no urémicos con clase funcional NYHA III-IV. La UF diaria obtenida osciló entre 500 y 1.000 ml, observándose una mejoría de la clase funcional, un aumento de la FE (del 22 al 27% y del 25 al 50%) y una mejoría de la función renal, sin necesidad de hospitalización durante el tiempo de seguimiento44. El grupo español de Díez ha publicado su experiencia con 5 pacientes con ICR y ERC no terminal. En 3 casos utilizaron un único intercambio con icodextrina y en los restantes emplearon tratamiento clásico con DPCA con icodextrina nocturna. El período de seguimiento osciló entre 5 y 19 meses, observando mejoría en la clase funcional en todos los pacientes y disminución en la tasa de hospitalización (promedio de 139 días/año antes de la terapia a 12 días/año después de iniciarla). Un paciente incrementó su FE del 35 al 45% y dos tuvieron una disminución de la presión sistólica pulmonar, aumentando el filtrado glomerular en un caso45. Más recientemente, Basile ha publicado sus resultados en 4 pacientes tratados con un intercambio de icodextrina nocturna, y uno con icodextrina nocturna más un intercambio de glucosa al 1,36%, seguidos entre 11 y 43 meses. En todos los casos hubo mejoría de la clase funcional y disminución en la hospitalización y aumento del volumen urinario en algún caso. Los pacientes no presentaron peritonitis durante el tiempo de seguimiento46. A pesar de estos resultados prometedores, son pocas las revisiones de terapia de la ICR que recomiendan el uso de este tipo de terapias coadyuvantes en el tratamiento crónico de pacientes con ICR47.
PROPUESTA DE ESTUDIOS FUTUROS
A la luz de la medicina basada en la evidencia y con el objetivo de extraer conclusiones que ayuden a responder a algunos de estos interrogantes sería recomendable iniciar diversos estudios prospectivos en pacientes con ICR y ERC no terminal:
1. Estudios comparativos de pacientes tratados con DP frente a tratamiento estándar evaluando beneficios en supervivencia, calidad de vida, morbilidad y coste-beneficio.
2. Estudios comparativos de pacientes tratados con DP frente a tratamiento estándar y observar el impacto sobre las enfermedades de base: preservación de función renal y retraso en la progresión de la IC.
3. Estudios comparativos de pacientes tratados con diferentes estrategias de DP: icodextrina nocturna diaria y DPA con icodextrina diurna, para evaluar la repercusión en la morbimortalidad y las complicaciones relacionadas con la técnica.
4. Estudios comparativos de pacientes tratados con DP frente al empleo de nuevas estrategias terapéuticas en la eliminación de líquidos (vaptanes) y observar los resultados de morbimortalidad y costes para la salud pública.
CONCEPTOS CLAVE
1. La ICR es una situación frecuente dentro del grupo de pacientes con IC. Esta situación lleva a un deterioro importante de la clase funcional con una alta tasa de hospitalización por las frecuentes descompensaciones.
2. Los pacientes con IC frecuentemente tienen disfunción renal asociada que contribuye a la refractariedad del tratamiento diurético.
3. Las diferentes modalidades de la DP (DPCA o DPA) constituyen una terapia adyuvante para el tratamiento de pacientes con ICR, mejorando la clase funcional y disminuyendo la tasa de hospitalización.
4. Las soluciones de DP con icodextrina permiten tratar a los pacientes con ICR con un único intercambio nocturno, lo que facilita el tratamiento y disminuye las complicaciones relacionadas con la técnica.
Tabla 1. Clasificación de la insuficiencia cardíaca
Tabla 2. Estudios publicados en los que se utiliza la diálisis peritoneal crónica en el tratamiento de la insuficiencia cardíaca congestiva
Tabla 3. Características de los pacientes con insuficiencia cardíaca refractaria antes y después del tratamiento con DPA (tres sesiones semanales de 8 horas)42
Figura 1. Objetivos del tratamiento en la insuficiencia cardíaca