La osteoporosis (OP) y la enfermedad renal crónica (ERC) influyen independientemente en la salud ósea. Numerosos pacientes con ERC presentan una disminución de densidad mineral ósea (DMO), un elevado riesgo de fracturas por fragilidad ósea y un incremento de su morbimortalidad. Con el envejecimiento de la población estos hechos no son dependientes solo de la «osteodistrofia renal» sino también de la OP asociada. Dado que la DMO tiene capacidad predictiva en pacientes con ERC (parteI), ahora analizaremos las implicaciones terapéuticas derivadas. Análisis post hoc de estudios aleatorizados han mostrado que fármacos como alendronato, risedronato, raloxifeno, teriparatida o denosumab tienen una eficacia comparable a la población general en pacientes con una disminución leve-moderada del filtrado glomerular (especialmente ERC-3). Estos estudios tienen limitaciones, pues incluyen mayoritariamente mujeres «sanas», sin diagnóstico conocido de ERC y habitualmente con parámetros normales de laboratorio; sin embargo, también existen datos positivos preliminares en estadios más avanzados (ERC-4) y más limitados en ERC-5D. Por todo ello, al menos en ausencia de alteraciones significativas del metabolismo mineral (i.e., hiperparatiroidismo severo), el beneficio potencial de dichos fármacos debería ser considerado en pacientes que presenten un riesgo de fractura elevado o muy elevado. Es novedad importante que las nuevas guías no condicionan su uso a la práctica de una biopsia ósea previa y que el beneficio/riesgo de estos fármacos podría estar justificado. Sin embargo, debemos considerar que la mayoría de estudios no son consistentes y tienen un bajo grado de evidencia, por lo que la indicación farmacológica (riesgo/beneficio) debe ser individualizada y prudente.
Osteoporosis (OP) and chronic kidney disease (CKD) both independently affect bone health. A significant number of patients with CKD have decreased bone mineral density (BMD), are at high risk of fragility fractures and have an increased morbidity and mortality risk. With an ageing population, these observations are not only dependent on “renal osteodystrophy” but also on the associated OP. As BMD predicts incident fractures in CKD patients (partI), we now aim to analyse the potential therapeutic consequences. Post-hoc analyses of randomised studies have shown that the efficacy of drugs such as alendronate, risedronate, raloxifene, teriparatide and denosumab is similar to that of the general population in patients with a mild/moderate decline in their glomerular filtration rate (especially CKD-3). These studies have some flaws however, as they included mostly “healthy” women with no known diagnosis of CKD and generally with normal lab test results. Nevertheless, there are also some positive preliminary data in more advanced stages (CKD-4), even though in CKD-5D they are more limited. Therefore, at least in the absence of significant mineral metabolism disorders (i.e. severe hyperparathyroidism), the potential benefit of these drugs should be considered in patients with a high or very high fracture risk. It is an important change that the new guidelines do not make it a requirement to first perform a bone biopsy and that the risk/benefit ratio of these drugs may be justified. However, we must also be aware that most studies are not consistent and the level of evidence is low. Consequently, any pharmacological intervention (risk/benefit) should be prudent and individualised.
La osteoporosis (OP) y la enfermedad renal crónica (ERC) aumentan con el envejecimiento de la población, condicionando un aumento exponencial de la incidencia de fracturas y sus consecuencias1-4. Hemos descrito que la ERC y las alteraciones del metabolismo óseo-mineral (CKD-MBD por su acrónimo inglés) están también asociadas a un envejecimiento acelerado5, y en la primera parte de esta revisión1 hemos mostrado que, especialmente en estadios tempranos de ERC sin anormalidades bioquímicas importantes de CKD-MBD, el riesgo de fractura podría estar más condicionado por la OP «primaria» (posmenopáusica y senil) que por la propia «osteodistrofia renal» (ODR). De hecho, la incidencia de fracturas no parece haber disminuido en los últimos años a pesar de las evidentes mejorías en el tratamiento del hiperparatiroidismo y/o la hiperfosfatemia6. Aunque existen datos que muestran que corregir dichas alteraciones puede disminuir el riesgo de fractura7, los estudios no son suficientes y es necesario valorar el resto de factores de riesgo a los que está sometida esta población. Por todo ello, insistimos en que el nefrólogo no puede obviar la importancia de la valoración del riesgo de fractura, tal como se recomienda para la población general1,2.
Si bien las guías clínicas abordan este tema8,9 (tabla 1), los nefrólogos no valoran sistemáticamente el diagnóstico y el tratamiento de la OP en pacientes con ERC. Una posible explicación es el condicionamiento terapéutico a la práctica de una biopsia ósea en pacientes con filtrado glomerular (FG)<30ml/min/1,73m28, esencialmente indicada para descartar la presencia de una enfermedad ósea adinámica (EOA) u osteomalacia (donde los fármacos antirresortivos no estarían indicados). Sin embargo, las nuevas guías KDIGO2017 (implementadas por las KDOQI americanas) anteponen la medición de la densidad mineral ósea (DMO) (guía 3.2.1) a la práctica de biopsia ósea (guía 3.2.2)10,11 (tabla 1) y afirman que la incapacidad de biopsiar no debería impedir el uso de terapias antirresortivas, al menos en algunos pacientes10,11, con el fin de evitar una actitud nihilista ante un problema importante1,2,4. En esta segunda parte, y en espera de estudios prospectivos más amplios específicos en la ERC, revisaremos la evidencia existente sobre los tratamientos destinados a incrementar la DMO y prevenir el riesgo de fracturas, así como el riesgo/beneficio asociado al uso de dichos fármacos en la población con ERC.
Comparación de guías KDIGO-CKD-MBD sobre densidad mineral ósea (DMO) y osteoporosis (OP) en pacientes con enfermedad renal crónica (ERC)
| KDIGO 2009 | KDIGO 2017 | Razonamientos y reflexiones |
|---|---|---|
| En pacientes con ERC estadios 1-2 con OP y/o alto riesgo de fractura, por criterios de la Organización Mundial de la Salud, recomendamos manejo como el de la población general (evidencia 1A). En pacientes con ERC estadio 3 con PTH en el rango normal y OP y/o alto riesgo de fractura, por criterios de la Organización Mundial de la Salud, sugerimos tratamiento como el de la población general (evidencia 2B) | En pacientes con ERC estadios 1-2 con OP y/o alto riesgo de fractura, por criterios de la Organización Mundial de la Salud, recomendamos manejo como el de la población general (guía 4.3.1, evidencia 1A). En pacientes con ERC estadio 3a-3b con PTH en el rango normal y OP y/o alto riesgo de fractura, por criterios de la Organización Mundial de la Salud, sugerimos tratamiento como el de la población general (guía 4.3.2, evidencia 2B) | Sin cambios |
| En pacientes con ERC estadios 3-5D, con evidencia de CKD-MBD, sugerimos que NO se practique de modo rutinario la medición de la DMO porque la DMO NO predice el riesgo de fractura como en la población general y la DMO NO predice el tipo de osteodistrofia renal (guía 3.2.2, evidencia 2B) | En pacientes con ERC estadios 3a-5D con evidencia de CKD-MBD o factores de riesgo para OP, debería medirse la DMO para evaluar el riesgo de fractura si los resultados pudieran afectar las decisiones terapéuticas (guía 3.2.1, evidencia 2B) | Múltiples estudios prospectivos nuevos han documentado que una DMO baja por DEXA predice fracturas incidentes en pacientes con ERC estadios 3a-5D. El orden de estas recomendaciones (DMO vs biopsia ósea) ha cambiado puesto que el resultado de la medición de la DMO por DEXA podría tener impacto sobre la decisión de hacer una biopsia ósea |
| En pacientes con ERC estadios 3-5D sería razonable hacer una biopsia ósea en varias circunstancias, incluyendo, pero no limitándose a: fracturas inexplicables, dolor óseo persistente, hipercalcemia-hipofosfatemia inexplicadas, posible toxicidad por aluminio y antes de terapia con bisfosfonatos en pacientes con CKD-MBD (guía 3.2.1, nivel de evidencia no graduado) | En pacientes con ERC estadios 3a-5D es razonable hacer una biopsia ósea si el conocimiento del tipo de osteodistrofia renal pudiera afectar las decisiones terapéuticas (guía 3.2.2 nivel de evidencia no graduado) | La motivación primaria de esta revisión fue la experiencia creciente sobre los fármacos para la OP en pacientes con ERC, DMO disminuida y alto riesgo de fractura. La incapacidad de hacer una biopsia ósea podría no justificar el retardar o descartar retener la terapia antirresortiva en pacientes con un alto riesgo de fracturas. Se comenta que hasta ahora los estudios en pacientes con ERC no han mostrado definitivamente que los bisfosfonatos causen EOA y que las preocupaciones en pacientes con ERC son más teóricas que basadas en la evidencia. Este hecho es particularmente relevante por el envejecimiento de la población general, en que las fracturas por fragilidad, la reducción del FG y la disminución de la DMO son todas altamente prevalentes |
| En pacientes con ERC estadio 3 con anormalidades bioquímicas de CKD-MBD y DMO disminuida y/o fracturas por fragilidad sugerimos que las opciones de tratamiento deberían tener en cuenta la magnitud y la reversibilidad de las alteraciones bioquímicas y la progresión de la ERC, considerando una biopsia ósea (guía 4.3.3, evidencia 2D) | En pacientes con ERC estadio 3a-5D con anormalidades bioquímicas de CKD-MBD y DMO disminuida y/o fracturas por fragilidad sugerimos que las opciones de tratamiento deberían tener en cuenta la magnitud y la reversibilidad de las alteraciones bioquímicas y la progresión de la ERC, considerando una biopsia ósea (guía 4.3.3, evidencia 2D) | Las recomendaciones previas de biopsia ósea antes del tratamiento con terapias antirresortivas u otros tratamientos para la OP se extienden de la ERC estadio 3 a la ERC estadios 3a-5D solamente si el conocimiento del tipo de osteodistrofia renal pudiera afectar decisiones terapéuticas |
| En pacientes con ERC estadio 4-5D con anormalidades bioquímicas de CKD-MBD y DMO disminuida y/o fracturas por fragilidad, sugerimos investigación adicional con una biopsia ósea antes del tratamiento con agentes antirresortivos (guía 4.3.4, evidencia 2C) | Ídem |
El objetivo final en el tratamiento de la OP es la prevención de las fracturas y sus consecuencias12. En 2017 se publicó un consenso español con diferentes especialistas en el que se consideraron objetivos adecuados («treat to target») la ausencia de nuevas fracturas, la reducción del riesgo de fractura (FRAX®) y el aumento de la DMO (T>−2,5 para columna y T>−2,5/−2,0 para cuello femoral)13. Para ello se consideran importantes (tabla 2) los cambios en el estilo de vida como hábitos dietéticos saludables, incrementar la actividad física y el ejercicio (yoga, taichí, baile…), disminuir el alcohol y la abstinencia tabáquica14,15. También es imprescindible tomar medidas para prevenir caídas, fundamentalmente en pacientes de edad avanzada, deterioro cognitivo y funcional, caídas previas, hipotensión ortostática o consumo de psicotropos (incluyendo antihistamínicos y opiáceos)12,14-16. La OP y la sarcopenia (osteosarcopenia) es una asociación bien documentada en pacientes frágiles17. Otras acciones importantes son corregir déficits visuales y auditivos, así como adecuar el entorno físico14,17-19. Aproximadamente el 30% de los >65años sufren una caída al año, y el 40% entre los >80años; de estas caídas, un 5% ocasionarán una fractura15. Todas estas acciones deberían ser también implementadas en pacientes con ERC5.
Medidas generales no farmacológicas en el tratamiento de pacientes con osteoporosis
| Dieta adecuada |
| Aumento de la actividad física general |
| Ejercicio relacionado con mantenimiento de equilibrio (yoga, taichí, baile…) |
| Disminuir (o evitar) la ingesta de alcohol |
| Abstinencia tabáquica |
| Prevención de caídas: |
| Evitar episodios de hipotensión e hipotensión ortostática |
| Evitar consumo de psicótropos (incluyendo antihistamínicos y opiáceos) |
| Corregir déficits visuales y auditivos |
| Medidas de seguridad en el hogar (evitar desorden, alfombras, superficies deslizantes, etc.) |
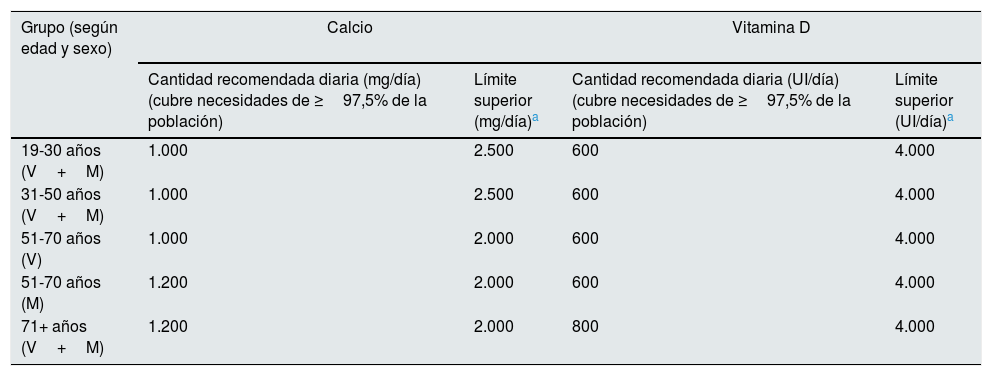
Las guías clínicas destinadas a la población general recomiendan la suplementación de calcio y vitaminaD como complemento al tratamiento en pacientes con OP18. La deficiencia de calcio puede predisponer a largo plazo a OP, pero es un error creer que la pérdida de DMO relacionada con la edad o la menopausia puede evitarse simplemente con el suplemento de calcio19-22. Es más, los suplementos aislados de calcio (sin vitaminaD) podrían incluso aumentar el riesgo de fractura de cadera22. Otras asociaciones negativas descritas de su uso indiscriminado son el incremento del riesgo de nefrolitiasis, arritmias y riesgo cardiovascular, aunque estos resultados son poco concluyentes o contradictorios1,5,14,19,21,23,24. El consumo de un aporte excesivo de calcio exógeno en adultos puede ser especialmente perjudicial en pacientes con ERC (o ERC «oculta»)10,25,26, especialmente en presencia de hipercalcemia, hipoparatiroidismo relativo (hormona paratiroidea [PTH] normal o baja en ERC), EOA, pacientes tratados con warfarina y/o con calcificaciones cardiovasculares8,10. Por ello, un enfoque razonable es alentar preferiblemente como primera medida un consumo apropiado de calcio en la dieta27-29, exposición solar diaria prudente y no utilizar rutinariamente la suplementación farmacológica10,14,18,25,26,28 ni los captores cálcicos10. Las dosis recomendadas para la población general estarían en torno a los 1.000-1.200mg/día28 (tabla 3), en función del paciente y de la edad, pero deben tenerse también en cuenta las recomendaciones o limitaciones dietéticas establecidas para el manejo del metabolismo mineral en función del estadio de ERC9,10,25,26.
Ingesta alimentaria de referencia para calcio y vitamina D en adultos (según edad y sexo) para la población general
| Grupo (según edad y sexo) | Calcio | Vitamina D | ||
|---|---|---|---|---|
| Cantidad recomendada diaria (mg/día) (cubre necesidades de ≥97,5% de la población) | Límite superior (mg/día)a | Cantidad recomendada diaria (UI/día) (cubre necesidades de ≥97,5% de la población) | Límite superior (UI/día)a | |
| 19-30 años (V+M) | 1.000 | 2.500 | 600 | 4.000 |
| 31-50 años (V+M) | 1.000 | 2.500 | 600 | 4.000 |
| 51-70 años (V) | 1.000 | 2.000 | 600 | 4.000 |
| 51-70 años (M) | 1.200 | 2.000 | 600 | 4.000 |
| 71+ años (V+M) | 1.200 | 2.000 | 800 | 4.000 |
M: mujeres; UI: unidades internacionales; V: varones.
El límite superior indica el nivel por encima del cual hay riesgo de eventos adversos. No supone un objetivo de tratamiento, pues no hay evidencia de un beneficio mayor a niveles superiores a la cantidad recomendada diaria. En pacientes con ERC, el límite superior de calcio sugerido para la población general sobrepasa en mucho la capacidad de tampón del paciente con disminución del filtrado glomerular, por lo que se deberían evitar estas cantidades máximas con las que se produciría acumulación indeseable de calcio25,26. Por lo tanto, deberemos tener también cuenta las recomendaciones o limitaciones dietéticas establecidas para el manejo del metabolismo mineral en función del estadio de ERC9,10,25,26.
Fuente: Institute of Medicine (IOM)28. Adaptado de Ross et al.28.
La sobrecarga de fósforo (con efectos directos e indirectos sobre la fragilidad ósea)4 también debería evitarse en pacientes con ERC, sobre todo el fósforo procedente de alimentos procesados, fácilmente absorbible10. El uso de captores de fósforo basados en calcio se ha asociado a un aumento de la progresión de calcificaciones vasculares10,30, aunque su restricción no ha demostrado definitivamente un aumento de la supervivencia31. Sin embargo, trabajos recientes prospectivos como COSMOS32,33, metaanálisis34,35 y las nuevas guías KDIGO201710 enfatizan la necesidad de restringirlos.
La deficiencia de vitaminaD es muy frecuente en pacientes con ERC, pero el uso de la vitaminaD nativa (i.e., colecalciferol) en ERC tampoco está claramente establecido10,36,37. Las guías españolas actuales recomiendan la suplementación de vitaminaD nativa si los niveles de calcidiol (25-OH vitamina D) son inferiores a 20-30ng/ml9,38,39. Las dosis recomendadas para la población general están en torno a las 600-800UI/día28 (tabla 3) y de unas 1.000UI/día para pacientes con OP. La suplementación con vitaminaD nativa, incluso en pacientes en diálisis, mejoraría la mineralización ósea, aunque con un efecto limitado en la reducción de la PTH4,22. Estos suplementos (incluido el calcifediol [calcidiol], frecuentemente utilizado en España) se deben administrar a dosis bajas con monitorización frecuente de calcio y fósforo. Es importante remarcar también que la vitaminaD nativa en posología diaria y en pacientes con déficit de vitaminaD podría contribuir modestamente a aumentar la fuerza muscular y a disminuir el riesgo de caídas28,39-42. Sin embargo, se ha publicado recientemente un metaanálisis en el que no se observa menor riesgo de fractura con el uso de calcio, vitaminaD o ambos en 51.145 individuos de la población general >50años no institucionalizados43. Los resultados de este estudio no son aplicables a pacientes con OP, con otras enfermedades metabólicas o a los que toman medicaciones protectoras del hueso, como ha sido destacado recientemente por la American Society for Bone and Mineral Research43b.
De este modo, múltiples estudios demuestran que la probabilidad de respuesta inadecuada a otros fármacos para la OP es mayor en pacientes con niveles de calcidiol <20-30ng/ml44,45, y que la corrección del déficit de vitaminaD también es necesaria para prevenir casos, no infrecuentes, de osteomalacia46 (p.ej., en pacientes con niveles bajos de calcio, calcidiol y/o fósforo, frecuentemente con fosfatasa alcalina desproporcionadamente elevada, con dolor óseo importante o múltiples fracturas)4,46,47.
Por último, y junto a la restricción de fósforo, el uso de metabolitos activos de la vitaminaD (p.ej., calcitriol, paricalcitol) ha sido uno de los pilares clásicos del tratamiento del hiperparatiroidismo secundario y/o la ODR de alto recambio (±calcimiméticos en pacientes en diálisis); no obstante, existe todavía debate sobre su uso apropiado en pacientes con ERC10,11,36,37. Los derivados de la vitaminaD son los únicos fármacos indicados específicamente para el control del hiperparatiroidismo secundario antes del inicio de diálisis48,49; se han asociado a un aumento de la supervivencia50,51 y se sugiere usarlos de modo juicioso para evitar hipercalcemia, hiperfosfatemia o una excesiva supresión de la PTH9,52,53.
El uso de colecalciferol, ergocalciferol, calcifediol, alfacalcidol y/o calcitriol podría ser efectivo (aunque no plenamente demostrado), junto a bisfosfonatos, en pacientes con exposición prolongada a corticoides14,54.
Fármacos antirresortivos para el tratamiento de la osteoporosisBisfosfonatosLos bisfosfonatos son análogos estructurales del pirofosfato inorgánico, regulador de la remodelación ósea55 (tabla 4). Por ello, los bisfosfonatos tienen una alta afinidad por el hueso al unirse a los cristales de hidroxiapatita (con una vida media variable en el esqueleto que podría ser de hasta 10años)55,56. Frenan la resorción ósea al inhibir la actividad de los osteoclastos y, por distintos mecanismos, inducen apoptosis de todas las células óseas55,57.
Comparación de agentes antirresortivos y anabólicos para el tratamiento de la osteoporosis en pacientes con enfermedad renal crónica
| Características generales | Potenciales ventajas |
|---|---|
| Agentes antirresortivos | |
| Bisfosfonatos | |
| Estructura P-C-P, similar al P-O-P del pirofosfato nativo (análogo del pirofosfato inorgánico) | Barato y fácilmente disponible en todo el mundo |
| Se acumula en hueso independientemente de la función renal, pero aumenta su depósito (debido a la prolongación de su vida media) cuando se reduce el aclaramiento renal | Aumento de la DMO y disminución de fracturas en pacientes con ERC antes de diálisis en análisis post hoc, pero con alto riesgo de sesgo |
| Al permanecer unidos al hueso tienen efecto residual tras su retirada (ventaja e inconveniente). De hecho, se aconsejan «vacaciones terapéuticas» tras un período de tratamiento | Potencial atenuación de la progresión de la calcificación vascular (beneficios descritos en calcifilaxis) |
| Riesgo potencial de EOA y toxicidad sistémica | |
| No recomendado en mujeres fértiles, sexualmente activas, sin control anticonceptivo efectivo | |
| Potencial absorción intestinal disminuida (baja biodisponibilidad) e interacciones medicamentosas (captores de fósforo, calcio, entre otras) | |
| Denosumab | |
| Anticuerpo monoclonal inhibidor del eje OPG/RANK/RANKL por bloqueo de RANKL | No aclaramiento renal |
| Precio más elevado | Gran aumento de DMO tras cortos períodos de tratamiento |
| Riesgo potencial de EOA | Aumento de la DMO y disminución de fracturas en pacientes con ERC antes de diálisis en análisis post hoc, pero con alto riesgo de sesgo |
| Hipocalcemia e hiperparatiroidismo de rebote; necesidad de monitorización en ERC avanzada | Menores efectos secundarios renales y raramente asociado a fracturas atípicas |
| No recomendado en mujeres fértiles, sexualmente activas, sin control anticonceptivo efectivo | Vida media más corta que los bisfosfonatos y efectos reversibles, pero requeriría terapia indefinida (o terapia secuencial), cambiando a un SERM (mujeres) o bisfosfonatos orales a menor dosis |
| Datos inadecuados sobre infecciones en pacientes inmunodeprimidos (p.ej., infecciones del tracto urinario, cutáneas), aunque no se ha descrito mayor incidencia de infecciones oportunistas | |
| Inyección subcutánea cada 6 meses | |
| Agentes anabólicos | |
| Teriparatida | |
| Secuencia 1-34 N-terminal de la PTH humana recombinante | No aclaramiento renal |
| Riesgo de hipercalcemia | Aumento de la masa y recambio óseo, no riesgo de EOA; de hecho, es indicación potencial para la EOA |
| Muy caro (precio cuadruplicado en la última década) y de uso limitado en el tiempo (2 años) por riesgo de osteosarcoma | Aumento de la DMO y disminución de fracturas en pacientes con ERC antes de diálisis en análisis post hoc, pero con alto riesgo de sesgo |
| Inyección subcutánea diaria | |
| Romosozumab | |
| Anticuerpo monoclonal contra la esclerostina | No aclaramiento renal |
| Aun en estudios en fase III en la población general | Gran aumento de DMO tras cortos períodos de tratamiento |
| Potenciales efectos indeseables cardiovasculares poco conocidos | Aumento de la masa y recambio óseo, no riesgo de EOA; de hecho, podría ser indicación potencial para la EOA |
| No aprobado por la FDA | |
Los bisfosfonatos son fármacos de primera elección en el tratamiento actual de todos los tipos de OP, sustentado en los años de experiencia clínica, en múltiples indicaciones en diferentes tipos de alteraciones óseas metabólicas y en su bajo coste58-61. La dificultad de absorción en las presentaciones orales (alendronato, risedronato) y el riesgo de esofagitis condicionan que su toma se realice en ayunas, con agua, en posición erguida y requieran esperar 30min antes de una nueva ingesta. En las guías KDIGO2009 (tabla 1) se sugería que los pacientes con ERC estadios1-2 con OP y/o alto riesgo de fractura, estadio3 y PTH en el rango normal, siguieran el mismo tratamiento indicado en la población general8. De hecho, los pacientes con ERC estadios1-3 suelen tener pocas anormalidades identificables del metabolismo mineral, compartiendo los mismos factores de riesgo que la población general62. Por otra parte, en pacientes con ERC estadio 3 con anormalidades bioquímicas propias de CKD-MBD y disminución de la DMO y/o fracturas por fragilidad se sugerían otros factores para la elección del tratamiento8 (tabla 1). Finalmente, en ERC estadios4-5D se sugería investigación adicional con una biopsia ósea antes de terapia con agentes antirresortivos8.
Hoy sabemos que con el deterioro de la función renal la prevalencia de OP aumenta63, y especialmente en estadios4-5D otros factores casi universales (ODR, acidosis metabólica, hipovitaminosisD, exceso de FGF23, hiperparatiroidismo, resistencia esquelética a la PTH…) complican el diagnóstico de OP basado en DMO. A pesar de que la biopsia ósea sea el único método que permite excluir otras alteraciones en presencia de ERC avanzada, existe un creciente consenso en que basar los tratamientos para OP en la necesidad de una biopsia ósea podría limitar inadmisiblemente el tratamiento en pacientes que presentan un riesgo muy elevado de fractura. Los bisfosfonatos parecen prevenir la pérdida de DMO en la ERC64-66 pero no han probado su efectividad en la reducción del riesgo de fracturas, por lo que se aconseja un uso prudente e individualizado (riesgo/beneficio)2,62,67.
Las guías para la población general (aplicables a pacientes con ERC leve sin alteraciones significativas del metabolismo mineral)5,14 proponen iniciar tratamiento con bisfosfonatos orales en situaciones como las indicadas en la tabla 5. Por otra parte, también en la población general se indica reevaluar el riesgo de fractura por DMO 2 o 3años tras el inicio del tratamiento. En un reciente trabajo de consenso14 FRAX® +DMO son también considerados conjuntamente como objetivos adecuados. Los pacientes que están recibiendo bisfosfonatos y que ya no presentan un alto riesgo de fractura son potenciales candidatos a «vacaciones terapéuticas»13,14,68. Por el contrario, en los pacientes con una DMO con T<−2,5 en cuello femoral, antecedente de fracturas y T<−2.0 en cuello femoral, o antecedentes familiares de fractura por fragilidad, los bisfosfonatos orales se podrían extender hasta 10años, dado que el beneficio sería probablemente mayor que los riesgos asociados14,68. Si tras ese periodo la situación de riesgo perdura, estaría indicada la transición a otro fármaco (terapia secuencial)14.
Indicaciones de tratamiento con bisfosfonatos en la población general en distintas guías, posiblemente aplicables a pacientes con ERC sin alteraciones significativas del metabolismo mineral y con riesgo de enfermedad ósea adinámica poco probablea
| a) Pacientes con antecedentes de fractura de cadera o vertebral |
| b) Pacientes que presentan una DMO (T-score ≤−2,5 DE) —indicada por cualquier motivo— en cadera o columna |
| c) DMO en rango de osteopenia (T-score entre −1,0 y −2,5 SD, especialmente si ≤−2,0) y al menos dos factores asociados a elevado riesgo de fractura (tabla1, parteI)2,118 |
| d) Pacientes con osteopenia y una probabilidad a 10años de fractura de cadera ≥3% o una probabilidad a 10años de fractura osteoporótica ≥7,5-20% (según países y basado en FRAX®)2,12,37,118 |
| e) En un trabajo reciente se consideraban pacientes con muy alto riesgo de fractura aquellos con T≤2,5 y una o más fracturas vertebrales moderadas o severas; o una T≤2,0 y dos o más fracturas vertebrales moderadas o severas, o una fractura de fémur proximal130 |
Es sabido que los pacientes con riesgo de EOA son fundamentalmente aquellos en diálisis peritoneal, diabéticos, mayores o malnutridos en los que destaca especialmente la presencia de hipoparatiroidismo relativo (niveles de PTH bajos o relativamente bajos a los esperados para su grado de ERC)52. En pacientes en diálisis estos niveles se han establecido indudablemente en valores de PTH intacta <2X, el límite alto de la normalidad para el ensayo utilizado. Por otra parte, la combinación de PTH intacta y fosfatasa alcalina (especialmente su fracción ósea) proporciona el mayor poder predictivo para el diagnóstico diferencial entre enfermedad ósea de alto o bajo recambio en otros casos (p.ej., PTH<200pg/ml y fosfatasa alcalina ósea <20ng/ml)4,47,52. En estos pacientes no estaría indicado el uso de agentes antirresortivos y se debería valorar la posibilidad de una biopsia ósea antes de indicarlos (o para indicar un tratamiento anabólico), al igual que ante una sospecha de osteomalacia (mencionada en el texto) o posibles intoxicaciones por aluminio u otros metales.
El motivo de estas limitaciones temporales está vinculado fundamentalmente a dos efectos adversos: la osteonecrosis de mandíbula (ONM) y las fracturas atípicas de fémur (subtrocantéreas-diafisarias). Además de una predisposición individual, se han asociado a la comorbilidad (principalmente neoplásica), al uso de vía intravenosa (i.e., zoledronato), a altas dosis, a exposición prolongada o a coadministración con glucocorticoides68-70. El riesgo de ONM se estima en 1/10.000 y <1-100.000 pacientes-año14,15,69, y se asocia además a pobre higiene bucal, historia de procedimientos dentales y al uso de dentadura postiza55. El riesgo de fracturas atípicas de fémur parece estar más asociado a una predisposición individual en pacientes con OP que propiamente con el tratamiento, dada la falta de asociación con dosis acumuladas14,70,71. En población general se ha calculado que para cada fractura atípica acontecida en un paciente tratado se habrían evitado unas 50-100fracturas de cadera, centenares de fracturas vertebrales y no vertebrales y, consecuentemente, el incremento de la mortalidad asociada a las mismas14,15.
Finalmente, la inhibición de la actividad osteoclástica inducida por bisfosfonatos ha generado la duda respecto a la posibilidad de generar un «hueso adinámico» por excesiva supresión del remodelado óseo y, por tanto, menor capacidad para la reparación de microfracturas y mayor fragilidad esquelética55,72,73. Al menos en población general, se ha demostrado que el beneficio de disminuir las fracturas supera este riesgo potencial68. De todos modos, en perros tratados con altas dosis de bisfosfonatos se ha observado un incremento de microfracturas74, y un estudio reciente mostró menos porosidad pero más microfracturas en los huesos fracturados de pacientes tratados con bisfosfonatos comparados con pacientes con fractura no tratados o controles sanos75. Sin embargo, biopsias de cresta ilíaca realizadas tras 5-10años de tratamiento no parecen mostrar sobresupresión del remodelado óseo76-78 o, en otros trabajos, no se ha observado aumento de microfracturas79,80. Merecen consideración las respuestas positivas (aunque no constantes) al tratamiento con teriparatida (anabolizante) en pacientes con fractura de fémur atípica previamente tratados con bisfosfonatos. Por todo ello, la duración óptima de la terapia con bisfosfonatos debería ser individualizada en función de los factores de riesgo del paciente, y aunque el riesgo parece bajo incluso en tratamientos hasta 10años68,77, queda pendiente valorar el riesgo/beneficio del uso extendido en pacientes de bajo riesgo o pacientes con ERC5,81.
En cuanto a los bisfosfonatos en la ERC, es bien conocida la contraindicación de los bisfosfonatos intravenosos con aclaramientos de creatinina por debajo de 30ml/min y que estos pueden producir diversos tipos de daño renal82,83. Sin embargo, en un análisis post hoc de los ensayos clínicos con alendronato y risedronato oral que incluyeron pacientes con disminución del FG (ERC estadios3-4), durante un máximo de 3años, no hubo diferencias en la aparición de efectos renales adversos64,65. Dado que los bisfosfonatos pueden potencialmente acumularse en el hueso de los pacientes con ERC avanzada84,85 (tabla 4), las KDIGO 2009 sugerían la práctica previa de una biopsia ósea antes de su uso en ERC4-5 (tabla 1)8. Como se comenta en las KDIGO2017, esta afirmación se sustentó en un estudio transversal de 13 pacientes con ERC estadios2-4 a los que se les practicó una biopsia ósea tras un período variable de tratamiento con bisfosfonatos (4 a >60meses), siendo todos ellos diagnosticados de EOA84. Además, Coco et al.86 mostraron que 6/6 pacientes con trasplante renal funcionante tratados con pamidronato intravenoso (con una frecuencia de administración muy superior a la habitual) presentaron EOA vs 3/8 en los controles, si bien las alteraciones óseas pretrasplante se desconocían. Adicionalmente, solo 14/72 pacientes fueron biopsiados, por lo que es difícil extrapolar estos datos. Actualmente la prevalencia de EOA está en aumento52,84,87, e incluso podría preceder a la enfermedad de alto recambio durante la evolución de la ERC88,89. El envejecimiento, la diabetes, la sobrecarga de calcio, la malnutrición, la inflamación y el hipoparatiroidismo relativo (niveles de PTH bajos o relativamente bajos) son factores de riesgo de EOA que deberían tenerse en cuenta antes de la indicación de bisfosfonatos52,84,90. De hecho, todos ellos tienen advertencias o contraindicaciones respecto a su uso en pacientes con ERC con aclaramientos de creatinina <30-35ml/min).
Sin embargo, desde las guías KDIGO 20098 diversos análisis han demostrado que la DMO sí predice el riesgo de fractura en pacientes con ERC91-94. Otros análisis post hoc de grandes ensayos aleatorizados (alendronato, risedronato) centrados en el tratamiento de la OP posmenopáusica han descrito que estos fármacos tienen una eficacia comparable en pacientes (especialmente mujeres) con ERC (la mayoría en estadios3-4), mejorando la DMO y reduciendo el riesgo de fracturas64,65(tabla 6). Por ello, al menos en ausencia de anormalidades significativas en el metabolismo óseo mineral, el uso de bisfosfonatos y otros fármacos aprobados para el tratamiento de la OP podrían ser apropiados en pacientes con niveles de creatinina «normales» y un FG disminuido2,10,11,64,65. De este modo, en la actualización de las KDIGO201710 (tabla 1) la necesidad de una biopsia ósea previa no es obligada en pacientes con ERC avanzada. De hecho, se considera que no se ha demostrado de modo fehaciente que los bisfosfonatos causen EOA y que la experiencia acumulada con fármacos antirresortivos permitiría considerar su uso aun sin biopsia10. Así, la «dificultad» de practicar y diagnosticar histomorfométricamente una biopsia no justificaría el nihilismo terapéutico en pacientes con un alto riesgo de fractura10. Más allá de las guías, debemos reconocer que otros análisis resaltan que no se han mostrado efectos beneficiosos consistentes más allá de la DMO, y que no existe evidencia absoluta sobre la disminución del riesgo de fractura o la calcificación vascular67 (tabla 6). Este último aspecto es también motivo de consideración dada la importante relación hueso-vaso95-97 y su potencial efecto incluso beneficioso98. A nivel experimental y clínico (en pequeños estudios en pacientes en diálisis) se ha descrito que algunos bisfosfonatos podrían disminuir la progresión de las calcificaciones vasculares o ser efectivos en pacientes con calcifilaxis99,100.
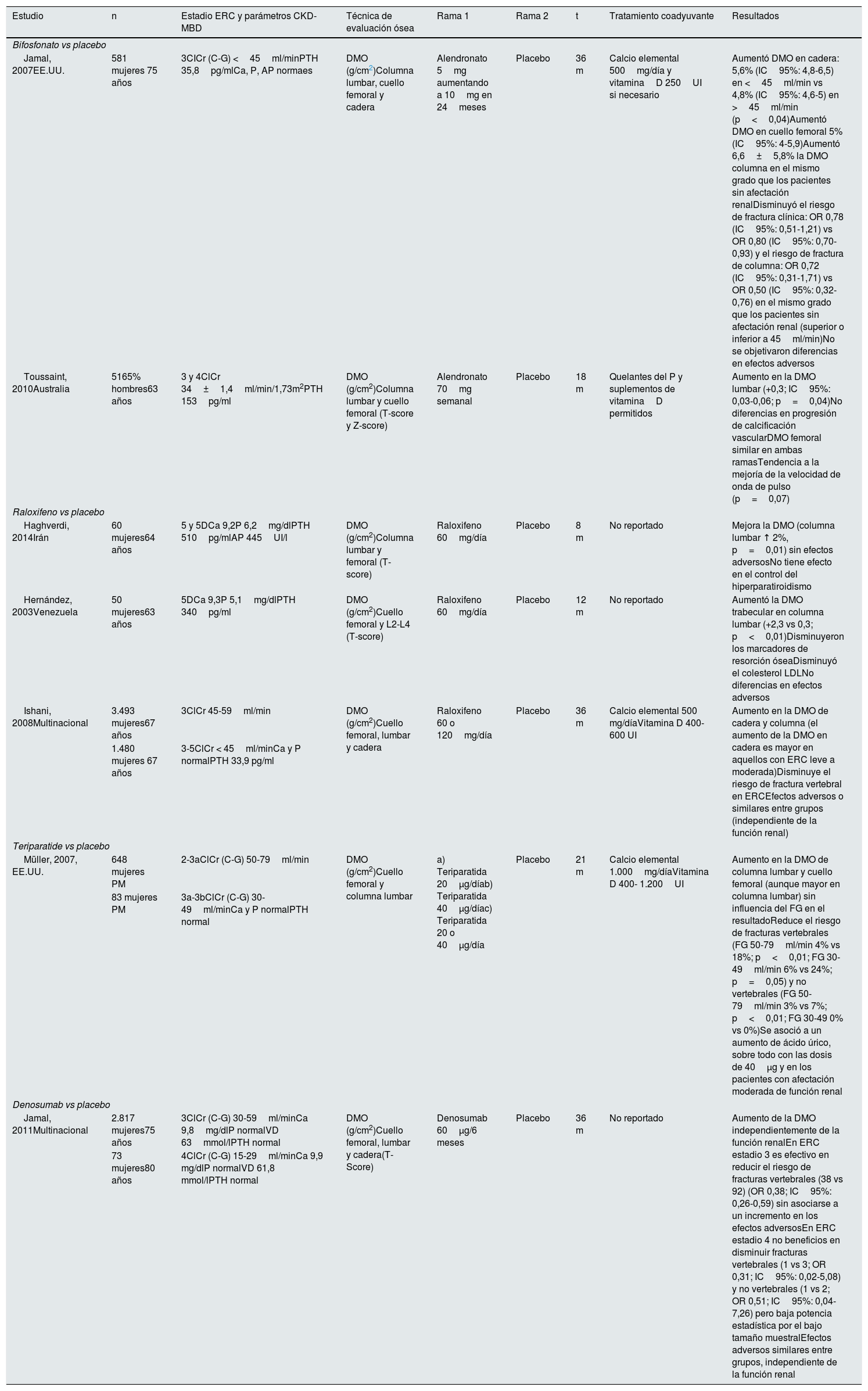
Estudios clínicos
| Estudio | n | Estadio ERC y parámetros CKD-MBD | Técnica de evaluación ósea | Rama 1 | Rama 2 | t | Tratamiento coadyuvante | Resultados |
|---|---|---|---|---|---|---|---|---|
| Bifosfonato vs placebo | ||||||||
| Jamal, 2007EE.UU. | 581 mujeres 75 años | 3CICr (C-G) <45ml/minPTH 35,8pg/mlCa, P, AP normaes | DMO (g/cm2)Columna lumbar, cuello femoral y cadera | Alendronato 5mg aumentando a 10mg en 24meses | Placebo | 36 m | Calcio elemental 500mg/día y vitaminaD 250UI si necesario | Aumentó DMO en cadera: 5,6% (IC95%: 4,8-6,5) en <45ml/min vs 4,8% (IC95%: 4,6-5) en >45ml/min (p<0,04)Aumentó DMO en cuello femoral 5% (IC95%: 4-5,9)Aumentó 6,6±5,8% la DMO columna en el mismo grado que los pacientes sin afectación renalDisminuyó el riesgo de fractura clínica: OR 0,78 (IC95%: 0,51-1,21) vs OR 0,80 (IC95%: 0,70-0,93) y el riesgo de fractura de columna: OR 0,72 (IC95%: 0,31-1,71) vs OR 0,50 (IC95%: 0,32-0,76) en el mismo grado que los pacientes sin afectación renal (superior o inferior a 45ml/min)No se objetivaron diferencias en efectos adversos |
| Toussaint, 2010Australia | 5165% hombres63 años | 3 y 4ClCr 34±1,4ml/min/1,73m2PTH 153pg/ml | DMO (g/cm2)Columna lumbar y cuello femoral (T-score y Z-score) | Alendronato 70mg semanal | Placebo | 18 m | Quelantes del P y suplementos de vitaminaD permitidos | Aumento en la DMO lumbar (+0,3; IC95%: 0,03-0,06; p=0,04)No diferencias en progresión de calcificación vascularDMO femoral similar en ambas ramasTendencia a la mejoría de la velocidad de onda de pulso (p=0,07) |
| Raloxifeno vs placebo | ||||||||
| Haghverdi, 2014Irán | 60 mujeres64 años | 5 y 5DCa 9,2P 6,2mg/dlPTH 510pg/mlAP 445UI/l | DMO (g/cm2)Columna lumbar y femoral (T-score) | Raloxifeno 60mg/día | Placebo | 8 m | No reportado | Mejora la DMO (columna lumbar ↑ 2%, p=0,01) sin efectos adversosNo tiene efecto en el control del hiperparatiroidismo |
| Hernández, 2003Venezuela | 50 mujeres63 años | 5DCa 9,3P 5,1mg/dlPTH 340pg/ml | DMO (g/cm2)Cuello femoral y L2-L4 (T-score) | Raloxifeno 60mg/día | Placebo | 12 m | No reportado | Aumentó la DMO trabecular en columna lumbar (+2,3 vs 0,3; p<0,01)Disminuyeron los marcadores de resorción óseaDisminuyó el colesterol LDLNo diferencias en efectos adversos |
| Ishani, 2008Multinacional | 3.493 mujeres67 años | 3ClCr 45-59ml/min | DMO (g/cm2)Cuello femoral, lumbar y cadera | Raloxifeno 60 o 120mg/día | Placebo | 36 m | Calcio elemental 500 mg/díaVitamina D 400-600 UI | Aumento en la DMO de cadera y columna (el aumento de la DMO en cadera es mayor en aquellos con ERC leve a moderada)Disminuye el riesgo de fractura vertebral en ERCEfectos adversos o similares entre grupos (independiente de la función renal) |
| 1.480 mujeres 67 años | 3-5ClCr < 45ml/minCa y P normalPTH 33,9 pg/ml | |||||||
| Teriparatide vs placebo | ||||||||
| Müller, 2007, EE.UU. | 648 mujeres PM | 2-3aClCr (C-G) 50-79ml/min | DMO (g/cm2)Cuello femoral y columna lumbar | a) Teriparatida 20μg/díab) Teriparatida 40μg/díac) Teriparatida 20 o 40μg/día | Placebo | 21 m | Calcio elemental 1.000mg/díaVitamina D 400- 1.200UI | Aumento en la DMO de columna lumbar y cuello femoral (aunque mayor en columna lumbar) sin influencia del FG en el resultadoReduce el riesgo de fracturas vertebrales (FG 50-79ml/min 4% vs 18%; p<0,01; FG 30-49ml/min 6% vs 24%; p=0,05) y no vertebrales (FG 50-79ml/min 3% vs 7%; p<0,01; FG 30-49 0% vs 0%)Se asoció a un aumento de ácido úrico, sobre todo con las dosis de 40μg y en los pacientes con afectación moderada de función renal |
| 83 mujeres PM | 3a-3bClCr (C-G) 30-49ml/minCa y P normalPTH normal | |||||||
| Denosumab vs placebo | ||||||||
| Jamal, 2011Multinacional | 2.817 mujeres75 años | 3ClCr (C-G) 30-59ml/minCa 9,8mg/dlP normalVD 63mmol/lPTH normal | DMO (g/cm2)Cuello femoral, lumbar y cadera(T-Score) | Denosumab 60μg/6 meses | Placebo | 36 m | No reportado | Aumento de la DMO independientemente de la función renalEn ERC estadio 3 es efectivo en reducir el riesgo de fracturas vertebrales (38 vs 92) (OR 0,38; IC95%: 0,26-0,59) sin asociarse a un incremento en los efectos adversosEn ERC estadio 4 no beneficios en disminuir fracturas vertebrales (1 vs 3; OR 0,31; IC95%: 0,02-5,08) y no vertebrales (1 vs 2; OR 0,51; IC95%: 0,04-7,26) pero baja potencia estadística por el bajo tamaño muestralEfectos adversos similares entre grupos, independiente de la función renal |
| 73 mujeres80 años | 4ClCr (C-G) 15-29ml/minCa 9,9 mg/dlP normalVD 61,8 mmol/lPTH normal | |||||||
Adaptado de KDIGO 201710.
Denosumab (DMab) es un anticuerpo monoclonal que actúa bloqueando el ligando del receptor activador del factor nuclear kappa-B (RANKL) y como consecuencia inhibe la osteoclastogénesis101,102 (tabla 4). DMab es útil para la prevención de fracturas vertebrales, no vertebrales y de cadera en la población general101,103,104. DMab no depende de la función renal para su metabolismo o excreción y no parece alterar la función renal, por lo que no se necesita ajustar dosis en pacientes con ERC ni tiene restricciones de uso en pacientes con disminución del FG14,105. DMab ha sido raramente asociado con fracturas atípicas, terminando el efecto del fármaco al cesar su administración14.
En análisis post hoc de mujeres osteoporóticas con ERC estadio3 (n=2.817) y 4 (n=73) se ha descrito que, tras 36meses de seguimiento, DMab también incrementa la DMO y reduce el riesgo de fractura vs placebo, independientemente de la función renal y sin efecto sobre la creatinina o la incidencia de efectos adversos105 (tabla 4). No obstante, algunos estudios han mostrado que el DMab puede inducir hipocalcemia, especialmente en pacientes con ERC y pacientes en hemodiálisis con alto recambio óseo subyacente106-109. Este efecto potencial es importante y ocasionalmente grave110,111, especialmente en la primera y segunda semanas, debiéndose prestar especial atención en los pacientes de riesgo o que estén recibiendo concomitantemente cinacalcet112 (posible también con etelcalcetida). De considerarse indicado DMab por la presencia de un elevado riesgo de fractura, deberá informarse al paciente de la sintomatología de hipocalcemia, monitorizar el calcio plasmático de modo más frecuente y realizar una reposición más intensa, temporal, de calcio y vitaminaD (nativa y/o calcitriol)106,107. También se han descrito hipercalcemias de «rebote» tras largos períodos de tratamiento con DMab, atribuidas a un aumento de la actividad osteoclástica tras su supresión, pero también a la administración previa de calcio-vitaminaD108. La progresión de calcificación aórtica y eventos cardiovasculares, con excepciones puntuales, no ha mostrado diferencias entre DMab y placebo113,114. Finalmente, en pacientes en hemodiálisis DMab se propone como un tratamiento relativamente seguro desde el punto de vista de la hipocalcemia (al menos con el habitual baño de 3mEq/l [1,5mmol/l])110, ya que cada sesión procuraría un cierto balance positivo de calcio. A pesar de la administración concomitante de vitaminaD, DMab puede producir un aumento (reversible) de PTH intacta que puede llegar a valores superiores a 1.000pg/ml110. En cualquier caso, tras la interrupción del tratamiento se produce una pérdida ósea que puede ser rápida, por lo que se debería valorar una terapia secuencial con otro fármaco para sostener el beneficio obtenido en la DMO14,18.
Varios estudios han mostrado efectos beneficiosos de DMab en pacientes en diálisis. En un estudio piloto prospectivo en 12pacientes, todos ellos con PTH>1.000pg/ml, T-score<−1,0 y dolor óseo, no candidatos a cirugía, Chen et al.115, fuera de ficha técnica, describieron los efectos de DMab, calcitriol, captores de fósforo y un baño de calcio ajustado según los datos bioquímicos. La DMO aumentó en el cuello femoral y en la columna lumbar tras 6meses y se redujo el dolor. En el primer mes, la mayoría de pacientes experimentaron un aumento de la PTH intacta que rápidamente descendió al final del estudio tras aumentar la dosis de calcitriol (1.702±182 a 519±127pg/ml)115. Otra experiencia más prolongada110 describe retrospectivamente 12pacientes osteoporóticos en hemodiálisis que recibieron DMab a dosis habituales; tras 24meses de seguimiento observaron también mejoría de parámetros de metabolismo óseo y del T-score, aunque este solo fue medido por ultrasonidos de falanges.
En resumen, a la luz del conocimiento actual parece que agentes antirresortivos como bisfosfonatos o DMab podrían usarse al menos en pacientes con fracturas por fragilidad y/o elevado riesgo de fractura2,116 en distintos estadios de ERC (especialmente ERC1-3) de un modo similar al de la población general y sin necesidad de practicar una biopsia ósea si tras la evaluación individualizada del paciente se considera poco probable la presencia de una EOA. Los bisfosfonatos podrían estar indicados en dichos pacientes, especialmente si se observan índices de alto recambio62 (PTH y fosfatasas alcalinas significativamente elevadas), probablemente espaciando las dosis y/o limitando la duración del tratamiento62,117. DMab podría extenderse a estadios de ERC más avanzados (ERC4 o incluso5), con especial control de la calcemia. Ensayos clínicos (i.e., con DMab o alendronato en ERC avanzada y diálisis [NCT01464931, NCT02792413, NCT02440581]) podrían proporcionar información relevante en los próximos años; hasta entonces, una opción válida es adoptar algoritmos diagnóstico-terapéuticos basados en el riesgo de fractura y no quedar a la espera de una evidencia absoluta4,116,118.
Fármacos anabólicos para el tratamiento de la osteoporosisTeriparatidaLa teriparatida (tabla 4) está aprobada como terapia osteoformadora (anabólica) para la OP posmenopáusica, esteroidea y en el varón con elevado riesgo de fractura (p.ej., dos o más fracturas vertebrales)14,19,119. Actúa incrementando la formación ósea, por la exposición de forma intermitente a la PTH, particularmente en el hueso trabecular. Una importante limitación es el elevado coste (la alternativa más cara). Por otra parte, se ha observado una disminución gradual de la masa ósea tras retirar teriparatida que se puede mitigar continuando la terapia con un bisfosfonato13,120. Otra limitación es que no se puede administrar por periodos superiores a 24meses (tabla 4).
Comparado con placebo, teriparatida mostró un incremento significativo de la DMO en la columna lumbar y en el cuello femoral y no hubo evidencia de que este incremento de la DMO se modificara por la enfermedad renal121 (tabla 6). Aunque por ficha técnica su uso es restringido en ERC moderada y contraindicado en ERC severa, un análisis post hoc reciente incluyó mujeres japonesas con OP, ERC estadios4-5 y alto riesgo de fractura (82% tenían una fractura previa), observándose que teriparatida subcutánea 20μg/día durante 24meses parecía ser efectiva (aumento de DMO y biomarcadores)122. Subrayamos que con el uso de este agente anabólico se ha descrito en algunos casos un incremento del recambio óseo en pacientes con EOA confirmada por biopsia ósea52,123,124. Hasta el momento no hay experiencia con abaloparatida o el recombinante humano de PTH Natpara® en pacientes con ERC125. Recientemente ha sido descrito que el uso de 56,5μg de teriparatida una vez a la semana aumentó la DMO lumbar en pacientes japoneses en hemodiálisis con hipoparatiroidismo y DMO baja, aunque 10/22 pacientes tuvieron que abandonar el tratamiento por efectos secundarios126.
Independientemente de teriparatida, no podemos olvidar que en pacientes en diálisis con PTH disminuida (<2veces el límite alto de la normalidad, y especialmente si tienen antecedentes de fractura) existe la posibilidad de disminuir el calcio en el líquido de diálisis para aumentar la PTH endógena y mejorar el remodelado óseo4,52. Por último, destacar que un ensayo clínico en marcha en pacientes con OP en diálisis asigna al brazo de bajo recambio óseo una combinación teriparatida-cinacalcet (NCT02440581), quizá para estimular la producción endógena de PTH por la hipocalcemia inducida por cinacalcet.
RomosozumabRomosozumab (RMab) (tabla 4) es un anticuerpo monoclonal humanizado contra la esclerostina, inhibidor de la vía Wnt responsable de la formación de hueso. La esclerostina producida por los osteocitos se une a las proteínas LRP4-5-6, receptores de los ligandos de la vía del Wnt. RMab estimula así la formación e inhibe la resorción ósea (a diferencia de los agentes osteoanabólicos clásicos)127,128. Estudios clínicos han mostrado mejoría importante en la DMO en columna y cadera127,129,130. Un estudio reciente en mujeres posmenopáusicas con muy alto riesgo de fractura mostró que el tratamiento secuencial con RMab mensual durante 12meses seguido de alendronato semanal redundó en un menor riesgo de fractura que el tratamiento con alendronato semanal solo130. Sin embargo, se adjudicaron un mayor número de algunos eventos cardiovasculares al grupo de RMab durante el primer año de tratamiento (2,5% vs 1,9%, respectivamente), aunque no hubo diferencias cuando RMab se comparó con placebo128-130. Por ese motivo la FDA ha frenado por el momento su comercialización en espera de nuevos estudios y reanálisis. El papel de este fármaco en pacientes con ERC es insuficiente para aconsejar su uso131.
Otros tratamientosEstrógenos y raloxifenoEl hipoestrogenismo es una causa bien conocida de OP, y tanto la terapia estrogénica adecuada como el uso de los moduladores selectivos de los receptores de estrógenos (SERM por su acrónimo inglés) han mostrado mejorar la OP posmenopáusica19. La menopausia precoz (o hipogonadismo prematuro) es más frecuente en mujeres con ERC132, por lo que estas pacientes representan una población especial de alto riesgo.
Raloxifeno es un SERM sin el riesgo carcinogénico de la terapia estrogénica clásica (incluso descrito como protector de cáncer de mama) y es una alternativa en la OP posmenopáusica133-135. Ha demostrado mejorar la DMO y disminuir el riesgo de fracturas vertebrales pero no las de cadera133,136. En un análisis post hoc en mujeres con aclaramiento de creatinina >20ml/min, se observó el mismo efecto sobre fracturas vertebrales. Otros estudios con pocos pacientes han descrito que raloxifeno incrementa la DMO y reduce la pérdida de masa ósea en columna, cadera y radio y reduce el riesgo de fractura vertebral en pacientes con ERC135,137 (tabla 6).
Es importante considerar que el raloxifeno podría jugar un papel interesante en terapias secuenciales de la mujer con OP14,15. Sus efectos secundarios más frecuentes son sofocos y calambres y la trombosis venosa es su efecto adverso más importante; por ello no se debería utilizar en pacientes con sintomatología climatérica o riesgo de tromboembolismo. No se dispone de experiencia con bazedoxifeno en pacientes con ERC.
Cinacalcet y paratiroidectomíaAdemás del efecto beneficioso de cinacalcet sobre la ODR138, un análisis secundario preespecificado del estudio EVOLVE evaluó la aparición de fracturas clínicas en pacientes en diálisis con hiperparatiroidismo secundario7. Tras varios ajustes estadísticos, el riesgo relativo de fractura fue discretamente menor con cinacalcet (0,83; IC95%: 0,72-0,98) y, usando otro análisis también preespecificado (lag-censoring analysis), el riesgo relativo de fractura con cinacalcet fue de 0,72 (0,58-0,90)7. Cinacalcet no es efectivo en el tratamiento de la disminución de la DMO en hiperparatiroidismo primario.
Si cinacalcet representaría la posibilidad teórica de «paratiroidectomía química», también se ha descrito que la paratiroidectomía quirúrgica disminuye el recambio óseo, mejora la DMO y reduce el riesgo de fractura en pacientes en diálisis4,139,140, pero en estos estudios existen numerosos sesgos por indicación y la intervención no está exenta de riesgos141.
CalcilíticosNo existen todavía en el mercado agentes inhibidores del receptor-sensor de calcio (a diferencia de agonistas como cinacalcet)142. Estos fármacos podrían suponer en el futuro un modo indirecto de aumentar la producción endógena de PTH en pacientes con EOA.
OtrosLa hiponatremia y la acidosis metabólica se asocian a OP, por lo que sería recomendable evitarlas. Por otra parte, distintos estudios experimentales y datos clínicos preliminares han mostrado efectos controvertidos y variables en el hueso tras inhibición del sistema renina angiotensina o con el uso de otros fármacos de interés nefrológico como betabloqueantes, diuréticos, estatinas, antidiabéticos orales, inmunosupresores u omeprazol143.
ConclusiónEn la publicación de la primera parte de esta revisión1 se hizo mención a que las nuevas guías sugieren, con cierta ambigüedad, valorar el riesgo de fractura (p.ej., DMO) siempre que los resultados puedan afectar decisiones terapéuticas. Si bien el efecto de diferentes fármacos sobre la DMO en población general no se puede equiparar en términos de eficacia a pacientes con ERC, en esta segunda parte de la revisión sobre OP en la ERC hemos enfatizado que en los últimos años se han obtenido resultados que sugieren que los fármacos que se utilizan para el manejo de la OP en la población general podrían ser utilizados en la ERC tras un análisis individualizado del riesgo/beneficio de estos pacientes.
Consecuentemente, en pacientes con ERC estadios1-3, sin alteraciones bioquímicas evidentes, la prevención de fracturas no debería diferir de los protocolos destinados a la población general. Se recomienda un contenido adecuado de calcio en la dieta y la corrección, según los niveles de calcidiol, con vitaminaD (p.ej., colecalciferol, calcifediol). Los agentes antirresortivos (bisfosfonatos o DMab) podrían usarse de modo seguro y efectivo sin la exigencia de tener que hacer una biopsia ósea. Los antirresortivos también podrían usarse en estadios más avanzados en pacientes seleccionados (tabla 5) o como mínimo en pacientes con fracturas clínicas o morfométricas previas (prueba de fragilidad ósea) y/o muy elevado riesgo de fractura, siempre y cuando se considere que una EOA es poco probable (tabla 5). Al no eliminarse por vía renal, DMab sería una alternativa más segura en presencia de ERC manifiesta y su utilización obliga a un control adecuado de la calcemia y repleción con vitaminaD. Teriparatida sería segura y potencialmente efectiva durante un máximo de 24meses en pacientes paratiroidectomizados y/o con alta sospecha de EOA. Por último, raloxifeno podría considerarse en pacientes posmenopáusicas con ERC sin riesgo de tromboembolismo ni clínica climatérica importante, quedando el tratamiento estrogénico limitado a la menopausia precoz, por tiempo limitado y con indicación ginecológica. Sin embargo, es indudable la necesidad de incluir pacientes con ERC (con y sin CKD-MBD) en futuros ensayos clínicos antes de poder extender ampliamente el uso de estos tratamientos, dado que la mayoría de estudios realizados hasta ahora no han sido consistentes, tienen sesgos importantes y un bajo grado de evidencia67,85,116,144.
FinanciaciónTrabajo no financiado.
Conflicto de interesesNinguno para esta revisión.
La presente revisión incluye autores que pertenecen a la Red Nacional RedinRen (RD06/0016/0001 y RD12/0021/0033), la Red de Biobancos Nacional Española (RD09/0076/00064) y al Grupo Catalán de Investigación AGAUR (2009 SGR-1116), así como colaboradores de la Fundación Iñigo Alvarez de Toledo (FRIAT). Queremos agradecer también a la Dra. Lucía Bailone su notable contribución a la elaboración de este artículo y al Sr. Ricardo Pellejero su importante labor de asistencia bibliográfica.