Desde la aparición en 1989 de la eritropoyetina humana recombinante (rHuEPO), muchos pacientes se han beneficiado de este tratamiento. Hasta 2008 se han desarrollado modificaciones de la estructura de la rHuEPO para aumentar su vida media y mejorar su eficacia y seguridad.
En la última etapa, la investigación en anemia renal se ha diversificado en múltiples líneas que superan la producción recombinante de la eritropoyetina, con la síntesis de pequeños péptidos activadores del receptor de eritropoyetina o moléculas que apuntan a nuevas dianas terapéuticas y aportan ventajas potenciales de seguridad, administración oral o efectos pleiotrópicos favorables. Esta nueva era ha revivido el interés de los nefrólogos en este campo. Los nuevos productos para la corrección de la anemia renal incluyen péptidos activadores del receptor de eritropoyetina, estabilizadores del factor inducible por hipoxia, reguladores de la hepcidina y otros. Toda esta evolución se revisa a continuación desde una perspectiva cronológica que facilite la aproximación sistemática del nefrólogo a estos nuevos tratamientos.
Since the appearance of recombinant human erythropoiesis-stimulating agents (rhESA) in 1989, many patients have benefited from this treatment. Until 2008, the structure of rhESA was modified to increase its half-life and improve its safety and efficacy. In the last stage, research into anaemia in chronic kidney disease has branched into multiple lines that go beyond recombinant erythropoietin production, with the synthesis of small peptides activating the erythropoietin receptor or molecules that act on new therapeutic targets and provide potential advantages in terms of safety, oral administration, or favourable pleiotropic effects. This new era has revived interest in this field among nephrologists. The new products to correct anaemia associated with chronic kidney disease include peptides activating the erythropoietin receptor, hypoxia-inducible factor stabilizers, and hepcidin regulators, among others. The present article reviews all these developments chronologically to facilitate a systematic approach to these new treatments among nephrologists.
INtRodUCCIóN
En 1989 se comercializa la eritropoyetina humana recombinante (rHuEPO) desarrollada por Amgen en la Unión Europea y comercializada en España por Janssen-Cilag. Desde entonces, muchos pacientes se han beneficiado de este tratamiento que se considera uno de los hitos del arsenal terapéutico de la nefrología en los últimos 25 años. En este tiempo se ha vivido el desarrollo de una investigación farmacológica que ha mantenido el mecanismo de acción primario (activación del receptor) y ha modificado la estructura de la rHuEPO para aumentar su vida media y mejorar su usabilidad y seguridad. Toda esta evolución histórica se revisa en el primer artículo del presente monográfico1.
Los nuevos productos en desarrollo pueden agruparse en 4 subgrupos: péptidos miméticos de la eritropoyetina (EPO), estabilizadores del factor inducible por hipoxia (HIF, del inglés hypoxia inducible factor), reguladores de la hepcidina y otros fármacos en fase precoz de desarrollo.
PéPtIdoS MIMétICoS dE la ERItRoPoyEtINa: PEgINESatIdE
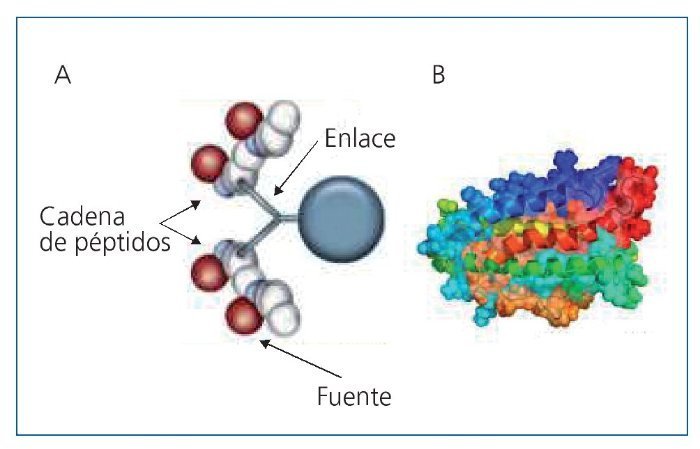
Los péptidos activadores de los receptores de EPO representan el siguiente paso en el desarrollo de moléculas con un perfil de mayor seguridad y un desarrollo de producción más sencillo que las clásicas rHuEPO. Fue en el año 1996 cuando Wrighton et al2 descubrieron la capacidad del péptido mimético de la EPO (EMP-1) sin homología estructural con la EPO, para estimular la proliferación celular de eritrocitos. Así pues, a pesar de ser un péptido de apenas 10 aminoácidos, de presentar baja afinidad por el receptor de EPO y de su baja actividad biológica, EMP-1 se presentaba como una revolución en el tratamiento de la anemia que estimulaba el aumento de la masa eritroide, el hematocrito y el recuento de reticulocitos3. Diez años más tarde, Fan et al describen peginesatide (Hematide® Affymax/Takeda): un péptido dimérico formado por 21 aminoácidos en cada cadena (peso molecular 45.000 Da) y estabilizado por una cadena pegilada (fig. 1). Tiene una vida media de 3-4 semanas, alcanza el pico de respuesta a los 7 días y presenta una excreción fundamentalmente renal. Este péptido con efectos estimulantes sobre la eritropoyesis, no presenta reacción cruzada con los anticuerpos frente a la EPO, resolviendo así el problema de la aplasia pura de células rojas (APCR) descrito con el uso de la rHuEPO4,5.
Figura 1. Estructura de peginesatide (A) y estructura de rHuEPO (B). PEG: polietilenglicol; rHuEPO: eritropoyetina humana recombinante.
Los primeros ensayos clínicos en individuos sanos llevados a cabo en 2006, confirmaron la capacidad de peginesatide para aumentar los valores de hemoglobina (Hb) con un alto perfil de seguridad y una reducción considerable de las administraciones (1 al mes)6. Tras obtener resultados positivos, también en estudios en fase 2, a partir de 2010 se lanzan 4 ensayos clínicos aleatorizados que incluyeron a pacientes con enfermedad renal crónica (ERC), con y sin necesidades de diálisis: EMERALD-1, EMERALD-2, PEARL-1 y PEARL-2, respectivamente7,8. Los 4 estudios se llevaron a cabo en Europa y Estados Unidos y fueron promovidos por Affymax y Takeda Pharmaceutical (Osaka, Japón).
Los estudios de corrección en prediálisis: PEARL-1 y PEARL-2 incluyeron a pacientes con ERC estadio 4-5, con anemia (Hb, 8-11 g/dl), no tratados con rHuEPO y sin ferropenia (índice de saturación de transferrina [IST] > 20% y ferritina > 100 ng/ml). Así pues, se trataba de pacientes naïve que se asignaban a recibir (1:1:1) darbepoetina (0,75 µg/kg peso quincenal) o peginesatide a dosis de 0,025 mg/ kg o 0,04 mg/kg mensual, con el objetivo de alcanzar y mantener Hb entre 11 y 12 g/dl7,8. De los 983 pacientes incluidos en ambos estudios, 224 abandonaron de manera prematura por diferentes razones y el resto fue seguido durante una media de 81 semanas. Al final del seguimiento, peginesatide demostró no ser inferior a darbepoetina. Sin embargo, el grupo peginesatide presentó una mayor tasa de eventos mortales, angina inestable y arritmias (en su mayoría fibrilación auricular). Pese a la aleatorización, había una mayor presencia de pacientes diabéticos (en PEARL-2) o con enfermedad vascular periférica (en PEARL-1) en el grupo de peginesatide, lo que hizo preciso un análisis ajustado por comorbilidad. El efecto negativo de peginesatide se atenuaba bastante, pero se mantenía un riesgo significativo frente al control (hazard ratio [HR]: 1,20). Como dato añadido, el 1,5% de los pacientes tratados con peginesatide desarrolló anticuerpos frente al fármaco, aunque en ningún caso se produjo APCR7,8.
Los estudios de conversión EMERALD-1 y 2 incluyeron a 1.626 pacientes que llevaban más de 3 meses en hemodiálisis (HD) con tratamiento estable con rHuEPO a y b por más de 8 semanas, con Hb entre 10 y 12 g/dl y sin ferropenia (IST > 20% y ferritina > 100 ng/ml). En este caso, los pacientes se aleatorizaban (ratio 2:1) a recibir peginesatide mensual o mantener su tratamiento de epoetina previo. De nuevo, peginesatide demuestra ser un fármaco no inferior a los agentes eritropoyéticos para el objetivo de Hb. Además, en este caso no se demuestra mayor riesgo de efectos adversos (HR: 1,06; valor de p no significativo) y solo el 1,1% desarrolló anticuerpos frente a peginesatide7. La información para pacientes en diálisis peritoneal (DP) se limita a un modesto estudio publicado recientemente, que incluyó a 59 pacientes y que demuestra que la conversión de EPO a peginesatide mantiene los valores de Hb sin efectos adversos atribuibles al fármaco9.
Por tanto, parece evidente que peginesatide consigue resultados favorables en los estudios de no inferioridad frente a darbepoetina y EPO para corregir y mantener los valores de Hb, tanto en ERC como en HD y DP, que añade ventajas de elaboración, intervalo de administración y utilidad en pacientes con APCR, pero con un riesgo mayor de efectos adversos. Esta situación, sumada a las reacciones anafilácticas reunidas por la Food and Drug Administration (FDA), ha provocado que el producto fuera definitivamente retirado en febrero de 2013.
Otros péptidos miméticos del receptor de EPO, como AGEM400 (HES AplaGen GmbH) o las moléculas de Centocor (CNTO 528, CNTO 530, CNTO 531), no han progresado más allá de fases 1 y han sido abandonados para el tratamiento de la anemia relacionada con ERC10, aunque continúan abiertos ensayos en el campo de la oncología que tienen entre sus objetivos secundarios evaluar la mejoría de las cifras de Hb, por lo que no se descarta que puedan volver a ser promovidos en el campo de la nefrología.
tRataMIENtoS dE FUtURo dE la aNEMIa dE la ENFERMEdad RENal CRóNICa
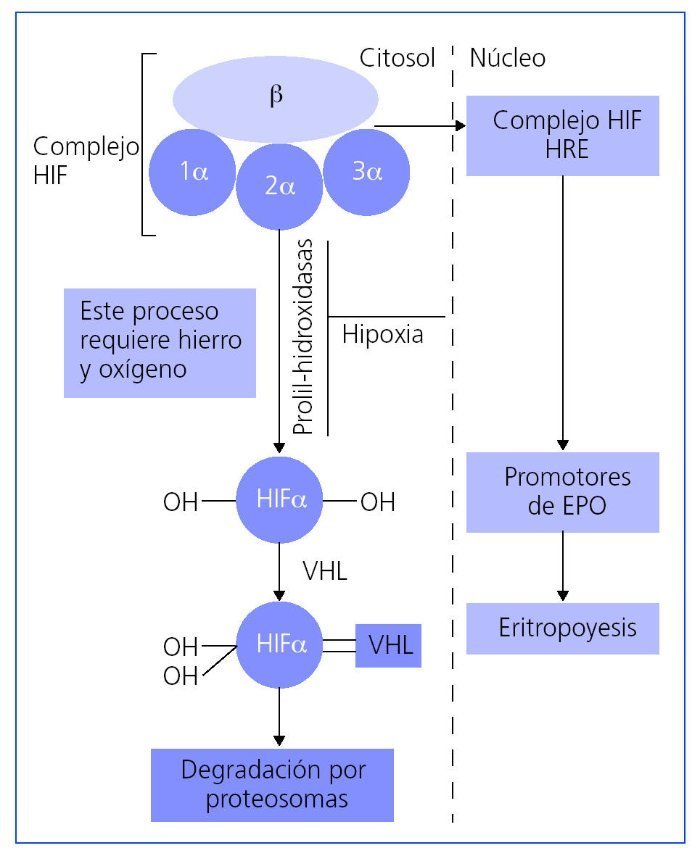
Existe otra vía de desarrollo completamente diferente a la estimulación directa del receptor de EPO, y es la interacción con el HIF. El HIF es un complejo proteico presente en todas las células de mamíferos y descubierto en 1993. Se trata de un heterodímero formado por 2 subunidades, la reguladora HIFa (que a su vez tiene 3 isoformas: HIF1a, HIF2a y HIF3a) y la constitutiva HIFb. En situaciones de normoxia y en presencia de hierro, las isoformas HIF1a y HIF2a se degradan por acción de las prolil hidroxilasas impidiendo la dimerización del HIF mediante la ubiquitinización de la molécula, gracias a la unión del complejo VHL (Von Hippel-Lindau) y la consecuente degradación por proteosomas del HIFa. En situación de hipoxia, las prolil hidroxilasas no degradan el complejo HIFa sino que este se estabiliza, se dimeriza con HIF1b y dentro del núcleo celular se une a HRE (elementos de respuesta a HIF [HIF-responsive elements]). Esta situación, a su vez aumenta la transcripción de numerosos genes incluyendo a los promotores de la eritropoyesis (fig. 2)3,11. Además, y a modo de confirmación, las mutaciones en alguna de las prolil hidroxilasas en humanos se han publicado puntualmente en individuos con eritrocitosis y, más extensamente, en ratones knockout12. En resumen, la hipoxia frena la degradación del HIF y secundariamente aumenta la eritropoyesis, por lo que se constituye en una nueva diana terapéutica.
Figura 2. Mecanismo de acción del complejo HIF (factor inducible por hipoxia [hypoxia inducible factor]). HRE: elementos de respuesta al factor inducible por hipoxia (hypoxia inducible factor-responsive elements); VHL: ubiquitina Von Hippel-Lindau.
INhIbIdoRES dE PRolIl hIdRoxIlaSaS dEl FaCtoR INdUCIblE PoR hIPoxIa
Actualmente, un grupo de fármacos en pleno desarrollo son los estabilizadores de HIF. Se trata moléculas diseñadas para competir frente a los radicales de 2-oxoglutarato de las prolil hidroxilasas y, por tanto, estimular la producción de EPO a nivel renal y también hepático. Presentan 2 claras ventajas potenciales frente a la terapia convencional con agentes estimuladores de la eritropoyesis. Por un lado, su administración es oral y, por otro, inducen la producción de EPO endógena, lo que conlleva valores más estables y aumentos en rango fisiológico que cuando se administra rHuEPO en pulsos que alcanzan valores en rango farmacológico13. Estás moléculas tienen además capacidad para modular otros genes relacionados con la eritropoyesis como la transferrina, la ferritina o el propio receptor de la EPO. Incluso, la estabilización de HIF promueve la disminución de la hepcidina, situación ventajosa para pacientes con ERC por su estado microinflamatorio asociado3. En este sentido, la modulación de la hepcidina ya se había propuesto como potencial mecanismo para mejorar la anemia inducida por inflamación. Hasta la fecha, pocos estudios han arrojado resultados positivos, aunque está completado un ensayo clínico promovido por Noxxon Pharma con lexaptepid (Nox H94) en pacientes en diálisis.
Tras el fracaso del primer fármaco, FG-2216, por un caso de hepatitis fulminante y algunos de elevación asintomática de transaminasas, FibroGen desarrolla FG-4592 o roxadustat. En el ensayo clínico de corrección de anemia en paciente con ERC 3-4 no en diálisis, Besarab et al14 aleatorizaron a 116 pacientes con Hb < 11 g/dl, a recibir placebo o roxadustat en dosis diferentes (0,7, 1, 1,5 y 2 mg/ kg) y en 2 o 3 tomas por semana durante 26 días. Al final del estudio, la Hb aumentó de manera dependiente de la dosis de roxadustat. Se obtuvo una respuesta al fármaco (definida como aumento de Hb > 1 g/dl) en el 100% de los pacientes del grupo de 2 mg/kg y se constató una disminución de los valores de hepcidina por un mecanismo no aclarado. No se detectaron diferencias en los efectos adversos entre los grupos del estudio.
Por otro lado, 2 ensayos clínicos muy recientes promovidos por el mismo grupo investigador han probado roxadustat en pacientes en diálisis. El primero fue un ensayo de corrección de anemia en pacientes incidentes en diálisis (12 en programa de diálisis peritoneal [DP] y 48 en hemodiálisis [HD]), que recibieron dosis crecientes de roxadustat (de 1,0 a 1,7 mg/kg) 3 veces por semana. En el grupo de HD se analizó a los pacientes de manera independiente según la ferroterapia (oral, intravenoso o nada), mientras que todos los pacientes del grupo DP estaban en tratamiento con hierro oral. Al final del estudio, más del 90% de los pacientes alcanzó respuestas significativas en cuanto al aumento de cifras de Hb con independencia del estatus de hierro. Además, y confirmando los datos del estudio en ERC, mejoraron los valores de hepcidina tras el tratamiento. En 6 pacientes hubo efectos adversos graves y hasta el 10% precisó aumento en la dosis de fármacos antihipertensivos15. En el otro ensayo clínico de conversión en fase de mantenimiento, 144 pacientes en HD se asignaron a recibir roxadustat o mantener su rHuEPO a (ratio 3:1) en 2 fases de diferente duración (6 y 19 semanas, respectivamente). Los resultados fueron similares en ambos grupos, lo que confirma la capacidad de roxadustat para elevar los valores de Hb de manera dependiente de la dosis en HD. No hubo diferencias significativas en las reacciones adversas entre ambos grupos16. Actualmente están en marcha varios estudios controlados en fase 3 en ERC, HD y DP, con resultados estimados para 2017 (clinicaltrial. gov NCT01750190, NCT02021318).
Roxadustat no es el único estabilizador de HIF en desarrollo. GSK1278863 (daprodustat), desarrollado por GlaxoS-mithKline, acaba de finalizar 2 pequeños estudios fase 2A en pacientes con ERC prediálisis y en HD, y muestra resultados superponibles a los publicados con roxadustat17,18. En el estudio de corrección de anemia naïve en pacientes con ERC sin diálisis se observa un aumento de los valores de Hb dependiente de la dosis. En el grupo de HD, los pacientes se aleatorizaron a recibir rHuEPO o GSK1278863, observando ausencia de diferencias en los valores de Hb entre grupos cuando la dosis del fármaco estabilizador de HIF supera los 5 mg al día. Nuevamente se refleja una disminución en los valores de hepcidina, así como de ferritina, de mecanismo poco aclarado. No existen en ambos estudios diferencias en cuanto a las reacciones adversas entre los grupos.
Akebia Therapeutics ha desarrollado otra molécula con capacidad para inhibir las prolil hidroxilasas, denominada AKB-6548 (vadadustat), con resultados sin publicar hasta la fecha. Según los anuncios realizados por la propia empresa, su estudio en fase 2b demuestra que AKB-6548 es eficaz en el mantenimiento o corrección de las cifras de Hb en pacientes con ERC y en HD sin efectos adversos13. Actualmente hay 2 estudios fase 3 que reclutan pacientes para comparar la eficacia de vadadustat con la referencia de darbepoetina en pacientes con ERC (clinicaltrial.gov NCT02648347, NCT02680574).
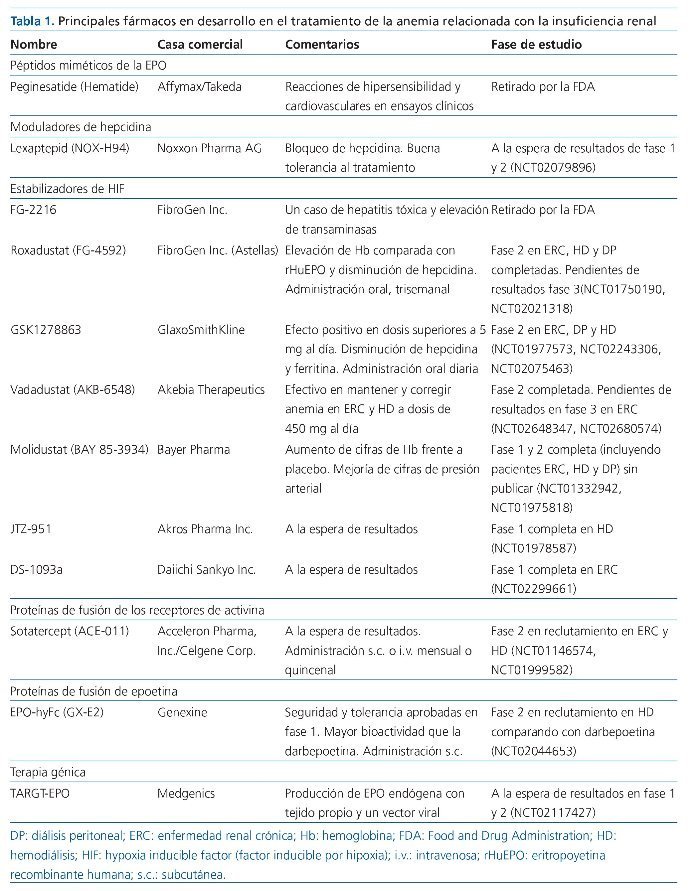
Aun sin resultados en humanos con enfermedad renal, varios estabilizadores del HIF por la vía de la inhibición de las prolil hidroxilasas están en pleno desarrollo. BAY 85-3934 (molidustat) fabricado por Bayer Pharma ha demostrado en animales normalizar la anemia mostrando un interesante efecto beneficioso sobre la presión arterial. Estamos a la espera de los resultados de los estudios en fases 1 y 2 que incluyeron a pacientes con ERC, DP y HD, ya completados pero aún sin publicar (clinicaltrial.gov NCT01332942, NCT01975818). Otros fármacos con estudios fase 1 en marcha se detallan en la tabla 1.
Por lo tanto, nos encontramos en situación de pleno desarrollo de estos fármacos que, hasta la fecha y a excepción del primer intento fallido con FG-2216, han abierto una vía innovadora para la corrección de la anemia en ERC por una vía más fisiológica, con administración oral y un efecto favorable sobre la ferrocinética y la disminución de la inflamación. Por ello, se están explorando nuevas aplicaciones clínicas como por ejemplo su papel en patologías isquémicas, dado su poder angiogénico. Además, su inhibición podría tener un efecto antitumoral al reducir la viabilidad celular al generar un ambiente hipoxémico11,19. Sin embargo, aún debemos ser cautos y esperar a los estudios en fase 3 para confirmar, sobre todo su perfil de seguridad, dado que HIF tiene la capacidad de estimular múltiples genes, incluyendo el factor de crecimiento endotelial vascular (VEGF, del inglés vascular endotelial growth factor), lo que podría favorecer el crecimiento tumoral o agravar una retinopatía diabética, entre otros posibles efectos secundarios. Aunque los resultados preliminares con estos fármacos no parecen observar aumentos de VEGF.
PRotEíNaS dE FUSIóN dE loS RECEPtoRES dE la aCtIvINa
Las activinas son dímeros de cadenas b de la inhibina, que pertenecen a la superfamilia de factor de crecimiento transformador beta (TGF-b, del inglés transforming growth factor beta). Junto con otras proteínas, tiene capacidad para regular la eritropoyesis a través de la activación de receptores de progenitores y alterando las células accesorias de la médula ósea. Algunos fármacos con capacidad de bloquear el receptor IIA de activina han demostrado aumentar las cifras de Hb por serendipia. Sotatercept (ACE-011 Acceleron Pharma) es un fármaco con capacidad para secuestrar activina que se evaluó en mujeres posmenopáusicas para comprobar su mejoría en la formación ósea. Sin embargo, en este ensayo clínico en fase 1, los resultados más sorprendentes fueron la mejoría de los valores de Hb y hematocrito de las participantes. Aunque la vía para mejorar la anemia bloqueando la activina no ha sido aclarada, se postulan varias teorías que incluyen la modulación de los receptores IIA de activina o la inhibición de TGF-b y la consecuente regulación de moléculas proeritroyéticas13. Los trabajos publicados hasta la fecha incluyendo a pacientes oncológicos presentan resultados satisfactorios. En cuanto a los pacientes con enfermedad renal, los resultados preliminares procedentes de un análisis intermedio de un estudio en marcha en HD (NCT01146574) son alentadores, aunque aún queda por establecer la dosificación óptima y la vía de administración más eficaz20. Además de estar esperando los resultados finales de dicho estudio, está en marcha otro ensayo clínico también en HD en fase de reclutamiento (clinical-trial.govNCT01999582). Será interesante poder cotejar los datos de metabolismo mineral en estos pacientes incluido como objetivo en uno de los ensayos. Aparte del potencial uso en la anemia, numerosas aplicaciones se están estableciendo en este grupo de fármacos, sobre todo las derivadas de su efecto antiangiogénico, de extraordinario interés en el campo de la oncología21. Moleculas similares, como luspatercept (ACE-536) y LY2157299, también han demostrado aumentar los valores de Hb en estudios preclínicos
INhIbIdoRES dE gata
En la vía de regulación de la eritropoyesis por HIF2a se ha identificado una nueva diana terapéutica: GATA. Este factor de transcripción inhibe la expresión de EPO en hígado y riñón y está estimulado por citocinas proinflamatorias (IL-1, IL-6 o TNFa). En la familia GATA, el subtipo GATA-2 es el inhibidor más potente de la síntesis de EPO. Por tanto, el bloqueo de GATA-2 llevaría a un aumento en la síntesis de EPO endógena. Se dispone de 2 inhibidores de GATA que han mostrado su efecto favorable sobre la eritropoyesis en animales, aunque no se dispone de datos en humanos por el momento. El K7174, que bloquea GATA-1, 2 y 3, y el K11706, que bloquea GATA-2 y 3. Ambos han demostrado promover la síntesis de EPO previamente inhibida por citocinas inflamatorias22,23.
PRotEíNaS dE FUSIóN y tERaPIa géNICa
La manipulación genética de la EPO con diferentes moléculas, como inmunoglobulinas o albúmina sérica, ha conducido a la creación de las proteínas de fusión. Así por ejemplo, actualmente se encuentra en fase 2 un estudio realizado en pacientes de HD anémicos que aleatoriza a recibir EPO-hyFc Genexine GX-E2 a diferentes dosis frente a darbepoetina alfa (clinicaltrials.gov NCT02044653). Los resultados previos con este fármaco avalan su utilización, al menos en términos de seguridad y tolerabilidad.
La última novedad en el campo de la investigación de la anemia es la terapia génica. La empresa Medgenics ha patentado un sistema de generación de EPO endógena mediante el que tomando una muestra de tejido y añadiéndole un vector viral es capaz de producir EPO, que se administra con una bomba subcutánea24. Las ventajas de este sistema (TARGT-EPO) radican en la liberación mantenida de EPO sin apenas inmunogenicidad, ya que es tejido autólogo25. Se esperan ya los resultados de un ensayo clínico fase 1/2 en pacientes con enfermedad renal avanzada en diálisis, actualmente en reclutamiento (clinicaltrials. gov NCT02117427).
Con la cautela necesaria por experiencias fallidas anteriores, parece claro que el tratamiento de la anemia asociada a la ERC ha entrado en una nueva era que explora vías de tratamiento innovadoras distintas a la de la activación directa del receptor de EPO. Los indicios actuales apuntan a una equivalencia en eficacia, pero con valores añadidos como una fabricación más simple y segura (no recombinante), la administración por vía oral, la menor necesidad de ajustes de dosis o los efectos pleiotrópicos positivos sobre el metabolismo del hierro, la inflamación u otros aspectos de la enfermedad renal. El futuro del tratamiento de la anemia renal es nuevamente prometedor.
Conflicto de intereses
J. Portolés manifiesta que ha participado como investigador en ensayos sobre la anemia patrocinados por Amgen, Roche y Takeda. B. Quiroga y J.M. López no presentan conflicto de intereses.
CoNCEPtoS ClavE
• El desarrollo del tratamiento de la anemia abre vías prometedoras más allá de la síntesis de variantes de rHuEPO y de la modificación de su farmacocinética y farmacodinamia.
• Los péptidos miméticos de la EPO demostraron su eficacia y aportaron las ventajas de elaboración no recombinante y menor inmunogenicidad. Sus efectos adversos llevaron a su retirada.
• Los inhibidores la prolil hidroxilasa promueven la eritropoyesis estabilizando el HIF y promoviendo la acción de la EPO endógena.
• Sus ventajas potenciales son: síntesis química (producto no recombinante), administración por vía oral, mejoría de la ferrocinética y mecanismo más fisiológico.
• Los inhibidores de la activina presentan resultados prometedores en la corrección de anemia con administración espaciada en el tiempo y planean efectos beneficiosos sobre la enfermedad minerovascular asociada.
Correspondencia:
josem.portoles@salud.madrid.org
* Relación de nombres del Grupo de Anemia de la SEN en el anexo.