Los pacientes con enfermedad renal crónica presentan con frecuencia alteraciones del metabolismo del hierro. En estadios avanzados, estos pacientes tienen un balance negativo de hierro, que está producido por una ingesta reducida, una alteración en la absorción intestinal y por un aumento en las pérdidas. Particularmente, este estado de deficiencia de hierro se observa en pacientes en hemodiálisis, por lo que la administración de suplementos de hierro es muy importante para mantener los requerimientos en la formación de hematíes. La suplementación por vía oral se asocia con una alta tasa de efectos secundarios gastrointestinales y con mala absorción intestinal, problemas que se evitan con la administración de hierro por vía intravenosa.
La administración de hierro intravenoso ha ido creciendo progresivamente en Estados Unidos y Europa. La introducción de la administración de eritropoyetina, con el consiguiente aumento de las concentraciones de hemoglobina, conduce a un movimiento del hierro tisular hacia el hematíe, y el déficit de este metal se convirtió en un problema frecuente. Con el fin de conseguir una adecuada corrección de la anemia, en las guías clínicas se fijaron objetivos de ferrocinética y se generalizó el uso de hierro. Después —principalmente como resultado de una mayor aportación de hierro intravenoso—, las concentraciones de ferritina se duplicaron y más adelante —como consecuencia de la práctica de reembolso que favorecía la administración de hierro intravenoso— en Estados Unidos se elevaron todavía más. En relación con estos cambios ha habido posicionamientos internacionales (KDIGO [Kidney Disease: Improving Global Outcomes]), europeos (European Best Practice Guideliness) y en Reino Unido (National Institute for Health and Clinical Excellence). En la Conferencia KDIGO en San Francisco se discutieron aspectos como la sobrecarga de hierro, la relación hierro e infecciones, hierro y morbimortalidad, estrés oxidativo y daño endotelial y reacciones de hipersensibilidad/anafilaxia, que se comentan en este artículo resumiendo también los otros conjuntos de recomendaciones.
Patients with chronic kidney disease often have iron metabolism alterations. At advanced stages, these patients have a negative iron balance, produced by reduced ingestion, altered intestinal absorption and an increase in blood losses. Iron deficiency is particularly found in patients under haemodialysis and consequently the administration of iron supplements is highly important to maintain requirements in the formation of red blood cells. Supplementation through the oral route is associated with a high rate of gastrointestinal adverse effects and with poor intestinal absorption. These problems can be avoided with iron administration through the intravenous route.
Intravenous iron administration has progressively increased in the United States and Europe. The introduction of erythropoietin administration, with the consequent increase in haemoglobin concentrations, leads to movement of iron in the tissues towards the erythro-cytes, making iron deficiency a frequent problem. To achieve adequate correction of anaemia, clinical guidelines established targets for iron kinetics, and the use of iron therapy became widespread. Subsequently—mainly as a result of a greater supply of intravenous iron—, ferritin concentrations were doubled and later — as a result of the practice of reimbursement favouring intravenous iron administration— they become even higher in the United States. With regard to these changes, an international position statement (KDIGO [Kidney Disease: Improving Global Outcomes]) has been published, as well as European (European Best Practice Guidelines) and United Kingdom (National Institute for Health and Clinical Excellence) guidelines. In the KDIGO conference in San Francisco, there were discussions on issues such as iron overload, the relationship between iron and infections, iron and morbidity and mortality, oxidative stress and endothelial damage and hypersensitivity reactions/ anaphylaxis. These issues, as well as recommendations on other issues, will be discussed in the present article.
INtRodUCCIóN
El hierro es un oligoelemento esencial imprescindible para algunas funciones metabólicas del organismo. Sin embargo, el exceso de hierro en estudios animales ha demostrado su toxicidad debida a la generación de radicales óxidos, a la alteración en la función de los neutrófilos y células T y a facilitar el crecimiento bacteriano. Estas acciones contrapuestas requieren que el organismo regule meticulosamente la homeostasis del hierro, tal vez más que cualquier otro oligoelemento. El contenido de hierro del cuerpo es controlado por la hepcidina, la ferroportina, la ferritina, la transferrina y por otras moléculas a través de una serie de procesos destinados a limitar estrictamente la disponibilidad del hierro protegiendo las células y tejidos del daño oxidativo1.
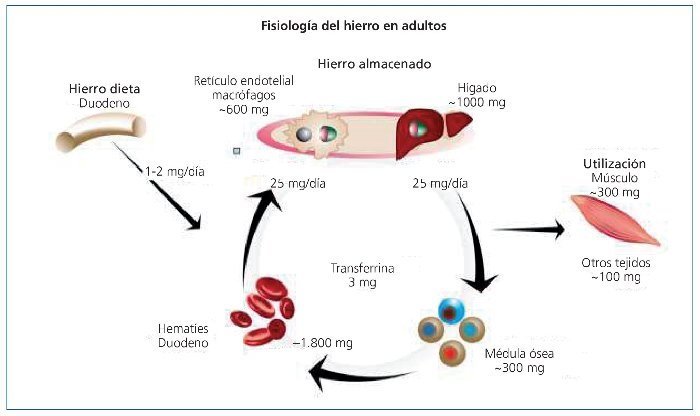
Las reservas de hierro están reguladas en márgenes muy estrechos por el organismo. En el estado fisiológico normal, aproximadamente 1 mg de hierro es lentamente absorbido de la dieta en 24 h bajo estrecha regulación intestinal, hepática y de otros sistemas (fig. 1)1. Por el contrario, cuando un paciente recibe la dosis habitual de 100 mg de hierro por vía intravenosa (i.v.), esta cantidad entra directamente en el torrente sanguíneo sorteando muchos procesos de regulación. Por la observación clínica parece evidente que la administración i.v. de hierro se tolera bien. Sin embargo, la seguridad y la eficacia de la administración de hierro i.v. no se han analizado suficientemente. No se han realizado ensayos clínicos con el tamaño de muestra y seguimiento adecuados, que proporcionen el suficiente conocimiento de la seguridad y eficacia de la administración de hierro por esta vía. Esto no significa que el hierro i.v. sea inseguro, sino que la seguridad debería ser más extensamente evaluada.
Figura 1. Fisiología del hierro en adultos sanos.
dEfINICIóN dE dEfICIENCIa dE hIERRo
La deficiencia de hierro es una situación en la que no existe suficiente hierro o que este no puede ser incorporado al proceso fisiológico para mantener la función normal de los tejidos. Para su valoración, hoy en día, lamentablemente, no hay marcadores muy precisos. La concentración de ferritina sérica tiene una buena correlación con las reservas corporales de hierro, pero su utilidad diagnóstica se ve limitada por su condición de reactante de fase aguda, ya que aumenta en cuadros de inflamación, infección y malignidad, independientemente de los depósitos de hierro, y también en las enfermedades hepáticas por liberación de ferritina desde los hepatocitos. El índice de saturación de transferrina (IST) es la medida más directa del hierro disponible para la eritropoyesis, pero su aplicación práctica tiene algunas limitaciones como la desnutrición, donde la transferrina puede estar disminuida independiente de las reservas de hierro, la variabilidad diurna en cada paciente y la disparidad entre los resultados de distintos laboratorios.
La deficiencia de hierro puede existir en presencia o en ausencia de anemia y se puede clasificar en:
• Deficiencia de hierro absoluta. Ocurre en las circunstancias en las que la reserva de hierro está disminuida.
• Deficiencia de hierro funcional. Ocurre cuando el hierro sí está presente en el organismo pero no puede ser utilizado.
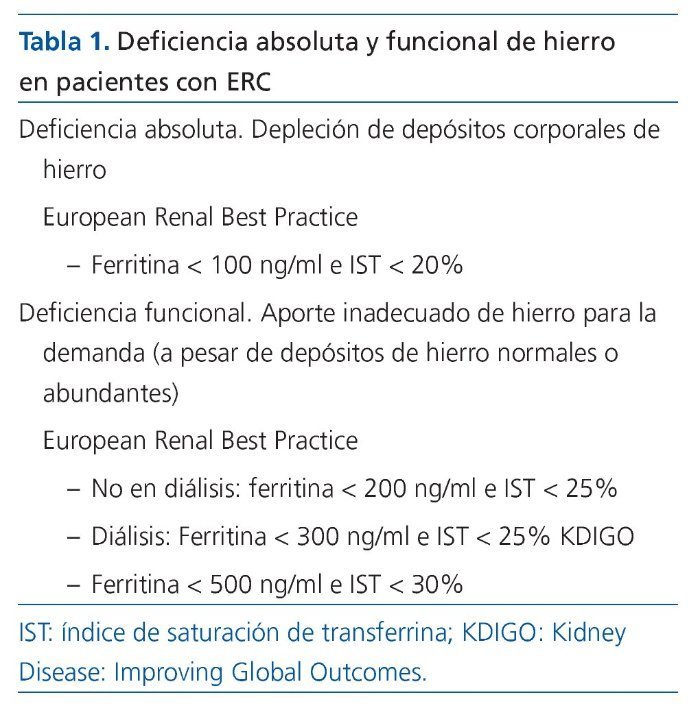
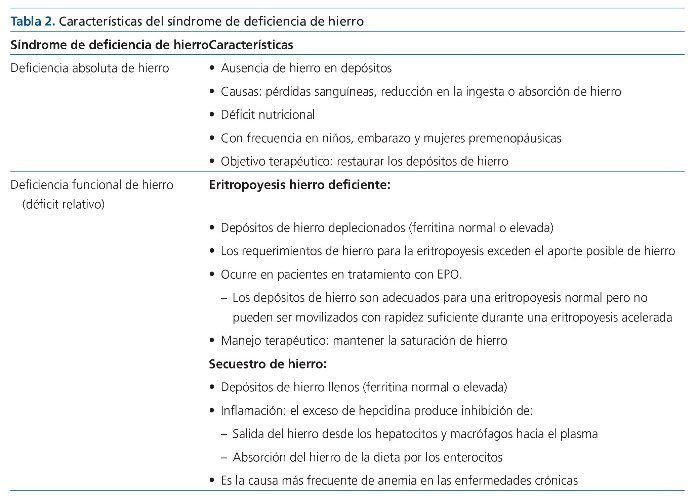
En la tabla 1 se muestran las diferentes definiciones de la deficiencia de hierro absoluta y funcional según las recomendaciones de las ERBP (European Renal Best Practices) y de KDIGO (Kidney Disease: Improving Global Outcomes). En la tabla 2 pueden observarse las diferentes características de los síndromes por deficiencia de hierro.
adMINIStRaCIóN dE hIERRo EN PaCIENtES CoN ENfERMEdad RENal CRóNICa
La administración de hierro en el paciente con enfermedad renal crónica (ERC) ha sido objeto de una gran controversia y debate, tanto en cuanto la vía (oral [v.o.] o i.v.) como en cuanto a sus pautas de administración (dosis y frecuencia).
Un punto relevante para comprender este debate fue el estudio TREAT2. En este estudio aleatorizado prospectivo, en el que se comparaban pacientes diabéticos con ERC y anemia que fueron sometidos a tratamiento con darbepoetina o placebo, se evidenció que la rama placebo, que únicamente recibían dosis de hierro i.v., conseguía controlar adecuadamente la hemoglobina (Hb) hasta una media de 10,6 g/dl durante el estudio e incluso superior al finalizar este. Eso significaba, que sin necesidad de agentes estimuladores de la eritropoyesis muchos pacientes con ERC, simplemente con la reposición de hierro podían alcanzar los valores de Hb diana deseados.
Aunque la administración de hierro v.o. es más barata y más fácil de administrar, los pacientes con ERC presentan una menor tolerabilidad gastrointestinal y una peor absorción debido al bloqueo de la expresión de ferroportina, que es la proteína encargada de la absorción de hierro en el intestino. Es por esto que la administración i.v. de hierro es necesaria en muchos casos para conseguir una repleción de hierro, un aumento en los valores de Hb o también para disminuir las dosis de agentes estimulantes de la eritropoyesis (AEE). Como consecuencia de las recomendaciones KDIGO hubo, especialmente en Estados Unidos, un cambio en la aproximación a la anemia del paciente con ERC, de manera que hubo una tendencia a la reducción de los valores de Hb y de las dosis de AEE y un aumento del consumo de hierro i.v. y de las transfusiones. Se observaron altos valores de ferritina, que pasaron de una media de 300 ng/ml al inicio de los años noventa a cerca de 800 ng/ml en la actualidad3. En el estudio DOPPS4, la prescripción de hierro i.v. varió entre países y asimismo creció con el tiempo provocando elevaciones en la ferritina, aunque menos en el IST. Y no solo debido a esta exagerada administración de hierro sino también a una disminución del uso de AEE manteniendo estas dosis de hierro y también al hecho de la inflamación asociada a la ERC.
CoNfERENCIa KdIGo EN SaN fRaNCISCo (MaRzo dE 2014)
Los depósitos de hierro están regulados con mucha precisión en el organismo. En condiciones normales, el hierro es absorbido lentamente cada día procedente de la dieta, y en esa absorción influyen intestino, hígado y otros sistemas de transporte y metabolización. Por el contrario, cuando un paciente recibe hierro i.v. se sortean los procesos que regulan la absorción, lo que podría tener efectos sobre la seguridad. Además de los cambios que introduce el tratamiento con hierro i.v., en los datos analíticos la evidencia de la repercusión de este incremento en la evolución clínica en relación con el uso de hierro i.v. no es muy abundante y el efecto de dicha administración sobre la morbilidad y mortalidad no es bien conocido. Además hay evidencia experimental y observacional de que el hierro i.v. puede aumentar el estrés oxidativo, favorecer la aterogénesis y el riesgo cardiovascular y, asimismo, aumentar la susceptibilidad a las infecciones y, en raras ocasiones, inducir reacciones de hipersensibilidad.
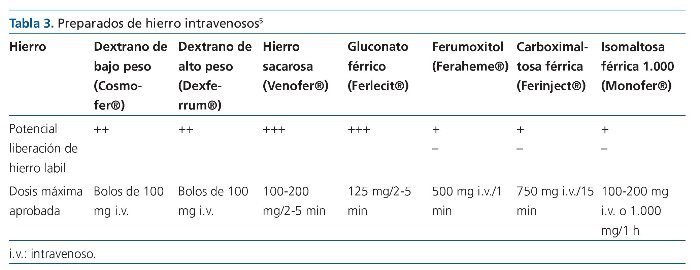
En consecuencia, es necesario conocer con precisión si la administración de hierro i.v. y la consiguiente elevación de los valores de ferritina son dañinos para los pacientes. Los diferentes productos comerciales pueden asimismo ser también diferentes en cuanto a toxicidad. En la tabla 3 se pueden ver los diferentes productos de hierro i.v.5.
En relación con todas estas incógnitas, la anteriormente mencionada conferencia KDIGO se centró en 4 temas fundamentales, que son los que se discuten en este documento: sobrecarga de hierro, estrés oxidativo, infecciones y reacciones de hipersensibilidad6.
SobRECaRGa dE hIERRo
Antes de la introducción de la eritropoyetina (EPO), los pacientes recibían múltiples transfusiones y la sobrecarga de hierro era un problema común, aunque se trata de una condición no sencilla de definir. En ella existe un aumento en el contenido total de hierro corporal asociado a algún tipo de disfunción orgánica. En observaciones realizadas en pacientes con hemocromatosis hereditaria se ha visto que el exceso de hierro en el parénquima y el exceso de hierro lábil pueden ser tóxicos, mientras que el hierro depositado en las células del sistema reticuloendotelial (SRE) no parece ser tan nocivo.
El problema es que la elevación de la ferritina no solo significa sobrecarga de hierro, puesto que es un reactante de fase aguda que puede incrementar en presencia de inflamación. Además, los valores elevados de ferritina sérica no nos indican si el hierro está almacenado en las células del parénquima o en las del SRE. Y siguiendo con el ejemplo de la hemocromatosis, lo que sí que se puede considerar es que cuando a esos valores elevados de ferritina sérica se les unen valores elevados del IST, entonces sí se puede presumir que existe un mayor depósito de hierro parenquimatoso.
Hasta ahora se ha intentado la aproximación al análisis de la sobrecarga de hierro mediante resonancia magnética (RM) u otros métodos de imagen, pero no está claro que unas imágenes que demuestren depósitos de hierro en el hígado sin alteraciones enzimáticas signifiquen algo clínicamente relevante.
Los aspectos sobre la sobrecarga de hierro en pacientes con ERC que reciben hierro i.v. fueron discutidos en esta conferencia KDIGO con las siguientes conclusiones:
• La sobrecarga patológica de hierro representa una condición de elevado contenido corporal de hierro asociada con signos de disfunción de órganos que están presumiblemente causados por el exceso de hierro.
• El exceso de hierro en el parénquima y el hierro lábil pueden ser perjudiciales, mientras que el hierro en las células del SRE no son tan preocupantes.
• El valor de ferritina sérica no indica si el hierro se almacena en las células del parénquima o en células del SRE.
• Es preocupante la combinación de valores elevados de IST y los altos valores de ferritina sobre la base de la experiencia en pacientes con hemocromatosis hereditaria y la inducida por sobrecarga de hierro transfusional.
• El contenido de hierro según las estimaciones de imágenes por RM se correlaciona con las dosis de hierro previas. Sin embargo, no está claro cuál es la relevancia clínica de estos hallazgos en ausencia de enzimas hepáticas elevadas.
• La técnica de RM se debe utilizar en investigación para comprender mejor su valor en la detección de cambios clínicamente relevantes en el contenido de hierro en los tejidos. La comparación de las señales en el bazo y el hígado puede proporcionar información acerca de la distribución de hierro entre las células del parénquima y del SRE.
• La RM no parece suficientemente madura todavía para utilizarse en la orientación del tratamiento con hierro en la rutina clínica.
EStRéS oxIdatIVo y RIESGo CaRdIoVaSCUlaR. hIERRo INtRaVENoSo y MoRbIMoRtalIdad
El estrés oxidativo se produce al inicio del deterioro de la función renal y se cree que se asocia a un mal pronóstico y, a menudo, con inflamación persistente. Aunque en la actualidad hay numerosos marcadores disponibles para la estimación del estrés oxidativo, en relación con el tópico que se está analizando, no existe una evidencia clara en los estudios realizados debido a la ausencia de rangos de referencia, la variabilidad de las técnicas de análisis utilizadas y a la falta de información contrastada sobre las relaciones entre los marcadores, el deterioro de la función renal y las comorbilidades asociadas. Ello impide su adopción generalizada en el entorno clínico. Por lo tanto, en la actualidad no existe una técnica de referencia (gold standard) para medir o monitorizar el estrés oxidativo de forma consistente como para valorar el riesgo clínico, la evaluación continuada o el pronóstico.
La administración de hierro i.v. en pacientes con ERC se ha asociado en múltiples estudios con daño oxidativo en diferentes estructuras del organismo (tabla 4) como ADN linfocitario, proteínas y lípidos. Asimismo, se ha comunicado que induce apoptosis celular, disfunción endotelial y aumento de la adhesión monocitaria7-9. Este aumento que produce el hierro i.v. en la adhesión monocito/endotelio y en la producción de anión superóxido se ha asociado a agravación de la aterosclerosis en el paciente urémico y a una mayor mortalidad.
Diferentes estudios observacionales y datos de registros en pacientes en hemodiálisis (HD) han estudiado la asociación entre el hierro i.v. y la mortalidad con resultados muy contradictorios. El estudio DOPPS, que analiza la asociación entre el hierro i.v. y la evolución clínica en más de 30.000 pacientes10, encuentra que existe una mayor mortalidad y riesgo de hospitalización en pacientes que reciben más de 300 mg mensuales de hierro. Sin embargo, los datos del registro DaVita11 en Estados Unidos muestran que solamente existe un aumento de la mortalidad cuando se reciben más de 400 mg de hierro i.v. al mes.
Toda esta confusión viene fundamentalmente porque los estudios no son de larga duración y, en líneas generales, se considera que los pacientes que tienen más morbilidad reciben más cantidad de hierro i.v. Estos pacientes con alta comorbilidad presentan una deficiencia funcional de hierro, de manera que este no se puede utilizar para la formación de hematíes y puede facilitar el estrés oxidativo, la aterosclerosis o la sobrecarga de hierro.
Hay estudios prospectivos aleatorizados, como el FIND-CKD12, que analizan la eficacia del hierro carboximaltosa i.v. en comparación con el hierro v.o. en pacientes que no estaban en diálisis, sin encontrar diferencias en morbilidad a los 12 meses de seguimiento.
Recientemente, un metaanálisis de 2.658 pacientes de 24 estudios realizados solamente con 1 rama y 10 ensayos clínicos aleatorizados, no demostró un aumento en el riesgo de acontecimientos adversos incluyendo infecciones, problemas cardíacos y mortalidad13. Sin embargo, más recientemente, otro estudio aleatorizado prospectivo que comparaba hierro v.o. frente a hierro i.v. en pacientes no en diálisis hubo de ser interrumpido por el comité de control de seguridad por una significativa diferencia de infecciones y mortalidad en el grupo que recibía hierro i.v.14.
Asimismo, también hay muchos estudios contradictorios respecto al tratamiento con antioxidantes para bloquear los efectos prooxidativos del hierro i.v. En la actualidad, no se sabe si el aumento del estrés oxidativo en el medio urémico responde a estrategias de tratamiento con antioxidantes.
Las conclusiones de la conferencia a este respecto fueron:
• El hierro i.v. puede provocar daño oxidativo en el ADN de linfocitos de sangre periférica en pacientes en HD, oxidación de proteínas y oxidación de lípidos.
• Hay estudios que demuestran que el hierro i.v. provoca apoptosis celular.
• Existen estudios en animales que demuestran diferencias entre los diferentes compuestos de hierro y entre hierro, sacarosa original y similares de hierro i.v. en lo que respecta a inducción de marcadores proinflamatorios, estrés oxidativo y depósitos tisulares (corazón, riñón, hígado).
• No se han encontrado cambios en los marcadores subrogados de estrés oxidativo e inflamación relacionados con tratamientos con antioxidantes (vitamina E, vitamina C, N-acetilcisteína).
• Las dosis elevadas de hierro i.v. se asocian en algunos estudios con una mayor tasa de mortalidad en la población en diálisis de Estados Unidos.
• Los estudios clínicos están viciados, bien por su naturaleza observacional, el sesgo de selección, diferentes preparados o por las diferentes indicaciones. Se necesitan más estudios prospectivos aleatorizados para aclarar si el hierro i.v. es mejor o peor que el hierro v.o.
• Los altos valores séricos de hepcidina y ferritina podrían representar una señal de advertencia con respecto a la administración adicional de hierro.
adMINIStRaCIóN dE hIERRo y RIESGo dE INfECCIoNES
El hierro es fundamental para los microorganismos. Mientras estos han desarrollado potentes mecanismos para su obtención, el cuerpo humano secuestra el hierro en los tejidos en presencia de infección. Pero por otra parte, la deficiencia de hierro produce una inhibición de la respuesta immune, así que nos encontramos ante una relación compleja entre el hierro y las infecciones, con muchos estudios básicos que buscan la respuesta adecuada.
Desde el punto de vista clínico, Ishida y Johansen15 revisaron la asociación entre tratamiento con hierro y aumento del riesgo de infección en pacientes en HD. En 13 trabajos estudiaron la asociación entre el riesgo de infección y los valores séricos de ferritina y en 24 estudios con la utilización de hierro i.v. Entre los 13 estudios que examinan el riesgo de infección con los valores séricos de ferritina, 9 encontraron una asociación y 4 no. Todos ellos tienen limitaciones, pues muchos son retrospectivos y con bajo número de pacientes. Entre los 24 estudios que analizan el uso de hierro y la infección, 12 encuentran una asociación y 12 no. Entre los estudios positivos, solo 2 son prospectivos aleatorizados, pero no tuvieron como objetivo el riesgo de infección.
Un reciente metaanálisis de ensayos controlados aleatorios que evalúan el efecto del hierro i.v. (a menudo administrado como bolos frecuentes) sobre el riesgo de infección en poblaciones diversas, demostró que el hierro i.v. está asociado con un 30% mayor de riesgo de infección en comparación con el hierro v.o. y no tratamiento con hierro16. Por el contrario, otro metaanálisis que evalúa la seguridad y eficacia del hierro i.v. en deficiencia funcional de hierro en pacientes con ERC, no encontró asociación con el riesgo de infección13.
Siguiendo las recomendaciones que hicimos en KDIGO se puede concluir que la evidencia respecto a la administración de hierro y el riesgo de infección se deriva principalmente de estudios observacionales realizados en pacientes en HD, no exentos de factores de confusión. Los pocos estudios aleatorizados incluyen un pequeño número de pacientes, con un corto seguimiento y no estaban específicamente diseñados para evaluar el riesgo de infección con la administración de hierro i.v. Por otra parte, varias revisiones sistemáticas y metaanálisis realizados hasta la fecha no son concluyentes. A pesar de las pruebas contradictorias en relación con la administración i.v., el uso de hierro y el riesgo de infecciones, las recomendaciones KDIGO actuales consideran tener en cuenta el balance riesgo-beneficio ante la administración de hierro i.v. y desaconsejar el uso de hierro i.v. en pacientes con infección sistémica activa.
Las conclusiones de la conferencia a este respecto fueron:
• El hierro afecta la proliferación de células T y la respuesta inmunológica (macrófagos/neutrófilos), tanto en modelos animales como en pacientes en diálisis. El cómo este efecto sobre el sistema inmune se traduce en un mayor riesgo de infección se desconoce aún.
• La revisión de la bibliografía apoya la existencia de una asociación entre el hierro e infección en los pacientes en HD, aunque ciertamente con limitaciones y sesgos importantes.
• A pesar de estos resultados inciertos, la guía KDIGO ha adoptado una recomendación basada en evitar la administración de hierro i.v. en presencia de infección activa. No obstante, hay que tener en cuenta que la suspensión del hierro puede condicionar una deficiencia de hierro, que a su vez conduce a un aumento del riesgo de infección.
hIERRo INtRaVENoSo y REaCCIoNES dE hIPERSENSIbIlIdad
Existen diferentes reacciones de hipersensibilidad a fármacos, como se puede observar en la tabla 5, desde reacciones anafilácticas y otras de menor importancia hasta reactivación de procesos inmunológicos. Las reacciones de hipersensibilidad relacionadas con la administración de hierro i.v. son francamente raras, pero, no obstante, la EMA (European Medicines Agency) advierte de una serie de precauciones que han de tenerse y, entre ellas, menciona la administración en ámbito hospitalario y las medidas de resucitación. Hay una serie de características de determinados pacientes que pueden sugerir un mayor riesgo de hipersensibilidad (tabla 6).
En general se han publicado siempre complicaciones incluso fatales con el hierro i.v., aunque son muy excepcionales, especialmente con las nuevas moléculas que poseen un escudo de carbohidrato que rodea al hierro, que minimiza la liberación de hierro bioactivo.
En general, con el hierro dextrano se han observado reacciones mediadas por IgG —y muy excepcionalmente por IgE— y con otras moléculas de hierro i.v. se ha detectado activación del complemento e inducción de cuadros de seudoalergia. Se han reportado con mayor frecuencia reacciones relacionadas con dextrano de alto peso molecular que con dextrano de bajo peso molecular y menos todavía con hierro sacarosa, aunque puede pasar con todos.
Las más preocupantes han sido reacciones anafilácticas relacionadas con la administración, en Estados Unidos, de ferumoxitol, por lo que se aconsejó mediante un warning box no administrarlo en pacientes con historia de alergia al hierro i.v.
Una revisión sistemática que analiza la seguridad del hierro i.v. y que incluyó 103 ensayos clínicos entre 1965 y 201317 encontró 35 reacciones graves sin ningún caso mortal, aunque en este estudio no estaban incluidos los dextranos. El estudio de Wang et al18 encuentra que la incidencia de anafilaxis en la primera exposición para hierro dextrano fue de 68/100.000 personas, mientras que para las otras moléculas fue de 24/100.000.
En conjunto, el riesgo de las reacciones por hipersensibilidad secundarias al hierro i.v. es bajo. Sin embargo, las recientes recomendaciones de la EMA han sensibilizado a los nefrólogos hacia esas posibles consecuencias negativas de reacciones graves que ocurren en circunstancias en las que no hay adecuada organización para un cuidado de tal emergencia. Por ello se ha reducido la prescripción de hierro i.v. en determinadas circunstancias, como por ejemplo en pacientes que no están en diálisis o en los que reciben HD fuera del hospital con asistencia limitada.
Las conclusiones de la conferencia respecto a este tema son las siguientes:
• El dextrano de alto peso molecular se asocia 3-4 veces más a reacciones adversas con riesgo vital (11,3 por millón de pacientes/tratados) que el dextrano de bajo peso molecular (3,3 por millón de pacientes/tratados) y que el gluconato férrico y hierro sacarosa (0,9 y 0,6 por millón de población tratada, respectivamente).
• Se recomiendan dosis más bajas de hierro sacarosa y gluconato de hierro cuando se administran como una sola infusión para reducir al mínimo el riesgo de valores elevados de hierro lábil y el riesgo para eventuales reacciones. Por el contrario, la carboximaltosa férrica tiene inmunogenicidad mínima y muy limitada liberación de hierro lábil a la circulación. Se puede administrar de forma segura en dosis más altas durante una sola infusión y a un ritmo más rápido que el requerido para las otras preparaciones.
• Dada la baja probabilidad de una reacción al hierro i.v. se recomienda:
– La primera dosis (ya sea en ERC o en diálisis) se debe administrar en un centro hospitalario.
– Las dosis i.v. de gluconato férrico o hierro sacarosa no deben superar los 200 mg/diálisis. Se debe a que el hierro no se une inmediatamente a la transferrina y puede dar lugar a una reacción debida a la presencia de hierro lábil.
– No hay ninguna base fisiológica para recomendar que los pacientes deban ser observados durante 30 min después de que se complete una infusión de hierro, ya que la administración de hierro i.v. no está asociada con una reacción tardía grave.
MoNItoRIzaCIóN y REGUlaCIóN dEl tRataMIENto CoN hIERRo INtRaVENoSo. RECoMENdaCIoNES
La ferritina sérica conjuntamente con la saturación de la transferrina o la capacidad total de transporte de hierro son los marcadores más actuales para valorar los depósitos de hierro. Otros marcadores que han sido propuestos, como el contenido de Hb de los reticulocitos, el porcentaje de hematíes hipocrómicos, el receptor soluble de la transferrina y el hierro lábil, son difíciles de introducir en la práctica clínica diaria.
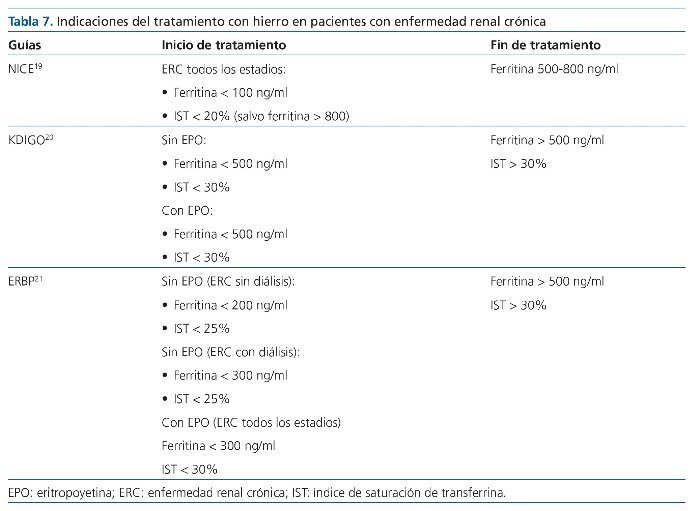
Diferentes guías han recomendado utilizar estos parámetros para el seguimiento de la terapia férrica. En la tabla 7 se resumen los aspectos más importantes de estas guías.
Guías NICE19
• Se recomienda que los pacientes estén replecionados de hierro para alcanzar el valor de Hb diana, estén o no recibiendo EPO (1A).
• Se define una situación de hierro adecuada si la ferritina sérica es:
– De 200 a 500 ng/ml en pacientes en HD.
– De 100 a 500 ng/ml en pacientes no en diálisis.
– IST > 20% y/o < 6% de hematíes hipocrómicos.
• Recomendamos que el tratamiento con EPO no se inicie en presencia de una deficiencia absoluta de hierro (ferritina < 100 ng/ml). En pacientes con deficiencia de hierro funcional, los suplementos de hierro se deben administrar antes o cuando se inicie tratamiento con EPO (1A).
• Sugerimos que el hierro v.o., en general se administre en pacientes con ERC que no están en diálisis y en aquellos en diálisis peritoneal (2B).
• Por el contrario, la mayoría de los pacientes en HD requerirán hierro i.v. (2A).
• Recomendamos que la ferritina sérica no exceda de 800 ng/ml en pacientes tratados con hierro, y para alcanzar esto el tratamiento con hierro debe ser revisado cuando la ferritina sea > 500 ng/ml (1B).
• Recomendamos control de la situación de hierro (1-3 meses) durante el tratamiento, para evitar la toxicidad (1B). Una ferritina sérica consistentemente > 800 ng/ml es sugestiva de sobrecarga de hierro (1B).
• Recomendamos que estén disponibles medidas preventivas y de control de recuperación y resucitación ante una eventual anafilaxis cuando se administre el hierro dextrano (1A).
Recomendaciones KdIGo20
Tratamientos con preparados de hierro
• Al prescribir un preparado con hierro es necesario balancear los beneficios de disminuir las transfusiones sanguíneas, el tratamiento con EPO y los síntomas asociados a la anemia frente a los riesgos (reacciones anafilácticas y otras reacciones agudas, efectos perjudiciales a largo plazo, etc.) (sin graduación).
• En pacientes con ERC con anemia sugerimos hierro i.v. (o en pacientes que no están en diálisis, alternativamente hierro v.o. en un período de 1 a 3 meses) (2C): si se desea un aumento en la concentración de Hb (o disminuir las dosis de EPO en los tratados) siempre que el IST sea < 30% y la ferritina < 500 ng/ml.
• Para pacientes con ERC no en diálisis que requieren suplementos de hierro, seleccionar la vía de administración según la gravedad de la deficiencia de hierro, las posibilidades de acceso venoso, la respuesta a un tratamiento previo con hierro v.o., los efectos secundarios relacionados con un tratamiento previo con hierro v.o. o tratamiento i.v., el cumplimiento del paciente y los costes (sin graduación).
• Seguir con la administración de hierro en pacientes con ERC según la respuesta de la Hb a tratamiento con hierro reciente, pérdidas sanguíneas, marcadores de estado férrico (IST y ferritina), concentración de Hb, respuesta a la EPO y dosis de EPO en pacientes que reciben EPO, tendencia en cada uno de los parámetros y estado clínico del paciente (sin graduación).
Evaluación de la deficiencia de hierro
• Evaluar la situación del hierro del paciente (IST y ferritina), al menos cada 3 meses durante el tratamiento con EPO (sin graduación).
• Realizar estos estudios de estado de hierro (IST y ferritina) cuando se está iniciando o aumentando la dosis de EPO, cuando hay pérdida sanguínea, cuando hay que monitorizar la respuesta después de un tratamiento con hierro i.v. y en otras circunstancias en que puede haber depleción de hierro.
Cuidados en relación con el tratamiento con hierro
• Cuando se inicia la dosis de hierro dextrano i.v., se recomienda (1B), y cuando se da una dosis inicial de hierro dextrano i.v., se sugiere (2C), que los pacientes sean monitorizados durante 60 min después de la infusión y con medidas de resucitación cercanas (incluyendo medicaciones y personal entrenado).
Hierro durante la infección
• Evitar la administración de hierro i.v. en pacientes con infecciones activas sistémicas (sin graduación).
European Best Practice Guidelines con relación al tratamiento con hierro21
• En pacientes adultos con ERC y con anemia que no están bajo tratamiento con hierro o con EPO sugerimos tratamiento con hierro i.v. o cuando se tolere oralmente como primer paso en aquellos pacientes no en diálisis, especialmente ERC grados II y III o en pacientes con diálisis peritoneal sí:
– Existe una deficiencia absoluta de hierro (IST < 20% y ferritina sérica < 100 ng/ml).
– Se desea un aumento en la concentración de Hb sin iniciar tratamiento con EPO.
– Se recomienda un IST < 25% y de la ferritina < 200 ng/ml en pacientes con ERC no en diálisis y < 25% y ferritina < 300 ng/ml en pacientes en diálisis.
• Después del tratamiento con hierro, el límite del IST del 30% y de la ferritina de 500 ng/ml no debe de excederse intencionalmente en todo tipo de pacientes con o sin diálisis.
• En pacientes adultos con ERC que están bajo tratamiento con EPO y que no reciben suplementos de hierro se recomienda iniciar tratamiento con hierro i.v. (en pacientes que no están en diálisis podría emplearse inicialmente tratamiento con hierro v.o. si es tolerado), si se desea un aumento en la concentración de Hb o una dosis menor de EPO y la saturación de la transferrina es < 30% y la ferritina < 300 ng/ml.
• En pacientes en HD es conveniente poner hierro i.v. y en los que tienen unos valores de ferritina elevados en presencia de resistencia a la EPO o cuando el balance entre el riesgo y el beneficio va contra el uso de EPO.
• Se aconseja, con cuidado, exceder la ferritina de valores de 500 ng/ml cuando se está tratando con hierro y EPO en pacientes en diálisis, especialmente en los que tienen un IST > 30%.
Conflicto de intereses
Los autores manifiestan no tener conflicto de intereses.
CoNCEPtoS ClaVE
• Por la observación clínica parece evidente que la administración i.v. de hierro se tolera bien. Sin embargo, la seguridad y eficacia de la administración de hierro i.v. no se han analizado suficientemente.
• No se han realizado ensayos clínicos con el tamaño de muestra y seguimiento adecuados, que proporcionen el suficiente conocimiento de la seguridad y eficacia de la administración de hierro i.v.
• La deficiencia de hierro absoluta ocurre en las circunstancias en las que la reserva de hierro está disminuida. La deficiencia de hierro funcional ocurre cuando el hierro sí está presente en el organismo, pero no puede ser utilizado.
• La conferencia KDIGO se centró en 4 temas fundamentales: sobrecarga de hierro, estrés oxidativo, infecciones y reacciones de hipersensibilidad.
• La sobrecarga patológica de hierro representa una condición de elevado contenido corporal de hierro asociada con signos de disfunción de órganos (y no por imagen en RM) que presumiblemente están causados por el exceso de hierro.
• El valor de ferritina sérica no indica si el hierro se almacena en las células del parénquima o en células del SER, en cuyo caso no es preocupante.
• La administración de hierro i.v. en pacientes con ERC se ha asociado, en múltiples estudios, con daño oxidativo en diferentes estructuras del organismo y asimismo apoptosis celular.
• Diferentes estudios observacionales y datos de registros en pacientes en HD han estudiado la asociación entre el hierro i.v. y la mortalidad, con resultados muy contradictorios.
• Los altos valores séricos de hepcidina y ferritina podrían representar una señal de advertencia con respecto a la administración adicional de hierro.
• La revisión de la bibliografía apoya la existencia de una asociación entre el hierro y la infección en los pacientes en HD, aunque ciertamente con limitaciones y sesgos importantes.
• Evitar la administración de hierro i.v. en presencia de infección activa.
• Las reacciones de hipersensibilidad relacionadas con la administración de hierro i.v. son francamente raras, pero hay una serie de precauciones preventivas a considerar. El dextrano de alto peso molecular se asocia 3-4 veces más a reacciones adversas con riesgo vital (11,3 por millón de pacientes/tratados) que el dextrano de bajo peso molecular (3,3 por millón de pacientes/tratados) y que el gluconato férrico y hierro sacarosa (0,9 y 0,6 por millón de población tratada, respectivamente).
• La carboximaltosa férrica tiene inmunogenicidad mínima y muy limitada liberación de hierro lábil a la circulación, por ello se puede administrar de forma segura en dosis más altas durante una sola infusión y a un ritmo más rápido que el requerido para las otras preparaciones.
• La ferritina sérica conjuntamente con la saturación de la transferrina o la capacidad total de transporte de hierro son los marcadores más actuales para valorar los depósitos de hierro.
• Las diferentes guías coinciden en administrar hierro si es necesario, siempre que la ferritina no sea > 500 ng/ml y el IST > 30%.
Correspondencia:
angelmartindefrancisco@gmail.com (A.L.M. de Francisco).
* Relación de nombres del Grupo de Anemia de la SEN en el anexo.