El paciente con enfermedad renal crónica avanzada (ERCA) presenta una elevada prevalencia de malnutrición. Las restricciones dietéticas que aplicamos habitualmente en cuanto a macro y micronutrientes obligan a nuestros pacientes a seguir pautas dietéticas alejadas de los patrones saludables.
ObjetivoDeterminar si un programa de intervención nutricional personalizado, minimizando las restricciones habituales estaría justificado si mejorase la evolución de la enfermedad renal comparado con el tratamiento estándar.
Objetivos secundariosDeterminar los cambios en las ingestas de nutrientes y en los parámetros antropométricos y bioquímicos, así como los episodios de hiperpotasemia.
Material y métodosSe realizó un ensayo clínico de intervención educativa, unicéntrico, randomizado y controlado en los pacientes de la consulta ERCA del Complejo Hospitalario Universitario de Albacete. Se incluyeron 75 pacientes, asignando 35 en un grupo control y 40 en el grupo de intervención con seguimiento a un año. La situación nutricional se determinó mediante datos antropométricos, composición corporal por bioimpedancia, parámetros bioquímicos en sangre y orina y cuestionario de recuerdo de 24 h. La intervención nutricional se realizó de tres formas: individual, colectiva y recuerdo telefónico.
ResultadosAl inicio del estudio, el IMC mostró una situación de exceso de peso con una media en hombres de 28,83 kg/m2 (5,4) y de 26,96 kg/m2 (4,09) en mujeres. El 70% de nuestros pacientes mostraron exceso de peso. La circunferencia abdominal fue de 105,3 cm (10,2) y 92,3 cm (13,7) para hombres y mujeres, respectivamente, sin cambios significativos a lo largo del estudio. El porcentaje de masa grasa (MG) fue elevado tanto hombres como en mujeres durante todo el estudio. Los parámetros bioquímicos no mostraron una situación de malnutrición y solo se observaron diferencias significativas en el filtrado glomerular (FG), que aumentó en el grupo intervención. Ningún paciente presentó episodios de hiperpotasemia durante el estudio. La ingesta energética mostró una inadecuada distribución de macronutrientes en ambos grupos con una pobre ingesta de hidratos de carbono (HC), que se suple con un exceso de grasa. Para los micronutrientes sí observamos en el grupo intervención un aumento en las ingestas de potasio y fibra con una disminución de las de sodio y fósforo.
ConclusionesMalnutrición no es sinónimo exclusivamente de desnutrición y engloba tanto los problemas derivados del déficit como del exceso de ingesta de nutrientes. El 70% de nuestros pacientes mostraron exceso de peso y un porcentaje de masa grasa mayor del deseable. La aplicación de un programa de educación nutricional individualizado realizando una dieta rica en vegetales y fibra, menos aterogénica, no provocó alteraciones electrolíticas y supuso un enlentecimiento en la progresión de la enfermedad renal.
Patients with advanced chronic kidney disease (ACKD) have a high prevalence of malnutrition. The dietary restrictions that we usually apply in terms of macro and micronutrients force our patients to follow dietary guidelines that deviate from healthy patterns.
ObjectivesTo determine if a personalized nutritional intervention program, minimizing the usual restrictions would be justified in case it improved the evolution of kidney disease compared to standard treatment.
Secondary objectivesTo determine changes in nutrient intakes and in anthropometric and biochemical parameters, as well as quantify episodes of hyperkalemia.
Material and methodsA single-center, randomized and controlled educational intervention clinical trial was conduct in patients from the ERCA outpatients clinic at the Complejo Hospitalario Universitario de Albacete. 75 patients were included, assigning 35 to a Control group and 40 to the Intervention group with 1-year follow-up. The nutritional status was determined using anthropometric data, body composition by Bioimpedance, blood and urine biochemical parameters and a 24-h recall questionnaire. The nutritional intervention was carried out in three different ways: individual, collective and telephone recall.
ResultsAt the beginning of the study, the BMI showed a situation of weight excess with a mean of 28.83 kg/m2 (5.4) in men and 26.96 kg/m2 (4.09) in women. 70% of our patients had overweight. The abdominal circumference was 105.3 cm (10.2) and 92.3 cm (13.7) for men and women respectively without significant changes throughout the study. The percentage of fat mass (FM) was high in both groups for men and women throughout the study. We did not find biochemical parameters of malnutrition and only significant differences were observed in glomerular filtration rate (GFR), which increased in the intervention group. No patient presented any episodes of hyperkalemia during the study. The energy intake in both groups showed an inadequate distribution of macronutrients with a poor intake of carbohydrates (CH) that was supplemented with an excess of fat. In the case of micronutrients, we did observe an increase in potassium and fiber intakes with a decrease in sodium and phosphorus in the intervention group.
ConclusionsMalnutrition is not exclusively an intake deficit and encompasses both the problems derived from a deficit and an excess of nutrients intake. Un to 70% of our patients showed weight excess and a fat mass higher than desirable. The implementation of an individualized nutritional education program, including a vegetables and fiber rich diet, less atherogenic, not only did not cause electrolyte alterations but also slowed the progression of kidney disease.
El manejo nutricional y dietético es un pilar fundamental en el tratamiento de los pacientes con enfermedad renal crónica (ERC) durante toda la evolución de su enfermedad. Los requerimientos nutricionales en macro y micronutrientes van a ir variando conforme avance la enfermedad renal, y las modificaciones en la dieta de nuestros pacientes se intensificarán conforme nos acercamos a los estadios más avanzados de ERC (estadios 4 y 5 de la clasificación1).
El paciente renal tiene muchas probabilidades de estar malnutrido en algún momento de su enfermedad. Según numerosos estudios que incluyen pacientes en diálisis, la prevalencia de malnutrición en la ERC oscila entre el 12-80%2,3, alcanzando cifras superiores en algunas de las series. Las cifras de prevalencia en enfermedad renal crónica avanzada (ERCA) no diálisis oscilan entre el 12 y el 28%, aunque el número de estudios es menor y suelen ser de menor tamaño4–6.
En los últimos años, el término protein energy wasting (PEW), que se define como el estado patológico en el que existe una disminución de los depósitos proteicos y energéticos, otorga igual importancia al catabolismo y a la malnutrición7,8. Existe evidencia de que la desnutrición en la ERC implica un aumento de la morbimortalidad, del número de ingresos hospitalarios, de la estancia media, de las complicaciones de etiología infecciosa y de la mortalidad de origen cardiovascular9.
Pero cuando hablamos de malnutrición en el paciente renal, no solo debemos pensar en el paciente desnutrido. En muchas ocasiones los términos malnutrición y desnutrición se confunden y se utilizan como sinónimos. Por malnutrición se entienden las carencias, los excesos o los desequilibrios de la ingesta de energía y/o nutrientes de una persona. Nos referimos a una problemática mucho más amplia que no solo engloba la desnutrición, sino también otras entidades relacionadas con la alimentación como son el sobrepeso y la obesidad10,11. De hecho, el porcentaje de obesidad está aumentando en nuestros pacientes de igual forma que lo hace en la población general, con datos alarmantes que ya nos indican que más de la mitad de los pacientes con ERCA presentan exceso de peso12.
El consejo nutricional se recomienda desde estadios iniciales. En esta etapa está recomendada una intervención dietética en pacientes con exceso de peso con el fin de disminuirlo, mejorando la hiperfiltración renal y enlenteciendo la progresión de la ERC13,14.
En los estadios más avanzados, las etapas que conforman la ERCA, el consejo nutricional se emplea de igual modo como medida renoprotectora y antiproteinúrica con el fin de intentar retardar la progresión de la ERC y mantener un adecuado estado nutricional15.
Aunque se recomienda que las consultas de ERCA sean multidisciplinares, en muchos centros el principal consejo sigue siendo realizado por el nefrólogo sin la colaboración de un experto en nutrición, viéndonos obligados en nuestro día a día a tratar y a dar consejo nutricional a pacientes muy complejos que están malnutridos de una u otra forma. Las medidas que habitualmente aplicamos a nuestros pacientes son, por un lado, la restricción de energía en forma de macronutrientes para los casos de sobrepeso y obesidad con factores de riesgo cardiovascular asociados y, por otro lado, dietas restrictivas en micronutrientes como fósforo, calcio, sodio y potasio16,17. Se recomiendan restricciones en la ingesta proteica, ya que hay estudios que demuestran que disminuyen la proteinuria y pueden aumentar el FG18. Varios trabajos han sugerido que la mitad de las proteínas de la dieta puedan ser aportadas en forma de proteínas vegetales, disminuyendo de esta manera la biodisponibilidad del fósforo y la producción de toxinas urémicas implicadas en la progresión de la ERC19,20. A pesar de ello, y probablemente por lo antes mencionado, tampoco suele ser la práctica habitual buscar un origen vegetal para el aporte de proteínas. En cuanto a la ingesta hídrica, en muchas ocasiones recomendamos una restricción de líquidos, a pesar de que muchas veces su diuresis probablemente permitiría una ingesta mayor21.
Las recomendaciones de la Organización Mundial de la Salud (OMS) son de un patrón de dieta mediterránea baja en sal en estos pacientes, pero en la práctica habitual, los nefrólogos no recomendamos dietas basadas en vegetales por temor a la hiperpotasemia y a que sean pobres nutricionalmente.
Parece probable que el consejo nutricional que habitualmente hemos ofertado podría no estar garantizando un adecuado soporte calórico y mineral, además de interferir negativamente en la calidad de vida de nuestros pacientes. La tendencia actual apunta a un intento de limitar las restricciones y a que el consejo dietético sea cada vez más individualizado. Algunos ensayos controlados y aleatorizados demuestran cómo en pacientes con ERC grados 3 y 4 que reciben asesoramiento nutricional general, o incluso dietas ricas en frutas y verduras, comparado con la toma de bicarbonato o de resinas en dietas restrictivas, no se observan muchas modificaciones en el potasio sérico o episodios de hiperpotasemia22,23. Nos preguntamos, por tanto, si son tan distintos los requerimientos de los enfermos renales respecto a la población general y qué ocurriría si liberásemos la dieta de nuestros pacientes con una estrecha vigilancia y adecuando el consejo nutricional de forma individual hacia dietas más ricas en vegetales y fibra con menor poder aterogénico. Así, y para conocer la situación en la que nos encontramos, se planteó este estudio, para valorar la situación nutricional del paciente que vemos en nuestra consulta ERCA y determinar si un programa de educación nutricional individualizado con liberación de la dieta mejoraría los parámetros nutricionales antropométricos, bioquímicos y la progresión de la insuficiencia renal, en comparación con las recomendaciones habituales recibidas en la consulta.
Pacientes, material y métodosEn el estudio participaron pacientes de 18 a 80 años diagnosticados de ERCA y atendidos en las consultas de nefrología del Hospital General Universitario de Albacete.
Se diseñó un ensayo clínico de intervención educativa, unicéntrico, randomizado, abierto, controlado, cuya población a estudio son los pacientes de la consulta ERCA de Albacete no en diálisis. El estudio fue aprobado por el Comité Ético y de Investigación de nuestro hospital.
Como criterios de inclusión los pacientes debían ser mayores de 18 años, sin tratamiento renal sustitutivo ni control por nutricionista previos. Los criterios de exclusión fueron padecer cualquier enfermedad infecciosa, inflamatoria o tumoral activa, y la incapacidad para obtener el consentimiento informado.
El tamaño muestral se calculó mediante Epidat (V3.1), software desarrollado por el Servicio de Epidemiología de la Dirección Xeral de Saúde Pública da Consellería de Sanidade (Xunta de Galicia) con el apoyo de la Organización Panamericana de la Salud (OPS-OMS) y la Universidad CES de Colombia.
Con una muestra de 75 pacientes, estos fueros distribuidos de forma aleatoria en grupo control con 35 pacientes y grupo intervención con 40.
Los pacientes de los dos grupos fueron valorados de igual manera. Al inicio se recogieron datos demográficos y las comorbilidades asociadas.
Se realizó la valoración nutricional mediante una detallada historia clínica. Las ingestas medias de energía (kcal), hidratos de carbono (HC) medidos en g y expresados como % de las kcal totales al igual que las grasas, proteínas (g/kg/día), grasas saturadas (%), sodio (mg), potasio (mg), fósforo (mg), fibra (g), vitaminas C (g), D (mcg) y E (g), se obtuvieron a partir de cuestionarios de recuerdo de 24 h realizados en tres días distintos, incluyendo uno de fin de semana. Para el análisis de estos datos se empleó el software de nutrición Odimet®, organizador dietético metabólico diseñado por el Hospital Clínico Universitario de Santiago de Compostela, España.
Las variables empleadas para valoración antropométrica fueron el peso (kg) y talla (cm), obteniendo el índice de masa corporal (IMC) en kg/m2, la circunferencia abdominal (CA) (cm), considerando que un perímetro ≥ 102 cm en hombres y ≥ 88 cm en mujeres diagnostica la obesidad abdominal. Además, se realizó una bioimpedancia multifrecuencia (BCM Fresenius®) para medir composición corporal. Mediante bioimpedancia, se valoró el porcentaje de masa libre de grasa (MLG) respecto a la masa corporal total (% MLG), que se considera adecuado cuando está por encima del 40-50%, siendo útil tanto para una sola medición como para valorar evolución y el porcentaje de masa grasa (% MG), útil tanto una sola medición como para valorar evolución y se considera obesidad cuando supera el 25% en hombres y el 33% en mujeres.
Las variables medidas en sangre y orina fueron (con las unidades y los rangos de normalidad de nuestro laboratorio): urea (10-50 mg/dL), creatinina (0,7-1,2 mg/dL), filtrado glomerular (FG) (mL/min/1,73 m2), proteinuria de 24 h (g/día), bicarbonato (22-26 mmol/L), linfocitos totales (1-4 x 103/mcl), transferrina (200-360 mg/dL), albúmina (3,5-5,2 g/dL), proteínas totales (6,6-8,7 g/dL), prealbúmina (20-40 mg/dL), PCR (0-5 mg/L), sodio (135-145 mmol/L), potasio (3,5-5,1 mmol/L), calcio (8,6-10,2 mg/dL) y fósforo (2,6-4,5 mg/dL).
El seguimiento se realizó durante un año. Estas mediciones se realizaron en la primera visita y a los 3, 6 y 12 meses.
Aquellos pacientes que iniciaron terapia renal sustitutiva con hemodiálisis, diálisis peritoneal o trasplante renal fueron excluidos del estudio.
Descripción de la intervención:
Fue preciso un periodo de reclutamiento de seis meses para alcanzar el tamaño muestral.
Se entregaron los consentimientos informados a todos los participantes para su firma.
La recogida de datos se realizó en los meses 0, 3, 6 y 12. La intervención nutricional constaba de cuatro sesiones individuales, ocho sesiones en grupo (que incluyeron talleres de cocina) y ocho recuerdos telefónicos. En las sesiones se trataron aspectos básicos de la alimentación, macronutrientes y micronutrientes, interpretación del etiquetado de alimentos, alergias y técnicas culinarias adaptadas a sus necesidades. Se explicó el sistema de intercambios adaptado a los gustos y preferencias de cada paciente y se hizo entrega de un libro con tablas de composición nutricional adaptado a enfermos renales editado para este estudio24.
En el grupo control se realizaron las recomendaciones sobre estilo de vida y las restricciones habituales que se dan en la consulta de ERCA.
Análisis estadístico: Para la descripción de la muestra se han utilizado medidas de tendencia central (media y desviación típica) en el caso de las variables métricas y medidas de frecuencia (frecuencia absoluta y porcentaje) en el caso de las variables cualitativas. Las diferencias entre grupos, cuando se trata de variables cuantitativas, se han evaluado mediante la prueba t de Student (pruebas paramétricas) o mediante la prueba U de Mann-Whitney (pruebas no paramétricas).
Las comparaciones intergrupales de variables cualitativas se han realizado mediante la prueba χ2, utilizando el estadístico exacto de Fisher en aquellas ocasiones en las que existía una frecuencia esperada inferior a 5. En el caso de las comparaciones intragrupo, para evaluar la progresión de los participantes a lo largo del estudio, comparando sus resultados en las cuatro visitas en las variables métricas, se han utilizado el modelo lineal general para medidas repetidas (pruebas paramétricas) y el estadístico de Friedman (prueba no paramétrica). Para las comparaciones intragrupo de variables cualitativas a lo largo de las cuatro visitas se ha utilizado la prueba Q de Cochran para muestras relacionadas.
Se consideró significativo un valor para la p < 0,05.
Los análisis estadísticos del estudio se han realizado con el software R® (versión 4.0.1), desarrollado por el Departamento de Estadística de la Universidad de Auckland, Nueva Zelanda.
ResultadosCaracterísticas demográficas y clínicasA los 12 meses de iniciado el estudio permanecen 57 pacientes, 21 en el grupo control (ocho abandonos, un trasplante y cinco diálisis). En el grupo intervención continuaron 36 pacientes (un exitus, un abandono y dos iniciaron diálisis). La diferencia en el inicio de diálisis o trasplante entre los grupos se debe al mayor deterioro del FG encontrado en el grupo control. Por otro lado, desconocemos si los abandonos del grupo control se debieron a la falta de una atención estrecha como la del grupo intervención. Estos resultados se tuvieron en cuenta a la hora de analizar los datos.
La media de edad fue de 56,9 años. La distribución por sexo fue en el grupo intervención 53% hombres y 47% mujeres y en el grupo control 60 y 40%, respectivamente.
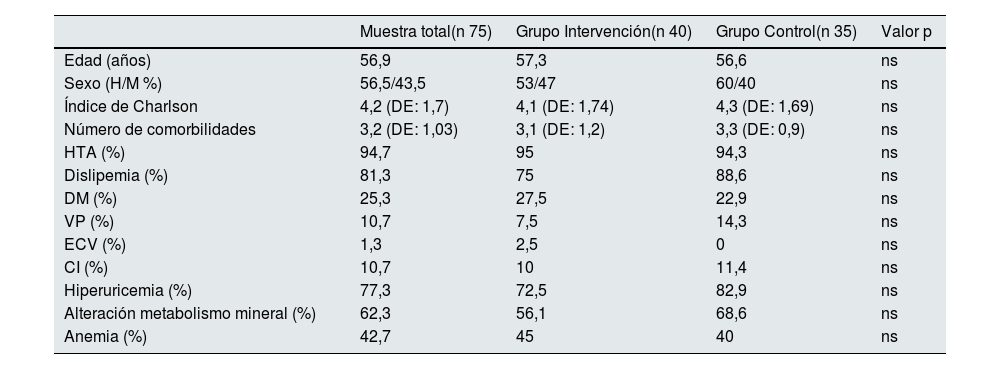
En ambos grupos existe una elevada comorbilidad con un índice de Charlson ajustado por edad de 4,1 (DE 1,74), con al menos tres comorbilidades asociadas (tabla 1).
Características epidemiológicas y comorbilidad asociada expresadas en porcentaje (%), excepto en edad, índice de Charlson y en número de comorbilidades que son numéricas
| Muestra total(n 75) | Grupo Intervención(n 40) | Grupo Control(n 35) | Valor p | |
|---|---|---|---|---|
| Edad (años) | 56,9 | 57,3 | 56,6 | ns |
| Sexo (H/M %) | 56,5/43,5 | 53/47 | 60/40 | ns |
| Índice de Charlson | 4,2 (DE: 1,7) | 4,1 (DE: 1,74) | 4,3 (DE: 1,69) | ns |
| Número de comorbilidades | 3,2 (DE: 1,03) | 3,1 (DE: 1,2) | 3,3 (DE: 0,9) | ns |
| HTA (%) | 94,7 | 95 | 94,3 | ns |
| Dislipemia (%) | 81,3 | 75 | 88,6 | ns |
| DM (%) | 25,3 | 27,5 | 22,9 | ns |
| VP (%) | 10,7 | 7,5 | 14,3 | ns |
| ECV (%) | 1,3 | 2,5 | 0 | ns |
| CI (%) | 10,7 | 10 | 11,4 | ns |
| Hiperuricemia (%) | 77,3 | 72,5 | 82,9 | ns |
| Alteración metabolismo mineral (%) | 62,3 | 56,1 | 68,6 | ns |
| Anemia (%) | 42,7 | 45 | 40 | ns |
H: hombre; M: mujer; HTA: hipertensión arterial; DM: diabetes mellitus; VP: vasculopatía periférica; ECV: enfermedad cerebro vascular; CI: cardiopatía isquémica; DE: desviación estándar; ns: no significativa.
Al inicio del estudio, la media de FG fue de 19,05 mL/min/1,73 m2 (DE: 5,22). No se encontraron diferencias significativas entre los grupos al inicio del estudio para los datos antropométricos y composición corporal, parámetros de laboratorio e ingestas medias.
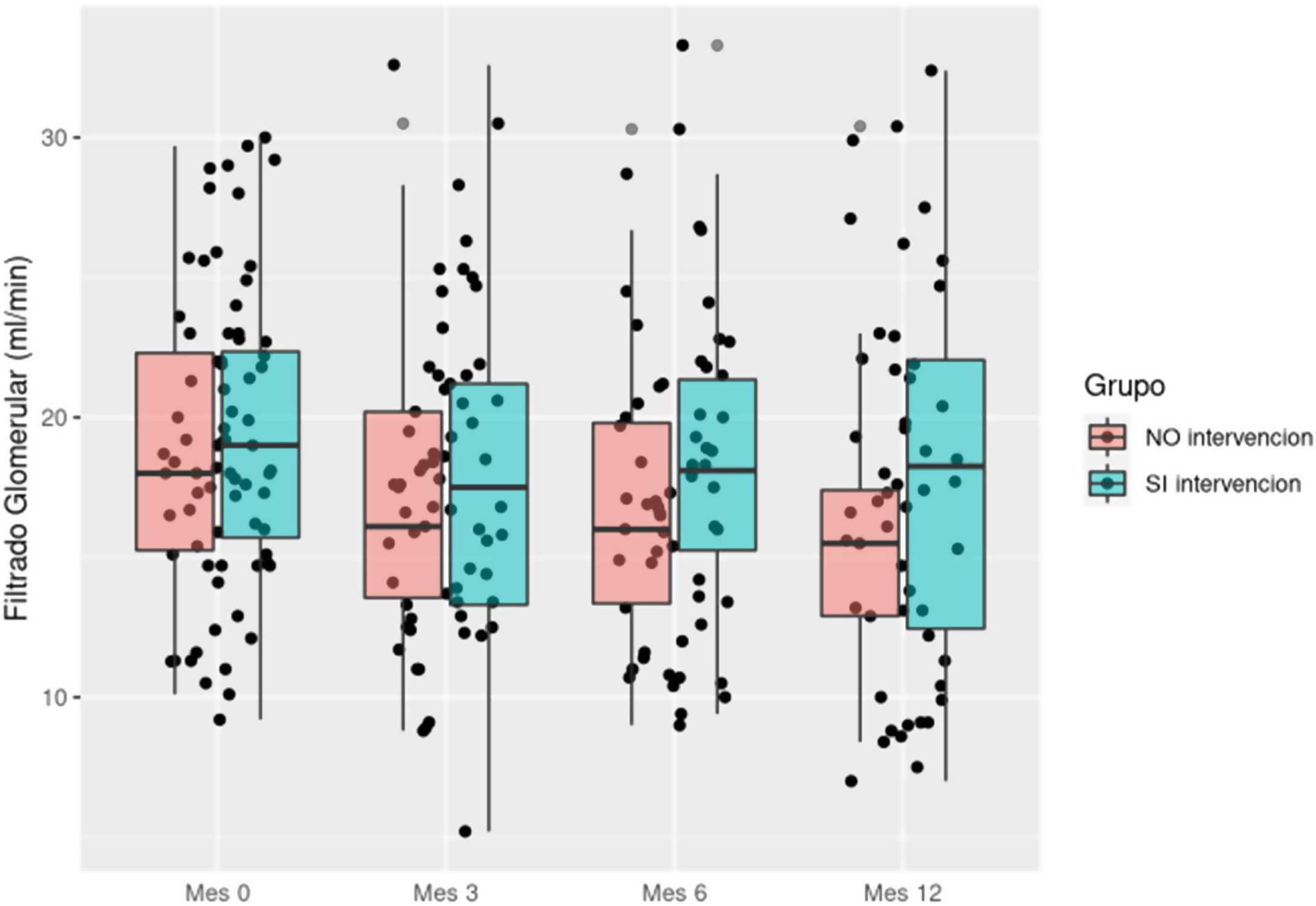
Evolución de la función renalAl final del estudio, la creatinina fue más baja en el grupo intervención y el FG fue más alto (p < 0,05). En la figura 1 vemos cómo el FG aumentó en el grupo intervención de 19,2 a 20,7 mL/min/1,73 m2 a 20,7 mL/min y desciende en el grupo control de 18,9 a 15,3 mL/min/1,73 m2 con diferencias significativas entre ambos grupos (p 0,015).
Antropometría y composición corporalEl peso se mantuvo estable con mínimo descenso en ambos grupos. La media para los hombres fue de 83,3 kg (DE: 10,86) al inicio y 80,3 kg (DE: 11,3) al final; para las mujeres fue de 66,5 kg (DE: 12,55) y 62,6 kg (DE: 9,7), respectivamente.
En el IMC, partiendo de una situación de sobrepeso en ambos grupos con una media de 26,3 kg/m2 en el grupo intervención y 27,9 kg/m2 en el grupo control, apenas se observaron cambios. Los hombres presentaron un IMC de 28,7 (DE: 8,5) y las mujeres 26,7 (DE: 4,7), sin diferencias significativas entre ellos. Cuando lo categorizamos, según lMC en bajo peso (< 18,5 kg/m2), normopeso (18,5-24,9 kg/m2), sobrepeso (25-29,9 kg/m2) y obesidad (> 30 kg/m2) tampoco encontramos diferencias entre los grupos al inicio y al final del estudio. Al inicio del estudio, el porcentaje de pacientes con un IMC en rango de sobrepeso fue de 38,2% y de obesidad con IMC > 30 fue de 31,6%.
La circunferencia abdominal no se modificó de forma significativa. Al comparar por sexo al inicio, se observó una diferencia esperable entre ellos, no significativa. En hombres, la media fue de 105,3 cm (DE: 10,2) y en mujeres 92,3 cm (DE: 13,7).
Las mediciones realizadas con bioimpedancia mostró un porcentaje de MG (%) para los hombres de 28,7% (DE: 8,5) al inicio y 26% (DE: 8,1) al final. Para las mujeres, la MG fue de 37,4% (DE: 10,2) al inicio y 32,6% (DE: 13,2) al final. No hubo modificaciones en ninguno de los grupos.
La masa libre de grasa MLG (%) tampoco sufrió cambios significativos a lo largo del estudio, diferenciando por sexo se encontraron las diferencias esperables entre hombres y mujeres, que no son significativas ni tampoco su cambio. Para hombres, la MLG (%) fue de 59,1 (DE:12,6) al inicio y 63% (DE: 11,7) al final. Para las mujeres, la MLG (%) fue de 48,2 (DE: 14,8) al inicio y 55% (DE: 19,3) al final.
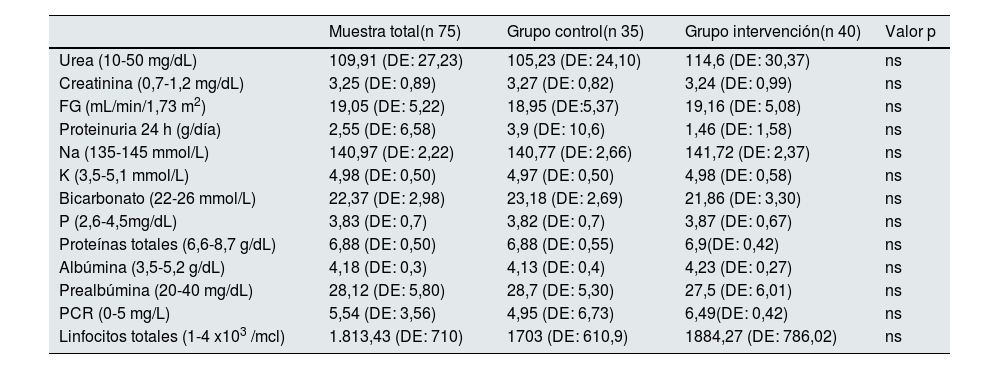
Parámetros bioquímicosLos valores de los parámetros bioquímicos al inicio del estudio se muestran en la tabla 2. No se observaron diferencias estadísticamente significativas a lo largo del estudio en ningún grupo, en cuanto a los valores de laboratorio medidos para urea, proteinuria de 24 h, linfocitos totales, transferrina, albúmina, proteínas totales, prealbúmina, PCR, sodio, potasio y fósforo. El bicarbonato aumentó en el grupo intervención de forma no significativa y sin modificaciones en el pH.
Parámetros bioquímicos al inicio del estudio. Al lado de cara parámetro se muestra el valor de referencia del laboratorio
| Muestra total(n 75) | Grupo control(n 35) | Grupo intervención(n 40) | Valor p | |
|---|---|---|---|---|
| Urea (10-50 mg/dL) | 109,91 (DE: 27,23) | 105,23 (DE: 24,10) | 114,6 (DE: 30,37) | ns |
| Creatinina (0,7-1,2 mg/dL) | 3,25 (DE: 0,89) | 3,27 (DE: 0,82) | 3,24 (DE: 0,99) | ns |
| FG (mL/min/1,73 m2) | 19,05 (DE: 5,22) | 18,95 (DE:5,37) | 19,16 (DE: 5,08) | ns |
| Proteinuria 24 h (g/día) | 2,55 (DE: 6,58) | 3,9 (DE: 10,6) | 1,46 (DE: 1,58) | ns |
| Na (135-145 mmol/L) | 140,97 (DE: 2,22) | 140,77 (DE: 2,66) | 141,72 (DE: 2,37) | ns |
| K (3,5-5,1 mmol/L) | 4,98 (DE: 0,50) | 4,97 (DE: 0,50) | 4,98 (DE: 0,58) | ns |
| Bicarbonato (22-26 mmol/L) | 22,37 (DE: 2,98) | 23,18 (DE: 2,69) | 21,86 (DE: 3,30) | ns |
| P (2,6-4,5mg/dL) | 3,83 (DE: 0,7) | 3,82 (DE: 0,7) | 3,87 (DE: 0,67) | ns |
| Proteínas totales (6,6-8,7 g/dL) | 6,88 (DE: 0,50) | 6,88 (DE: 0,55) | 6,9(DE: 0,42) | ns |
| Albúmina (3,5-5,2 g/dL) | 4,18 (DE: 0,3) | 4,13 (DE: 0,4) | 4,23 (DE: 0,27) | ns |
| Prealbúmina (20-40 mg/dL) | 28,12 (DE: 5,80) | 28,7 (DE: 5,30) | 27,5 (DE: 6,01) | ns |
| PCR (0-5 mg/L) | 5,54 (DE: 3,56) | 4,95 (DE: 6,73) | 6,49(DE: 0,42) | ns |
| Linfocitos totales (1-4 x103 /mcl) | 1.813,43 (DE: 710) | 1703 (DE: 610,9) | 1884,27 (DE: 786,02) | ns |
FG: filtrado glomerular, Na: sodio, K: potasio, P: fósforo, PCR: proteína C reactiva, DE: desviación estandar, ns: no significativa.
Las ingestas de macro y micronutrientes en un análisis previo se compararon según si el paciente era diabético o no, sin mostrar ninguna diferencia, por lo que han sido obviados en los resultados.
La ingesta de energía fue de 22 kcal/kg/día (DE: 6,43) para la muestra, permaneciendo estable en ambos grupos sin cambios significativos. La distribución de la energía en los distintos macronutrientes se detalla a continuación.
Las ingestas de HC fueron el 45,14% (DE: 11,2) de la dieta. En el grupo intervención aumentó inicialmente para luego descender hasta niveles basales a partir de la segunda visita. No se modificaron en el grupo control.
La media de consumo de proteínas fue de 0,92 g/kg/día (DE: 0,3). Las ingestas de proteínas se mantuvieron estables en los dos grupos.
El consumo medio de grasas fue de 35,7% (DE: 3,9) con un 9,8% (DE: 4) de grasas saturadas. Inicialmente bajó la ingesta de grasa en el grupo intervención para ir subiendo de forma progresiva hasta valores basales al final del estudio al igual que las grasas saturadas. Las grasas monoinsaturadas aumentaron ligeramente en el grupo intervención y bajaron en el control. Las poliinsaturadas no se modificaron de forma significativa.
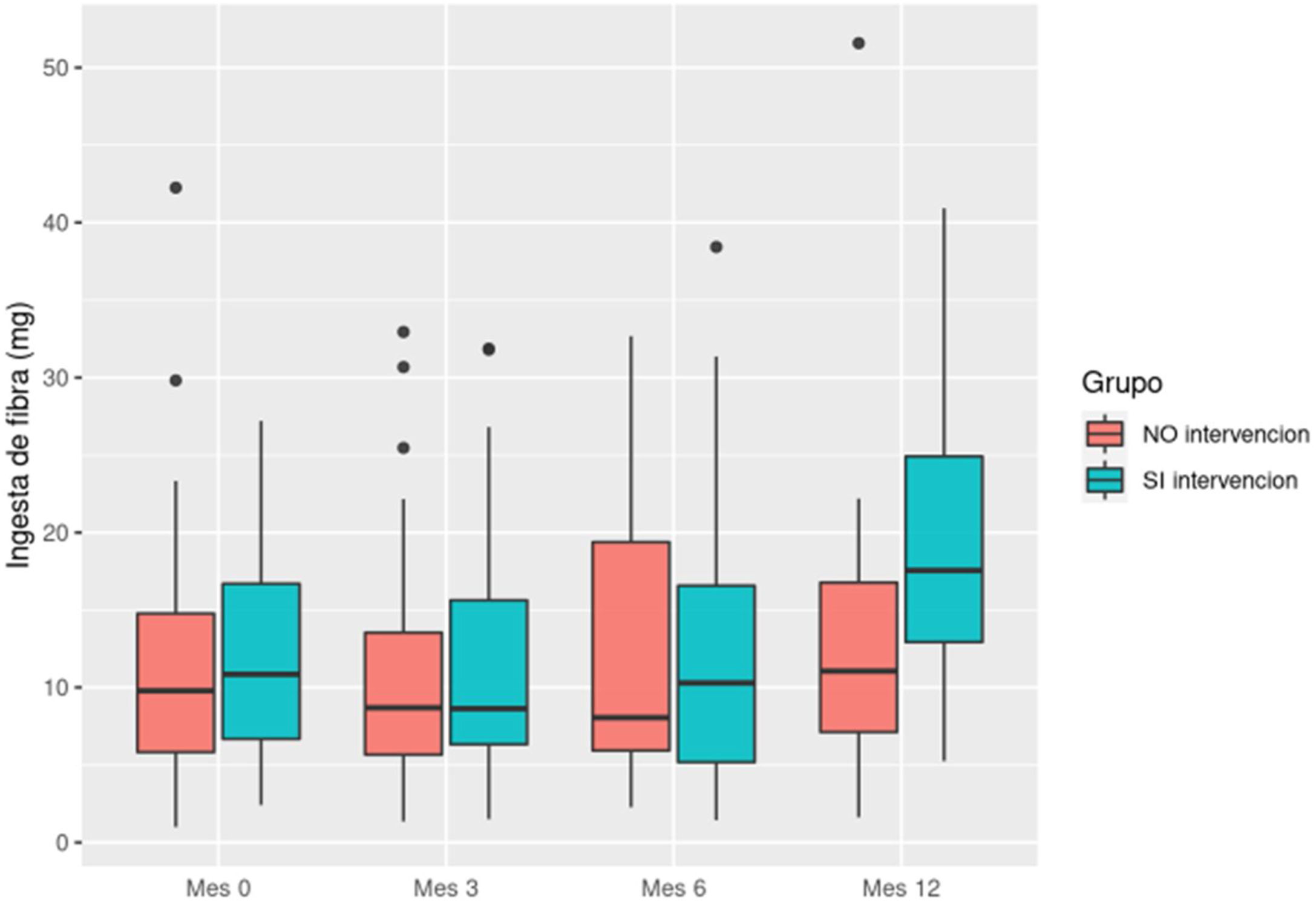
La ingesta media de fibra fue de 11,98 g (DE: 7,74). Se produjo un aumento de consumo en el grupo intervención que partía de 12,25 g (DE: 7,09) y finalizaron el estudio con un consumo medio de 19,9 g (DE: 9,60). En el grupo control fue de 11,67 g (DE: 8,51) y 13,4 g (DE: 10,42), respectivamente (fig. 2).
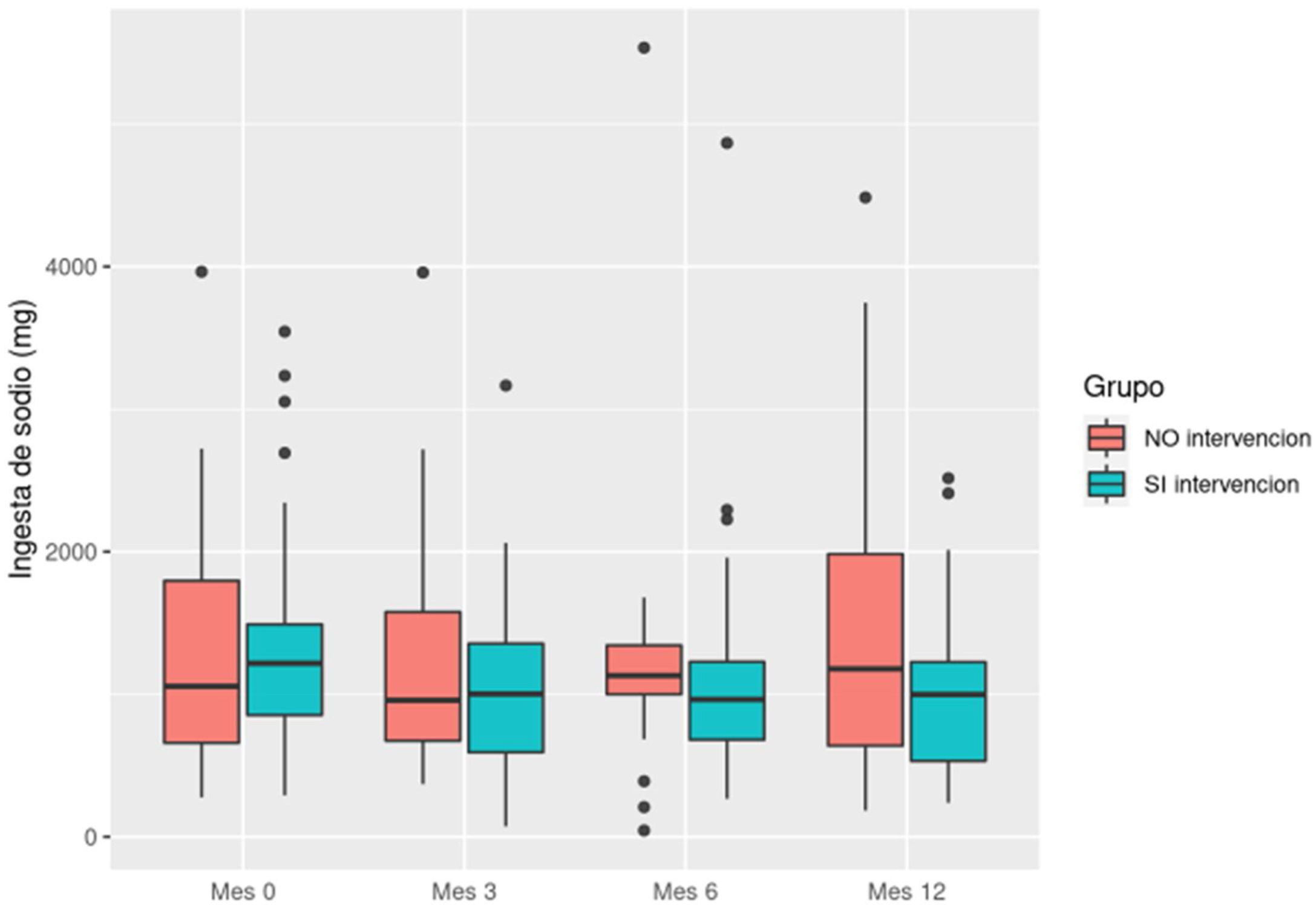
La ingesta diaria de sodio disminuyó en el grupo intervención pasando de un consumo diario de 1.358,2 mg (DE: 750,20) a 983,6 mg (DE: 576,48). En el grupo control aumentó de 1.325,9 (DE: 847,56) a 1.480,81 mg (DE: 1.169,52) (fig. 3).
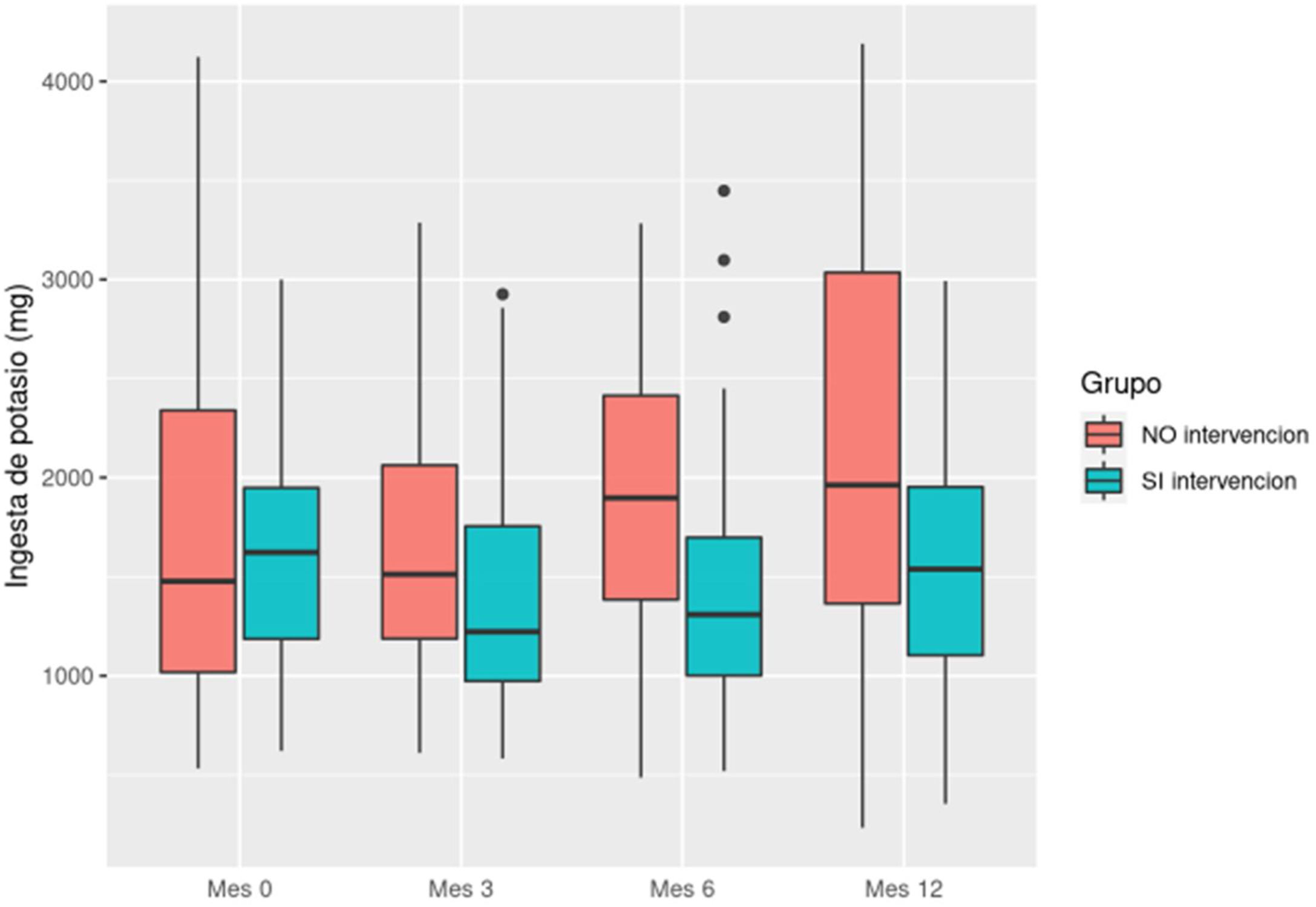
En cuanto al potasio en el grupo intervención, se observa una ingesta más baja de potasio al final del estudio, de los 1.608 mg (DE: 557,06) a los 582,56 (DE: 538,18) al final. En el grupo control fue de 1.093,77 mg (DE: 831,39) al inicio y 1.093,77 mg (DE: 1.093,77) al final (fig. 4).
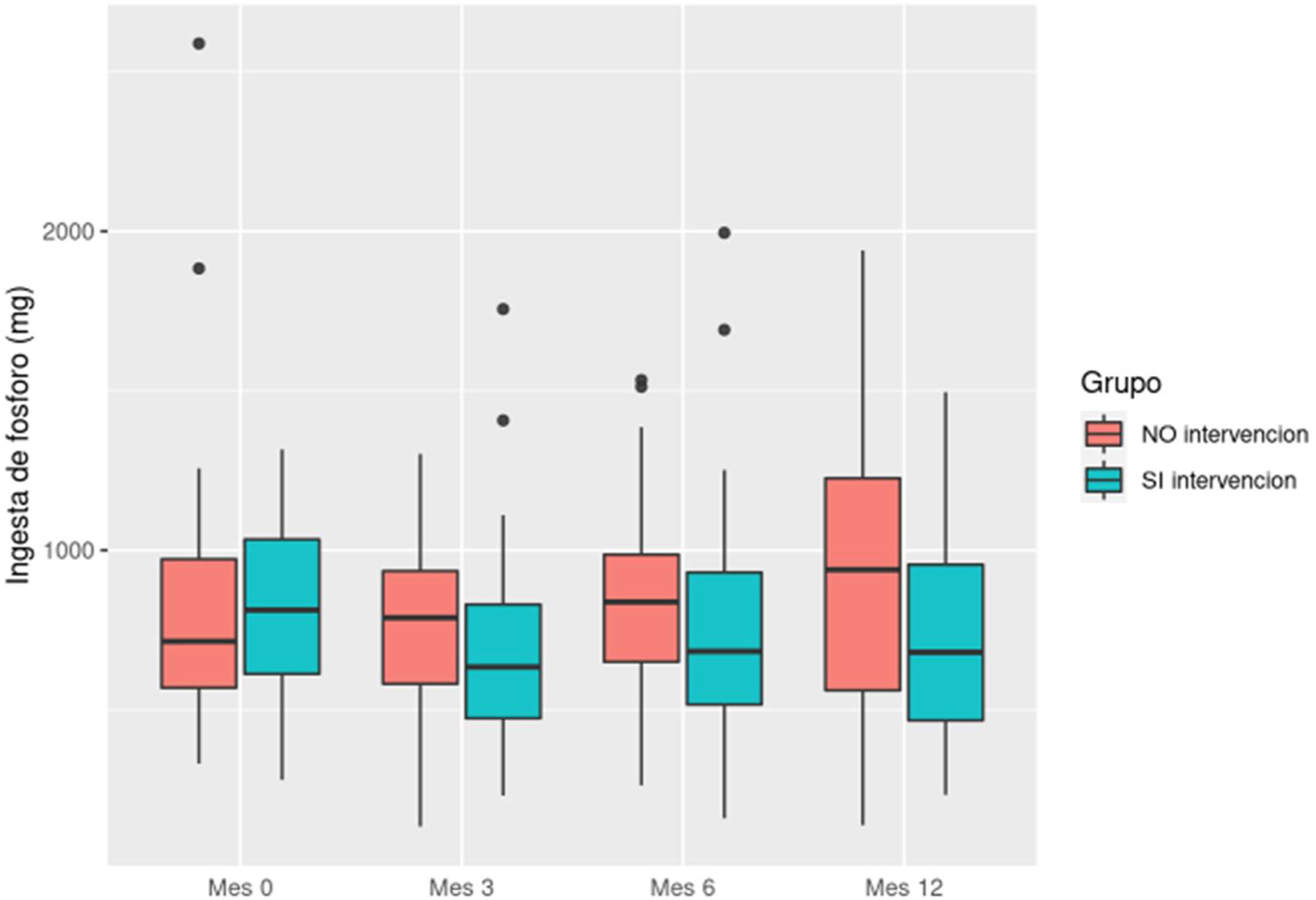
En la ingesta diaria de fósforo, el grupo intervención bajó su consumo de 813,88 mg (DE: 286,06) a 723,57 mg (DE: 324,72), y aumentó en el grupo control de 833 mg (DE: 430,15) a 948,67 mg (DE: 497,13) (fig. 5).
La ingesta de vitaminas A, C, D y E no se modificó de forma relevante.
Frecuencia de consumoA pesar de no encontrar diferencias significativas, sí hemos observado una tendencia de aumento de consumo de vegetales y fruta en el grupo intervención. En el grupo intervención, la frecuencia de consumo de verdura fue de 1,52 (DE: 0,65) al inicio aumentando hasta 2,03 (DE: 1,13) al final. Para el grupo control, la media de consumo de verdura fue de 1,62 (DE: 0,94) al inicio y de 1,5 (DE: 0,65) al final.
Para el consumo de fruta, las raciones fueron de fueron de 1.68 (DE:) y 1.45 (DE: 7,74) en el grupo intervención y 1.53 (DE: 1,14) al inicio y 1,68 (DE: 1,14) a los 12 meses en el grupo control.
DiscusiónEl consejo nutricional es fundamental en el tratamiento de la ERC, ya que la malnutrición asociada con la enfermedad renal predispone a un peor pronóstico y aumento de la morbimortalidad25. El enfermo renal se ha etiquetado habitualmente de desnutrición calórico-proteica, siendo la mayoría de estudios en pacientes en diálisis donde se ha reportado una prevalencia de malnutrición-desnutrición que oscila entre el 12-80%3,26. Hasta la fecha existen muy pocos estudios describiendo la prevalencia de malnutrición en ERCA no en diálisis, con cifras que oscilan entre el 18-28%4–6. En el año 2018 se publicó un estudio español de 186 pacientes que tras la realización de valoración global subjetiva (VGS), criterios de desgaste proteico energético (DPE), registro dietético de tres días, parámetros antropométricos y bioimpedancia, un 27,9% tenía valores en rango de desnutrición6. En nuestro estudio encontramos que el perfil predominante es de malnutrición por exceso con casi un 70% de pacientes con exceso de peso y un porcentaje de masa grasa mayor del deseable. En cuanto a la distribución grasa predomina la obesidad androide, tomando como referencia de riesgo cardiovascular una circunferencia abdominal de 88 cm en la mujer y 102 cm en el hombre, nuestros resultados mostraron una clara situación de riesgo.
La prevalencia de exceso de peso en adultos estimada en España, según datos de la OMS (2017), por IMC, el 61,6% presenta exceso de peso (37,8% de sobrepeso y 23,8% de obesidad)27. El perfil nutricional en la ERC está cambiando conforme el cambio de patrón de la sociedad debido a la epidemia de obesidad y sobrepeso, que a su vez es causante del posterior desarrollo de enfermedades cardiovasculares, hipertensión arterial, dislipemia, resistencia a la insulina y al aumento en la incidencia de algunos tipos de cáncer que están sobrecargando nuestro sistema sanitario, luego la sobrecarga del sistema ya de por sí está saturado.
En ERC, una intervención dietética que consiga bajar de peso produce un incremento en el FG durante un tiempo medio de dos años, independientemente del tipo de dieta llevada a cabo13,28. El tratamiento de la obesidad podría crear conflicto, por lo descrito en algunos trabajos sobre los efectos beneficiosos del sobrepeso sobre la supervivencia en diálisis, fenómeno conocido como «epidemiologia inversa», y que afecta también a variables como la presión arterial o el colesterol, entre otras; 29 pero no está tan claro si este efecto beneficioso se puede mantener a largo plazo30. De Nuevo, la mayoría de estudios son en población en diálisis y no en las etapas previas. Nuestros resultados mostraron una progresión más lenta de la enfermedad renal en el grupo intervención con un FG más elevado, comparado con el grupo control de forma significativa; sin embargo, esta mejoría en el FG no se acompañó de una reducción de peso significativa. Pensamos que el menor deterioro en el grupo intervención podría deberse a los cambios de estilo de vida y probablemente a la mejoría en su calidad de vida.
La OMS recomienda un estilo de vida basado en la dieta mediterránea y dieta pobre en sal en la población general, y en especial, en los pacientes con riesgo cardiovascular, obesidad y sobrepeso. Se trata de un patrón alimentario rico en grasas de fuentes vegetales naturales (aceite de oliva virgen y frutos secos), con un consumo abundante de alimentos de origen vegetal mínimamente elaborados (verduras, frutas, cereales integrales y legumbres), bajo consumo de carne (especialmente de carnes rojas o procesadas), consumo moderado de pescado y frugalidad en las comidas. El ensayo PREDIMED demostró que una dieta mediterránea alta en grasa suplementada con aceite de oliva virgen o frutos secos, implementada en un entorno de prevención cardiovascular primaria, resultó en una reducción de un 30% de eventos clínicos de enfermedad cardiovascular31; también se encontró una protección significativa de la dieta mediterránea frente a la diabetes. Sin embargo, al igual que en nuestros resultados, en el estudio preliminar no se encontró una reducción de peso asociada con la mejoría de los eventos cardiovasculares.
Los grupos de expertos creados por los Institutos Nacionales de Salud y la OMS recomiendan que los adultos con sobrepeso con patología y los obesos pierdan el 10% de su peso inicial, y el tratamiento primario debería consistir en una intervención sobre el estilo de vida (National Institute of Health, 1998; OMS, 1998). Por otro lado, según la Asociación Americana de Dietistas, dicha intervención para perder peso debe incluir una dieta hipocalórica, la práctica de actividad física y una terapia conductual. Se debe realizar prevención con un adecuado aporte proteico y ejercicio.
Algunos estudios en pacientes en diálisis ya comparan las recomendaciones típicas de la dieta de pacientes con ERC con las de un patrón de dieta mediterránea32. Pero esta no es la práctica habitual. En el paciente con ERCA son necesarias unas calorías en torno a 30-35 kcal/kg/día33, pero limitamos la ingesta con las restricciones típicas para controlar el peso, el potasio o el fósforo. Así, en la mayoría de pacientes con ERC observamos un patrón energéticamente pobre con pocos hidratos de carbono provenientes de vegetales y excesivo consumo de grasas34. Los pacientes con ERCA de forma espontánea suelen tener una baja ingesta de energía y de proteínas que puede llegar a < 0,7 g/kg/día, lo que está por debajo de las recomendaciones mínimas35. Sin embargo, se insiste en recomendar la disminución de la ingesta proteica con el objetivo de preservar la función renal, sin conocer, en muchas ocasiones, cuál es la ingesta de ese paciente. Los requerimientos proteicos de los pacientes con ERC son controvertidos, debido a que la mayoría de los estudios tienen pocos pacientes y su duración es demasiado corta, pero se recomienda un aporte proteico entre 0,6-0,8 g/kg/día en etapas previas al inicio de diálisis y se aceptan restricciones de hasta 0,66 g/kg/día, debiendo ser al menos la mitad de estas proteínas de alto valor biológico36. Una vez iniciada la diálisis, el estado nutricional es más vulnerable y cambiamos las indicaciones, e insistimos a los pacientes en aumentar la ingesta a 1-1,2 g/kg/día hasta necesitar incluso 1,5 g/kg/día en situaciones de PEW o estados catabólicos en diálisis37,38. Nuestros resultados concuerdan con la inadecuada distribución de macronutrientes observada en la ERC. Observamos una ingesta energética pobre con pocos HC y un exceso de grasa. Pensamos que uno de los motivos de este descenso de HC podría ser la restricción del consumo de fruta, verdura, granos y legumbres, al recomendar una dieta pobre en potasio. Por otro lado, es necesario suplir estas carencias con otros grupos de alimentos que pueden aumentar la ingesta global de grasas.
La restricción proteica suele estar respaldada por el consejo de la reducción de la ingesta de fósforo, ya que los alimentos ricos en proteínas habitualmente también lo son en fósforo. Este fósforo orgánico lo encontramos en alimentos de origen animal y vegetal, pero la absorción de este es distinta, por ejemplo, el fósforo de las legumbres y de los frutos secos al ser en forma de ácido fítico y carecer los humanos de la enzima fitasa, la absorción intestinal puede verse reducida hasta la mitad39. Pero una vez más, los vegetales son los alimentos que restringimos en la dieta de nuestros pacientes por temor a la hiperpotasemia. Nuestros pacientes sí modificaron la ingesta de micronutrientes y observamos un aumento en las ingestas de potasio y fibra, acompañándose de una reducción medida por recuerdo de 24 h de las ingestas diarias de sodio y fósforo, según los objetivos fijados en la intervención. Si bien estas diferencias no fueron estadísticamente significativas, sí nos parece que siguen una tendencia y que pueden tener relevancia clínica, sobre todo en que no se traduce en una elevación de los niveles plasmáticos de potasio.
Otro punto fuerte de la dieta mediterránea o patrones más saludables con abundante consumo de vegetales sería el aporte de fibra. Las recomendaciones de ingesta de fibra en nuestros pacientes deben ser similares a las de la población general (en torno a 20-35 g/día). En la ERC existe una disregulación en la microbiota intestinal en favor de bacterias proteolíticas (Clostridium y Bacteroides), que producen sustancias tóxicas como son amonio, tioles, fenoles e indoles que se acumulan en el enfermo renal, en detrimento de bacterias sacarolíticas (bifidobacterias y Lactobacillus) que fermentan preferentemente hidratos de carbono, dando lugar a ácidos grasos de cadena corta como acetato, propionato y butirato, beneficiosos para el organismo. Esta disbiosis con una ratio alta de nitrógeno/carbohidratos, propia de una dieta con poca fibra, promueve la fermentación de proteínas que conducen a un aumento de las toxinas urémicas. El aumento de la ingesta de fibra supone tomar fruta, verdura o legumbres, que también están restringidas en esta población40–42. De nuevo existe conflicto en este punto, ya que si recomendamos una dieta rica en fibra también lo será en frutas, verduras y legumbres que contienen potasio.
El tratamiento de los alimentos con remojos prolongados y dobles y hasta triples cocciones tradicionalmente recomendados para reducir la cantidad de potasio, producen una pérdida importante del resto de vitaminas y minerales, modificando además las cualidades del alimento, con pérdida de sabor y texturas. Algunos estudios han demostrado que la cocción simple es suficiente para conseguir la reducción de potasio necesaria en muchos de los vegetales más frecuentes empleados en nuestra dieta43.
En ERCA no diálisis, la escasez de estudios, el temor a la hiperpotasemia y la falta de educación nutricional de los pacientes hacen que el manejo de las recomendaciones dietéticas sea muy complejo44. Parece que el riesgo de hiperpotasemia y el temor a un aporte insuficiente de nutrientes de las dietas con más vegetales, los que hacen que la dieta del enfermo renal se aleje de patrones saludables. Según las últimas recomendaciones de las guías Kidney Disease: Improving Global Outcomes (KDIGO)45, la restricción de potasio en la dieta es una estrategia válida para tratar la hiperpotasemia aguda, pero no hay una evidencia directa que apoye la recomendación actual de restringir el potasio en la dieta de pacientes con ERC como norma, aunque tampoco se ha encontrado evidencia de que el aumento de la ingesta de potasio o la liberalización de las restricciones de potasio en pacientes con ERC avanzada sea seguro. Se plantea la hipótesis de que la restricción de potasio como estrategia general para prevenir la hiperpotasemia en personas con ERC puede privar a los pacientes de los efectos beneficiosos asociados con las dietas ricas en potasio. Por ello, cada vez es más importante pasar de las recomendaciones tradicionales de nutrientes individuales a un manejo integral de la dieta46. Con un programa de educación nutricional y liberando dieta, además, podemos mejorar la calidad de vida de forma considerable47. Nuestro estudio pretendía precisamente demostrar que el consejo nutricional individualizado y la educación nutricional de los pacientes con enfermedad renal con las consiguientes relajaciones en las restricciones podrían mejorar el perfil nutricional de los pacientes con ERCA, sin favorecer la hiperpotasemia.
Tras la educación nutricional y liberando la dieta, el consumo de vegetales aumentó en los cuestionarios de frecuencia de consumo, también aumentó el consumo de fibra en el grupo intervención y, aun así, durante el estudio, la ingesta de potasio disminuyó en el grupo intervención y aumentó en el grupo control. Las cifras de potasio en plasma, pese a todo, se mantuvieron estables en ambos grupos. En nuestro estudio, el aumento de consumo de fruta y verdura, así como de grasas vegetales, si bien no redujo el peso, no condujo a un aumento del mismo ni tampoco se observaron casos de hiperpotasemia, probablemente por reducción de otros productos que también son ricos en potasio como algunos lácteos o procesados, ya que está demostrado que influye más en nuestra salud la calidad de las grasas ingeridas que la cantidad.
Nuestros pacientes no se encontraban desnutridos por parámetros bioquímicos clásicos. No presentaban niveles bajos de albúmina, prealbúmina, transferrina, bicarbonato, colesterol o linfocitos totales. Lo que sí hemos encontrado en cuanto a los parámetros analíticos han sido diferencias en las cifras de creatinina y el filtrado glomerular. En cuanto a la proteinuria, no hubo cambios significativos en ningún grupo permaneciendo estable.
ConclusionesEl concepto de malnutrición no es sinónimo exclusivamente de desnutrición y engloba tanto los problemas derivados del déficit como del exceso de ingesta de nutrientes y la existencia de sobrepeso u obesidad no excluye un déficit nutricional. Las cifras actuales en ERCA no diálisis no son buenas, reflejo de la epidemia mundial de sobrepeso y obesidad que vivimos. El consejo nutricional del enfermo renal es complejo debido a las múltiples restricciones que se han realizado de forma habitual, lo que por un lado nos aleja de unos patrones alimentarios saludables, como puede ser el mediterráneo, y además empeoran la calidad de vida, lo que se relaciona con aumento de la morbimortalidad en estos pacientes. Por tanto, ¿debemos cambiar la dieta actual de nuestros pacientes a un patrón de dieta mediterránea rica en vegetales? La respuesta, según lo observado en nuestro estudio, es que estamos en vías de modificarlo. Parece razonable modificar las recomendaciones habituales hacia dietas más saludables, siempre que la terapia nutricional en el paciente con ERC sea individualizada para evitar los posibles riesgos. Este cambio puede suponer un enlentecimiento en la progresión de la enfermedad renal con escaso riesgo de hiperpotasemia bajo un estrecho control. Además, se debería recomendar la realización de ejercicio físico, incluyendo ejercicio de fuerza en la medida de las posibilidades de cada paciente. Son necesarios más estudios, multicéntricos, y con equipos multidisciplinares para valorar resultados a largo plazo y poder mejorar así la nutrición de nuestros pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación. Forma parte de la tesis doctoral de la Dra María Martínez Villaescusa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.