La elección del tratamiento sustitutivo renal (TSR) es una decisión importante que determina la calidad de vida y la supervivencia. La mayoría de los pacientes cambiará de una modalidad de TSR a otra para adaptarla a sus necesidades dentro de lo que se conoce como modelo de TSR integrado. En estas circunstancias surgen nuevas preguntas sobre la mejor secuencia de técnicas o las consecuencias de las transiciones.
Material y métodosDescribimos las transiciones entre técnicas de TSR y su impacto en la supervivencia a partir del Registro Madrileño de Enfermos Renales (REMER), durante un periodo de 11 años. Se utilizaron los modelos de riesgos proporcionales y de riesgos competitivos para realizar un análisis por intención de tratar (ITT) según su 1.er tratamiento y como tratado (AT) considerando la 1.ª transición.
ResultadosUn total de 8.971 pacientes iniciaron su primer TSR durante este periodo en Madrid (6,6 millones habitantes): 7.207 (80,3%) en hemodiálisis (HD), 1.401 (15,6%) en diálisis peritoneal (DP) y 363 (4,1%) recibieron un trasplante renal anticipado (TXR). En el análisis ITT, los pacientes incidentes en HD eran mayores (HD 65,3 años (DE 15,3) vs. DP 58,1 años [DE 14,8] vs. TXR 52,0 años (DE 17,2); p<0,001) y tenían más comorbilidades. Presentaron mayor mortalidad (HD 40,9% vs. DP 22,8% vs. TXR 8,3%, p<0,001) y menor acceso a trasplante (HD 30,4% vs. DP 51,6%; p<0,001). Las transiciones entre las técnicas de diálisis identifican diferentes fenotipos de pacientes con diferentes resultados clínicos en el análisis AT. Los pacientes que cambiaban de HD a DP lo hacían más precozmente (HD→DP: 0,7 años (DE 1,1) vs. DP→HD: 1,5 años [(DE 1,4); p<0,001), eran más jóvenes (HD→DP: 53,5 años (DE 16,7) vs. DP→HD: 61,6 años, (DE 14,6) p<0,001), sufrían menor mortalidad (HD→DP: 24,5% vs. DP→HD: 32%, p<0,001) y tenían mayor acceso al TXR (HD→DP: 49,4% vs. DP→HD: 31,7%, p<0,001). El hecho de que accedieran más al TXR modifica la probabilidad de alcanzar el evento analizado (mortalidad) y actúa como un riesgo competitivo. En este análisis, la supervivencia de los pacientes que cambian de una técnica a otra se parece más a la de la modalidad de destino que a la de origen.
ConclusiónNuestros datos sugieren que las transiciones entre técnicas describen diferentes perfiles de pacientes, con distintos riesgos asociados y deben analizarse de manera integrada para definir acciones de mejora. Este enfoque podría incorporarse en el análisis y los informes de los registros renales.
The choice of renal replacement therapy (RRT) is an important decision that determines the quality of life and survival. Most patients change from one RRT modality to another to adapt RRT to clinical and psychosocial needs. This has been called «integrated model of RRT» that implies new questions about the best sequence of techniques.
Material and methodsThe study describes the impact of transitions between RRT modalities on survival using the Madrid Registry of Renal Patients (2008–2018). This study used the proportional hazards models and competitive risk models to perform an intention-to-treat (ITT), according to their 1st RRT modality and as-treated (AT) analysis, that consider also their 1st transition.
ResultsA total of 8971 patients started RRT during this period in Madrid (6.6 Million population): 7207 (80.3%) on hemodialysis (HD), 1401 (15.6%) on peritoneal dialysis (PD) and 363 (4.2%) received a pre-emptive kidney transplantation (KTX). Incident HD-patients were older (HD group 65.3 years (SD 15.3) vs PD group 58.1 years (SD 14.8) vs KTX group 52 years (SD 17.2); p<0.001) and had more comorbidities. They presented higher mortality (HD group 40.9% vs PD group 22.8% vs 8.3% KTX group, p<0.001) and less access to a transplant (HD group 30.4% vs DP group 51.6%; p<0.001). Transitions between dialysis techniques define different groups of patients with different clinical outcomes. Those who change from HD to PD do it earlier (HD→PD: 0.7 years (SD 1.1) vs PD→HD: 1.5 years (SD 1.4) p<0.001), are younger (HD→PD: 53.5 years (SD 16.7) vs PD→HD: 61.6 years (SD 14.6); p<0.001), presented less mortality (HD→PD: 24.5% vs PD→HD: 32.0%; p<0.001) and higher access to a transplant (HD→PD: 49.4% vs PD→HD: 31.7%; p<0.001). Survival analysis by competitive risks is essential for integrated RRT models, especially in groups such as PD patients, where 51.6% of the patients were considered as lost follow-up (received a KTX after during the first 2.5 years on PD). In this analysis, survival of patients who change from one technique to another, is more similar to the destination modality than the origin one.
ConclusionOur data suggest that transitions between RRT-techniques describes different patients, who associate different risks, and could be analyzed in an integrated manner to define improvement actions. This approach should be incorporated into the analysis and reports of renal registries.
Cada año más de 120.000 estadounidenses1, 83.000 europeos2 y 6.500 españoles3 pasan a la última fase de su enfermedad renal crónica (ERC) e inician diálisis o trasplante (TXR). La elección del tratamiento sustitutivo renal (TSR) es una importante decisión que afecta a la calidad de vida, a los eventos intercurrentes y a la supervivencia del paciente4. Los pacientes con ERC en diálisis tienen un riesgo de muerte 10 veces superior a la población general5, con tasas de hospitalización notablemente más altas y una peor calidad de vida relacionada con la salud6,7. Resulta llamativo que el riesgo de mortalidad no se distribuye de forma uniforme a lo largo del tiempo y parece ser mayor durante los primeros 3 meses en TSR8.
La búsqueda de la técnica idónea de TSR ha guiado el enfoque convencional del análisis comparado de resultados como si fueran campos independientes; sin embargo, la realidad clínica demuestra que muchos pacientes utilizarán diferentes modalidades dependiendo de sus circunstancias en cada momento9,10. Este paradigma se define como «modelo de TSR integrado» porque tiene la intención de considerar vías de tratamiento en lugar de técnicas individuales de TSR. Algunos estudios demuestran que existen diferencias en función de la secuencia elegida para los cambios de modalidad de TSR11,12.
En estas circunstancias es inevitable abandonar el enfoque dicotómico hemodiálisis (HD) frente a diálisis peritoneal (DP) y plantearnos nuevas preguntas sobre la secuencia óptima de técnicas o el tiempo idóneo de permanencia en las diferentes modalidades para planificar las transiciones entre las distintas terapias de TSR13–15. La literatura disponible sugiere que, en la actualidad, la transición entre las distintas modalidades está mal coordinada, lo que podría explicar el aumento significativo de morbimortalidad16,17.
En España la atención de la ERC es universal y depende del sistema público de salud, que garantiza una libre elección del TSR, solo limitada por las contraindicaciones técnicas de cada caso. Además, nuestro sistema recoge la información básica del TSR en registros oficiales, de cumplimentación obligatoria, lo que garantiza la exhaustividad, precisión y validez de los datos. Sin embargo, los informes de los registros suelen analizar las técnicas de forma independiente, imputando la mortalidad a la técnica presente en el momento del evento, sin contemplar las transiciones en el seguimiento completo del paciente.
El objetivo principal del presente trabajo es describir el movimiento de pacientes entre las distintas técnicas de TSR. También analizaremos la supervivencia y los datos sociodemográficos asociados a las secuencias de TSR, que impliquen permanencia o transición entre terapias.
Material y métodosPoblación del estudioEstudio observacional, descriptivo, en el que analizamos todos los pacientes incidentes mayores de 16 años del Registro Madrileño de Enfermos Renales (REMER), durante el periodo comprendido entre el 1 de enero de 2008 y el 31 de diciembre de 2018 sin exclusión de ningún paciente que haya iniciado TSR en el periodo de estudio. De acuerdo con las definiciones del GRER (Grupo de Registros de Enfermos Renales) se considera paciente incidente a todo aquel que inicia por primera vez en cualquiera de las técnicas de diálisis o trasplante, y cualquier cambio de técnica posterior se considerará una transición. Así, por ejemplo, el TXR de un paciente de HD no sería incidencia en TXR sino transferencia o cambio de técnica, lo mismo ocurriría en un paciente que iniciara diálisis tras disfunción del TXR. El REMER cruza su información con la base de datos de la Organización Nacional de Trasplante (ONT) y del Instituto Nacional de Estadística (INE), para depurar la mortalidad y las inconsistencias de seguimiento.
Los hospitales de la Comunidad de Madrid se clasifican en tres grupos según su cartera de servicios y grado de atención a la complejidad de acuerdo con los criterios de la Dirección General de Atención Especializada18. En el nivel 3 o de alta complejidad se encuentran los centros con cartera de servicio completa que realizan algún tipo de trasplante; al nivel 2 o de complejidad intermedia pertenecen los hospitales con cartera de servicios amplia, pero sin trasplante, y en el nivel 1 o de baja complejidad están los centros con cartera de servicios más reducida.
Variable de exposición/objetivosLa variable principal analizada es el estado en el que se ha encontrado el paciente a lo largo del tiempo de seguimiento. Estos estados representan los diferentes tipos de TSR: HD, DP y el TXR.
Las transiciones quedan definidas como las progresiones entre los distintos tratamientos disponibles hasta el evento final de fallecimiento del paciente, y reflejan la evolución de la patología renal avanzada.
Se incluyen todas las variables recogidas en la descripción del REMER: variables demográficas, de enfermedad renal y tipo de TSR y desenlace19. Se realiza un análisis descriptivo de la evolución integrada de los diferentes grupos de pacientes, ya sea manteniéndose siempre en una técnica o cambiando entre ellas. Analizamos la modalidad de TSR de inicio según el grado de complejidad del centro hospitalario y centros de diálisis.
Como objetivo secundario de interés se describen las causas de mortalidad para cada uno de los grupos.
El análisis estadístico se realiza inicialmente por intención de tratar (ITT) y agrupa los pacientes por la técnica de inicio; de esta manera, se evita que las transferencias entre técnicas puedan influir en los resultados. A continuación, se realiza un análisis por el TSR recibido hasta el momento del evento, as-treated (AT), para estudiar si la evolución varía en función de los cambios de modalidad. De esta manera definimos cuatro subgrupos en función de las diferentes situaciones de transición en diálisis hasta el TXR o el evento muerte: solo HD, solo DP, inicio HD y paso a DP o inicio en DP y paso a HD.
Análisis estadísticoLos resultados se expresan como porcentajes, media y desviación estándar (DE) o mediana y rango intercuartílico (RIC) según la normalidad de distribución y naturaleza de las variables. Las comparaciones entre variables categóricas se realizan con chi-cuadrado y entre cuantitativas con una t de Student o U de Mann-Whitney según la distribución de la muestra. Para el análisis de eventos dependientes del tiempo (supervivencia, mantenimiento en técnica), los resultados se han estimado mediante el método Kaplan-Meier (KM) y el test log-rank para evaluar la significación estadística. Se realizan estimaciones de supervivencia por ITT, contemplando el primer TSR realizado. Para analizar el impacto de las transiciones en la supervivencia se considera solamente la primera transición entre los diferentes TSR.
Para definir los modelos multivariantes de riesgo se utiliza la regresión de Cox, incluyendo aquellas covariables significativas en el modelo univariante o las que modificaron el modelo con un pIN/pOUT 0.05/0.1.
Análisis de riesgos competitivosCuando un suceso modifica la probabilidad de obtener el evento de interés, los modelos de riesgos proporcionales no son adecuados para estimar la probabilidad de supervivencia (modelo KM, Cox). En este caso debería emplearse un modelo de riesgos competitivos, que a diferencia del modelo KM no sobreestima la tasa real del evento20.
El análisis de regresión para evaluar riesgos competitivos se ha utilizado para determinar los efectos de las distintas modalidades de diálisis y sus transiciones, sobre la mortalidad (evento principal) y el TXR (evento competitivo). Representamos las curvas de eventos acumulados (CIF, cumulative incidence failure), para los eventos de interés (mortalidad y TXR). Todos los análisis han sido realizados con Stata 14 (StataCorp2015. Stata Statistical Software: Release 14. College Station, TX: StataCorp LP.X).
Este proyecto ha sido aprobado por el CEIm del Hospital Universitario Puerta de Hierro (NREF 132/16), por el Comité Técnico del REMER y autorizado por la Consejería de Sanidad de la Comunidad de Madrid bajo la tutela de la Oficina de Seguridad de Sistemas de Información Sanitaria (OSSI) como se describe en publicaciones previas6.
ResultadosDescripción de la cohorte según el tratamiento sustitutivo renal de inicioUn total de 8.971 pacientes iniciaron TSR en la Comunidad de Madrid durante los 11 años de seguimiento. La mayoría, el 80,3% (7.207), lo hicieron en HD mientras que el 15,6% (1.401) empezaron en DP y el 4,1% (363) recibieron TXR en prediálisis, siendo el 33,3% de donante vivo. El porcentaje de pacientes que iniciaron hemodiálisis domiciliaria (HDD) fue del 0,3%.
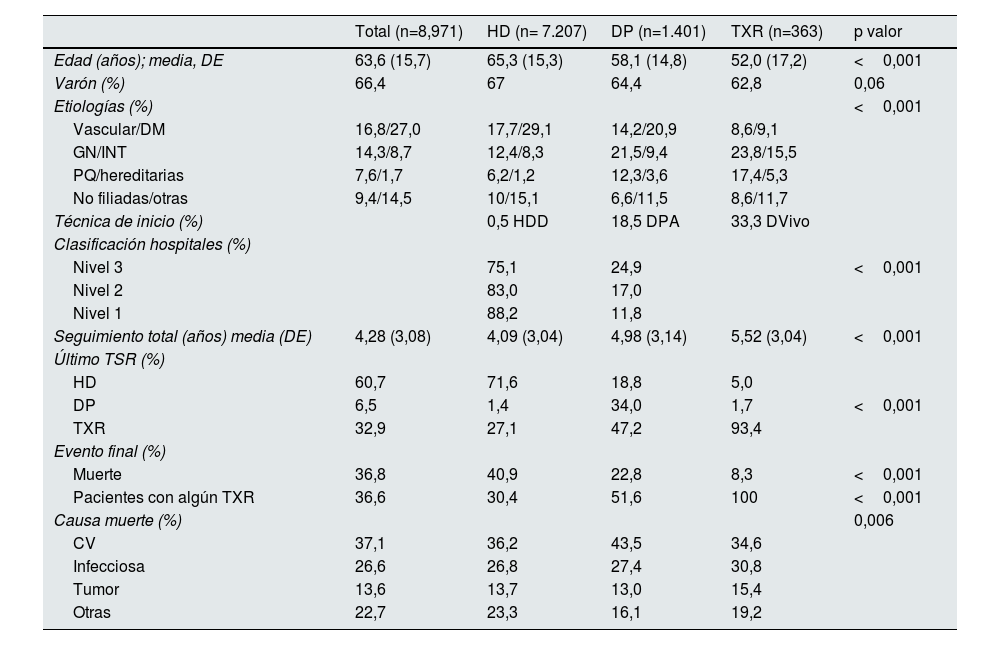
La tabla 1 muestra las características de los pacientes clasificados por ITT, con una media de seguimiento de 4,38 años (DE 3,08). Los pacientes que inician HD son los de mayor edad y comorbilidad diabética y presentan una mortalidad más elevada. Los pacientes en DP y los que reciben un TXR en prediálisis tienen una mayor proporción de pacientes con poliquistosis o patología glomerular; además, aquellos que reciben un TXR prediálisis son los más jóvenes y tienen la menor mortalidad.
Características de los pacientes incidentes en tratamiento renal sustitutivo según su técnica de inicio
| Total (n=8,971) | HD (n= 7.207) | DP (n=1.401) | TXR (n=363) | p valor | |
|---|---|---|---|---|---|
| Edad (años); media, DE | 63,6 (15,7) | 65,3 (15,3) | 58,1 (14,8) | 52,0 (17,2) | <0,001 |
| Varón (%) | 66,4 | 67 | 64,4 | 62,8 | 0,06 |
| Etiologías (%) | <0,001 | ||||
| Vascular/DM | 16,8/27,0 | 17,7/29,1 | 14,2/20,9 | 8,6/9,1 | |
| GN/INT | 14,3/8,7 | 12,4/8,3 | 21,5/9,4 | 23,8/15,5 | |
| PQ/hereditarias | 7,6/1,7 | 6,2/1,2 | 12,3/3,6 | 17,4/5,3 | |
| No filiadas/otras | 9,4/14,5 | 10/15,1 | 6,6/11,5 | 8,6/11,7 | |
| Técnica de inicio (%) | 0,5 HDD | 18,5 DPA | 33,3 DVivo | ||
| Clasificación hospitales (%) | |||||
| Nivel 3 | 75,1 | 24,9 | <0,001 | ||
| Nivel 2 | 83,0 | 17,0 | |||
| Nivel 1 | 88,2 | 11,8 | |||
| Seguimiento total (años) media (DE) | 4,28 (3,08) | 4,09 (3,04) | 4,98 (3,14) | 5,52 (3,04) | <0,001 |
| Último TSR (%) | |||||
| HD | 60,7 | 71,6 | 18,8 | 5,0 | |
| DP | 6,5 | 1,4 | 34,0 | 1,7 | <0,001 |
| TXR | 32,9 | 27,1 | 47,2 | 93,4 | |
| Evento final (%) | |||||
| Muerte | 36,8 | 40,9 | 22,8 | 8,3 | <0,001 |
| Pacientes con algún TXR | 36,6 | 30,4 | 51,6 | 100 | <0,001 |
| Causa muerte (%) | 0,006 | ||||
| CV | 37,1 | 36,2 | 43,5 | 34,6 | |
| Infecciosa | 26,6 | 26,8 | 27,4 | 30,8 | |
| Tumor | 13,6 | 13,7 | 13,0 | 15,4 | |
| Otras | 22,7 | 23,3 | 16,1 | 19,2 |
Clasificación hospitales: clasificación hospitalaria en función del grado de complejidad de la Comunidad de Madrid18. Nivel 3: hospitales de alta complejidad; Nivel 2: hospitales de complejidad intermedia; Nivel 3: hospitales de baja complejidad.
CV: cardiovascular; DE: desviación estándar; DM: diabetes mellitus; DP: diálisis peritoneal; DPA: diálisis peritoneal automatizada; DVivo: donante vivo; GN: glomerulonefritis; HD: hemodiálisis; HDD: hemodiálisis domiciliaria; INT: intersticial; PQ: poliquistosis; TSR: tratamiento sustitutivo renal; TXR: trasplante renal.
El 40% de los pacientes inician TSR en hospitales de alta complejidad, que son centros de referencia para realización de TXR y cuentan con programas de DP más amplios.
De los 8.608 pacientes incidentes en diálisis, el 30,4% (2.190) de los pacientes en HD y el 51,6% (723) de los de DP recibieron un TXR a lo largo de un seguimiento de 4,09 años (DE 3,04) en HD y 4,98 años (DE 3,14) en DP.
Si analizamos la técnica en la que se encontraban los pacientes al final de su seguimiento, la mayoría de los que se trasplantaron en prediálisis (93,4%) y de los que iniciaron en HD (71,6%) continuaban en la misma técnica. Sin embargo, casi la mitad de los pacientes que eligieron DP estaban trasplantados al final del seguimiento, manteniéndose en DP solamente un tercio aproximadamente (tabla 1).
Más de un tercio de los pacientes fallecieron durante un tiempo de seguimiento global en TSR de 4,28 años (DE 3,08), siendo la causa de muerte más frecuente la cardiovascular (37,1%). En nuestra serie, los pacientes que recibieron un TXR de inicio fallecieron casi 5 veces menos que los que lo que iniciaron en HD y 2,4 veces menos que los que lo hicieron en DP (mortalidad en HD del 40,9% en 4,09 años, DE 3,04; mortalidad en DP del 22,7% durante un seguimiento de 4,98 años, DE 3,14 y mortalidad en TXR del 8,3% en 5,52 años, DE 3,04, de seguimiento).
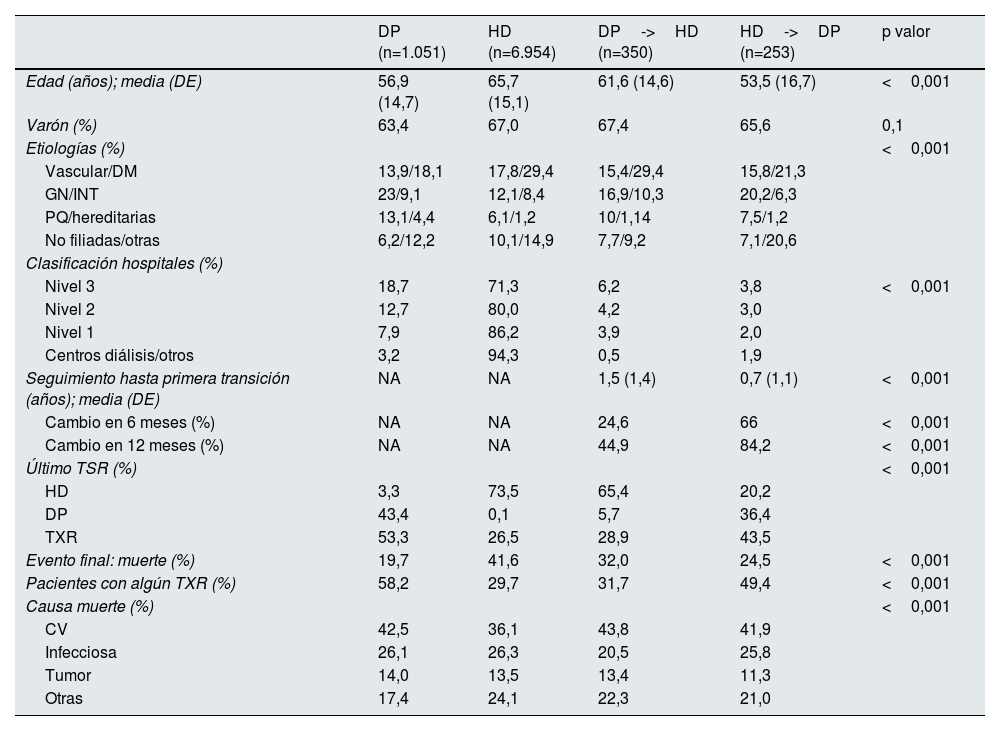
La tabla 2 recoge las características de los pacientes según el tipo de TSR de inicio y su primera transición. En ella se evidencia que los pacientes que solo reciben HD son los de más edad del grupo, los que menos se trasplantan y los que tienen una mayor mortalidad; al final del periodo de análisis el 41,6% de estos pacientes han fallecido. Por el contrario, los pacientes que solo realizan DP son los más jóvenes, los que tienen más incidencia de patología glomerular y los que más se trasplantan, además de tener la mejor supervivencia de la serie.
Descriptivo de las transiciones de pacientes incidentes en tratamiento renal sustitutivo
| DP (n=1.051) | HD (n=6.954) | DP->HD (n=350) | HD->DP (n=253) | p valor | |
|---|---|---|---|---|---|
| Edad (años); media (DE) | 56,9 (14,7) | 65,7 (15,1) | 61,6 (14,6) | 53,5 (16,7) | <0,001 |
| Varón (%) | 63,4 | 67,0 | 67,4 | 65,6 | 0,1 |
| Etiologías (%) | <0,001 | ||||
| Vascular/DM | 13,9/18,1 | 17,8/29,4 | 15,4/29,4 | 15,8/21,3 | |
| GN/INT | 23/9,1 | 12,1/8,4 | 16,9/10,3 | 20,2/6,3 | |
| PQ/hereditarias | 13,1/4,4 | 6,1/1,2 | 10/1,14 | 7,5/1,2 | |
| No filiadas/otras | 6,2/12,2 | 10,1/14,9 | 7,7/9,2 | 7,1/20,6 | |
| Clasificación hospitales (%) | |||||
| Nivel 3 | 18,7 | 71,3 | 6,2 | 3,8 | <0,001 |
| Nivel 2 | 12,7 | 80,0 | 4,2 | 3,0 | |
| Nivel 1 | 7,9 | 86,2 | 3,9 | 2,0 | |
| Centros diálisis/otros | 3,2 | 94,3 | 0,5 | 1,9 | |
| Seguimiento hasta primera transición (años); media (DE) | NA | NA | 1,5 (1,4) | 0,7 (1,1) | <0,001 |
| Cambio en 6 meses (%) | NA | NA | 24,6 | 66 | <0,001 |
| Cambio en 12 meses (%) | NA | NA | 44,9 | 84,2 | <0,001 |
| Último TSR (%) | <0,001 | ||||
| HD | 3,3 | 73,5 | 65,4 | 20,2 | |
| DP | 43,4 | 0,1 | 5,7 | 36,4 | |
| TXR | 53,3 | 26,5 | 28,9 | 43,5 | |
| Evento final: muerte (%) | 19,7 | 41,6 | 32,0 | 24,5 | <0,001 |
| Pacientes con algún TXR (%) | 58,2 | 29,7 | 31,7 | 49,4 | <0,001 |
| Causa muerte (%) | <0,001 | ||||
| CV | 42,5 | 36,1 | 43,8 | 41,9 | |
| Infecciosa | 26,1 | 26,3 | 20,5 | 25,8 | |
| Tumor | 14,0 | 13,5 | 13,4 | 11,3 | |
| Otras | 17,4 | 24,1 | 22,3 | 21,0 |
Clasificación hospitales: clasificación hospitalaria en función del grado de complejidad de la Comunidad de Madrid18. Nivel 3: hospitales de alta complejidad; Nivel 2: hospitales de complejidad intermedia; Nivel 1: hospitales de baja complejidad.
CV: cardiovascular; DE: desviación estándar; DM: diabetes mellitus; DP: diálisis peritoneal; DP->HD: pacientes que inician en diálisis peritoneal y pasan a hemodiálisis; GN: glomerulonefritis; HD: hemodiálisis; HD->DP: pacientes que inician en hemodiálisis y pasan a diálisis peritoneal; INT: intersticial; NA: no aplica; PQ: poliquistosis; TSR: tratamiento sustitutivo renal; TXR: trasplante renal.
En cuanto a la posibilidad de cambiar de modalidad, es casi 7 veces superior en los pacientes que inician DP (25,0%) que los que lo hacen en HD (3,6%).
Llama la atención que los pacientes que inician TSR en una modalidad y luego cambian se parecen a los pacientes de la técnica de destino. Los pacientes que cambian de HD a DP lo hacen precozmente, en un tiempo promedio de 0,7 (DE 1,1) años; además, la mayoría de las transiciones se producen antes de que finalice el primer año. Estos son más jóvenes, tienen menor mortalidad y reciben más TXR que los pacientes que están solo en HD, y tienden a compartir más características con los pacientes que solo realizan DP.
Aquellos que se transfieren de DP a HD lo hacen de manera tardía después de una media de 1,5 (DE 1,4) años en DP. Tienen unas características basales similares a los pacientes que solo reciben HD, aunque con mayor incidencia de patología glomerular.
Los pacientes que solo reciben DP son los que tienen mayor probabilidad de sobrevivir. Así los que inician HD tienen el doble de mortalidad HR 2,5 IC 95% [2,2-2,9]; los que inician DP y pasan a HD tienen un riesgo de 1,6 [1,3-2,0], y los que inician HD y pasan a DP, 1,2 [0,9-1,6]. Los pacientes en DP también son los que más se trasplantan; el doble que los que reciben solo HD; 1,8 veces más que los que pasan de DP a HD y 1,2 veces más que los que inician en HD y pasan a DP.
Descripción de las transiciones a lo largo del tiempoEn cuanto al número de transiciones registradas por paciente, el 63% (5.652) se mantienen en el tratamiento de inicio durante todo el periodo de análisis y el 29% (2.612) cambiaron una vez de estado. Al finalizar el seguimiento, había fallecido un 36,8%, continuaba TSR un 58,2% y un 5% había perdido seguimiento.
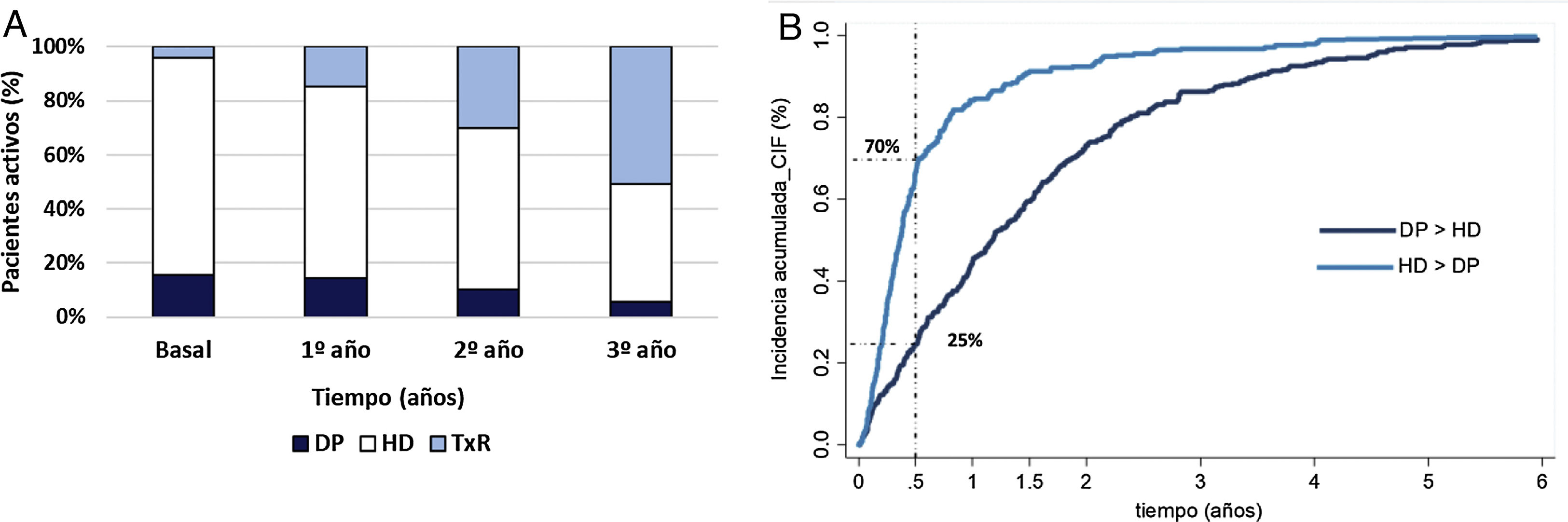
La HD es la técnica de inicio más frecuente. Según transcurre el tiempo, el TXR pasa a ser la modalidad de mayor prevalencia en los pacientes activos al finalizar el tercer año de seguimiento (fig. 1A).
(A) Distribución por año de las técnicas de TSR de los pacientes activos al final de cada año. (B) Curva de incidencia acumulada hasta cambio de técnica para aquellos pacientes que cambian de DP a HD y de HD a DP.
DP: diálisis peritoneal; HD: hemodiálisis; TXR: trasplante renal. DP>HD: pacientes que inician en diálisis peritoneal y pasan a hemodiálisis. HD>DP: pacientes que inician en hemodiálisis y pasan a diálisis peritoneal.
Si nos fijamos solamente en los pacientes que cambian de técnica (fig. 1B), los pacientes que inician en HD y pasan a DP lo hacen precozmente (el 66% de las transferencias se producen antes de los primeros 6 meses) mientras que el cambio de HD a DP es más gradual y perdura más en el tiempo.
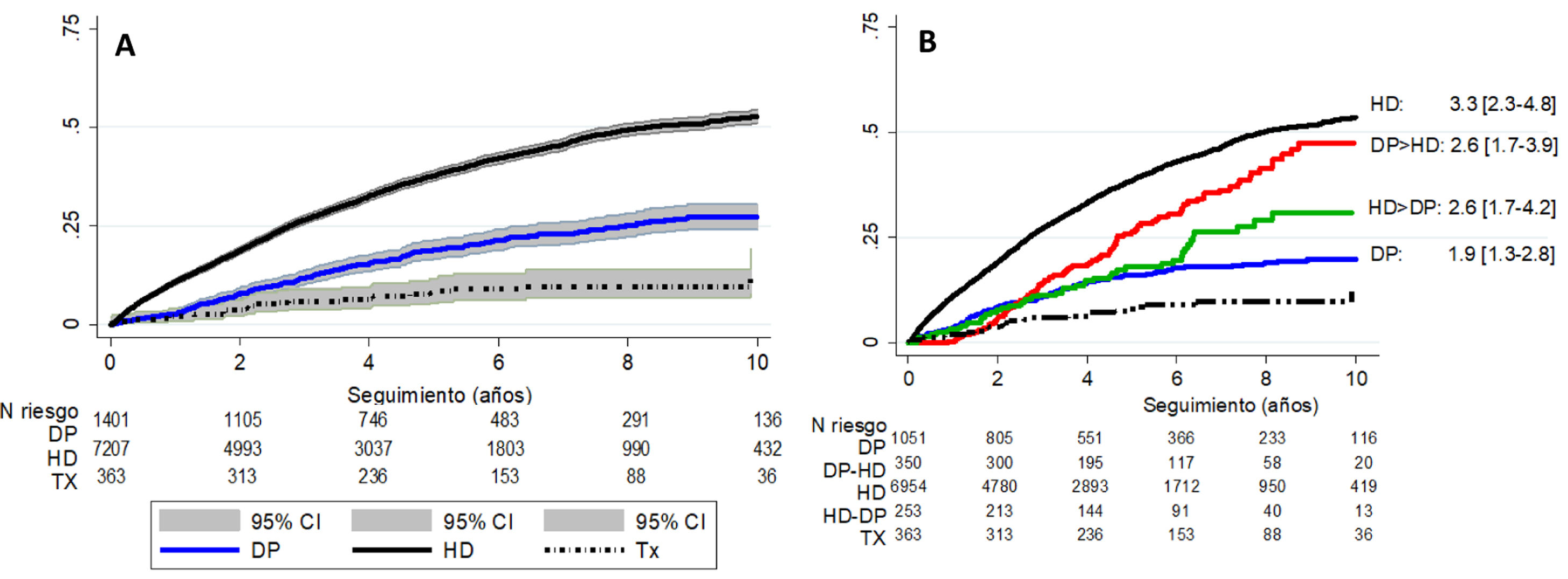
Durante una media de seguimiento de 4,28 (DE 3,04) años, se produjeron un total de 3.303 muertes. En el análisis por ITT, tras corregir por edad, sexo y diabetes, la supervivencia es mayor en los pacientes que reciben un TXR inicialmente, seguidos de los pacientes en DP y por último los de HD (fig. 2A).
Curva de incidencia acumulada de mortalidad por todas las causas; (A) según el modelo Kaplan-Meier por intención de tratar y según TSR de inicio; (B) según tratamiento realizado según la secuencia TSR. Se muestra el HR ajustado por edad, sexo y nefropatía diabética siendo el TX la técnica de referencia (HR=1).
DP: diálisis peritoneal; HD: hemodiálisis; TX: trasplante renal. DP>HD: pacientes que inician en diálisis peritoneal y pasan a hemodiálisis. HD>DP: pacientes que inician en hemodiálisis y pasan a diálisis peritoneal. CI: intervalo de confianza; HR: hazard ratio.
Si comparamos la mortalidad por todas las causas entre las distintas formas de TSR y sus transiciones en el momento del evento as-treated, siendo el TXR la técnica de referencia (fig. 2B), se aprecia como los pacientes que reciben solo HD tienen mayor riesgo de mortalidad que el resto de los grupos durante el periodo de análisis.
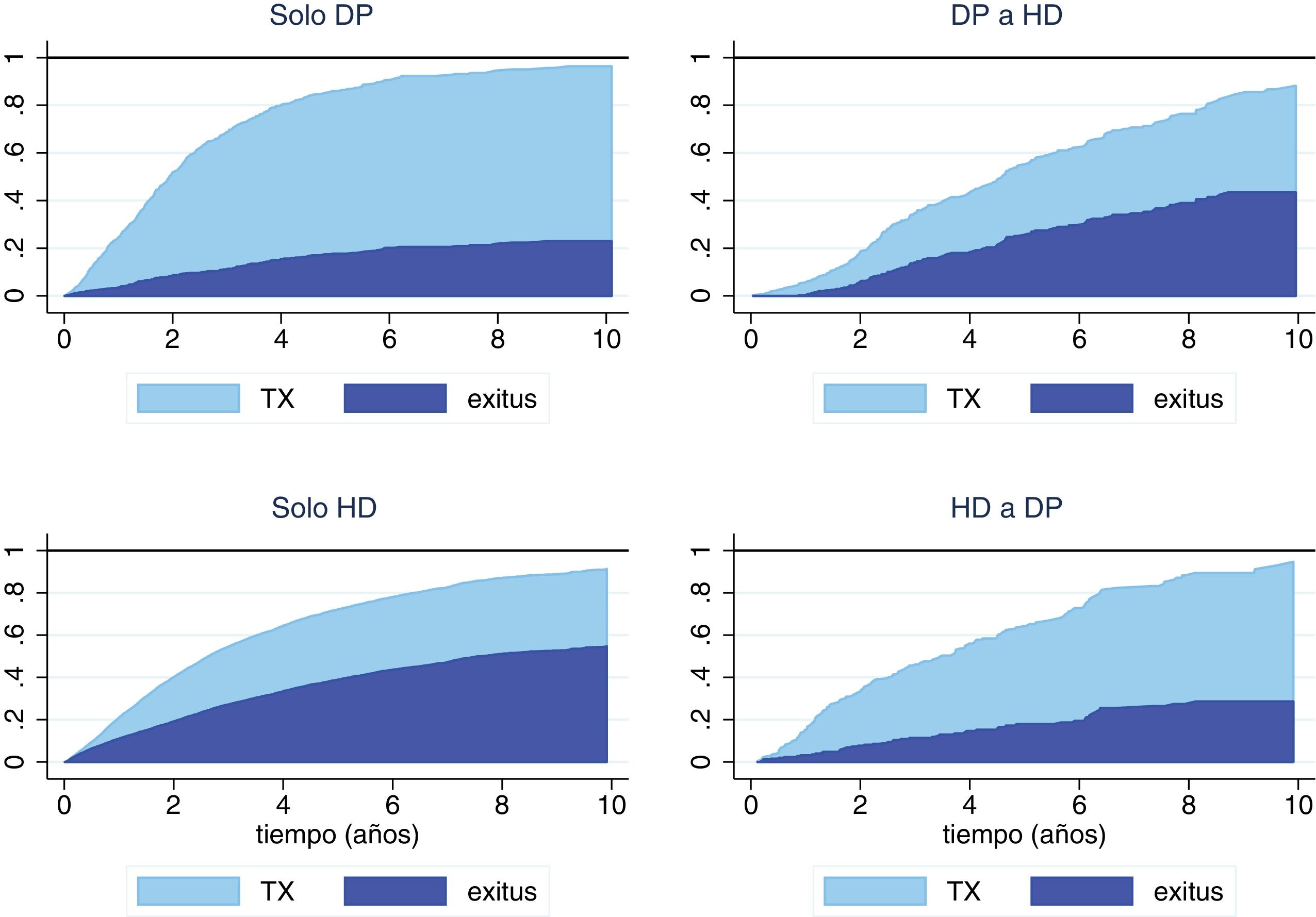
En nuestra serie, se trasplantaron un elevado porcentaje de pacientes, sobre todo en el grupo de solo DP (58,2%) y los que cambiaron de HD a DP precozmente (49,4%), lo que modifica la probabilidad de alcanzar el evento en que se focaliza el análisis (mortalidad). Por esta razón, lo más adecuado es analizar la mortalidad considerando el TXR como un riesgo competitivo y comparar los subgrupos de evolución en TSR predefinidos: solo DP, solo HD, DP a HD y HD a DP (fig. 3). En estas gráficas se refleja como los pacientes que inician TSR en una modalidad y luego cambian tienden a asemejarse más a los pacientes de la técnica de destino que a la de origen en cuanto a supervivencia.
Curva de incidencia acumulada (CIF) según la técnica de inicio y el primer cambio de tratamiento (as-treated).
DP: diálisis peritoneal; HD: hemodiálisis; TX: trasplante renal. DP>HD: pacientes que inician en diálisis peritoneal y pasan a hemodiálisis. HD>DP: pacientes que inician en hemodiálisis y pasan a diálisis peritoneal.
Es la primera vez que se describen en detalle los cambios de técnica aportando la secuencia temporal de cada paciente (porcentaje de cambio, tiempo pasado en cada técnica y características de los pacientes en cada grupo), lo que nos da una nueva visión del TSR como un proceso integrado y deja clara la complejidad de los análisis que comparan resultados entre distintas técnicas de diálisis. Este es un aspecto que estaba insuficientemente detallado en los informes previos de nuestro registro autonómico y la presentación anual del REER.
Los análisis se realizan desde dos puntos de vista: por ITT, que incluye a los pacientes según la técnica de TSR seleccionado inicialmente (HD, DP o TXR), independientemente de que cambiaran de técnica o no durante el periodo de análisis, y un análisis as-treated (AT), que clasifica a los pacientes según el tratamiento que recibieron y no según el que se asignó inicialmente. En este caso se contemplan los cambios entre HD y DP y se dividen en cuatro grupos: solo DP, solo HD, DP que cambia a HD y HD que cambia a DP.
En el análisis ITT se evidencia que la mejor supervivencia de nuestra serie fue la de los pacientes que recibieron un TRX en prediálisis, concordante con lo evidenciado en otros trabajos previos21–23. Sin embargo, solo el 4,1% de nuestros pacientes recibieron un TRX en situación de prediálisis; esto se debe a la falta de disponibilidad de órganos y las comorbilidades que hacen que el paciente tenga que iniciar tratamiento sustitutivo con DP o HD.
Si analizamos la mortalidad no ajustada según la modalidad de inicio (fig. 2A), se evidencia una mayor supervivencia en el grupo que inicia con DP con respecto a los que lo hacen en HD; esto coincide con lo descrito previamente y se debe probablemente a que, en el modelo español, la inclusión en DP presenta una selección positiva del paciente más joven y con menor comorbilidad24.
En el análisis as-treated estudiamos la mortalidad asociada a la existencia de transiciones entre modalidades ajustada por edad, sexo, presencia de diabetes mellitus, considerando el TXR como técnica de referencia. En nuestro trabajo, el tratamiento exclusivamente con HD sigue estando asociado con una mayor mortalidad en el análisis multivariante y con un menor acceso al TXR, como se evidencia en el modelo que evalúa riesgos competitivos (fig. 3). Esto podría deberse a que está integrado por pacientes de mayor edad que podrían tener mayor comorbilidad. En contraposición, los pacientes que tienen una mayor supervivencia a largo plazo y que más se trasplantan son aquellos que se mantienen en DP sin pasar por HD; estos resultados son congruentes con lo publicado previamente25, donde los pacientes de DP tienen una alta tasa de salidas a TXR por sus características demográficas y privilegiada situación clínica.
En cuanto a la transición de DP a HD, parece que hay dos etapas. Una etapa temprana en los primeros 3 a 6 meses después del inicio de DP, en la que se ha descrito una mayor participación de la disfunción relacionada con el catéter26,27, y otra etapa más tardía por fracaso de la técnica. Nuestro registro no incluye un informe detallado de las causas de salida, pero hay estudios como los de Htay et al.28,29 que señalan como factores de riesgo para fracaso de DP: un tamaño de centro más pequeño, menor uso de icodextrina, insuficiente control del fosfato sérico, bajo uso de diálisis peritoneal automatizada y uso de profilaxis antifúngica. Sabemos que la supervivencia de la técnica en DP disminuye significativamente después de los 2 años, y dado que el tiempo de espera del TXR puede ser largo, el cambio a HD es frecuente30. En nuestro estudio los pacientes de DP que cambian a HD lo hacen tardíamente (14 meses de mediana). Pensamos que representan un perfil de pacientes complejos que salen tardíamente de DP por complicaciones o agotamiento de la técnica. Llama la atención que las características basales de estos pacientes que cambian de DP a HD son similares a los que solo reciben HD en cuanto a edad, nefropatía diabética y posibilidades de TXR; sin embargo, la supervivencia es mayor en los pacientes que inician en DP y luego cambian a HD que los que solo reciben HD. Este resultado podría estar en relación con los datos de algunas series en las que se describe una ventaja de supervivencia inicial de la DP en comparación con la HD4,31,32, además de un mayor conocimiento en autocuidados, un mejor mantenimiento de la función renal residual, una mayor satisfacción del paciente y preservación del acceso vascular para el futuro33.
Los pacientes que inician HD y pasan a DP lo hacen precozmente, la mayoría en los primeros 6 meses, y se comportan en la supervivencia competitiva de forma similar a los que empezaron directamente en DP. Están representados por los pacientes más jóvenes del estudio y tienen menos incidencia de nefropatía diabética que los pacientes que están exclusivamente en HD. Pensamos que podrían representar pacientes con un inicio no programado a los que se les ofrece DP después de haber iniciado HD. La transferencia tardía de HD a DP parece deberse más a un fallo de la técnica, lo que se asocia a un mayor riesgo de mortalidad17,34–36.
Limitaciones y fortalezasSe sabe que el paciente que inicia TSR de manera no programada, muchas veces sin seguimiento en la consulta de enfermedad renal crónica avanzada (ERCA), suele hacerlo en HD a través de un catéter temporal37; ambos factores se han asociado a una mayor mortalidad38–40 y complicaciones como bacteriemia, hospitalización prolongada41, trombosis o estenosis venosa central41. El registro REMER, base de este trabajo, no recoge comorbilidades ni parámetros analíticos, por lo que no podemos corregir nuestros resultados con estos datos. Por otro lado, nuestro objetivo no es analizar la superioridad de una forma de diálisis sobre otra, sino analizar el TSR como un tratamiento integrado constituido por una secuencia de distintas terapias, en las que la elección inicial de técnica, cómo y cuándo se cambia de modalidad podría influir en la evolución del paciente que recibe TSR.
Las características de la población de la Comunidad de Madrid no tienen por qué ser iguales a las de otras comunidades, lo que puede limitar la extrapolación de resultados a otras poblaciones. Sin embargo, una de las ventajas de este trabajo es que analiza el 100% de los pacientes incidentes en TSR en nuestro ámbito. Los datos analizados provienen de una base de datos oficial, de obligado cumplimiento, completa y mantenida en la serie histórica, en la que la validez interna está garantizada.
Finalmente, nuestro estudio es el primero en tener en cuenta los riesgos competitivos a la hora de analizar la evolución según la modalidad elegida inicialmente de forma conjunta con los cambios entre las distintas técnicas. Esto es especialmente relevante ya que, en presencia de estos, las estimaciones de supervivencia por KM podrían no ser correctas y los modelos de Cox podrían conducir a interpretaciones imprecisas.
Oportunidades de mejoraEl proceso de toma de decisiones que conduce a la elección de un TSR es complejo y puede verse influido por las circunstancias sociales y la educación sanitaria recibida por el paciente42. Se sabe que la falta de preparación del paciente con ERCA y un inicio urgente de diálisis se asocia a una menor supervivencia y mayor mortalidad43,44. Con un soporte adecuado y entrenamiento prediálisis, se ha estimado que hasta un 50% de los pacientes ERCA pueden realizar diálisis de autocuidado con DP o HDD45. No disponemos de los motivos por los que se cambia de técnica, pero sí hemos podido observar, en nuestra muestra, que el 66% de los pacientes que pasan de HD a DP lo hace en los 6 primeros meses de tratamiento. Estos pacientes con cambio precoz en su tratamiento podrían representar una elección tardía de técnica en pacientes con inicio urgente de TSR o falta de preparación previa. La remisión en tiempo del paciente con enfermedad renal avanzada a los servicios de Nefrología, y el desarrollo continuado de las unidades ERCA, podría variar estos resultados.
ConclusionesNuestros datos sugieren que las transiciones entre técnicas describen diferentes perfiles de pacientes, con distintos riesgos asociados y que deben analizarse de manera integrada para definir acciones de mejora. Este enfoque podría incorporarse en el análisis y los informes de los registros renales. Los datos aquí presentados podrían demostrar que no solo la elección inicial de técnica, sino cómo y cuándo se cambia de modalidad, influyen en la evolución del paciente que recibe TSR. Las intervenciones oportunas y el cambio de modalidad en el momento adecuado podría ayudar a atenuar los riesgos en un grupo tan vulnerable. Los análisis más complejos como los riesgos competitivos y el seguimiento de cambios de técnica aportan una visión más realista del TSR. Necesitamos más estudios que profundicen en los factores asociados a los cambios de técnicas para poder ofrecer estrategias que mejoren resultados globales en salud renal.
FinanciaciónEste estudio ha sido financiado por el Instituto de Investigación Segovia-Arana-Puerta de Hierro-Majadahonda, Fundación Iñigo Álvarez de Toledo y por la Fundación Madrileña de Nefrología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses con el presente artículo. Estos resultados no han sido presentados previamente.
Agradecemos la colaboración del comité del registro REMER y especialmente de su secretario D. Manuel Aparicio, así como a todos los servicios clínicos y su personal que con su trabajo diario contribuye a la generación y mantenimiento del registro REMER.