La irisina es una adipomioquina con posibles efectos antiobesidad y antidiabéticos. Esta hormona ha sido insuficientemente estudiada en pacientes con enfermedad renal crónica (ERC) avanzada.
ObjetivoRealizar un análisis exploratorio de los niveles séricos de irisina en pacientes con diferentes modalidades de tratamiento de la ERC.
MétodoSegún diseño transversal, estimamos niveles de irisina en 95 pacientes con ERC manejados conservadoramente (ERCA), con diálisis peritoneal (DP) o con hemodiálisis, comparándolos con un grupo control de 40 individuos sanos. También investigamos las correlaciones entre irisina sérica y variables demográficas, clínicas, metabólicas y de composición corporal.
ResultadosLos niveles de irisina fueron más bajos en cualquier grupo de pacientes que en los controles. El análisis univariante desveló correlaciones moderadas entre irisina, por un lado, y masa grasa (pero no magra), filtrado glomerular (GFR) y albúmina y bicarbonato plasmático, por otro. El análisis multivariante confirmó que los pacientes con ERCA (diferencia 111,1ng/mL), en DP (25,9ng/mL) o hemodiálisis (61,4ng/mL) (todos p<0,0005) presentaban niveles ajustados más bajos de irisina que los controles. Asimismo, los pacientes en DP presentaban niveles más altos de la hormona que los de hemodiálisis (diferencia 39,4ng/mL; p=0,002) o ERCA (24,4ng/mL; p=0,036). El análisis multivariante también identificó bicarbonato plasmático (B=3,90 por mM/L; p=0,001) y GFR (B=1,89 por mL/min; p=0,003) como predictores independientes de los niveles de irisina. Por el contrario, no observamos correlación ajustada entre irisina y marcadores de composición corporal.
ConclusionesLos niveles de irisina son bajos en pacientes con ERC, y muestran correlación consistente con GFR y bicarbonato plasmático. Los pacientes en DP presentan niveles más altos de irisina que los manejados conservadoramente o con hemodiálisis. Nuestro estudio confirma una inconsistencia general en los análisis de asociación entre irisina sérica, por un lado, y marcadores metabólicos y de composición corporal, por otro.
Irisin is an adipomyokine with claimed anti-obesity and anti-diabetic effects. This hormone has been insufficiently studied in patients with advanced chronic kidney disease (CKD).
ObjectiveTo perform an exploratory analysis of serum irisin levels in patients undergoing different CKD treatments.
MethodFollowing a cross-sectional design, we estimated serum levels of irisin in 95 patients with CKD managed conservatively (advanced CKD), with peritoneal dialysis (PD) or with haemodialysis, and compared our findings with a control group of 40 healthy individuals. We investigated the correlations between serum irisin and demographic, clinical, body composition and metabolic variables.
ResultsIrisin levels were lower in all the CKD groups than in the control group. The univariate analysis revealed limited correlations between irisin, on the one hand, and fat (but not lean) mass, glomerular filtration rate (GFR) and plasma albumin and bicarbonate, on the other. The multivariate analysis confirmed that advanced CKD patients managed conservatively (difference 111.1ng/ml), with PD (25.9ng/ml) or haemodialysis (61.4ng/ml) (all P<.0005) presented lower irisin levels than the control group. Furthermore, PD patients presented higher serum levels of irisin than those on haemodialysis (difference 39.4ng/ml, P=.002) or those managed conservatively (24.4 ng/ml, P=.036). The multivariate analysis also identified plasma bicarbonate (B=3.90 per mM/l, P=.001) and GFR (B=1.89 per ml/minute, P=.003) as independent predictors of irisin levels. Conversely, no adjusted correlation between irisin and body composition markers was found.
ConclusionsSerum irisin levels are low in patients with CKD and show a consistent correlation with GFR and plasma bicarbonate levels. PD patients present higher levels of irisin than those managed conservatively or with haemodialysis. Our study confirms a general inconsistency of the association between serum irisin levels, on the one hand, and body composition and metabolic markers, on the other.
En los últimos años, el tejido muscular se ha ido revelando como un importante órgano endocrino, implicado en la regulación de múltiples procesos fisiológicos1–3. La irisina4 es una adipomioquina que parece participar en la regulación del metabolismo energético y otros procesos fisiológicos. Su función más conocida, y probablemente más importante, es causar degradación de la masa grasa, convirtiéndola en tejido adiposo pardo4. La consecuencia principal es un aumento en el gasto energético, provocado por la naturaleza termogénica de la grasa parda. Este fenómeno contribuye a la regulación de la temperatura corporal como efecto más inmediato, pero otras consecuencias potenciales incluyen la pérdida de peso y tanto un descenso en los niveles plasmáticos como una mejoría en la tolerancia a la insulina. Por tanto, la irisina podría tener un efecto beneficioso como agente antidiabético y antiobesidad5,6.
Los efectos de la enfermedad renal crónica (ERC) sobre la síntesis y secreción de irisina, así como su influencia en los complejos trastornos metabólicos que presentan los pacientes con esta enfermedad, no han sido investigados suficientemente. Algunos estudios han reportado niveles relativamente bajos de irisina sérica en pacientes con ERC avanzada7–9, pero el efecto comparado de diferentes modalidades de tratamiento no ha sido adecuadamente estudiado. Además, las correlaciones observadas entre irisina y diferentes marcadores clínicos, bioquímicos y metabólicos en estos pacientes son objeto de controversia.
Hemos emprendido un análisis exploratorio transversal de una muestra amplia de pacientes con ERC bajo diferentes modalidades de tratamiento. Nuestro objetivo fue llevar a cabo un análisis comparativo de los niveles de irisina, así como desvelar asociaciones potenciales con diferentes marcadores demográficos, clínicos, bioquímicos, metabólicos y de composición corporal.
Población y métodoSiguiendo un diseño transversal, investigamos los niveles séricos de irisina en una muestra extraída consecutivamente del conjunto de pacientes prevalentes con ERC bajo tratamiento conservador (ERCA), diálisis peritoneal (DP) o hemodiálisis (HD), en nuestro centro. Aplicamos los siguientes criterios de inclusión/exclusión:
- 1.
Edad entre 18 y 80 años.
- 2.
ERC, con filtrado glomerular estimado (GFR) <40mL/min.
- 3.
Sin eventos clínicos significativos durante al menos 3meses antes de la inclusión.
- 4.
Plena capacidad para entender los objetivos y condiciones del estudio.
- 5.
Consentimiento informado por escrito.
La variable principal del estudio fue la irisina sérica. Investigamos la correlación de esta variable con las siguientes:
- a)
Demográficas: edad, sexo, diabetes, comorbilidad (escala de Charlson), modalidad de tratamiento (ERCA, DP, HD), tiempo en diálisis, tensión arterial (en el momento de la extracción de muestras) y tratamiento con estatinas, antagonistas del eje renina-angiotensina-aldosterona (RAA) y factores estimuladores de la eritropoyesis (FEE).
- b)
Composición corporal: peso corporal, índice de masa corporal (peso/talla2), agua corporal total, cociente de agua intra-/extracelular, sobrehidratación y masas grasa y magra (corregidas para superficie corporal [SC]). Los últimos 5parámetros se estimaron mediante un dispositivo de bioimpedancia multifrecuencia (BIA) (BCM, Fresenius, Heidelberg, Alemania).
- c)
Laboratorio: GFR (media de aclaramientos renales de urea y creatinina), proteinuria, hemoglobina, albúmina, colesterol, triglicéridos, ácido úrico, bicarbonato, calcio, fosfato (autoanalizador), hormona paratiroidea (PTH) (IRMA, Nichols Inst, San Juan Capistrano, EE. UU.), interleucina 6 (ELISA, Abcam, Cambridge, Reino Unido) y proteína C reactiva (PCR) (Inmunoturbidimetría, Roche, Mannhein, Alemania).
- d)
Hormonales: glucemia, péptido C (Chemiluminiscence. Immulite 2000, Siemens, Munich, Alemania), insulina (RIA, CIS Bio Int. Cedex, Francia), índice HOMA (según Matthews)10, hormona de crecimiento (RIA, Nichols), IGF1 (Inmunoensayo, Nichols), leptina (ELISA, R&D Systems, Minneápolis, EE. UU.) y 25OH vitamina D (Quimioluminiscencia, Centaur, Siemens, Erlangen, Alemania).
- e)
Para seleccionar el método de estimación de niveles de irisina, realizamos un análisis preliminar de la concordancia entre 2kits ELISA disponibles comercialmente (EK-067-29 de Phoenix Pharmaceuticals, Burlingame, EE. UU. y AG-45A-0046 de Adipogen International, San Diego, EE. UU.). Como media, el kit EK-067-29 proporcionaba estimaciones un 41% más altas que el kit AG-45A-0046. Finalmente, se seleccionó el kit AG-45A-0046 por la mayor consistencia interna de las estimaciones, que se hicieron por duplicado. Las muestras de sangre se llevaron a tubos separadores y se centrifugaron a 3.000g durante 15 min a 4°C. Se almacenó el suero a −80°C hasta el análisis.
Las variables se presentan como medias (± desviación estándar [DE]) salvo las de distribución anormal (mediana con amplitud). Las comparaciones univariantes se generaron mediante ANOVA, pruebas de Kruskall Wallis y distribución χ2. Las correlaciones univariantes se estimaron mediante el coeficiente de correlación de Spearman. Las correlaciones ajustadas entre irisina sérica y diferentes variables se investigaron mediante modelos de regresión múltiple por pasos (stepwise). Utilizamos una muestra aleatoria de 40 individuos sanos, equilibrados para edad, sexo e índice de masa corporal, como grupo control de referencia. Utilizamos el software SPSS 19.0 para manejo de datos.
ResultadosSe solicitó participación en el estudio a 105 pacientes. Siete de ellos negaron consentimiento y otros 3fueron excluidos por padecer eventos clínicos durante la fase de selección. Así, el grupo de estudio lo compusieron 95 pacientes. Las principales variables demográficas y de composición corporal se presentan en la tabla 1, mientras que las variables bioquímicas y relativas a tratamientos se presentan en la tabla 2. Los pacientes en HD presentaban una permanencia media más larga en diálisis que los de DP, así como valores más bajos de peso corporal y masa grasa, y un mayor nivel medio de sobrehidratación que los otros 2grupos de estudio (tabla 1). Las diferencias observadas para valores de GFR fueron las esperadas (tabla 2). El grupo de controles sanos estaba compuesto por 20 varones y 20 mujeres, con una edad de 56,6±8,7 años y un índice de masa corporal de 27,6±4,6 kg/m2.
Variables demográficas y de composición corporal
| ERCA | Diálisis peritoneal | HD | p | |
|---|---|---|---|---|
| N | 30 | 35 | 30 | |
| Edad (años) | 57,0 (12,4) | 60,8 (12,3) | 56,1 (13,3) | 0,29 |
| Sexo (% varones) | 60,0 | 61,1 | 50,0 | 0,62 |
| Diabetes (%) | 10 (33,3) | 16 (44,4) | 12 (40) | 0,87 |
| Escala de Charlson | 4,5 (1,8) | 5,3 (2,0) | 5,4 (1,9) | 0,11 |
| Peso corporal (kg) | 78,1 (12,5) | 75,5 (11,5) | 64,7 (13,7) | 0,0005a |
| Índice de masa corporal (kg/m2) | 28,6 (4,3) | 28,2 (3,9) | 24,6 (3,7) | 0,001a |
| TA sistólica (mmHg) | 142,9 (18,1) | 144,1 (19,3) | 141,9 (23,5) | 0,91 |
| TA diastólica (mmHg) | 82,6 (11,4) | 83,0 (13,0) | 79,1 (13,5) | 0,16 |
| Tiempo en diálisis (meses) | NA | 29,8 (29,2) | 60,7 (52,3) | 0,0005a |
| Agua corporal total (L) (BIA) | 34,8 (6,2) | 34,3 (6,9) | 31,3 (7,4) | 0,10 |
| Agua intra/extracelular (BIA) | 0,92 (0,11) | 0,97 (0,14) | 0,98 (0,13) | 0,12 |
| Masa grasa (kg)b (BIA) | 15,4 (5,4) | 15,0 (4,7) | 11,5 (85,4) | 0,008a |
| Masa magra (kg)b (BIA) | 13,6 (5,9) | 12,5 (2,7) | 11,7 (3,2) | 0,20 |
| Sobrehidratación (L) (BIA) | 0,70 (1,15) | 1,40 (1,72) | 1,83 (2,37) | 0,059 |
BIA: bioimpedancia multifrecuencia; ERCA: enfermedad renal crónica avanzada (GFR estimado <30mL/min); HD: hemodiálisis; NA: no aplicable; TA: tensión arterial.
Comparaciones por ANOVA y análisis χ2.
Variables de laboratorio y tratamientos
| ERCA | Diálisis peritoneal | HD | p | |
|---|---|---|---|---|
| N | 30 | 35 | 30 | |
| GFR (mL/m) | 18,4 (8,3)a | 5,8 (4,3) | 0,9 (1,3) | 0,0005 |
| Proteinuria (g/24 h) | 1,8 (1,8)a | 1,1 (1,4) | 0,2 (0,4) | 0,0005 |
| Hemoglobina (g/dL) | 11,3 (1,7) | 11,6 (1,4) | 11,5 (1,6) | 0,77 |
| FEE (%) | 8 (26,7)a | 22 (61,1) | 27 (90,0) | 0,0005 |
| Albúmina, plasma (g/dL) | 4,0 (0,4)a | 3,7 (0,4) | 3,7 (0,7) | 0,007 |
| Colesterol, plasma (mg/dL) | 161,6 (40,2) | 155,9 (44,4) | 139,1 (28,5)a | 0,0005 |
| HDL colesterol (mg/dL) | 42,3 (10,9) | 41,1 (14,7) | 43,3 (11,1) | 0,50 |
| LDL colesterol (mg/dL) | 90,9 (38,9) | 93,8 (39,8) | 88,8 (35,5) | 0,79 |
| Triglicéridos, plasma (mg/dL) | 146 (60,445)a | 106 (49,233) | 108 (33,242) | 0,020 |
| Acido úrico, plasma (mg/dL) | 7,6 (1,5)a | 5,9 (1,1) | 6,2 (1,2) | 0,0005 |
| Bicarbonato, plasma (mM/L) | 23,2 (4,6) | 28,1 (3,5)a | 24,5 (2,6) | 0,0005 |
| Calcio, plasma (mg/dL) | 9,3 (0,5) | 9,0 (0,6) | 9,1 (0,8) | 0,42 |
| Fosfato, plasma (mg/dL) | 4,8 (1,1) | 4,8 (0,9) | 4,9 (1,2) | 0,94 |
| PTH, plasma (pg/mL) | 306,8 (194,6) | 309,8 (220,8) | 438,0 (370,4) | 0,10 |
| Interleucina 6, plasma (pg/mL) | 1,1 (0,5; 31,0) | 2,8 (0,5; 35,0) | 3,0 (1,0; 66,0) | 0,29 |
| PCR, plasma (mg/dL) | 0,33 (0,10; 11,30) | 0,45 (0,11; 6,40) | 0,50 (0,10; 12,40) | 0,15 |
| Antagonistas del eje RAA (%) | 15 (50,0) | 15 (41,7) | 8 (26,7) | 0,17 |
| Estatinas (%) | 25 (83,3) | 26 (72,2) | 19 (63,3) | 0,22 |
Los valores indican medias (DE) excepto triglicéridos, PCR e interleucina 1, expresados como mediana (amplitud), ANOVA.
ERCA: enfermedad renal crónica avanzada; FEE: factores eritropoyéticos; GFR: filtrado glomerular estimado; HD: hemodiálisis; HDL: high density lipoprotein; LDL: low density lipoprotein; PCR: proteína C reactiva; PTH: hormona paratiroidea; RAA: renina-angiotensina-aldosterona.
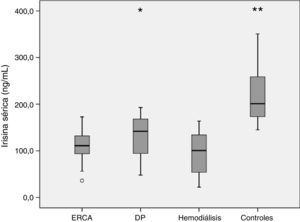
La tabla 3 muestra las principales variables hormonales escrutadas. Los niveles séricos de irisina resultaron más bajos en cualquier grupo de pacientes que en los controles sanos. Además, las comparaciones entre pacientes revelaron niveles más bajos de la adipomioquina en pacientes en HD que en los tratados con DP (fig. 1). Para el conjunto de pacientes, los niveles de irisina fueron similares en diabéticos (108,0±32,4ng/mL) y no diabéticos (113,3±45,4ng/mL) (p=0,77). La tabla 4 muestra las principales correlaciones univariantes de irisina. Se observó una asociación directa moderada con masa grasa (BIA), tensión arterial diastólica y GFR. La asociación más notable fue la observada entre irisinemia y bicarbonatemia, relativamente consistente en los distintos grupos, aunque no alcanzara significación estadística para los pacientes en DP. Por el contrario, los niveles de irisina no mostraron asociación con tratamientos con estatinas, antagonistas del eje RAA o FEE. Tampoco observamos asociaciones consistentes entre los niveles de irisina y los marcadores hormonales escrutados (tabla 4).
Variables hormonales
| ERCA | Diálisis peritoneal | HD | Controles sanos | p | |
|---|---|---|---|---|---|
| Glucemia (mg/dL) | 98,4 (37,8) | 114,0 (37,1) | 101,3 (37,3) | 95,5 (13,4) | 0,11 |
| Péptido C, plasma (ng/mL) | 4,6 (3,7)a | 9,5 (6,7) | 9,0 (5,1) | - | 0,001 |
| Insulina, plasma (mcUI/mL) | 20,5 (19,8) | 21,1 (17,7) | 13,4 (6,6) | 7,1 (5,0)e | 0,0005 |
| Índice HOMA | 3,65 (2,30) | 5,21 (2,51)b | 3,46 (2,50) | 1,67 (1,40)f | 0,011 |
| GH, plasma (ng/mL) | 0,52 (0,02;13,80) | 0,83 (0,11; 13,54) | 2,25 (0,28; 23,71)c | 0,47 (0,05; 9,00)g | 0,0005 |
| IGF1, plasma (mg/dL) | 209,6 (93,2) | 260,6 (129,5) | 199,3 (89,7) | 139,0 (67,1)e | 0,0005 |
| Leptina, plasma (pg/mL) | 141,2 (105,3) | 161,1 (106,1) | 74,9 (80,0)c | 26,6 (12,7)f | 0,004 |
| 25OH vit. D, plasma (ng/mL) | 19,2 (12,8) | 17,8 (10,4) | 11,5 (6,2)c | - | 0,010 |
| Irisina, suero (ng/mL) | 109,1 (34,3) | 132,2 (45,3) | 95,1 (41,2)d | 215,6 (53,1)f | 0,0005 |
ERCA: enfermedad renal crónica avanzada; HD: hemodiálisis; IGF1: insulin-like growth factor.
Los valores indican media (DE) excepto GH (hormona del crecimiento), expresada como mediana (amplitud), ANOVA.
Correlaciones univariantes entre irisina sérica y principales variables
| Todos | ERCA | Diálisis peritoneal | HD | |
|---|---|---|---|---|
| Edad | 0,09 (0,42) | 0,35 (0,08) | −0,07 (0,71) | −0,01 (0,95) |
| Sexo | 0,15 (0,18) | 0,13 (0,54) | 0,11 (0,57) | 0,19 (0,36) |
| Escala de Charlson | 0,025 (0,83) | 0,36 (0,08) | −0,21 (0,21) | 0,14 (0,51) |
| Índice de masa corporal | 0,14 (0,21) | 0,09 (0,66) | −0,03 (0,90) | 0,09 (0,66) |
| Masa magra por SC (BIA) | −0,12 (0,29) | 0,001 (0,99) | −0,23 (0,26) | −0,25 (0,23) |
| Masa grasa por SC (BIA) | 0,21 (0,07) | 0,10 (0,52) | 0,10 (0,64) | 0,12 (0,55) |
| GFR | 0,21 (0,07) | 0,40 (0,05) | 0,15 (0,35) | 0,37 (0,07) |
| Proteinuria | 0,00 (0,99) | −0,04 (0,84) | 0,13 (0,52) | 0,31 (0,12) |
| Albúmina (plasma) | −0,25 (0,030) | −0,15 (0,45) | 0,15 (0,46) | 0,12 (0,56) |
| Bicarbonato (plasma) | 0,44 (0,0005) | 0,46 (0,02) | 0,28 (0,16) | 0,72 (0,001) |
| Proteína C reactiva (plasma) | −0,15 (0,20) | −0,15 (0,49) | −0,30 (0,13) | −0,03 (0,90) |
| Interleucina 6 (plasma) | −0,16 (0,20) | −0,18 (0,42) | −0,28 (0,19) | 0,08 (0,72) |
| Glucemia | 0,01 (0,94) | −0,03 (0,90) | −0,29 (0,14) | 0,04 (0,86) |
| Insulina (plasma) | 0,10 (0,39) | −0,39 (0,04) | 0,11 (0,60) | 0,21 (0,30) |
| Índice HOMA | −0,24 (0,20) | −0,37 (0,05) | −0,06 (0,78) | 0,11 (0,59) |
| Péptido C (plasma) | −0,05 (0,67) | −0,38 (0,05) | −0,06 (0,77) | 0,11 (0,61) |
| GH (plasma) | −0,12 (0,28) | −0,06 (0,80) | −0,14 (0,49) | 0,07 (0,73) |
| IGF1 (plasma) | −0,04 (0,73) | −0,47 (0,019) | −0,10 (0,70) | 0,08 (0,68) |
| Leptina (plasma) | 0,18 (0,23) | 0,14 (0,52) | 0,16 (0,43) | 0,12 (0,58) |
BIA: bioimpedancia; GFR: filtrado glomerular estimado; GH: hormona del crecimiento; IGF1: insulin-like growth factor; SC: superficie corporal.
Los valores indican coeficientes de correlación de Spearman (p). Otras variables, incluyendo tensión arterial (sistólica, diastólica, media), ácido úrico, colesterol, colesterol HDL, colesterol LDL, triglicéridos, hemoglobina, calcio, fosfato, PTH y vitamina D, con valores no significativos.
En negrita correlaciones estsadisticamente significativas.
El análisis multivariante confirmó que, tras ajustar por edad, sexo y masa corporal, los niveles de irisina eran más bajos en pacientes ERCA (diferencia media 111,1ng/mL, IC 95%: 83,0/139,2; p<0,0005), tratados con DP (25,9ng/mL; IC 95%: 15,1/36,7; p<0,0005) o HD (61,4ng/mL; IC 95%: 45,2/77,6; p<0,0005) que en controles sanos. Al considerar solo pacientes, el análisis multivariante de bicarbonato plasmático, GFR y modalidad de tratamiento de la ERC eran los únicos predictores consistentes de irisina sérica (tabla 5). Además, los pacientes en DP presentaban niveles más altos de irisina que los ERCA o tratados con HD. Estas diferencias persistían tras ajustar por masa grasa y magra (BIA).
Correlaciones ajustadas entre irisina sérica y principales variables
| Variable | B | 95% IC | p |
|---|---|---|---|
| Diabetes mellitus | −0,52 | −11,69, 10,73 | 0,93 |
| Índice de masa corporal (kg/m2) | 1,24 | −1,02, 3,50 | 0,28 |
| Masa grasa (kg) (BIA) | 1,24 | −0,80, 3,29 | 0,23 |
| Masa magra (kg) (BIA) | −0,27 | −2,83, 2,30 | 0,84 |
| GFR (mL/min) | 1,89 | 0,65, 3,13 | 0,003 |
| Proteinuria (g/24 h) | 1,72 | −5,70, 9,15 | 0,64 |
| Colesterol, plasma (mg/dL) | 0,13 | −0,10, 0,37 | 0,29 |
| Colesterol HDL, plasma (mg/dL) | 0,66 | −0,41, 1,74 | 0,28 |
| Colesterol LDL, plasma (mg/dL) | 0,02 | −0,32, 0,36 | 0,90 |
| Triglicéridos, plasma (mg/dL) | 0,00 | −0,15, 0,16 | 0,95 |
| Bicarbonato, plasma (mM/l) | 3,90 | 1,79, 6,01 | 0,001 |
| Interleucina 6, plasma (pg/mL) | −0,56 | −1,41, 0,30 | 0,20 |
| Proteína C reactiva, plasma (mg/dL) | −1,14 | −5,37, 3,10 | 0,59 |
| Índice HOMA | 1,03 | −1,80, 3,87 | 0,47 |
| Modalidad de tratamiento | |||
| DP vs. ERCA | 24,40 | 1,67, 47,14 | 0,036 |
| DP vs. hemodiálisis | 39,39 | 15,37, 63,40 | 0,002 |
| Hemodiálisis vs. ERCA | −6,91 | −17,58, 3,76 | 0,20 |
BIA: bioimpedancia; DP: diálisis peritoneal; ERCA: enfermedad renal crónica con manejo conservador; GFR: filtrado glomerular estimado; IC: intervalo de confianza.
Análisis de regresión múltiple por pasos. Todos los pacientes. En negrita, variables con asociación independiente con irisina sérica. El mejor modelo incluye las variables significativas, ajustadas para edad y sexo. Los coeficientes de las demás variables (no significativos) representan la correlación individual de cada variable con irisina tras ajustar para el mejor modelo.
La irisina es un péptido de degradación compuesto por 112 aminoácidos, que se forma cuando el dominio 5 de la fibronectina tipo iii es degradado por proteasas4. Se categorizó inicialmente como una mioquina, ya que se consideraba que se sintetizaba esencialmente en los músculos esquelético y cardíaco, pero investigaciones más recientes indican que la grasa11,12 y, en grado variable, otros tejidos periféricos5 también son capaces de secretar este factor. La irisina mantiene una notable homología molecular a través de diferentes especies de mamíferos13.
Los mecanismos que regulan la síntesis y posterior secreción de irisina no han sido totalmente elucidados. La creencia inicial de que el ejercicio y el acondicionamiento físicos estimulan la síntesis y secreción de irisina ha sido confirmada por la mayoría, pero no por todas las investigaciones posteriores5. Tanto el frío como el calor también parecen estimular la liberación de este factor. Por otra parte, se ha señalado que los niveles de irisina son más altos en varones que en mujeres, y que están elevados en pacientes obesos, con una correlación directa con la masa grasa y el índice de masa corporal6, aunque estas asociaciones no han sido confirmadas por otros estudios5. Se ha hipotetizado que la elevación de los niveles de irisina en obesos sería un mecanismo compensatorio de la acumulación progresiva de grasa corporal6 y, también, que la irisina podría tener un papel en la mejoría del metabolismo hidrocarbonado que se observa tras la reducción de peso en obesos con síndrome metabólico14. Por último, algunos estudios han reportado niveles relativamente bajos de irisina en diabéticos tipo 215,16 y en pacientes con hígado graso6.
El efecto de la enfermedad renal sobre los niveles séricos de irisina no ha sido adecuadamente investigado. Los niveles de irisina podrían mantener una correlación inversa con el grado de proteinuria en la diabetes tipo 217. Wen et al.7 observaron niveles de irisina hasta un 60% más bajos en 38 pacientes no diabéticos con ERC que en 19 controles sanos equilibrados para edad y sexo. Los autores señalaban que la sarcopenia y la inhibición inducida por indoxil sulfato de la expresión de fibronectin type III domain-containing protein 5 (FNDC5) en células musculares podrían explicar este fenómeno. Un análisis exploratorio superficial de valores bioquímicos seleccionados mostró tan solo correlación leve directa con niveles plasmáticos de HDL colesterol. En otro estudio8 sobre 532 pacientes con ERC (incluyendo 169 en HD) se observó correlación directa (r ajustada=0,277) entre niveles de irisina y GFR. En este estudio los niveles de irisina observados eran similares en diabéticos y no diabéticos, más altos en mujeres que en varones, y mostraban asociación ajustada significativa con edad (inversa), colesterol- HDL y colesterol- LDL e índice HOMA (directa). Finalmente, Liu et al.9 estudiaron a 365 pacientes con diabetes tipo 2 y diferentes niveles de GFR, y confirmaron la existencia de una asociación inversa entre irisina sérica y GFR. Este estudio también detectó correlación inversa entre edad e irisina sérica que, notablemente, parecía desaparecer en pacientes con niveles más bajos de GFR. Por último, este análisis no detectó asociación con sexo, aunque observó tendencias, poco consistentes, de correlación entre irisinemia y masas magra y grasa.
En conjunto, los intentos de caracterizar los patrones de secreción de irisina y su correlación con marcadores clínicos y metabólicos han sido poco exitosos, y estas inconsistencias paracen afectar también a los pacientes con ERC. Hay varias posibles explicaciones para las discrepancias observadas. En primer lugar, la irisina es habitualmente medida por ELISA, pero se han observado notables variaciones en los valores estimados cuando se han usado los diferentes kits comercializados18. Las limitaciones de conocimiento sobre la síntesis y secreción de irisina dificultan mucho la búsqueda de explicaciones para estas discrepancias, y ha impedido hasta la fecha establecer rangos de normalidad de niveles séricos de irisina. Las inconsistencias en las estimaciones también ayudan a entender las múltiples contradicciones sobre las correlaciones entre irisinemia, por una parte, y variables como (por ejemplo) masa grasa o magra, resistencia a insulina o patrones lipídicos, entre otras. Por otra parte, los niveles de irisina han sido investigados en contextos muy heterogéneos, lo que añade confusión al análisis general. Por ejemplo, la diabetes o la obesidad podrían modificar significativamente el comportamiento fisiológico de la irisina. En conjunto, está claro que es necesaria más investigación para aclarar el significado de la irisina en la salud y la enfermedad.
Nuestro estudio confirma análisis previos que indicaban una correlación directa entre GFR e irisinemia. Como sería de esperar en este contexto, los niveles de irisina fueron más bajos en pacientes con ERC que en controles sanos (fig. 1). Esta diferencia afectaba tanto a pacientes ERCA como a tratados con DP o HD. Además, los pacientes en DP mostraron niveles más altos de irisina que los otros 2grupos. En nuestro conocimiento, este es el primer estudio que analiza específicamente esta cuestión. La explicación para las diferencias observadas no está clara. Los pacientes en HD presentaban una masa grasa relativamente baja, que podría contribuir a la diferencia, aunque este factor no mostró asociación independiente con la irisinemia en nuestro estudio. En el caso de los pacientes ERCA, el nivel significativamente más alto de GFR permitió a este grupo mantener niveles crudos de irisina comparables a los observados en DP. Por otra parte, los niveles de bicarbonato sérico resultaron más altos en pacientes en DP que en cualquier otro grupo de enfermos (tabla 2), y esta variable fue un predictor consistente de irisinemia. En nuestro conocimiento, esta asociación no ha sido investigada previamente, y no tenemos explicación clara para ella, aunque la acidosis metabólica ha sido ya mencionada como determinante de la secreción de otras adipoquinas19.
Este estudio adolece de limitaciones significativas, incluyendo su diseño exploratorio transversal, que no permite investigar la causalidad. La potencia estadística de la muestra es también limitada, lo que podría explicar algunas inconsistencias en los resultados, aunque este problema ya se observó en estudios con muestras más amplias.
En resumen, nuestro estudio confirma que los niveles séricos de irisina son relativamente bajos en pacientes con ERC, así como la asociación directa entre GFR y niveles de esta adipomioquina. Además, nuestros datos indican que la irisinemia mantiene una relación consistente e independiente con los niveles de bicarbonato plasmático en pacientes con ERC. Los pacientes en DP presentan niveles más elevados de irisina que los ERCA o tratados con HD. Finalmente, nuestros datos confirman una inconsistencia esencial en las asociaciones entre irisina sérica, por un lado, y marcadores metabólicos o de composición corporal, por el otro, ya observada en investigaciones previas. Serán necesarios más estudios para caracterizar el significado de los niveles anormales de irisina en la ERC.
FinanciaciónEste estudio se ha financiado parcialmente con becas del Fondo de Investigación Sanitaria del Instituto de Salud Carlos III PI10/00088, PI13/00322 (FEDER de la Unión Europea) y de la Xunta de Galicia IN845B-2010/187, 10CSA916014PR, CN2012/312.
Conflictos de interésNinguno mencionable.