Presentamos el caso de un paciente de 37 años que ingresa a cargo de Hematología, trasladado desde las Urgencias de Otorrinolaringología, donde había acudido por amigdalitis. Allí se demuestra anemia y leucopenia e ingresa con agranulocitosis en estudio. Un día más tarde el paciente presenta crisis blástica, y se le diagnostica de leucemia aguda con crisis mieloide. En dicha situación de crisis blástica el paciente inicia un cuadro de dolor lumbar brusco, con oliguria y deterioro de la función renal, seguido de anemización, en el contexto de un cuadro de hemólisis compatible con microangiopatía trombótica, por lo que somos consultados. Se inicia tratamiento con plasmaféresis y al día siguiente hemodiálisis (se realiza un total de 12 sesiones de plasmaféresis, hasta desaparecer los datos de hemólisis). Cinco días más tarde presenta cuadro de insuficiencia respiratoria, por el que pasa a la Unidad de Cuidados Intensivos, donde continúa con plasmaféresis y hemodiálisis. El paciente se mantiene en anuria desde entonces, con necesidad de hemodiálisis, sin ningún signo de recuperación renal. Una vez normalizadas las plaquetas, con tratamiento quimioterápico hematológico, se realiza biopsia renal percutánea, que confirma el diagnóstico de necrosis cortical. Finalmente el paciente queda incluido en programa sustitutivo de la función renal mediante hemodiálisis periódica.
A 37-year-old patient was transferred to Haematology from the ENT Emergency Department where he had been admitted due to tonsillitis. He displayed anaemia and leukopenia and had agranulocytosis in the study. A day later the patient had blast crisis, and was diagnosed with myeloid acute leukaemia. Due to blast crisis the patient experienced sudden back pain, with oliguria and renal function deterioration followed by anaemia, in the context of haemolysis consistent with thrombotic microangiopathy, and as such, we were consulted. We began treatment with plasmapheresis and on the following day we performed haemodialysis (we carried out a total of 12 sessions of plasmapheresis until haemolysis disappeared). Five days later there was respiratory failure, and the patient was consequently transferred to the Intensive Care Unit, where he continued treatment with plasmapheresis and haemodialysis. The patient remained anuric thereafter, requiring haemodialysis, with no sign of renal recovery. Once platelet levels normalised with haematology chemotherapy, a percutaneous renal biopsy was performed, which confirmed the diagnosis of cortical necrosis. Finally, the patient underwent renal replacement therapy by regular haemodialysis.
Caso clínico
Se trata de un paciente varón de 37 años sin antecedentes personales de interés, salvo el de amigdalitis de repetición, exfumador y consumo esporádico de cannabis; acude a Urgencias por odinofagia severa de 24 h de evolución. En la exploración física no había nada destacable, salvo el ligero sobrepeso (índice de masa corporal: 29 kg/m2), con amígdalas hiperhémicas. Dado el mal estado general del enfermo, la febrícula (37,3 ºC) y la presencia de amígdalas que impiden la deglución, se decide el ingreso en Otorrinolaringología el 25 de abril de 2013.
Al día siguiente al ingreso el enfermo es trasladado a cargo de Hematología por agranulocitosis en estudio, tras evidenciar en la analítica ligera anemia (hemoglobina [Hb]: 11,9 g/dl); leucopenia (340/l); plaquetas 270 000/l, con creatinina plasmática (Crp) de 0,9 mg/dl, coagulación normal; con una extensión en sangre periférica con neutropenia, sin dismorfias, ni células inmaduras, con macrocitosis borderline y plaquetas normales. Se sacan cultivos faríngeos y serologías de citomegalovirus, Epstein-Barr, rubeola, toxoplama, virus de la inmunodeficiencia humana y herpes, que son negativos.
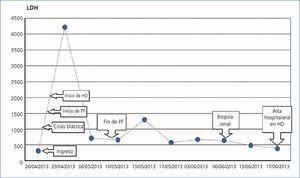
Al día siguiente al traslado se realiza analítica de control que evidencia 8290 leucocitos, Hb 11 g/dl, plaquetas 20 000/l, urea 59 mg/dl y Crp 2,3 mg/dl. Se realiza nuevo frotis de sangre periférica en el que se detecta una población patológica de células inmaduras de aspecto mieloide con intensa granulación. Algunas de ellas con núcleo hendido «en hachazo», eritroblastosis con promielocitos atípicos. Compatible con leucemia mieloblástica aguda probablemente promielocítica, posteriormente se realiza mielograma que confirma el infiltrado de células promielocíticas con un estudio citogenético que confirma la translocación (t15;17). Ese mismo día, somos consultados debido a que el paciente presentó por la noche un cuadro de dolor abdominal brusco, centrado a nivel lumbar, con oligoanuria; se revisa el frotis de sangre periférica en el que se detectan esquistocitosis significativa en torno al 8 %. Este contexto hace muy posible el diagnóstico de microangiopatía trombótica. El mismo 27 de abril de 2013 se realiza una tomografía axial computarizada (TAC) abdominal que muestra defecto de perfusión a nivel de la corteza renal bilateral, con arteria y vena renales permeables, compatible con necrosis cortical. Igualmente se realiza gammagrafía renal que es orientativa de necrosis cortical. En la analítica practicada 6 h más tarde ya presentaba un sedimento con microhematuria y proteinuria de 100 mg/dl, una analítica con Crp de 4,6 mg/dl, con ligera elevación de enzimas hepáticas con proteína C reactiva (PCR) ultrasensible de 165 mg/l, bilirrubina total 5,9 mg/dl, con coagulación (dímero-D 36 mg/l, actividad de protrombina 53 %, resto normal), test de Coombs directo e indirecto normal, por lo que, ante la alta sospecha clínica de síndrome hemolítico urémico (SHU), se inicia tratamiento con plasmaféresis diaria con 5 litros de plasma fresco congelado (1,5 volúmenes plasmáticos), junto a terapia hipotensora, dada la elevación progresiva de las cifras tensionales: 120/70 a 170/90 mmHg. Al día siguiente el paciente permanecía en oliguria con una Crp de 7 mg/dl y cifras tensionales elevadas (160/80 mmHg), por lo que se inicia hemodiálisis (primera sesión: 28 de abril de 2013). Se realizan un total de 12 sesiones de plasmaféresis (7 consecutivas y 5 a días alternos), hasta desaparecer los datos de hemólisis (descenso de lactato deshidrogensa [LDH], bilirrubina indirecta y esquistocitos [figura 1], junto al aumento de haptoglobina: mg/dl [70 (1 de mayo de 2013) a 75 (13 de mayo de 2013) a 217 (17 de junio de 2013)], y plaquetas). El 1 de mayo de 2013, al finalizar la quinta sesión de plasmaféresis, el paciente presenta un cuadro de insuficiencia respiratoria severa junto a leve hemoptisis y disminución del nivel de conciencia, por lo que pasa a la unidad de cuidados intensivos (UCI), donde continúa con plasmaféresis y hemodiálisis. En la UCI es necesaria la ventilación mecánica y se practica una gammagrafía pulmonar por la sospecha de infartos pulmonares que no evidencia datos de tromboembolismo pulmonar; también se practica TAC craneal que descarta infartos cerebrales. Finalmente, el paciente sale de la UCI cuatro días más tarde con respiración espontánea con una infección respiratoria por Acinetobacter y Pseudomona aeruginosa e infección urinaria por Acinetobacter baumanii. La respuesta clínica a la quimioterapia con ATRA más idarurrubicina es satisfactoria y presenta una buena respuesta al tratamiento, siendo dado de alta por hematología el 18 de junio de 2013 con revisiones en consultas externas.
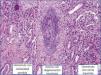
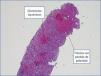
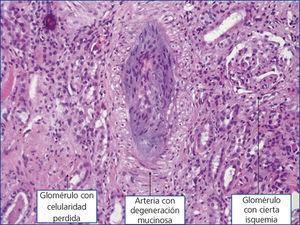
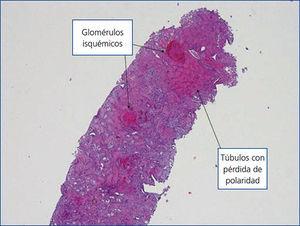
El paciente, desde el punto de vista renal, se mantiene en anuria desde entonces, con necesidad de hemodiálisis, sin ningún signo de recuperación. Se practica una angio-TAC de control que evidencia una hipoperfusión cortical. Una vez normalizadas las plaquetas, con tratamiento quimioterápico, se realiza biopsia renal percutánea (7 de junio de 2013): con 19 glomérulos, 16 de los cuales presentan severos cambios propios de necrosis de coagulación con destrucción completa de todos los elementos celulares secundarios a la isquemia. En tres de ellos se observan los mismos signos, pero con conservación de sus núcleos, así como mesangiolisis, engrosamiento de las membranas con presencia de hematíes (esquistocitos), y ocasionales polimorfosnuclares (PMN), sin dobles contornos, ni semilunas, ni necrosis fibrinoide del ovillo capilar, ni de la arteriola aferente. En el ámbito intersticial se evidencia una necrosis cortical difusa con presencia en el ámbito de la unión córtico-medular y medular de túbulos con cilindros hemáticos, pigmento hemosiderínico, cambios isquémicos celulares con pérdida del ribete en cepillo y marcada atipia nuclear, parches de infiltrado inflamatorio crónico y de fibrosis leve. A nivel vascular, arterias de mediano calibre, presencia de degeneración mucoide intimal con oclusión luminal y cambios fibrosos miointimales incipientes, que confirma el diagnóstico de necrosis cortical coagulativa con cambios vasculares compatibles con SHU (figura 2 y figura 3), por lo que ante las pocas expectativas de recuperación renal se solicita valoración por Cirugía Vascular para la realización de un acceso vascular, quedando el paciente incluido en programa sustitutivo de función renal mediante hemodiálisis periódica.
Diagnóstico
Insuficiencia renal aguda por necrosis cortical renal bilateral de causa isquémica por microangiopatía trombótica en el contexto de crisis mieloide de leucemia mieloide aguda.
DISCUSIÓN
La necrosis cortical constituye menos del 2 % de todas las causas de fracaso renal agudo en adultos y representa un 15-20 % de los fracasos renales agudos en el tercer trimestre del embarazo. La necrosis cortical renal puede tener diversos grados de extensión: mínima, focal y masiva, y puede ser unilateral o bilateral. Nuestro paciente tuvo una forma bilateral y masiva, dada su mala evolución clínica. Generalmente se conserva la zona de tejido cortical subcapsular y yuxtamedular, salvo en las necrosis corticales por rechazo, en las que puede necrosarse todo el tejido de la corteza1,2.
Entre sus causas más frecuentes están las complicaciones obstétricas (50-70 %) y las no obstétricas representan el 20-30 % restante. Entre las obstétricas, el desprendimiento prematuro de la placenta es la causa más frecuente. Entre las no obstétricas, el SHU constituye la causa más frecuente (en torno al 50-70 % de los casos), seguido por las situaciones sépticas. Otras causas son los cuadros de deshidratación severa, el rechazo renal hiperagudo y agudo, los venenos biológicos y el etilenglicol, etc.
El mecanismo exacto por el que se produce la necrosis cortical renal es desconocido. Es causado por una disminución significativa de la perfusión arterial renal secundaria a espasmo vascular, lesión microvascular o coagulación intravascular, y es la progresión patológica de una necrosis tubular aguda lo que da lugar a la necrosis cortical. Clínicamente suele cursar con anuria, precisando hemodiálisis en la mayoría de las ocasiones. Entre las pruebas diagnósticas, las de imagen juegan un papel fundamental ante el riesgo de sangrado que supone la biopsia renal en estos casos, debido a las frecuentes alteraciones en la coagulación que presentan estos enfermos. La técnica habitualmente utilizada para realizar el diagnóstico es la arteriografía, que además de diagnóstica es pronóstica en cuanto a funcionalidad renal, dado que, a mejor perfusión renal, mejor será el pronóstico de recuperación. Sin embargo, la angio-TAC o la gammagrafía renal también son técnicas válidas que nos sirven para realizar el diagnóstico3. Su pronóstico es malo, con una mortalidad en torno al 50 %. Los depósitos de calcio que se observan en la corteza renal sugieren necrosis cortical renal, pero estos se desarrollan tardíamente en el curso de la enfermedad como resultado de la cronificación y se encuentran solamente en un 20-50 % de los casos4-7.
En la fase prodrómica de los SHU atípicos se observaron infección respiratoria de vías altas (23 %), fiebre no catalogada (46 %), como presentó nuestro caso, y vómitos (81 %). La lesión histológica renal característica del SHU atípico es la microangiopatía trombótica arteriolar, mientras que en el grupo de SHU típico la lesión más frecuente es la microangiopatía trombótica glomerular, hecho que se corresponde con lo observado en nuestro paciente. La necrosis cortical renal es la complicación más grave de este cuadro, que lleva a la mayoría de los pacientes a diálisis8,9.
En resumen, hemos de decir que, en cuanto a la microangiopatía que presentó el paciente, en el contexto de la crisis blástica, se trata de un SHU secundario al proceso tumoral, y que en dicha explosión de células atípicas se presenta el cuadro agudo, que llevó al paciente al fracaso renal por una necrosis cortical renal.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Gráfica evolutiva
Figura 3. Imagen de arteria típica del síndrome hemolítico urémico secundario.
Figura 2. Cilindro renal