INTRODUCCIÓN
La esperanza de vida del paciente trasplantado renal ha mejorado considerablemente en los últimos años, en gran medida debido a la introducción de nuevos fármacos inmunosupresores y a un mayor conocimiento ¿y manejo¿ de las complicaciones a corto plazo que, clásicamente, han comprometido su evolución.
Esta mayor supervivencia, sin embargo, hace que adquieran más importancia las complicaciones a largo plazo, especialmente la enfermedad cardiovascular y el cáncer.
Aunque la enfermedad cardiovascular sigue siendo la principal causa de muerte en el paciente con injerto funcionante, el cáncer podría alcanzar e incluso superar su incidencia, especialmente en pacientes mayores.1
Además de por su mayor incidencia, hay que añadir que el cáncer en el paciente trasplantado se caracteriza por una progresión más rápida, un pronóstico menos favorable y una peor respuesta al tratamiento.2
EPIDEMIOLOGÍA
Las neoplasias (junto a las enfermedades cardiovasculares) constituyen hoy en día la principal causa de muerte a largo plazo de los pacientes con injerto renal funcionante.3
Para los pacientes receptores de un injerto de cadáver, se estima que el riesgo de desarrollar un cáncer de piel a los diez años es mayor del 30%.4 Según Kasiske et al.,5 la incidencia acumulada de cáncer (excluyendo el de piel no melanocítico) es del 1,2, 1,9, 3,3, 5,5 y 7,5% a los meses 3, 6, 12, 24 y 36, respectivamente.
Globalmente, el cáncer conlleva una mortalidad del 9-12% de los pacientes trasplantados.6
Esto hace que sea imperativa la implementación de medidas para la prevención, el diagnóstico precoz y el tratamiento de esta patología en los pacientes trasplantados.7
El desarrollo de una neoplasia puede producirse por tres vías diferentes:
1. Por transmisión de la enfermedad a partir del donante
Se produce con una frecuencia extremadamente baja. Según el documento de consenso de la Organización Nacional de Trasplantes (ONT) de mayo de 2006,8 en los últimos 15 años sólo el 0,02% de los pacientes trasplantados desarrolló un cáncer transmitido por el donante. Los tumores transmitidos fueron un sarcoma de partes blandas, un carcinoma de células germinales, una carcinomatosis indiferenciada y dos carcinomas renales.
Debido a la escasez de órganos, diversos consensos aceptan donantes con ciertas enfermedades neoplásicas, como tumores de piel de bajo grado o con poca capacidad metastatizante (carcinoma basocelular o espinocelular), carcinomas in situ, tumores renales de bajo grado de malignidad y ciertos tumores del sistema nervioso central (grados I y II de la OMS y, en ausencia de otros factores de riesgo, los de grado III).8,9
Aunque se han propuesto estrategias para reducir el riesgo de transmisión de tumores, no siempre es posible llevarlas a cabo en la práctica, debido a que la urgencia en la obtención de órganos no permite realizar a tiempo las determinaciones o pruebas diagnósticas recomendadas. Por ello, en ocasiones el diagnóstico de un tumor en el donante se hace una vez realizado el trasplante.
Cuando el paciente trasplantado ha desarrollado un cáncer, se pueden contemplar diversas opciones, como la trasplantectomía y el cese de la inmunosupresión. En el trasplante renal se podría valorar el uso como inmunosupresor de los inhibidores mTOR o de la señal de proliferación (sirolimus/everolimus), debido a su actividad antitumoral.3 En general, sin embargo, habrá que considerar el tratamiento específico antitumoral con quimioterapia, radioterapia y/o cirugía.
2. Por recurrencia de una neoplasia previa en el receptor
Para la mayoría de los cánceres, el porcentaje de recurrencia aumenta en la medida en que disminuye el tiempo entre el tratamiento del mismo y la realización del trasplante. Si el candidato a trasplante renal tiene historia previa de tumor, se recomienda un cierto período de espera entre la remisión del cáncer y el trasplante. Como veremos más adelante, este tiempo depende del tipo y grado de tumor.
También se puede considerar la utilización de inhibidores de la señal de proliferación, lo que podría ser una estrategia profiláctica para evitar la recidiva de tumores tras el trasplante renal en aquellos enfermos que ya lo presentaban en lista de espera. Sin embargo, se necesitan estudios prospectivos que confirmen estos aspectos.
Por otro lado, aunque el paciente en espera no tenga antecedentes tumorales, es importante realizar una evaluación clínica del mismo ¿sobre todo en aquellos por encima de los 50 años¿ con el fin de detectar neoplasias no diagnosticadas. En la tabla 1 se establecen posibles estrategias diagnósticas para el cribado pretrasplante de los tumores más frecuentes.6
3. Por aparición de un nuevo cáncer
Aparte de los casos de cáncer transmitido por el donante y de las recidivas de neoplasias previas, el trasplante de riñón está relacionado con un marcado aumento del riesgo de desarrollar un nuevo cáncer.
Según el registro ANZDATA,7 el riesgo relativo estandarizado para todas las neoplasias es del 1,35 para pacientes en diálisis frente al 3,27 para la población trasplantada, y la supervivencia global de los pacientes con cáncer es de 2,2 años.
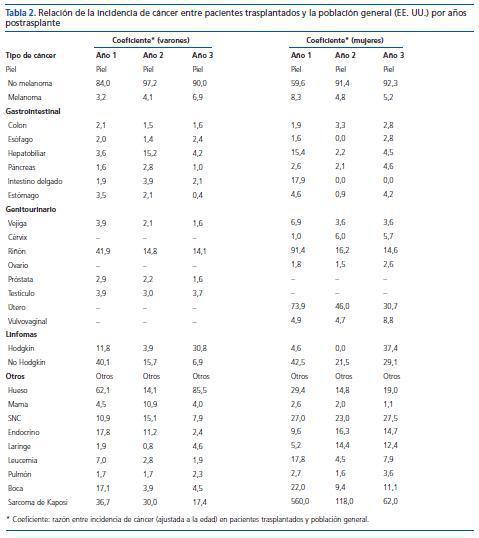
Al comparar la incidencia de diferentes tipos de cáncer entre pacientes trasplantados y la población general, Kasiske5 (tabla 2) observó que los tumores de piel no melanocíticos, el sarcoma de Kaposi y el linfoma no Hodgkin tuvieron una incidencia al menos 20 veces superior a la de la población general. Por su parte, el cáncer renal aumentó 15 veces, mientras que los de vejiga y testículo fueron sólo tres veces más frecuentes. El melanoma, la leucemia y los tumores hepatobiliares, de cérvix y vulvovaginales fueron aproximadamente cinco veces más frecuentes, y la mayoría de los tumores más comunes en la población general (colon, pulmón, próstata, estómago, esófago, ovario y mama) aumentaron dos veces.
Otros autores coinciden en que los receptores de un trasplante renal tienen al menos cuatro veces más riesgo de desarrollar otras neoplasias, incluyendo cánceres de esófago, hígado, cavidad nasal, vulva, vagina, cérvix, pene y otros órganos genitales masculinos, vejiga, tiroides y otras glándulas endocrinas. Mientras que otras neoplasias sólo presentan un riesgo moderadamente superior al de la población general, como son el cáncer de mama1,3 o el carcinoma de colon.3,4,10
Podemos decir, por tanto, que ciertas neoplasias se asocian de una manera mucho más significativa al paciente trasplantado, como son los cánceres de piel ¿especialmente los no melanocíticos¿, los linfomas y las enfermedades linfoproliferativas, englobadas en el concepto de «Enfermedad Linfoproliferativa Difusa Postrasplante» (ELDP).
El cáncer de piel es la neoplasia más frecuente en los pacientes con trasplante renal y está representado fundamentalmente por los tumores no melanocíticos, que suponen alrededor del 90% de todas las neoplasias de la piel. Según el registro australiano, su incidencia acumulada es del 30% a los cinco años y del 82% a los veinte años del trasplante.11
Los datos de incidencia, sin embargo, varían según los estudios y registros realizados. Así, el registro australianoneozelandés ANZDATA 20024 refiere que entre los receptores de un trasplante de cadáver, el riesgo de desarrollo de un cáncer de piel es superior al 30% a los diez años. Otro estudio, también australiano,11 concluye que la frecuencia aumenta en relación directa a la duración de la inmunosupresión, de forma que el desarrollo de al menos un tumor no melanocítico se produce en un 29,1, 52,2, 72,4 y 82,1% cuando la inmunosupresión ha sido <5, 5-10, 10-20 y >20 años, respectivamente.
Las EDLP constituyen un importante grupo de neoplasias en esta población, tanto por su incidencia como por su alta mortalidad. Según diversos autores, el riesgo de padecer este tipo de neoplasias está aumentado entre 10 y 29 veces con respecto a la población general. En los pacientes pediátricos, la incidencia varía con respecto a la población adulta. Así, las EDLP son las neoplasias más frecuentes, constituyendo el 50% de todos los tumores, mientras que el cáncer cutáneo aparece en segundo lugar (20%).1,12
El sarcoma de Kaposi, raro en la población general, se encuentra entre los cánceres cuya aparición aumenta considerablemente en el paciente trasplantado. Los datos de incidencia varían según las diferentes áreas geográficas. A pesar de tener un componente cutáneo importante, normalmente se considera dentro de «otros cánceres», ya que puede afectar otros órganos como el pulmón, los ganglios o el tracto digestivo con un carácter sistémico.
FACTORES DE RIESGO
El riesgo de desarrollar una neoplasia está aumentado en el enfermo con insuficiencia renal crónica y en el enfermo en diálisis. La incidencia de cáncer es aún mayor en el postrasplante. En el trabajo de Kasiske,5 al comparar con pacientes en lista de espera, se vio que algunos tumores fueron significativamente más frecuentes después del trasplante: cáncer de piel no melanocítico (2,6 veces), melanoma (2,2 veces), sarcoma de Kaposi (9 veces), linfoma no Hodgkin (3,3 veces), cáncer de boca (2,2 veces) y cáncer renal (39% superior).
Esto sugiere que la inmunosupresión está implicada de forma importante en este aumento del riesgo.13 La afectación a largo plazo del sistema inmunitario jugaría un papel importante en el desarrollo tanto de infecciones víricas como de enfermedades neoplásicas.14 Los cánceres con mayor riesgo de aparición (ELDP, sarcoma de Kaposi, hígado, esófago, cérvix, vulva, vagina y pene) tienen en común la presencia o sospecha de un componente vírico (oncovirus) en su etiología, lo que apoyaría la interacción entre el sistema inmune y los oncovirus en la etiología del cáncer.15
Aunque reconozcamos la mayor importancia de la inmunosupresión como factor de riesgo, debemos considerar también otros factores como la edad en el momento del trasplante, el sexo, el tiempo transcurrido desde el trasplante y el tiempo durante el que el paciente ha permanecido con una enfermedad renal en fase terminal antes del trasplante.
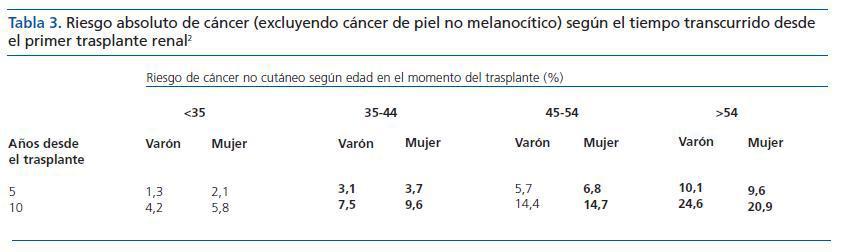
En este sentido, el informe del registro ANZDATA,10 que analiza los factores de riesgo asociados a una mayor incidencia de cánceres (excluyendo los de piel no melanocíticos), muestra que el sexo y la edad en el momento del trasplante, así como el tiempo transcurrido desde el mismo, son factores predictores significativos del desarrollo de cáncer (tabla 3).
Por otro lado, el tiempo durante el que el paciente permanece con una enfermedad renal en fase terminal ¿antes del trasplante¿ se considera un factor determinante del riesgo de desarrollo de cáncer renal.16
PATOGÉNESIS
El principal factor de riesgo de oncogénesis postrasplante está íntimamente relacionado con la inmunosupresión a la que están sometidos los pacientes.
Dos serían los mecanismos principales por los que la inmunosupresión puede incidir en el desarrollo del cáncer:
- Por acción directa de ciertos fármacos inmunosupresores (no ligada al efecto inmunosupresor). Hay datos que sugieren que tanto la ciclosporina como el tacrolimus podrían inducir la expresión del factor de crecimiento transformante beta1 (TGF β1), asociado con la invasión y diseminación de los tumores.17
- Por depresión sostenida del sistema inmune que:
- Favorece las infecciones oportunistas por virus con potencial oncogénico (tabla 4).
- Altera ciertos componentes del sistema inmune, como son las células «natural killer», involucradas en la vigilancia inmunológica y la eliminación temprana de células neoplásicas.1
Por otro lado, la estimulación antigénica crónica a partir de órganos trasplantados y de infecciones de repetición podría estimular un sistema inmune parcialmente deprimido, favoreciendo el desarrollo de linfomas asociados al trasplante.
MANEJO DEL PACIENTE CON CÁNCER EN LISTA DE ESPERA
Todo paciente candidato a trasplante debe ser valorado clínicamente con el fin de descartar cualquier neoplasia no diagnosticada. El progresivo aumento de la edad de los pacientes susceptibles de trasplante hace que la posibilidad de desarrollar una neoplasia sea cada vez mayor. Por ello, se recomienda que a los pacientes mayores con cierto tiempo en lista de espera se les evalúe periódicamente con el fin de detectar algún tumor oculto.5
En general, se considera contraindicación para el trasplante la presencia de cualquier enfermedad que condicione una expectativa de vida inferior a dos años, las infecciones sistémicas activas y el cáncer no controlado a pesar del tratamiento.18
En principio, contraindican el trasplante el cáncer metastático, el cáncer de mama o de próstata avanzados y el mieloma múltiple. El resto de pacientes con antecedentes de cáncer deberían ser considerados para su inclusión en la lista de espera. Esta decisión, sin embargo, debe tener en cuenta dos factores importantes: el tipo de tumor, que condiciona la probabilidad de recurrencia y el tiempo transcurrido desde la cirugía, diagnóstico o tratamiento, que se correlaciona de forma inversamente proporcional con el riesgo de recurrencia.
Teniendo en cuenta el tiempo hasta el trasplante, el mayor índice de recurrencias (54%) se observa cuando la espera es inferior a dos años.6
Considerando cada tumor, la capacidad de recidiva depende del tipo del mismo y de su estadio. Así, el cáncer de testículo o de tiroides tienen en general un bajo índice de recidivas tras el trasplante (3-12 y 7-8%, respectivamente), mientras que el mieloma o el cáncer de piel no melanocítico recidivan en un alto porcentaje de pacientes (67 y 48-62%, respectivamente). Por otro lado, un mismo tipo de cáncer puede comportarse de forma diferente según su grado de evolución al diagnóstico. Así, en el cáncer de mama, el estadio del mismo parece ser el factor determinante de su recurrencia (5,4 y 8% en estadios I y II y hasta el 63,6% en estadio III),19 y un cáncer de colon grado A o B1 de Dukes presenta un 14 o un 19% de recidivas, respectivamente, mientras que grados más avanzados del mismo tumor llegan hasta un 42% de recurrencias.20
Teniendo en cuenta estos factores, podemos encontrarnos con tumores para los que no es preciso ningún tiempo de espera, como los renales incidentales pequeños, ciertos tumores in situ y los basocelulares, mientras que en otros casos se aconseja un tiempo de espera que, como hemos visto, dependerá del tipo y del grado del tumor.
La sociedad canadiense de trasplantes ha publicado recientemente unas guías en las que analiza las diferentes situaciones clínicas y establece el tiempo de espera aconsejable para cada tipo de tumor (tabla 5).21
PRINCIPALES TIPOS DE TUMORES EN LA POBLACIÓN TRASPLANTADA RENAL
Enfermedad Linfoproliferativa Difusa Postrasplante (ELDP)
La ELDP es una grave complicación cuya incidencia varía según diferentes publicaciones entre un 1 y un 20%, dependiendo del tipo de inmunosupresión, del órgano trasplantado y de la presencia de infección por el Virus Epstein Barr (VEB).22
Se ha visto que las enfermedades linfoproliferativas en el postrasplantado ienen una diferente histología, son más agresivas y, en general, tienen un peor pronóstico.
Se han descrito casos de aparición precoz, en el primer año postrasplante, y otros de aparición tardía. La mayoría de los casos que se presentan durante el primer año parecen estar en relación con la infección por el VEB y presentan mayor afectación del órgano trasplantado.1,23 Los de aparición tardía son en general VEB-negativos.
La mortalidad global es en general alta. Los datos varían, pero podemos hablar de cifras que oscilan entre un 30 y un 60%. Los factores que se asocian a un mejor pronóstico son la menor edad en el momento de presentación, la enfermedad limitada a un solo sitio o al injerto, lesiones resecables o lesiones que pueden tratarse con reducción de la inmunosupresión. El peor pronóstico lo presentan las formas que afectan el Sistema Nervioso Central (SNC).1
Diagnóstico
Debido a sus elevados índices de mortalidad y a que la enfermedad se presenta frecuentemente de forma inespecífica, es importante llegar a su diagnóstico lo más precozmente posible.24
La EDLP se presenta de forma muy variada, desde enfermedades benignas como la mononucleosis o la hiperplasia amigdalar en niños hasta formas más agresivas. Cualquier manifestación, incluyendo los linfomas, puede presentarse como lesiones únicas o múltiples que pueden afectar tanto a ganglios como a órganos sólidos.1 Para Bakker,24 debido a la frecuencia de presentación extraganglionar, hay que tener en cuenta manifestaciones clínicas que involucren otros órganos, incluyendo el propio injerto. Ante disfunción renal, hidronefrosis por obstrucción ureteral y fiebre, una ecografía puede detectar fácilmente la presencia de adenopatías o de una masa renal mal definida. Del mismo modo, la aparición de signos y síntomas gastrointestinales como diarrea o sangre en heces debe hacernos sospechar de una afectación a ese nivel.
La enfermedad puede presentarse con otros signos más inespecíficos, como fiebre de origen desconocido o linfadenopatía, o más localizados, como cefalea o confusión (por afectación del SNC), obstrucción nasal (por afectación sinusal) o síntomas oculares (por afectación de la órbita).
Por último, la EDLP puede presentarse con perforación intestinal o como enfermedad diseminada en pacientes por otro lado asintomáticos. La inespecificidad y variedad de síntomas y signos frecuentemente hace que se confunda con infecciones o reacciones adversas al tratamiento. Incluso podemos encontrarnos con ausencia total de síntomas. Por todo ello, es de gran importancia la utilización de métodos de diagnóstico precoz:
- En primer lugar, deben utilizarse métodos diagnósticos convencionales con el fin de visualizar la enfermedad: ultrasonidos, Tomografía Axial Computarizada (TAC), endoscopia, resonancia magnética y, de uso más reciente, la Tomografía por Emisión de Positrones (PET), útil sobre todo para la detección de localizaciones extraganglionares y para la evaluación del tratamiento.
- También la determinación de la carga viral del VEB puede tener valor predictivo positivo, aunque su negatividad no excluye el riesgo. Debido al número de variables que influyen en la respuesta individual de los pacientes trasplantados, no es posible definir un punto de corte para determinar una carga de VEB crítica para el desarrollo de EDLP. Por ello, se considera más apropiado evaluar el incremento de los valores detectados para identificar el riesgo individual de cada paciente.24
Manejo terapéutico
El tratamiento de la EDLP incluye la cirugía cuando la enfermedad está localizada, la trasplantectomía, la disminución de la inmunosupresión y el uso de fármacos específicos, como quimioterapia estándar, interferón, y más recientemente anticuerpos monoclonales como el rituximab.
La elección del tratamiento de la EDLP dependerá de su histología, localización y actividad biológica:1
- Debido a la íntima relación entre la EDLP y la inmunosupresión, parece clave la restauración del sistema inmune del paciente. Por ello, una primera opción de tratamiento debe consistir en la reducción de la inmunosupresión. Se ha llegado a producir remisión completa con el uso de esta estrategia de forma aislada o en combinación con cirugía o radioterapia,25 aunque se ha estimado en un 25% el porcentaje de remisión cuando únicamente se reduce la inmunosupresión.26
- Sin embargo la práctica general es, el uso de pautas habituales de quimioterapia (ciclofosfamida, doxorrubicina, vincristina y prednisona-CHOP).1
- Se ha ensayado el uso de antivirales, aunque parece en general más efectivo como prevención que como tratamiento.25 Se recomendaría su uso en pacientes VEB-negativo, especialmente si han recibido un trasplante de donante VEB-positivo.1
- El rituximab (anticuerpo anti-CD20) ha mostrado beneficios en la población general con linfoma. Aunque la experiencia en trasplantados aún es limitada, su uso solo o en combinación con quimioterapia ha demostrado beneficios. En una publicación reciente25 se recomienda su uso en pacientes para los que la reducción de la inmunoterapia no sea suficiente, especialmente en aquellos VEB-positivo. La quimioterapia, debido a su mayor toxicidad, debería reservarse para pacientes que no responden a rituximab, son VEB-negativo o necesitan una rápida respuesta.
Por último, basándose en la posible acción antineoplásica de los inhibidores de la señal de proliferación (sirolimus/everolimus), se han ensayado pautas de inmunosupresión con estos fármacos, asociando quimioterapia, fármacos anti-CD20 (rituximab) o intensificación con trasplante autólogo de progenitores hematopoyéticos, con lo que se permite el mantenimiento del injerto.3
Inmunosupresión
Como vimos anteriormente, el tipo, duración e intensidad del tratamiento inmunosupresor juegan un importante papel en el desarrollo de la ELDP.
El uso de CsA se ha relacionado con un aumento del riesgo, atribuido generalmente a la agresividad de la inmunosupresión.27 Los inhibidores de la señal de proliferación, por el contrario, han mostrado un papel protector antitumoral sin menoscabo de su efecto inmunosupresor.
En modelos experimentales in vivo, sirolimus ha mostrado actividad antiangiogénica ligada a la disminución del factor de crecimiento endotelial vascular y a la inhibición de la respuesta del endotelio vascular a la estimulación por el mismo factor.28
Vaysberg et al.,29 por su parte, han estudiado el mecanismo por el que rapamicina inhibe in vitro e in vivo la proliferación de las células B infectadas por el VEB procedentes de pacientes con ELDP, demostrando el potencial de estos fármacos como opción terapéutica en la ELPD, así como en otros linfomas VEB-positivo.
Esta acción antitumoral puede evidenciarse clínicamente en trabajos como los de Kaham et al.,30 que encontraron en una serie de 1.008 pacientes trasplantados renales una incidencia marcadamente inferior de tumores en pacientes tratados con sirolimus. Por otro lado, Ghobrial et al.26 confirman la alta tasa de respuesta obtenida en pacientes tratados con rapamicina (58-62%). Pascual,27 por su parte, publica la experiencia clínica de nueve centros europeos en los que se obtuvo una remisión del 78% (15 de 19 pacientes con ELDP) tras la conversión a inhibidores de la señal de proliferación y la minimización o eliminación de inhibidores de la calcineurina.
Otros autores confirman la ausencia de aumento del riesgo de EDLP con el uso del MMF.31 Su posible actividad antitumoral estaría en relación con su capacidad para reducir la unión de las células tumorales al endotelio.32
Sarcoma de Kaposi
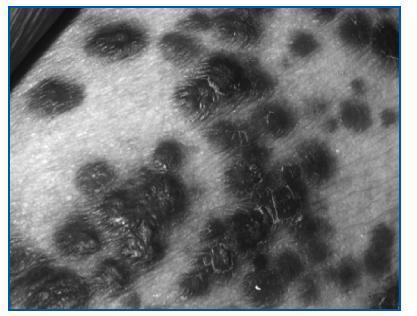
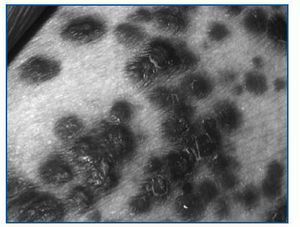
La aparición del sarcoma de Kaposi se produce en general en torno al año del trasplante, es más frecuente en la población masculina y está relacionado con la infección por el Virus Herpes 8 (VHH-8). Se puede manifestar como lesiones cutáneas, mucosas y viscerales (incluyendo ganglios, tracto gastrointestinal y pulmón).
Diagnóstico
Los síntomas incluyen la aparición de manchas de color rojo, púrpura o marrón en piel y/o mucosas (figura 1), dolor abdominal o intestinal, tos persistente o dificultad para respirar e inflamación de ganglios o vasos linfáticos.
El diagnóstico debe contemplar, aparte de la historia clínica y la exploración física, la realización de biopsias de las lesiones mucocutáneas y de estudios de imagen, incluyendo rayos X, CT, resonancia magnética y cualquier técnica de imagen que pueda detectar el tejido invadido por el sarcoma.
Ya que la mortalidad es alta, es importante llevar a cabo evaluaciones periódicas de los pacientes con el fin de detectar cualquier lesión lo más precozmente posible. En general, se recomienda una revisión anual de piel y mucosas, aunque en pacientes con mayor riesgo (etnia, área geográfica o serología positiva para el VHH-8) se pueden hacer estudios más frecuentes.33
Manejo terapéutico
El tratamiento del sarcoma de Kaposi en el paciente trasplantado no es específico. En general, se recomienda su abordaje local (escisión quirúrgica, radioterapia, quimioterapia intralesional) y el tratamiento sistémico con quimioterapia específica.
Por otro lado, existe consenso al considerar que es prioritario reconstruir el sistema inmune reduciendo la terapia inmunosupresora, en cuyo caso habría que tener en cuenta el balance entre el riesgo de diseminación de la enfermedad y el riesgo de rechazo y fallo renal secundario a la disminución de la inmunosupresión.34
Sin embargo, estudios recientes han demostrado la implicación de mTOR en la génesis del sarcoma, por lo que la utilización de inhibidores de la señal de proliferación tendría importancia en la inmunosupresión y, además, actuaría directamente en la patogénesis del tumor.
Diversos trabajos demuestran el beneficio del uso de inhibidores de la señal de proliferación en pacientes que han desarrollado sarcoma de Kaposi.35-37
Inmunosupresión
Existen evidencias que relacionan el tratamiento inmunosupresor y la infección por el Virus Herpes Humano 8 (VHH-8) con el sarcoma de Kaposi. Sin embargo, no todo tratamiento inmunosupresor tiene el mismo efecto.
Parece que los inhibidores de la CsA y los inhibidores de la síntesis de nucleótidos (MMF) favorecerían su desarrollo, mientras que los ihibidores de la señal de proliferación lo prevendrían. Este concepto estaría apoyado por trabajos como los de Stallone et al.,38 que encontraron que pacientes que habían desarrollado esta neoplasia durante el tratamiento con CsA, MMF y prednisona, revirtieron cuando se les sustituyó el tratamiento previo con CsA y MMF por sirolimus.
Cáncer de piel
La piel es el órgano más susceptible de desarrollar tumores en el paciente trasplantado. Su incidencia varía dependiendo en gran medida del grado de exposición al sol.
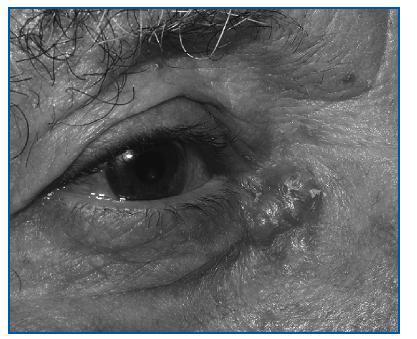
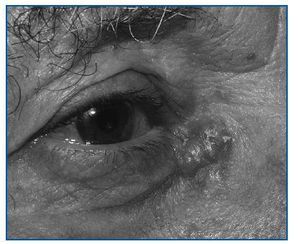
Comparado con la población general, su aparición es mucho más temprana y es frecuente su presentación en forma de tumores múltiples. Además, a diferencia de la población general, estos cánceres tienen más tendencia a la recidiva (12% tras la ablación) y se comportan de forma más agresiva (8% de metástasis). Los tumores no melanocíticos son el grupo más frecuente, especialmente el epitelioma basocelular (figura 2) y el espinocelular. El primero aparece entre 65 y 250 veces más frecuentemente que en la población general, y el segundo alrededor de 10 veces más.1,3
Diagnóstico
El diagnóstico se basa en la detección de lesiones cutáneas características: planas o elevadas, de color nacarado, rojo o rosa, de predominio en zonas expuestas al sol, en el caso del carcinoma basocelular. Y lesiones carnosas de color rojo o rosa, a menudo con escamas blanquecinas sobre la piel, en el caso del espinocelular. Ante una lesión sospechosa, el diagnóstico se hará mediante biopsia.
Manejo terapéutico
El manejo del cáncer cutáneo debe incluir la prevención, el cuidado de las lesiones premalignas y el tratamiento del cáncer ya instaurado:
- En la prevención, hay que tener en cuenta los factores claramente relacionados con el desarrollo de lesiones cancerosas, como la exposición al sol y otros que, aunque con menor certeza, también pueden influir, como la dieta.39
Así, se debe recomendar evitar o limitar la exposición al sol, teniendo especial precaución en las zonas más expuestas (cabeza, cuello, manos). En cuando a la dieta, aunque la evidencia es menor, se debe recomendar aumentar la ingesta de vegetales y reducir la de grasas.
Por otro lado, la prevención puede incluir la reducción de la inmunosupresión en pacientes especialmente susceptibles, valorando siempre el riesgo de rechazo agudo.40
Por último, es importante instruir al paciente sobre cómo realizar autoexámenes periódicos y recomendar revisiones periódicas por un dermatólogo para su seguimiento.
Teniendo en cuenta que la mayor parte de los epiteliomas espinocelulares se desarrollan a partir de lesiones premalignas (carcinoma in situ, queratosis actínica), es importante que todo paciente trasplantado sea evaluado precozmente por un especialista ante la aparición de cualquier lesión sospechosa.
Debido a la frecuencia con que estas lesiones pueden recidivar y/o malignizar, su tratamiento debe realizarse precozmente. En general, se recomienda utilizar medios físicos, como la crioterapia, la terapia fotodinámica o la electrocoagulación. Los retinoides tópicos o por vía oral pueden usarse en lesiones extensas o como prevención de recidivas locales. Más reciente es el uso tópico de fármacos modificadores de la respuesta inmune, como el imiquimod o el resiquimod.41
- El tratamiento del carcinoma cutáneo, cuando se trata de lesiones superficiales o iniciales, puede realizarse con curetaje, radioterapia, criocirugía, láser o terapia fotodinámica. También está indicado el uso de fármacos inmunomoduladores tópicos (como imiquimod o el resiquimod), ensayados con buenos resultados en el epitelioma basocelular superficial.41,42
Para carcinomas más avanzados, el tratamiento de elección sigue siendo la cirugía, que incluye la escisión del tumor y la reconstrucción de la piel afectada. La histología de la pieza confirmará el diagnóstico e indicará el grado de invasión y de agresividad. Cuando las lesiones son grandes, recurrentes o afectan la piel de la cara, se recomienda la cirugía de Mohs, que consiste en la resección de la lesión capa a capa y en su evaluación histológica intraoperatoria. La resección continúa hasta que la imagen histológica muestra ausencia de células malignas.43
Cuando hay afectación linfática, puede bastar con la linfadenectomía o puede ser necesaria la radioterapia adyuvante (si hay varios ganglios afectados o hay diseminación extracapsular).
Los cánceres invasivos requerirán tratamiento quimioterápico con las pautas estándar (bleomicina, fluorouracilo y cisplatino). Por último, se recomienda la reducción de la inmunosupresión en epiteliomas espinocelulares múltiples y recidivantes y, sobre todo, en aquellos que han metastatizado.44
En la actualidad, como veremos más adelante, disponemos de datos que demuestran el efecto antitumoral de everolimus/sirolimus, por lo que la conversión a estos fármacos tendría un efecto beneficioso antitumoral manteniendo un estado de inmunosupresión adecuado.
Inmunosupresión
La relación entre inmunosupresión y tumores cutáneos se conoce desde que Walter et al.45 comunicaron en 1971 un aumento en la incidencia de tumores cutáneos en pacientes trasplantados renales.
En general, la incidencia del cáncer cutáneo aumenta con la duración del tratamiento inmunosupresor, lo que sugiere una relación dosis-respuesta.
Se ha relacionado el uso de CsA con el aumento del riesgo de tumores cutáneos, incluso de forma dosis-dependiente.46 La azatioprina, por su parte, parece que reduce la reparación del ADN, especialmente en células expuestas a la irradiación ultravioleta.47
Por otro lado, las propiedades antitumorales del MMF han sido demostradas in vitro, si bien no han sido validadas en modelos animales o humanos.47
Otros fármacos, como los inhibidores la señal de proliferación, parecen estar relacionados con una menor incidencia e incluso mejor evolución de tumores cutáneos. Aunque aún la experiencia es escasa, diversos estudios empiezan a demostrar que la conversión de ciclosporina a everolimus o sirolimus se acompaña de remisión de las lesiones cutáneas en un alto porcentaje de pacientes.48-51
Cáncer de órgano sólido
Como hemos visto, los pacientes trasplantados tienen además un mayor riesgo de padecer otros tipos de cáncer. Según Kasiske,5 el cáncer renal podría producirse hasta 15 veces más frecuentemente que en la población general. Los tumores hepatobiliares, de cérvix y vulvovaginales pueden estar aumentados hasta cinco veces; los tumores testiculares y de vejiga, tres veces más; y los tumores de colon, pulmón, próstata, estómago, páncreas, ovario y mama, alrededor de dos veces más.
Teniendo en cuenta la amplia variedad de tumores que podrían afectar a los pacientes trasplantados, es importante considerar la prevención, así como el diagnóstico precoz y su tratamiento temprano.
El European Code Against Cancer (disponible en http://www.cancercode.org/) establece recomendaciones tanto para la prevención como para el diagnóstico precoz de la enfermedad, e incluso para el tratamiento del cáncer en sus estadios más iniciales.
CONCLUSIONES
La aparición de tumores en el paciente trasplantado es cada vez más frecuente, debido a factores como la edad ¿cada vez mayor¿ del paciente trasplantado, su mayor esperanza de vida y el uso de tratamientos inmunosupresores eficaces.
El riesgo relativo de padecer un tumor está aumentado respecto a la población general, desde dos veces para los tumores más comunes en la población general (colon, pulmón, próstata, etc.) o cinco veces para el melanoma, los tumores hepatobiliares, de cérvix y vulvovaginales, hasta más de 20 veces para los de piel no melanocítico, sarcoma de Kaposi y linfoma no Hodgkin.5 La mortalidad global debida al cáncer es del 9-12%, y la supervivencia media de los pacientes con cáncer es de 2,2 años.7
De todo ello la importancia de la prevención, el diagnóstico precoz y el tratamiento adecuado de esta enfermedad.
Para la prevención, es preciso reconocer los factores de riesgo asociados al desarrollo de distintos tumores con el fin de evitarlos o minimizarlos en la medida de lo posible. En este punto, la terapia inmunosupresora juega un importante papel, ya que hemos visto cómo ciertos inmunosupresores pueden favorecer el desarrollo de determinados tumores, mientras que otros pudieran prevenirlo.
El diagnóstico precoz debe intentarse sometiendo tanto al paciente en diálisis como al ya trasplantado a evaluaciones clínicas periódicas, con el fin de detectar lo más precozmente posible cualquier tumor en sus estadios más iniciales.
En cuanto al tratamiento, hemos visto la importancia tanto de la aplicación de pautas específicas para cada tipo de tumor como la del manejo adecuado de la terapia inmunosupresora.
El papel de la mTOR en la génesis tumoral convierte a los inhibidores mTOR en fármacos de uso potencial en el tratamiento de las neoplasias en el paciente trasplantado. También hemos visto su papel en la inhibición de la replicación de oncovirus, como el VEB. Estudios in vitro e in vivo han demostrado este efecto antineoplásico, que está siendo corroborado clínicamente en un número cada vez mayor de publicaciones que demuestran los beneficios del uso de mTOR en pacientes con cáncer. Estos estudios demuestran una menor incidencia de tumores, así como un alto índice de remisiones tras la conversión a tirolimus/everolimus. En general, esta actitud implica la supresión del CsA y/o la minimización del tratamiento inmunosupresor previo y puede llevar añadida la terapia antitumoral específica.
Todos los trabajos destacan que este cambio de terapia mantiene su eficacia frente al rechazo del injerto y, además, es bien tolerado.
Aunque es pronto para hacer recomendaciones basadas en la aún escasa experiencia, sí podemos decir que el grupo de fármacos everolimus/sirolimus aparece como una terapia prometedora en el manejo de los pacientes trasplantados en general, en aquellos con mayor riesgo de desarrollar un cáncer y, especialmente, en los pacientes que ya lo han desarrollado.
Tabla 1. Posibles estrategias diagnósticas para el cribado pretrasplante de los tumores más frecuentes
Tabla 2. Relación de la incidencia de cáncer entre pacientes trasplantados y la población general (EE. UU.) por años postrasplante
Tabla 3. Riesgo absoluto de cáncer (excluyendo cáncer de piel no melanocítico) según el tiempo transcurrido desde el primer trasplante renal
Tabla 4. Virus relacionados con el desarrollo de enfermedades neoplásicas
Tabla 5. Tiempo de espera recomendado para incluir en la lista de trasplante para cada tipo de tumor
Figura 1.
Figura 2. Carcinoma basocelular
RECOMENDACIONES